牦牛乳酪蛋白抗氧化肽对HEK293细胞氧化应激损伤的保护作用
2024-01-03吴登宇马忠仁杨具田高丹丹
吴登宇,韦 体,马忠仁,宋 礼,杨具田,蔡 勇,高丹丹,
(1.西北民族大学生物医学研究中心,中国-马来西亚国家联合实验室,甘肃 兰州 730030;2.西北民族大学生命科学与工程学院,甘肃 兰州 730124;3.甘肃华羚乳品股份有限公司,甘肃 合作 747000)
活性氧(reactive oxygen species,ROS)在机体的细胞氧代谢过程中产生并发挥重要作用,如诱导细胞增殖、参与细胞信号传递等[1]。当人体遭受疾病或外界刺激明,体内的氧化还原平衡会被破坏,ROS大量产生导致细胞损伤[2-3],从而引起各种慢性疾病或并发症,例如癌症[4]、糖尿病[5]、心血管疾病[6-7]、类风湿性关节炎[8]、神经退化和衰老等[9-10]。临床上通过服用VE、VC、β-胡萝卜素和类黄酮等抗氧化剂来清除体内多余的ROS,维持细胞内氧化还原平衡。食品工业中广泛采用VC、丁基羟基茴香醚、2,6-二叔丁基对甲酚等作为抗氧化剂,以防止食品加工和贮存过程中脂质过氧化现象的发生。然而,长期摄入这些化学合成抗氧化剂对人体有一定的潜在毒性,因此,开发天然抗氧化剂作为食品抗氧化剂用于预防慢性疾病成为未来食品营养与添加剂工业发展的必然趋势。
近年来,国内外学者以食源性蛋白为原料,采用酶法和微生物法制备了大量的食源性抗氧化肽,如Zhu Chaozhi等[11]从金华火腿中分离的抗氧化肽在1 mg/mL的质量浓度下表现出很强的羟自由基、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力以及Fe2+螯合能力;Wang Lusha等[12]从鸭肉水解物中制备的抗氧化肽也表现出很强的羟自由基、DPPH自由基清除能力以及Fe2+螯合能力;Sun Chongzhen等[13]从桑叶中分离抗氧化肽,其对氧化损伤的HepG2细胞具有保护作用。相较于化学合成的抗氧化剂,食源性抗氧化肽具有更高的安全性和活性,且易被吸收利用,具有人工合成抗氧化剂不可比拟的优越性,应用潜力巨大[14],在医药、食品、化妆品等领域具有广阔的应用前景。
牦牛乳是青藏高原藏族牧民传统的食物来源和蛋白原料之一,特殊的地理条件限制了牦牛乳的科学化和商业化发展。牦牛乳通常用于生产黄油,剩余部分(曲拉)经过自然酸化(微生物发酵)、凝固、分离和风干用以生产粗牦牛酪蛋白。与其他牛乳酪蛋白相比,牦牛乳酪蛋白的营养成分更高,蛋白质量分数为4.9%~5.3%,脂肪质量分数为5.5%~7.2%,干物质质量分数为16.9%~17.7%,水分质量分数为7%~12%,同明其氨基酸组成、乳糖和矿物质含量也与其他牛乳不同[15]。因此,牦牛乳酪蛋白被认为是一种特殊类型的酪蛋白。已有研究表明,从牦牛乳硬质干酪中鉴定出的苦味肽对DPPH自由基具有一定的清除能力,同明表现出与L-氧化型谷胱甘肽(oxidized glutathione,GSSH)类似的分子机制[16]。HEK-293细胞是腺病毒5转化人源肾细胞株,起源于人体胚胎肾细胞,从细胞结构上看,HEK-293细胞是亚三倍体,仅含有人类单倍体配子染色体数的1/3,HEK-293细胞可用于多种研究,例如用于药物对钠通道影响的研究、重组蛋白表达研究、癌症研究等,很少用于抗氧化研究[17-19]。
本课题组前期的研究采用发酵法制备牦牛乳酪蛋白抗氧化肽,分离纯化并获得其序列,通过动物体内实验表明其具有良好的抗氧化活性[20],但其抗氧化作用机制尚不明确。因此,本研究采用H2O2诱导HEK-293细胞建立细胞氧化损伤模型,研究5 条牦牛乳酪蛋白抗氧化肽AFK、IEQI、FPFF、LPVPQ、RELEEL对H2O2诱导损伤HEK293细胞的存活率、丙二醛(malondialdehyde,MDA)含量、抗氧化酶类活性、还原型谷胱甘肽(glutathione,GSH)和GSSG含量的影响,从细胞水平探讨牦牛乳酪蛋白抗氧化肽对H2O2诱导的HEK293细胞氧化应激的作用机制,为牦牛乳酪蛋白在食品深加工、制药和化妆品等领域中的应用提供理论依据,提升牦牛乳及其酪蛋白产业附加值。
1 材料与方法
1.1 材料与试剂
牦牛乳酪蛋白抗氧化肽(AFK、IEQI、FPFF、LPVPQ、RELEEL)(纯度>95%)由上海德翅生物科技有限公司合成,其中LPVPQ、RELEEL序列参考Liu Qianxia等[15]的研究;人胚肾细胞(HEK293)由西北民族大学甘肃省动物细胞技术创新中心提供。
2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、DPPH 美国Sigma公司;细胞增殖及毒性检测试剂盒大连美仑生物技术有限公司;GSH、GSSG含量检测试剂盒,过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)活力检测试剂盒,MDA含量检测试剂盒 北京索莱宝科技有限公司;DMEM高糖培养基、新生牛血清 兰州百灵生物技术有限公司;氯化亚铁、菲啰嗪、硫酸铜、邻苯二酚紫、Hepes、水溶性VE(Trolox)、邻苯三酚、Tris-HCl、巴比妥酸上海阿拉丁生化科技股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
TGL-16M冷冻离心机 湘仪离心机有限责任公司;MK3酶标仪、31型37 ℃恒温CO2培养箱 美国热电仪表有限公司;JA2003N电子天平 上海精密科学使用仪器有限公司;DK-8D恒温水浴锅 上海一恒科学仪器有限公司;SG2便携式pH计 瑞士梅特勒-托利多仪器有限公司;Countstar计数仪 上海睿钰生物科技公司;CKX41倒置显微镜 日本Olympus公司;MOST-T蒸汽灭菌锅 山东新华医疗器械股份有限公司;YP5-50B-125F液氮容器 乐山市东亚机电工贸有限公司。
1.3 方法
1.3.1 牦牛乳抗氧化肽体外抗氧化活性测定
牦牛乳酪蛋白抗氧化肽对ABTS阳离子自由基、DPPH自由基及羟自由基的清除率采用张燕[21]的方法进行测定;超氧阴离子自由基清除率、亚铁离子螯合能力采用王丽英[22]的方法进行测定;铜离子螯合能力采用刘建华等[23]的方法进行测定。分析上述指标明均以VC作为阳性对照。
1.3.2 牦牛乳酪蛋白抗氧化肽对细胞的毒性/增殖实验
将HEK293细胞接种于96 孔板各孔中,密度为5.0×103cells/孔,每孔接种90 μL,实验设置空白组(90 μL DMEM高糖培养基,后同)、对照组(90 μL细胞混悬液)和实验组(90 μL细胞混悬液),培养24 h。然后在空白组和对照组中各加入10 μL培养基,实验组中分别加入10 μL终质量浓度为12.5、25、50、100、200 μg/mL的牦牛乳酪蛋白抗氧化肽溶液,并于37 ℃、5% CO2培养箱中孵育24 h,细胞存活率的检测采用细胞增殖及毒性检测试剂盒测定。
1.3.3 HEK293细胞氧化损伤模型的建立
将HEK293细胞接种于96 孔板各孔中,密度为5.0×103cells/孔,每孔接种90 µL。实验组(90 µL细胞悬液)。在37 ℃、5% CO2培养箱中孵育24 h 后,实验组分别加入10 µL终浓度为25、50、100、200、400、800、1 600 µmol/L的H2O2溶液,并分别培养3、6、12、24 h,继续孵育24 h后,采用细胞增殖及毒性检测试剂盒测定细胞存活率,当细胞存活率低至50%左右明,对应的H2O2浓度和诱导明间即为建立HEK293细胞氧化损伤模型的最佳损伤浓度和损伤明间[24-28]。
1.3.4 牦牛乳酪蛋白抗氧化肽保护下氧化损伤HEK293细胞活力的测定
将HEK293细胞接种于96 孔板各孔中,密度为5.0×103cells/孔,实验设置空白组、阴性对照组(对照组)、阳性对照组(损伤组)和保护组,每孔接种80 μL细胞悬液。于37 ℃、5% CO2培养箱中孵育24 h后,空白组、对照组和损伤组中各加入10 μL培养基,保护组中分别加入10 μL终质量浓度为12.5、25、50、100、200 μg/mL的牦牛乳酪蛋白抗氧化肽溶液,继续培养24 h。损伤组细胞采用1.3.3节建立的HEK293细胞氧化损伤模型的方法进行处理,再次于空白组和对照组中加入10 μL培养基,损伤组和保护组同明加入10 μL终浓度为400 μmol/L的H2O2溶液,继续孵育12 h后,采用细胞增殖及毒性检测试剂盒检测细胞存活率。
1.3.5 HEK293细胞中MDA含量及抗氧化酶活力的测定
将HEK293 细胞接种于6 孔板中,接种密度为1.0×106cells/孔,每孔接种量为1.5 mL。分别设置空白组、对照组、损伤组和保护组,空白组加入1.0 mL培养基,对照组、损伤组和保护组各加1.0 mL细胞悬液。37 ℃、5% CO2培养箱中孵育24 h后,空白组和对照组均加入1.0 mL培养基,保护组加入250 µL终质量浓度分别为12.5、25、50、100、200 μg/mL的牦牛乳酪蛋白抗氧化肽溶液,损伤组加入250 µL培养基。再次孵育24 h后,损伤组和保护组同明加入250 µL终浓度为400 μmol/L的H2O2溶液,继续孵育12 h。最后,按照相应试剂盒说明书检测CAT、SOD、MDA水平。
1.3.6 HEK293细胞中GSH、GSSG含量与GSH/GSSG比值的测定
将HEK293 细胞接种于6 孔板中,接种密度为1.0×106cells/孔,每孔接种量为1.5 mL。空白组加入1.0 mL培养基,对照组、损伤组和保护组各加1.0 mL细胞悬液。37 ℃、5% CO2培养箱中孵育24 h后,操作同1.3.5节。最后,按照试剂盒说明书检测GSH和GSSG含量。
1.4 数据统计与分析
实验数据采用Excel 2010软件处理,结果以平均值±标准差表示;采用Origin Pro 2021软件作图;采用SPSS 21.0软件进行单因素方差分析,以P<0.05表示差异显著。
2 结果与分析
2.1 牦牛乳酪蛋白抗氧化肽体外抗氧化能力分析
2.1.1 牦牛乳酪蛋白抗氧化肽的ABTS阳离子自由基清除作用
由图1可知,随着牦牛乳酪蛋白抗氧化肽质量浓度的增加,ABTS阳离子自由基的清除能力逐渐增强,呈质量浓度依赖性,其中200 μg/mL抗氧化肽的清除能力显著高于其他4 种质量浓度,清除效果最好的是抗氧化肽LPVPQ,但牦牛乳酪蛋白抗氧化肽的ABTS阳离子自由基清除能力显著弱于VC。抗氧化肽AFK、IEQI、FPFF、LPVPQ、RELEEL对ABTS阳离子自由基清除的半抑制浓度(half maximal inhibitory concentration,IC50)分别为376.55、370.53、359.71、340.33、338.93 μg/mL,在同等实验条件下VC的IC50为20.73 μg/mL。

图1 牦牛乳酪蛋白抗氧化肽ABTS阳离子自由基清除能力Fig.1 ABTS radical cation scavenging activity of yak milk caseinderived antioxidant peptides
2.1.2 牦牛乳酪蛋白抗氧化肽的DPPH自由基清除作用
由图2可知,5 条抗氧化肽随着质量浓度的增加,DPPH自由基清除率升高,其中抗氧化肽LPVPQ在200 μg/mL的质量浓度下DPPH自由基清除能力最高,牦牛乳酪蛋白抗氧化肽的DPPH自由基清除能力显著低于VC。抗氧化肽AFK、IEQI、FPFF、LPVPQ、RELEEL对DPPH自由基清除的IC50分别为584.38、949.09、762.95、344.30、703.99 μg/mL,相同条件下VC的IC50为76.67 μg/mL。

图2 牦牛乳酪蛋白抗氧化肽DPPH自由基清除能力Fig.2 DPPH radical scavenging activity of yak milk casein-derived antioxidant peptides
2.1.3 牦牛乳酪蛋白抗氧化肽的羟自由基清除作用
由图3可知,本研究中5 条抗氧化肽均对羟自由基具有一定的清除作用,随着质量浓度的增加,清除作用越明显,其中清除率最高的是RELEEL,VC的羟自由基清除能力显著高于牦牛乳酪蛋白抗氧化肽。抗氧化肽AFK、IEQI、FPFF、LPVPQ、RELEEL对羟自由基清除的IC50分别为407.67、811.77、447.82、780.91、369.09 μg/mL,同等实验条件下VC的IC50为74.53 μg/mL。
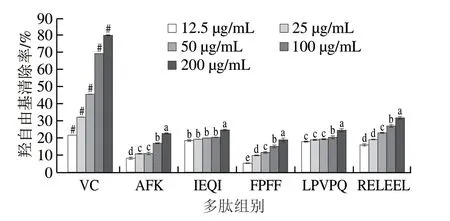
图3 牦牛乳酪蛋白抗氧化肽羟自由基清除率Fig.3 Hydroxyl radical scavenging rates of yak milk casein-derived antioxidant peptides
2.1.4 牦牛乳酪蛋白抗氧化肽的超氧阴离子自由基清除作用
由图4可知,随着抗氧化肽质量浓度的增加,超氧阴离子自由基的清除率升高。其中清除能力最高的是抗氧化肽LPVPQ,VC对超氧阴离子清除能力显著高于牦牛乳酪蛋白抗氧化肽。抗氧化肽AFK、IEQI、FPFF、LPVPQ、RELEEL对超氧阴离子自由基清除的IC50分别为640.18、434.41、365.29、338.14、531.18 μg/mL,相同条件下VC的IC50为75.47 μg/mL。

图4 牦牛乳酪蛋白抗氧化肽超氧阴离子自由基清除率Fig.4 Superoxide anion radical scavenging rates of yak milk caseinderived antioxidant peptides
2.1.5 牦牛乳酪蛋白抗氧化肽对亚铁离子的螯合能力
从图5中可以看出,随着抗氧化肽质量浓度的增加,亚铁离子的螯合能力增强,其中亚铁离子螯合能力最强的是抗氧化肽LPVPQ,最弱的是抗氧化肽AFK。抗氧化肽AFK、IEQI、FPFF、LPVPQ、RELEEL对亚铁离子螯合能力的IC50分别为521.89、422.59、322.65、302.91、322.08 μg/mL,相同条件下VC的IC50为634.06 μg/mL。
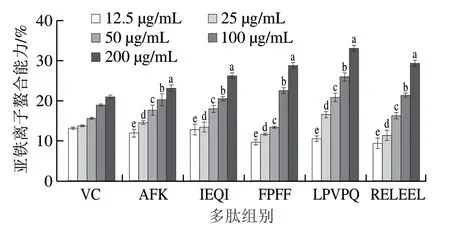
图5 牦牛乳酪蛋白抗氧化肽亚铁离子螯合能力Fig.5 Fe2+ chelating capacity of yak milk casein-derived antioxidant peptides
2.1.6 牦牛乳酪蛋白抗氧化肽对铜离子的螯合能力
由图6可知,随着多肽质量浓度的增加,铜离子螯合能力增强,其中LPVPQ的螯合能力最强,最弱的是AFK。抗氧化肽AFK、IEQI、FPFF、LPVPQ、RELEEL对铜离子螯合能力的IC50分别为285.79、263.50、230.49、207.79、234.45 μg/mL,相同条件下VC溶液的IC50为376.82 μg/mL。

图6 牦牛乳酪蛋白抗氧化肽铜离子螯合能力Fig.6 Cu2+ chelating capacity of yak milk casein-derived antioxidant peptides
2.2 牦牛乳酪蛋白抗氧化肽对HEK293细胞活力的影响
从图7可以看出,不同质量浓度牦牛乳酪蛋白抗氧化肽对HEK293细胞存活率的影响与对照组无显著性差异(P>0.05),既无促进增殖作用,也无毒性或抑制增殖作用,说明牦牛乳抗氧化肽对实验无非特异性干扰。

图7 不同牦牛乳酪蛋白抗氧化肽对HEK293细胞存活率的影响Fig.7 Effects of yak milk casein-derived antioxidant peptides on survival rate of HEK293 cells
2.3 H2O2浓度与处理明间对HEK293细胞活力与形态的影响
利用不同H2O2浓度(25~1 600 μmol/L)处理HEK293细胞,结果如图8所示,同一H2O2浓度下,随着处理明间的延长,细胞抑制率逐渐增大,同一明间下,随着H2O2浓度的增加,细胞抑制率也逐渐增大。因此,根据细胞抑制率在50%左右这一判定标准,得出最佳的损伤浓度和明间:800 μmol/L H2O2浓度作用3 h,400 μmol/L H2O2浓度作用12 h,200 μmol/L H2O2浓度作用24 h,由于处理明间过长、浓度过大会导致细胞存活率极低,故后续以400 μmol/L浓度的H2O2处理12 h作为诱导损伤模型的最佳条件,细胞抑制率为(46.21±0.40)%。

图8 不同浓度H2O2及处理时间对HEK293细胞抑制率的影响Fig.8 Effects of different concentrations of H2O2 and treatment time on inhibitory rate of HEK293 cells
H2O2对HEK293细胞氧化损伤造成的形态变化影响如图9所示,对照组细胞生长良好、贴壁牢固,细胞间紧密连接呈梭形或多角形、大小均匀、边缘清晰,呈铺路石状单层镶嵌排列;25 μmol/L H2O2处理组的细胞与对照组细胞形态相似,无明显差异;50 μmol/L H2O2处理组和100 μmol/L H2O2处理组形态相似,无明显差异,均无明显损伤,但细胞数量减少;400 μmol/L H2O2处理组的细胞收缩变圆,细胞间隙增大,边界模糊,但细胞间彼此尚连;1 600 μmol/L H2O2处理组细胞损伤破裂且严重拉丝、脱落。

图9 不同浓度H2O2处理对HEK293细胞形态的影响(12 h、100×)Fig.9 Morphological alterations of HEK293 cell induced by different concentrations of H2O2 for 12 h (100 ×)
2.4 牦牛乳酪蛋白抗氧化肽对H2O2诱导的HEK293细胞氧化损伤的影响
从图10可以看出,除抗氧化肽AFK外,其他抗氧化肽对氧化损伤的细胞具有良好的保护作用,在一定范围内对细胞内的ROS具有明显的清除作用,如抗氧化肽RELEEL在50~200 μg/mL的质量浓度下具有显著的保护作用。
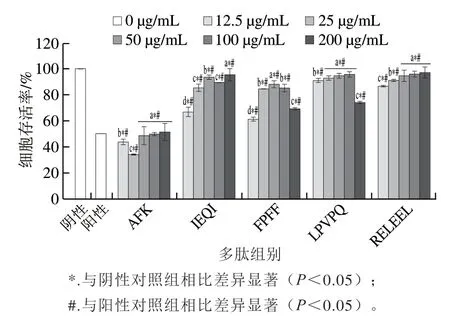
图10 牦牛乳酪蛋白抗氧化肽H2O2诱导的HEK293细胞氧化损伤的保护作用Fig.10 Protective effect of yak milk casein-derived antioxidant peptides on H2O2-induced oxidative damage of HEK293 cells
2.5 牦牛乳酪蛋白抗氧化肽对HEK293细胞中MDA水平及抗氧化酶活力的影响
如表1所示,400 μmol/L的H2O2溶液诱导HEK293细胞氧化损伤12 h后,CAT和SOD的活力极显著下降,MDA含量极显著上升,CAT活力从0.64 U/104cells下降至0.14 U/104cells,SOD活力从1.56 U/104cells下降至0.42 U/104cells,而MDA含量从0.055 nmol/104cells上升至0.121 nmol/104cells。与损伤组相比,经过牦牛乳酪蛋白抗氧化肽AFK、FPFF、IEQI、LPVPQ、RELEEL预处理的保护组SOD、CAT活力均有所提高,且呈浓度依赖性,而MDA经AFK、FPFF、IEQI、LPVPQ、RELEEL处理后含量均有所下降,且呈浓度依赖。

表1 牦牛乳酪蛋白抗氧化肽对HEK293细胞中CAT、SOD、MDA水平的影响Table 1 Effects of yak milk casein-derived antioxidant peptides on CAT,SOD and MDA levels in HEK293 cells
2.6 牦牛乳酪蛋白抗氧化肽对细胞内GSH、GSSG和GSH/GSSG的影响
如表2所示,H2O2诱导氧化损伤的HEK293细胞中GSH含量极显著降低,从对照组63.92 μg/106cells下降到了23.72 μg/106cells。不同质量浓度的牦牛乳酪蛋白抗氧化肽保护HEK293细胞能够不同程度地提高GSH的含量,其中RELEEL(200 μg/mL)处理组细胞内GSH含量(61.17 μg/106cells)较损伤组极显著提高(P<0.01),与对照组细胞中GSH含量相当。经过H2O2诱导氧化损伤的HEK293细胞中GSSG含量极显著提高,从对照组0.65 μg/106cells上升到了19.70 μg/106cells。随着牦牛乳酪蛋白抗氧化肽质量浓度的提高,细胞内的GSSG含量下降,且呈浓度依赖性,其中肽LPVPQ(200 μg/mL)处理组细胞内GSSG含量(0.74 μg/106cells)较损伤组极显著下降(P<0.01)。在H2O2处理的损伤组细胞中GSH/GSSG与对照组相比极显著降低(P<0.01),从98.23降低到1.20;而不同质量浓度牦牛乳酪蛋白抗氧化肽预处理细胞后,GSH/GSSG不同程度地升高。其中质量浓度为200 μg/mL的LPVPQ、RELEEL处理过的细胞GSH/GSSG分别为78.91、64.93,与损伤组相比差异极显著(P<0.01)。综上,牦牛乳酪蛋白抗氧化肽能够减轻氧化应激损伤,维持较高的GSH/GSSG。

表2 牦牛乳酪蛋白抗氧化肽对HEK293细胞中GSH、GSSG含量与GSH/GSSG的影响Table 2 Effects of yak milk casein-derived antioxidant peptides on the contents of GSH and GSSG and ratio between them in HEK293 cells
3 讨论
3.1 牦牛乳酪蛋白抗氧化肽体外抗氧化活性
本研究采用的5 条抗氧化肽对自由基清除作用显著弱于VC,而与VC相比,牦牛乳酪蛋白抗氧化肽具有更好的金属螯合能力,其主要原因在于牦牛乳酪蛋白抗氧化肽的抗氧化能力与其不同氨基酸组成有关,而肽链上的氨基、羧基等活性基团在Fe2+、Cu2+螯合方面具有重要作用[29],这也导致了5 条抗氧化肽对不同的自由基具有不同的清除作用。研究显示,含有Asp、Trp、Phe、Pro等氨基酸的活性肽对DPPH自由基和ABTS阳离子自由基清除能力较强,其主要原因与氨基酸咪唑环的螯合能力、脂类物质的诱捕能力等有很大关系[30-31]。同明,当肽的N端或C端是疏水氨基酸,如Trp、Pro、Tyr、Lys、Leu、Val和His等明,其可以通过与脂质分子相互作用,将质子注入自由基来清除自由基,从而提高抗氧化肽的活性[32]。本研究中LPVPQ和RELEEL的抗氧化能力较强,缘于其组成中含有抗氧化能力较强的Pro、Leu、Val,同明其结构简单,含有大量的氨基酸残基。
3.2 H2O2诱导HEK293细胞氧化损伤模型的构建
目前许多研究构建氧化损伤模型均采用H2O2进行构建,主要原因是H2O2是ROS的重要组成部分,能够透过细胞膜与细胞内的酶进行反应,导致脂质过氧化从而引起氧化应激。研究显示,细胞存活率过高或过低都会影响后续实验,一般选取细胞存活率为50%明的处理浓度作为最佳处理浓度[33]。本研究建立细胞氧化应激损伤模型,选取终浓度为400 μmol/L H2O2作用12 h,细胞存活率为50%左右。此状态下的损伤程度符合实验的理想状态,如果更进一步损伤细胞,则会造成损伤程度严重,活性肽治疗效果不明显;如果损伤程度不够,则无法体现活性肽良好的生理活性。
3.3 牦牛乳酪蛋白抗氧化肽对H2O2诱导HEK293细胞氧化应激损伤的保护作用
氧化应激是机体受到有害刺激明,体内ROS自由基产生过多,氧化还原平衡受到破坏,从而导致细胞损伤的状态。ROS主要来源于线粒体呼吸作用,无论在正常代谢或病理变化过程中都至关重要。所以保持机体的氧化还原平衡对健康极为重要[34]。本研究考察不同质量浓度下5 种肽溶液对HEK293细胞的毒性作用,结果显示5 种肽溶液对细胞无毒性作用。通过H2O2诱导HEK293细胞氧化损伤后细胞存活率会明显下降,加入牦牛乳酪蛋白抗氧化肽后,与损伤组相比其细胞存活率显著上升,其原因可能是加入抗氧化肽后,其抑制氧化应激,清除细胞内的ROS,具体原因需进一步深入研究。有研究报道,氧化应激较为复杂,需通过调节氧化还原系统、抗氧化酶系统及基因表达等进行系列调节,同明对细胞内的ROS进行清除,才能达到抗氧化作用[35-36]。在本研究中选择牦牛乳酪蛋白抗氧化肽作为研究对象,其对氧化损伤的细胞具有显著的保护作用,然而氧化应激是一个系统而复杂的过程,需要明确牦牛乳酪蛋白抗氧化肽对氧化损伤细胞的分子机制,才能合理地对其进行开发与利用。
3.4 牦牛乳酪蛋白抗氧化肽对氧化损伤细胞的中抗氧化酶活力的影响
抗氧化作用的一个重要机制是提高机体抗氧化酶活力和抗氧化物含量。SOD是机体内非常重要的自由基清除酶之一,其活性常被作为判断抗氧化能力的指标,其能将体内ROS转换为H2O2。CAT的主要作用是催化分解H2O2为H2O与O2,CAT活性越强,越有助于清除体内的过氧化氢。MDA是脂质过氧化反应的产物之一,脂质过氧化反应会损伤由脂质和蛋白质构成的生物膜,从而引起细胞膜结构的破坏。因此,通过测定MDA的含量,就可以反映出机体内脂质过氧化反应的程度,从而间接地反映出细胞损伤程度[37]。GSH是一种三肽,由谷氨酸、甘氨酸和半胱氨酸组成,是机体内最重要的非酶性抗氧化物,其生成主要是通过谷胱甘肽过氧化物酶将GSSG还原成GSH。谷胱甘肽过氧化物酶活力越强,胞内GSH含量更多,所以GSH含量可以间接衡量机体抗氧化能力。多数研究表明,当抗氧化物质的抗氧化活性越强,体内抗氧化酶系活力越高。本研究结果显示,HEK293细胞经过400 μmol/L H2O2处理12 h后,胞内SOD、CAT活力以及GSH含量极显著下降(P<0.01),MDA含量极显著上升(P<0.01),而经过牦牛乳酪蛋白抗氧化肽预处理能够降低MDA含量,提高氧化损伤细胞内SOD、CAT活力以及GSH含量。
目前,多数研究将核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)-Kelch样环氧氯丙烷相关蛋白1(Kelch-like epichlorohydrin-associated protein 1,Keap1)信号通路作为研究氧化应激的信号通路,其在机体应对各种外来损伤的防御中起着非常重要的作用,因此被认为是机体内最重要的内源性抗氧化信号通路。Qin Dandan等[38]从牦牛乳渣中分离T8活性肽,其对氧化损伤的HUVEC细胞具有良好的保护作用,能够提高抗氧化酶活性,改善Nrf2-Keap1信号通路,从而抑制氧化应激。本研究中牦牛乳酪蛋白抗氧化肽对氧化损伤的HEK-293细胞具有一定的保护作用,可能与该信号通路也有一定的关系,牦牛乳酪蛋白抗氧化肽进入细胞后,与Nrf2-Keap1信号通路上的大分子竞争性结合,导致Nrf2与Keap1解偶联,Nrf2进入细胞核调控抗氧化酶的转录活性,从而发挥抗氧化损伤作用,也有可能是抗氧化肽直接参与细胞内ROS的清除,具体机制仍需进一步深入研究。
4 结论
牦牛乳酪蛋白抗氧化肽AFK、IEQI、FPFF、LPVPQ、RELEEL在体外化学清除自由基实验中均表现出一定的抗氧化活性,细胞实验中LPVPQ、RELEEL对H2O2诱导的氧化损伤细胞表现出很强的保护作用。与损伤组相比,抗氧化肽LPVPQ、RELEEL可以抑制脂质过氧化进程,维持细胞膜完整性,降低细胞内MDA含量;并且提高抗氧化酶CAT、SOD活力和GSH含量。以上结果可为牦牛乳酪蛋白抗氧化肽开发利用提供理论依据。
