2 种青稞多糖对胰α-淀粉酶的抑制作用
2023-12-14李志鹏周晨熠潘书童崔泽文王光强艾连中
李志鹏,周晨熠,潘书童,崔泽文,谢 凡,王光强,艾连中,张 汇
(上海理工大学健康科学与工程学院,上海食品微生物工程技术研究中心,上海 200093)
淀粉在体内的消化速率与人体健康息息相关。研究表明,淀粉的快速消化会引起餐后血糖的升高,从而诱发代谢性疾病的发生,如II型糖尿病和心血管疾病,而通过饮食管理调控淀粉消化速率可有效降低代谢性疾病发生的风险[1]。α-淀粉酶和α-葡萄糖苷酶是人体中重要的消化酶,直接参与淀粉的消化[2]。淀粉在进入人体消化道后,通过α-淀粉酶水解成低聚糖,这些低聚糖在α-葡萄糖苷酶的作用下转化成葡萄糖,并经小肠吸收进入血液,导致餐后血糖升高[3]。因此,抑制胰α-淀粉酶活性可能是延缓淀粉消化,调控淀粉类食物餐后血糖水平的有效途径,从而预防和缓解II型糖尿病等代谢性疾病[4]。
研究表明,膳食多糖与人体健康息息相关,增加膳食多糖的摄入可以降低肥胖、心血管疾病、II型糖尿病的患病风险[5-6]。谷物中含有丰富的膳食多糖,如阿拉伯木聚糖和β-葡聚糖。青稞是大麦的变种,主要种植在高海拔和寒冷地带[7]。青稞中含有丰富的膳食多糖,其中青稞阿拉伯木聚糖(highland barley arabinoxylan,HBAX)和青稞β-葡聚糖(highland barleyβ-glucan,HBBG)分别是来源于青稞麸皮和胚乳中的主要膳食多糖[8]。研究表明,HBAX由6 个阿拉伯木聚糖重复单元通过β-1,4糖苷键连接而成,其阿拉伯糖和木糖的物质的量比为0.58,与其他谷物麸皮中的阿拉伯木聚糖结构类似[9-10]。HBBG则是以三糖和四糖组成的线性β-葡聚糖,其三糖和四糖比例为1∶1,与燕麦(三糖和四糖比例为1.5∶2.3)等谷物的β-葡聚糖差异显著[11-12]。有研究表明,谷物多糖会与淀粉相互作用,改变淀粉凝胶的糊化和流变特性,从而减慢淀粉在体内的消化速率[13]。课题组前期研究发现,HBAX和HBBG对淀粉的糊化和流变特性有不同的影响,HBAX可以附着在淀粉颗粒表面,降低淀粉体系黏度,HBBG则与淀粉分子发生交联,增加了淀粉体系黏度,这表明不同青稞多糖调控淀粉消化的作用机制可能不同[14]。此外,一些研究还表明谷物多糖还可通过抑制α-淀粉酶活性延缓淀粉的消化[15]。然而,谷物多糖通过抑制胰α-淀粉酶调控淀粉消化速率的作用机制尚不明确,解析不同谷物多糖延缓淀粉消化和降低淀粉类主食餐后血糖响应的作用机制对预防和控制相关代谢疾病的发生和发展将发挥重要作用。
本研究以2 种青稞多糖HBAX和HBBG为原料,通过酶活性抑制实验比较两者对胰α-淀粉酶活性的影响,通过酶促动力学分析2 种多糖对胰α-淀粉酶抑制方式和类型的差异,采用荧光光谱分析2 种多糖对胰α-淀粉酶的相互作用关系,以期阐明HBAX和HBBG抑制胰α-淀粉酶活性的异同。本研究将为不同青稞多糖在淀粉消化调控和低血糖生成指数食物中的应用提供一定理论依据。
1 材料与方法
1.1 材料与试剂
青稞仁和青稞麸皮均来自青海省;猪胰α-淀粉酶和可溶性淀粉(来源于马铃薯)上海源叶生物科技有限公司;磷酸二氢钠、磷酸氢二钠、酒石酸钾钠、3,5-二硝基水杨酸、苯酚、氢氧化钠 国药集团化学试剂有限公司。所有化学试剂均为国产分析纯。
1.2 仪器与设备
725型紫外-可见分光光度计 上海光谱仪器有限公司;RF6000荧光分光光度计 日本岛津公司;C-MAG MS10磁力搅拌器 德国IKA公司;DK-8AD型电热恒温水槽 上海一恒科技有限公司。
1.3 方法
1.3.1 2 种青稞多糖的制备
参考Zhang Hui等[11]的方法,从青稞仁中提取β-葡聚糖。青稞仁粉分散于70%乙醇溶液,搅拌12 h(料液比1∶10(g/mL)),去除油脂、低聚糖等成分。脱脂后的青稞仁粉按料液比1∶10(g/mL)加入去离子水和高温α-淀粉酶(4 000 U/g),在95 ℃反应30 min,冷却至室温后,加入NaOH溶液使体系中NaOH浓度为0.5 mol/L,室温下搅拌3 h,离心,上清液用盐酸(2 mol/L)调节pH 5.0,静置过夜后4 500 r/min离心,上清液透析,浓缩,冷冻干燥得到HBBG,得率为4.3%。通过AOAC 991.43的方法,测得β-葡聚糖含量为85.50%[11]。
根据徐中香等[16]的方法,从青稞麸皮中提取阿拉伯木聚糖。青稞麸皮粉采用95%乙醇溶液脱脂,脱脂的青稞麸皮粉按料液比1∶10(g/mL)加入去离子水和高温α-淀粉酶(4 000 U/g),95 ℃反应30 min,冷却至室温后,离心,料渣干燥。脱脂、脱淀粉后的青稞麸皮粉按料液比1∶25(g/mL)加入0.375 mol/L的NaOH溶液,55 ℃搅拌萃取3 h,离心,上清液用盐酸(2 mol/L)调节pH 4.5,静置过夜后4 500 r/min离心,上清液透析,浓缩,冷冻干燥得到HBAX,得率为3.7%。根据苗露等[17]的方法,通过高效阴离子交换色谱测得阿拉伯木聚糖含量为75.57%。
1.3.2 2 种青稞多糖对胰α-淀粉酶的抑制作用测定
参考张永均等[18]的方法并进行适当修改。将可溶性淀粉(来源于马铃薯,10 mg/mL)溶于磷酸盐缓冲液(phosphate buffered saline,PBS)(0.02 mol/L,pH 6.8)溶液中,置于95 ℃条件下糊化20 min,冷却至室温后使用。将HBAX或HBBG溶解在相同浓度PBS中配制成不同浓度的多糖溶液。胰α-淀粉酶(1 mg/mL)溶解在相同浓度PBS中并在5 000 r/min离心10 min,取上清液于4 ℃保存。
移取适量的胰α-淀粉酶溶液与多糖溶液或PBS(空白)混合,使HBAX或HBBG终质量浓度为0~7 mg/mL或者0~15 mg/mL,胰α-淀粉酶终质量浓度为0.5 mg/mL。将混合溶液于37 ℃孵育10 min后加入糊化后的淀粉溶液0.5 mL(10 mg/mL),混匀后继续孵育5 min。反应结束后加入1 mL 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)溶液,混匀,沸水浴5 min,反应结束后冷却至室温,再加入10 mL去离子水稀释,混合均匀后测定混合溶液在540 nm波长处的吸光度。
背景组是以灭活酶溶液与多糖溶液或者PBS(空白)混合,其余步骤一致。IC50值为抑制50%酶活力所需的抑制剂质量浓度,通过对抑制率曲线多变量非线性回归计算获得。不同青稞多糖对胰α-淀粉酶的抑制率通过式(1)计算:
式中:A1为样品组与样品背景组吸光度的差值;A2为对照组(以同等体积PBS代替多糖溶液)与对照背景组吸光度的差值。
1.3.3 2 种青稞多糖对胰α-淀粉酶的抑制方式分析
应注重学科最新成果和技术的运用 在介绍国内外最新理论或国家政策的同时,还应增加最新的技术成果的应用,加强教材的时代性和科学性。
按照1.3.2节方法,在1 mL反应体系中,移取不同质量浓度的HBAX(0~1.6 mg/mL)或HBBG(0~8 mg/mL)溶液0.25 mL,加入不同质量浓度酶(0.1~0.4 mg/mL)溶液0.25 mL,37 ℃孵育10 min后加入糊化后的可溶性淀粉(16 mg/mL)溶液0.5 mL,继续孵育2 min,反应结束后加入1 mL DNS试剂,混匀,沸水浴5 min,冷却至室温,加入10 mL去离子水稀释,混合均匀后测定混合溶液在540 nm波长处的吸光度。通过测定反应体系吸光度的变化,作出酶促反应速率(ΔA/min)与胰α-淀粉酶质量浓度的关系曲线图。根据曲线图特点判断HBAX和HBBG对胰α-淀粉酶的抑制方式(可逆或不可逆)。
1.3.4 2 种青稞多糖对胰α-淀粉酶的抑制类型分析
按照1.3.2节方法,在1 mL反应体系中,移取不同质量浓度的HBAX(0~1.6 mg/mL)或HBBG(0~8 mg/mL)溶液0.25 mL,加入0.4 mg/mL酶溶液0.25 mL,37 ℃孵育10 min后加入不同质量浓度糊化后的可溶性淀粉溶液0.5 mL(1~9 mg/mL),继续孵育2 min,反应结束后加入1 mL DNS试剂,混匀,沸水浴5 min,冷却至室温,加10 mL去离子水稀释,混匀后测定混合溶液在540 nm处的吸光度。以可溶性淀粉溶液浓度的倒数1/S为横坐标,酶促反应速率(ΔA/min)的倒数1/V为纵坐标,作出Lineweaver-Burk双倒数曲线图,根据曲线特点判断HBAX和HBBG对胰α-淀粉酶的抑制类型。
竞争性抑制:
非竞争性抑制:
以直线的斜率和纵坐标截距分别对HBAX和HBBG质量浓度进行二次作图,可求得抑制剂对酶的抑制常数KI和酶-底物复合物的抑制常数KIS,计算如式(4)、(5)所示:
式中:V为初始反应速率/(ΔA/min);S为底物质量浓度/(m g/m L);Vmax为最大初始反应速度/(ΔA/min);I为抑制剂质量浓度/(mg/mL);Km为米氏常数/(mg/mL);KI和KIS分别为抑制剂与酶和酶-底物复合物结合的平衡常数/(mg/mL)。
1.3.5 2 种青稞多糖对胰α-淀粉酶荧光猝灭分析
1.3.6 2 种青稞多糖对胰α-淀粉酶荧光猝灭机制分析
荧光猝灭可分为动态猝灭和静态猝灭,猝灭类型的判断可由KSV或Ka值区分。为了验证青稞多糖与胰α-淀粉酶之间的猝灭机理,采用Stern-Volmer方程分析猝灭数据,见式(6):
式中:F0为不存在猝灭剂时相对稳定的荧光强度;F为存在猝灭剂时荧光强度;[Q]为猝灭剂质量浓度/(mg/mL);τ0为没有猝灭剂存在情况下荧光分子的平均寿命,约为10-8s;Ka为双分子猝灭速率常数/(mL/(mg·s));KSV为Stern-Volmer猝灭常数/(mL/mg)。
2 种青稞多糖的结合常数和结合位点数由式(7)确定:
式中:K为表观结合常数/(mL/mg);n为结合位点数。
1.4 数据分析
所有实验一式三份,并使用Microsoft Excel计算各参数平均值和标准差,由Origin 2021软件绘图。
2 结果与分析
2.1 2 种青稞多糖对胰α-淀粉酶的抑制作用分析
淀粉需要通过α-淀粉酶的初步水解,才能被α-葡萄糖苷酶水解为可供人体吸收的葡萄糖。因此,抑制胰α-淀粉酶活性可有效地降低淀粉的消化速率。据报道,一些天然多糖能抑制胰α-淀粉酶活性[20]。为研究不同青稞多糖对胰α-淀粉酶的抑制作用,在相同质量浓度的胰α-淀粉酶溶液中加入不同浓质量度多糖溶液,分析HBAX和HBBG对胰α-淀粉酶活性的影响,结果如图1所示。随着HBAX和HBBG质量浓度的升高,两者对胰α-淀粉酶的抑制率均增大,这表明HBAX和HBBG均能抑制胰α-淀粉酶活性。但两者对胰α-淀粉酶抑制速率变化存在显著差异:随着HBAX质量浓度的增加,其对胰α-淀粉酶的抑制作用逐渐增大,最后达到最大抑制率74%左右;而HBBG在低质量浓度范围(0~7 mg/mL)时,对胰α-淀粉酶的抑制率变化不大,从17%上升至27%,在高质量浓度范围(7~15 mg/mL),对胰α-淀粉酶的抑制率从27%快速上升至56%。HBAX和HBBG对胰α-淀粉酶的IC50值分别为3.26 mg/mL和13.23 mg/mL,这表明在相同质量浓度下,HBAX对胰α-淀粉酶的抑制效果显著优于HBBG。综上所述,HBAX和HBBG对胰α-淀粉酶都具有抑制作用,但是HBAX的抑制活性强于HBBG。
2.2 不同青稞多糖对胰α-淀粉酶的抑制方式判断
HBAX和HBBG对胰α-淀粉酶活性的抑制能力不同,这可能与其抑制机制不同有关。由图2可知,在相同多糖质量浓度下,酶初始反应速率随胰α-淀粉酶质量浓度的增加而增加。此外,不同质量浓度HBAX和HBBG酶初始反应速率与酶质量浓度的线性关系曲线都通过原点,表明HBAX和HBBG对胰α-淀粉酶的抑制均为可逆抑制[21]。可逆性抑制说明HBAX和HBBG均是通过非共价键(疏水相互作用、氢键等)与胰α-淀粉酶相互作用,导致酶活力降低[22]。结果表明,HBAX与HBBG对胰α-淀粉酶的抑制方式相同,但是这2 种多糖对胰α-淀粉酶的抑制类型还需要进一步研究。
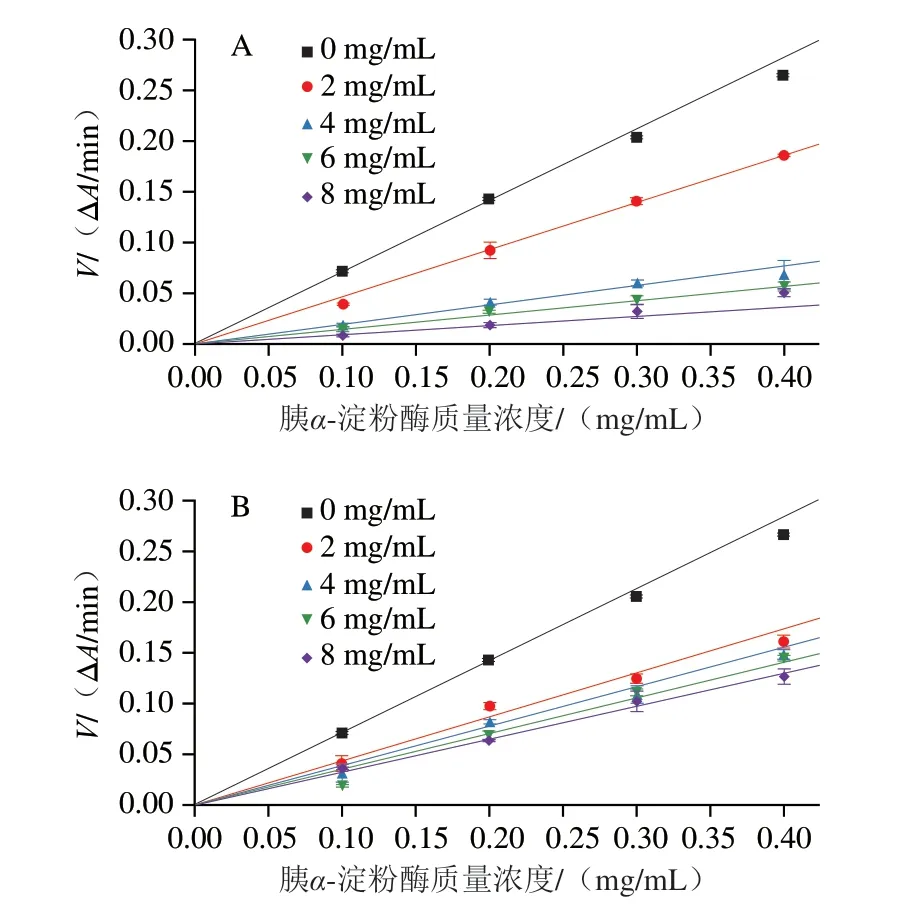
图2 不同质量浓度HBAX(A)和HBBG(B)对胰α-淀粉酶反应速率的影响Fig.2 Effects of HBAX (A) and HBBG (B) at various concentrations on the reaction rate of pancreatic α-amylase
2.3 2 种青稞多糖对胰α-淀粉酶的抑制类型判断
HBAX和HBBG对胰α-淀粉酶的抑制均为可逆抑制,而可逆抑制又分为竞争性抑制、非竞争性抑制、反竞争性抑制和混合型抑制[23]。通过Lineweaver-Burk双倒数图可判断2 种多糖对胰α-淀粉酶的抑制类型[24]。其中,拟合曲线在X轴上的截距代表-1/Km值,Y轴截距代表1/Vmax值。由图3A所示,随着HBAX质量浓度增加,Km值由1.89 mg/mL增大至2.04 mg/mL,Vmax值由0.17 ΔA/min减小至0.04 ΔA/min,这表明HBAX对胰α-淀粉酶的抑制为竞争性和非竞争性的混合型抑制。由图3B可知,随着HBBG质量浓度增加,Km值由5.26 mg/mL减小至3.57 mg/mL,Vmax值由0.28 ΔA/min减小至0.16 ΔA/min,这表明HBBG对胰α-淀粉酶的抑制为反竞争性和非竞争性的混合型抑制。竞争性和非竞争性混合抑制说明HBAX既能与淀粉竞争同一活性位点结合在酶的活性部位,阻碍酶和底物的结合,使酶促反应速率下降,又能通过非竞争性抑制与酶的非活性部位结合,形成酶-底物-抑制剂复合物,从而阻断酶促反应的进行[25]。反竞争性和非竞争性混合抑制说明HBBG不仅能够与酶的非活性部位结合,还能与酶-淀粉复合物结合,形成酶-底物-抑制剂复合物。
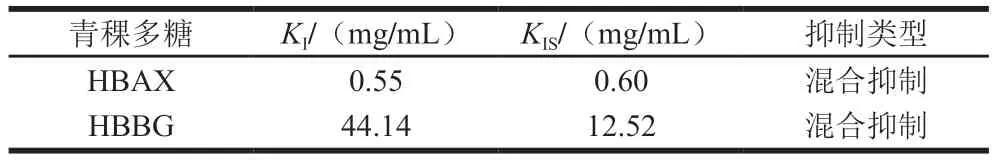
表1 HBAX和HBBG对胰α-淀粉酶的抑制常数Table 1 Inhibitory constants of HBAX and HBBG on the activity of pancreatic α-amylase
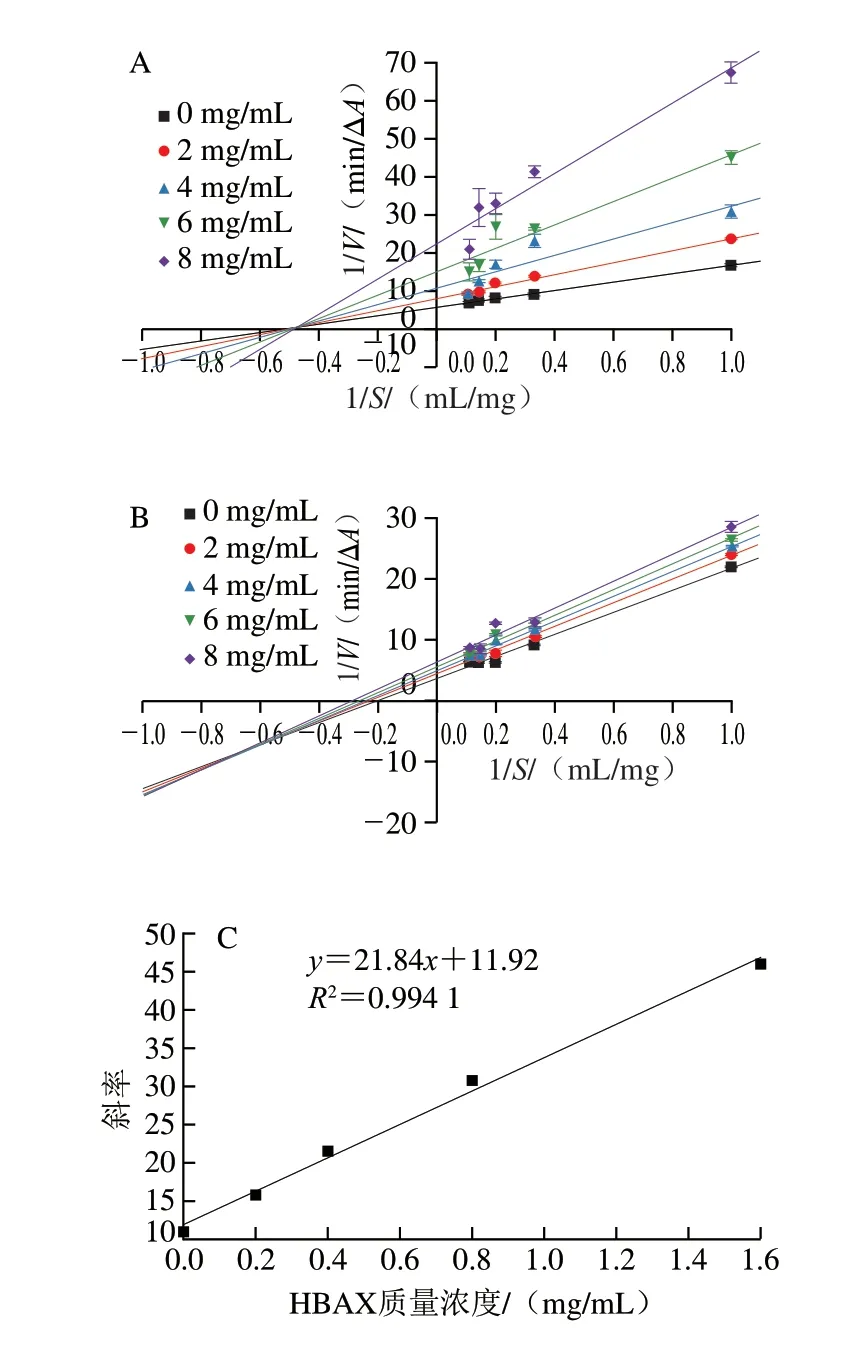
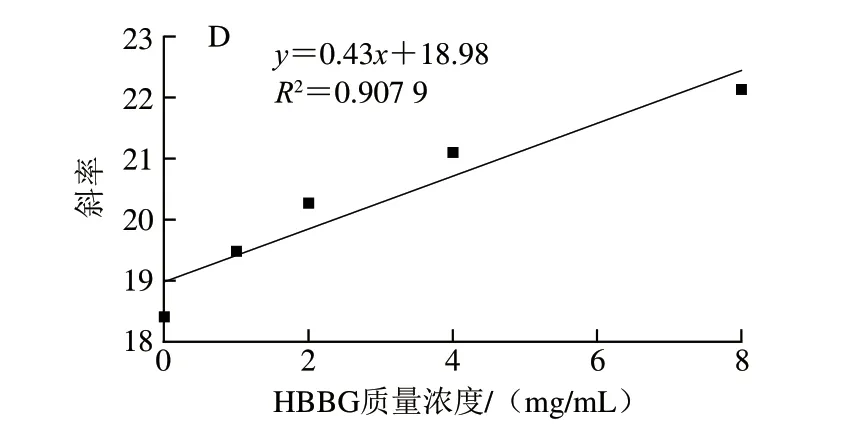
图3 不同质量浓度HBAX(A)、HBBG(B)抑制胰α-淀粉酶的Lineweaver-Burk及HBAX(C)、HBBG(D)质量浓度与斜率的关系Fig.3 Lineweaver-Burk plots for inhibition of pancreatic α-amylase by HBAX (A) and HBBG (B) at different concentrations,and plots of the slope versus the concentration of HBAX (C) and HBBG (D)
HBAX和HBBG对胰α-淀粉酶的抑制类型不同,其在胰α-淀粉酶上的结合位点数也可能不同。通过斜率与HBAX(R2=0.994 1)或HBBG(R2=0.907 9)质量浓度作线性相关图,如图3C、D所示,表明HBAX和HBBG在胰α-淀粉酶上有一个或者一种结合位点[26]。综上所述,HBAX和HBBG在胰α-淀粉酶上的结合位点数相同,但2 种多糖对胰α-淀粉酶的抑制类型不同,这可能导致2 种多糖对胰α-淀粉酶产生不同的抑制效果。
2.4 2 种青稞多糖对胰α-淀粉酶的抑制常数计算
KI和KIS分别是抑制剂与酶或者酶-底物复合物结合的平衡常数,其值可以反映抑制剂和酶或酶-底物复合物亲和力的大小,亲和力越大,代表抑制剂与酶或酶-底物复合物结合越紧密,其抑制效果越好[27]。HBAX和HBBG的KI和KIS值如表1所示,HBAX的KI和KIS值均小于HBBG,说明HBAX对胰α-淀粉酶的抑制能力远大于HBBG,这与IC50值结果一致。HBAX的KI值小于KIS值,而HBBG的KI远大于KIS值,这说明HBAX和HBBG与酶或者酶-底物复合物的亲和力不同,HBAX对酶的亲和力强于酶-底物,而HBBG对酶-底物复合物亲和力更强[28]。综上所述,虽然HBAX和HBBG都是混合型抑制,但是HBAX和HBBG对酶或酶-底物复合物亲和力不同,这可能是其对胰α-淀粉酶抑制效果不同的原因之一。
2.5 2 种青稞多糖对胰α-淀粉酶荧光光谱分析
酶抑制动力学分析结果表明,HBAX和HBBG对胰α-淀粉酶的抑制类型不同,HBAX更倾向于与酶直接结合,而HBBG更容易形成酶-底物-抑制剂复合物。但是,这2 种多糖与酶的相互作用机制仍不明确。通过荧光光谱不仅能监测多糖与蛋白质的结合,还能得出多糖与蛋白质结合机制、结合常数以及猝灭常数等信息[29]。胰α-淀粉酶的内源荧光性主要来源于色氨酸、苯丙氨酸和酪氨酸,其中色氨酸和酪氨酸的激发波长为280 nm,最大荧光强度在340 nm左右[29]。此外,最大荧光强度的波长能反映这些芳香族氨基酸所处微环境的变化[30]。如图4所示,随着多糖质量浓度增大,胰α-淀粉酶在340 nm处的荧光强度逐渐降低,这说明HBAX或HBBG与胰α-淀粉酶皆存在相互作用[31]。胰α-淀粉酶发生荧光猝灭表明青稞多糖可能与胰α-淀粉酶的色氨酸和酪氨酸发生静电相互作用或氢键作用,从而使酶的空间构象发生一定改变,导致酶活性下降。图4还表明在相同质量浓度水平下,HBAX对胰α-淀粉酶的荧光猝灭作用强于HBBG,说明HBAX与胰α-淀粉酶的相互作用强于HBBG,这与酶抑制作用实验结果一致。此外,随着HBAX质量浓度增加,胰α-淀粉酶的最大荧光强度波长发生红移现象,说明HBAX对胰α-淀粉酶的相互作用改变了胰α-淀粉酶中色氨酸和酪氨酸的微环境,胰α-淀粉酶的色氨酸和酪氨酸残基的疏水结构发生改变,极性增加,疏水性降低[32]。HBBG最大荧光强度的波长并未发生红移或者蓝移现象,说明HBBG不改变胰α-淀粉酶中色氨酸和酪氨酸的微环境。因此,HBAX和HBBG都能与胰α-淀粉酶相互作用,但是HBAX对胰α-淀粉酶内部微环境影响更大。

图4 不同质量浓度HBAX(A)和HBBG(B)对胰α-淀粉酶的荧光猝灭光谱Fig.4 Fluorescence quenching spectra of pancreatic α-amylase by HBAX (A) and HBBG (B) at various concentrations
2.6 2 种青稞多糖对胰α-淀粉酶结合位点和结合常数计算
荧光猝灭过程可分为动态猝灭和静态猝灭[33]。对于动态猝灭来说,随着温度的升高,反应体系的扩散系数增加,分子运动加快,猝灭常数KSV增大;反之,静态猝灭随着温度升高,相互作用产物遭到破坏,猝灭常数KSV减小[34]。通过Stern-Volmer方程,分析了3 个温度下(298、304、310 K)HBAX和HBBG对胰α-淀粉酶的荧光猝灭规律,结果如图5所示,荧光猝灭分析的KSV和Ka值的计算结果如表2所示。结果表明,当温度从298 K上升至310 K时,HBAX的KSV值从1.50 mL/mg降低至0.92 mL/mg,HBBG的KSV值从0.20 mL/mg降低至0.16 mL/mg,这表明HBAX和HBBG与胰α-淀粉酶的猝灭类型皆为静态猝灭[35]。根据文献报道,静态猝灭说明酶抑制剂与胰α-淀粉酶形成了非荧光复合物,从而引起荧光强度的降低[36]。此外,KSV值反映了多糖的扩散和与酶的碰撞对酶荧光寿命衰减速率的影响,HBAX的KSV值远大于HBBG,这说明HBAX对胰α-淀粉酶内源荧光的影响更大。

表2 HBAX和HBBG在不同温度下对胰α-淀粉酶的猝灭参数Table 2 Quenching parameters of HBAX and HBBG against pancreatic α-amylase at different temperatures
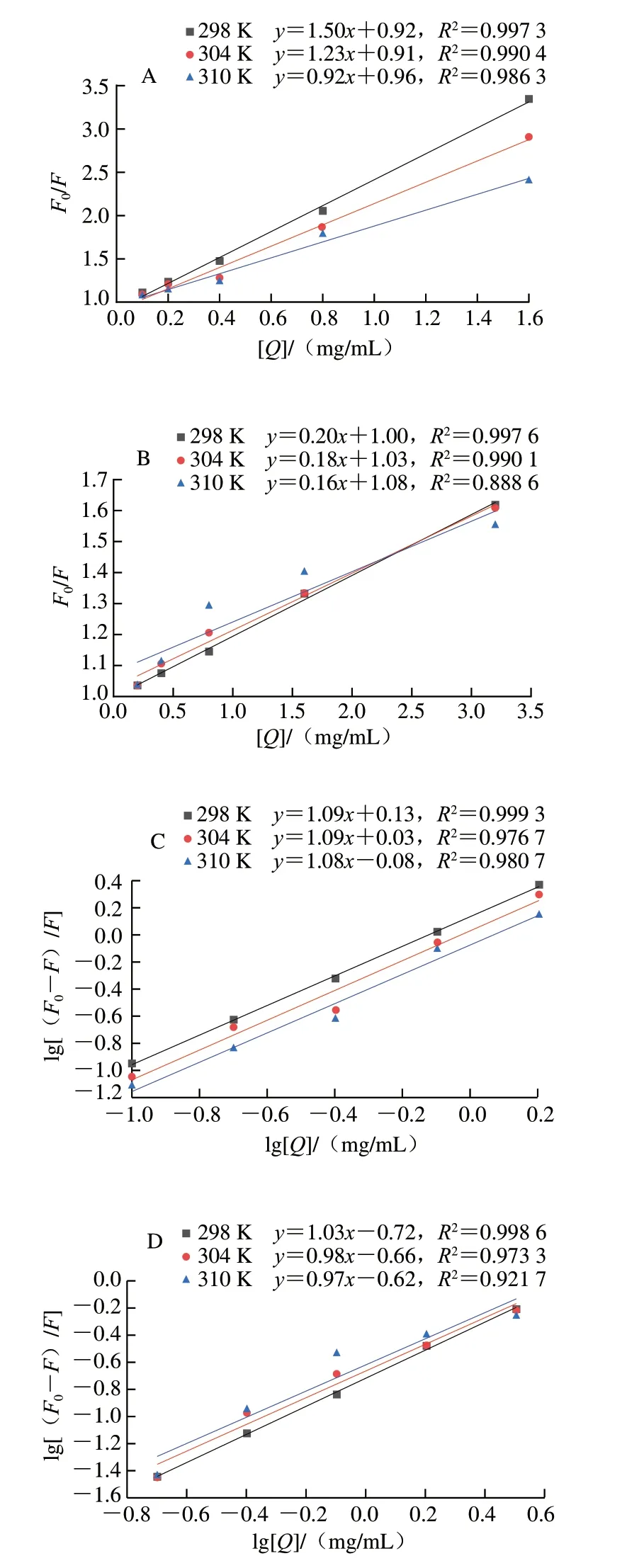
图5 HBAX(A)、HBBG(B)不同温度下对α-淀粉酶的Stern-Volmer曲线以及HBAX(C)、HBBG(D)对胰α-淀粉酶猝灭作用的对数曲线Fig.5 Stern-Volmer plots for the quenching of pancreatic α-amylase by HBAX (A) and HBBG (B) at different temperatures,and plots of lg[(F0-F)/F]versus lg[Q]for quenching effects of HBAX (C) and HBBG (D) on pancreatic α-amylase
HBAX和HBBG与胰α-淀粉酶的结合常数(K)和结合位点数(n)计算结果如表2所示。HBAX和HBBG在不同温度(298、304、310 K)下结合位点n均近似于1,推测HBAX和HBBG与胰α-淀粉酶有一个或一种类型的结合位点,这与前面Lineweaver-Burk图结果一致。同时,K值能反映抑制剂与酶的亲和力,K值越大,抑制剂与酶的亲和力越高。HBAX的K值远大于HBBG,说明HBAX对酶活性抑制强于HBBG,这与前面IC50值结果一致。综上所述,HBAX和HBBG在胰α-淀粉酶皆有一个或一种类型的结合位点,但是HBAX对胰α-淀粉酶的结构影响更大,这可能是其抑制作用更强的原因之一。
3 结论
通过酶促动力学和荧光猝灭分析比较了HBAX和HBBG对胰α-淀粉酶的抑制作用,证明了HBAX和HBBG通过与胰α-淀粉酶相互作用抑制酶促反应,但HBAX的抑制能力显著优于HBBG。酶促动力学分析表明HBAX不仅能与酶活性位点结合,还能形成酶-淀粉-抑制剂复合物阻碍酶反应,而HBBG只能和酶的非活性位点结合形成酶-淀粉-抑制剂复合物,这可能是HBAX抑制作用强于HBBG的原因之一。此外,HBAX和HBBG均能通过静态猝灭胰α-淀粉酶的内源荧光,但HBAX还能使胰α-淀粉酶内部疏水环境极性增加,这可能是HBAX抑制作用强于HBBG的另一重要原因。该研究表明,不同青稞多糖延缓淀粉消化和降低淀粉类主食餐后血糖响应的作用机制不同,后续将通过热力学理论进一步研究不同青稞多糖与α-淀粉酶相互作用的分子机理。
