中压制备色谱法分离黑果枸杞中2 个矮牵牛素花色苷及其对胰脂肪酶的抑制活性
2023-12-14张渌淘魏佳仪闫亚美曹有龙
米 佳,张渌淘,禄 璐,魏佳仪,金 波,罗 青,闫亚美,曹有龙
(宁夏农林科学院枸杞科学研究所/国家枸杞工程技术研究中心,宁夏 银川 750002)
黑果枸杞(Lycium ruthenicumMurr.),属茄科(Solanceae)枸杞属(LyciumL.),是近年来发现的多年生,抗旱、耐盐野生枸杞资源,主要分布于我国西北地区,在欧洲和中亚地区也有少量分布[1]。黑果枸杞富含花色苷类化合物,其花色苷含量占干果质量的1.5%~3.2%,远高于其他果蔬,是蓝莓花色苷含量的1.7 倍[2]。花色苷是花青素在自然状态下与各种单糖或双糖结合在一起形成的糖苷类化合物[3],黑果枸杞中富含不同于其他果蔬的花色苷,主要为芳香酸酰化的矮牵牛素花色苷及其同分异构体,有十余种[4],其中含量最高的为矮牵牛素-3-O-芸香糖(反式-对香豆酰基)-5-O-葡萄糖苷,其分子质量较大,结构同时具有矮牵牛素母核、芳香酸酰化、芸香糖和葡萄糖糖苷化的特征,在食源性材料中较为少见[5-7],研究发现黑果枸杞花色苷具有抗氧化、抗炎症、提高免疫、降血脂、抗肿瘤、改善记忆力[8-14]等多种功效。
胰脂肪酶是水解膳食中脂质的酶,抑制其活性能够降低人体对脂质的吸收,从而改善肥胖[15-16]。前期研究发现黑果枸杞花色苷提取物可与胰脂肪酶通过氢键和范德华力相结合,进而抑制胰脂肪酶的活性[17],且单体矮牵牛素-3-O-芸香糖(反式-对香豆酰基)-5-O-葡萄糖苷的活性高于粗提物[18],是较好的胰脂肪酶活性抑制剂。研究还表明,不同的花色苷单体可能存在活性差异,黑果枸杞花色苷的抗氧化能力与其结构中A、B环上的羟基基团数目、酰化程度、糖配基种类有关联[19-20],黑果枸杞花色苷具有抑制胰脂肪酶活性的作用,但黑果枸杞中存在不同的矮牵牛素花色苷对胰脂肪酶抑制活性尚未进行研究。因此有必要从黑果枸杞中分离制备获得不同的矮牵牛素花色苷单体,并比较其对其胰脂肪酶的抑制作用。
采用大孔树脂、凝胶树脂纯化黑果枸杞主要花色苷的研究已有不少报道,但多采用柱体积较小的常压柱,制备量小[21-22],杜霞[23]采用flash C18柱(80 g,25~35 μm,100 Å)联合中压快速分离系统制备黑果枸杞花色苷,获得了纯度为60.0%的矮牵牛素-3-芸香糖苷(对香豆酰)-5-葡萄糖苷,但目前对于同时制备2 个较高纯度黑果枸杞矮牵牛素花色苷的方法鲜见报道。大孔树脂、凝胶树脂等与中压制备色谱联合用于纯化多酚类物质具有快速、高效的效果,能从复杂的样品中富集到微量化合物[24-25]。本研究在对8 种大孔树脂对黑果枸杞花色苷的分离效果进行筛选后,选择最适于黑果枸杞花色苷分离纯化的大孔树脂,与中压制备色谱联用分离纯化黑果枸杞花色苷,并用LH-20凝胶树脂进一步纯化黑果枸杞花色苷,获得纯度较高的2 个黑果枸杞花色苷单体,采用超高效液相色谱(ultra-high performance liquid chromatography,UPLC)技术分析其相对纯度,超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)和核磁共振氢谱(1H nuclear magnetic resonance,1H NMR)技术对其结构进行鉴定,旨在为黑果枸杞花色苷的功效研究和开发利用提供基础。
1 材料与方法
1.1 材料与试剂
黑果枸杞为市售;AB-8、XAD-7、HPD100、ADS-7、D101、NKA-9、DA201、D4020大孔树脂 北京索莱宝科技有限公司;Sephadex LH-20树脂 美国GE公司;乙醇(食品级)、乙酸(色谱纯)国药集团化学试剂有限公司;甲醇(色谱纯)美国ACS公司;氘代甲醇、氘代三氟乙酸 上海柏飞化工科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
中压制备色谱仪系统(C620 Control System,C605 Pump Module,C640 UV Photometer,C660 Fraction Collector)、R-300旋转蒸发器 瑞士Büchi公司;TU1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;DC-1006低温恒温槽 上海菁海仪器有限公司;QYC 200恒温摇床 上海福马实验设备有限公司;1260高效制备液相色谱仪、C18色谱柱(4.6 mm×100 mm,1.8 μm)、ZORBAX SB-C18色谱柱(25 mm×250 mm,5 μm)美国安捷伦科技有限公司;H-class UPLC系统(ACQUITY PDA/ePDA检测器)美国沃特世科技有限公司;Q-Exactive HF液相色谱-质谱联用仪 美国赛默飞世尔科技有限公司;A-VANCE NEO 400 MHz NMR仪 德国布鲁克科技有限公司。
1.3 方法
1.3.1 黑果枸杞花色苷的提取
黑果枸杞去除坏果、果柄等杂质,粉碎后过40 目筛,用4‰的盐酸-无水乙醇溶液按料液比1∶30(g/mL)提取。在常温条件下提取30 min,滤液过0.45 μm滤膜,滤渣继续用相同方法提取2 次,合并滤液,45 ℃减压浓缩,冻干后得到花色苷粗提物。
1.3.2 花色苷含量的测定
参考文献方法[24],用pH值示差法进行测定。
式中:A为吸光度;C为花色苷质量浓度/(mg/mL);M为矢车菊-3-O-葡萄糖苷的分子质量(449.2 g/mol);n为稀释倍数;ε为消光系数(29 600 L/(mol·cm))。
1.3.3 大孔树脂分离纯化黑果枸杞花色苷
1.3.3.1 静态实验筛选树脂
静态吸附实验:准确称取经过预处理后的8 种大孔树脂各6.000 g置于100 mL具塞三角瓶中,精密加入黑果枸杞花色苷粗提液50.00 mL,25 ℃、100 r/min振荡24 h,在530 nm波长处测定剩余溶液的吸光度A1。按式(3)、(4)计算静态吸附量、吸附率。
静态解吸实验:向已吸附饱和的10 种树脂分别精密加入50 mL 70%乙醇+0.4%盐酸溶液,25 ℃、100 r/min振荡24 h。在530 nm波长处测定解吸液吸光度。按式(3)~(5)计算吸附量、吸附率和解吸率:
式中:qe为花色苷吸附量/(mg/g);A和D分别为吸附率/%和解吸率/%;C0和C1分别为吸附前和吸附后花色苷质量浓度/(mg/mL);A0和A1为吸附前和吸附后花色苷在530 nm波长处吸光度;A2为解吸后530 nm波长处吸光度;m为树脂的质量/g。
1.3.3.2 大孔树脂静态吸附-解吸动力学测定
将初步筛选出的3 种树脂,进行花色苷静态吸附和解吸的动力学实验,方法同1.3.3.1节,在吸附和解吸过程中,每隔30 min取0.5 mL,在530 nm波长处测定吸光度,直到吸附和解吸平衡。分别以吸附率和解吸率为纵坐标,时间为横坐标,绘制吸附解吸动力学曲线,确定纯化花色苷最佳的大孔树脂。
1.3.3.3 D101树脂静态吸附解吸条件优化
D101大孔树脂对不同质量浓度枸杞花色苷的吸附效果:在室温(25 ℃)下的恒温振荡器中,向装有1.000 g D101大孔吸附树脂的150 mL具塞三角瓶中分别加入不同质量浓度(0.010、0.018、0.036、0.051、0.100、0.137、0.153、0.180、0.200 mg/mL)的花色苷提取液50.00 mL,100 r/min振荡吸附4.5 h,测定滤液中剩余花色苷质量浓度,计算吸附量,确定最佳进样质量浓度。
花色苷溶液pH值对吸附效果的影响:用0.01 mol/L盐酸将70%乙醇溶液调至不同pH值(1.0、2.0、3.0、4.0、5.0),并分别配制质量浓度为0.179 mg/mL花色苷溶液,各取50 mL装入150 mL三角瓶中,各三角瓶中分别装入处理后的大孔树脂1.000 g,置于恒温振荡器中,以100 r/min吸附4.5 h。分别测定吸附前后的吸光度,计算大孔树脂的吸附率。
乙醇体积分数对D101树脂静态解吸效果的影响:准确称取已吸附饱和的大孔树脂1.000 g装入三角瓶中,分别加入50 mL体积分数50%、60%、70%、80%、90%的酸性乙醇溶液(pH 3.0),放于恒温振荡器中25 ℃、100 r/min解吸4.5 h,分别测定解吸前后花色苷的吸光度,计算解吸率。
1.3.3.4 D101大孔树脂分离纯化黑果枸杞花色苷
在Ф8 cm×100 cm的层析柱中,采用湿法灌柱,平衡后,将pH 3、0.180 mg/mL的花色苷粗提液以2.0 mL/min流速上样,吸附,吸附平衡后,用蒸馏水洗去表面杂质,准备洗脱。
洗脱流速对动态解吸率的影响:选取不同流速(15、20、25、30 mL/min)70%乙醇溶液进行洗脱,收集流出液并测定不同体积流出液中花色苷质量浓度,计算花色苷的回收率。
纯化后花色苷得率按式(6)进行计算:
式中:m1为纯化后花色苷质量/mg;m0为花色苷上样量/g。
1.3.4 Sephedex LH-20分离纯化黑果枸杞花色苷
将D101大孔树脂纯化后的花色苷溶液继续采用Sephadex LH-20联合中压制备色谱(Ф36 mm×460 mm)分离,柱压为0.1 bar,花色苷溶液质量浓度为2.0 mg/mL,上样量为10 mL,然后用体积分数为30%的酸性乙醇溶液洗脱,流速2.5 mL/min,每10 mL收集一管,合并相同组分,浓缩和冻干后,得到黑果枸杞花色苷P1、P2。
1.3.5 高效制备液相色谱分离纯化黑果枸杞花色苷
用去离子水溶解适量花色苷单体,过0.45 μm微孔滤膜,即为分析用液。流动相A为15%甲醇-乙腈,流动相B为1%甲酸-0.1%三氟乙酸溶液。流速18 mL/min,柱温25 ℃,检测波长280 nm,进样体积500 μL。梯度洗脱条件:0~11 min,15%~30% A、85%~70% B;11~15 min,30%~15% A、70%~85% B;15~18 min,15% A、85% B。按峰分别收集P1、P2纯化组分,用于结构鉴定。
1.3.6 UPLC法检测花色苷
用去离子水溶解适量花色苷单体,过0.45 μm微孔滤膜,即为分析用液。UPLC分析条件:流动相A为0.1%的甲酸水溶液;B为0.1%甲酸-乙腈溶液。洗脱梯度为:0~2 min,95% A、5% B;2~12 min,95%~75% A、5%~25% B;12~14 min,75%~50% A、25%~50% B;14~21 min,50%~20% A、50%~80% B;21~22 min,20% A、80% B;22~24 min,20%~95% A、80%~5% B;流速1.0 mL/min,柱温30 ℃,进样体积10 μL,检测波长280 nm。
1.3.7 黑果枸杞花色苷P1、P2的结构鉴定
质谱条件:离子源为电喷雾电离源,扫描模式为正离子模式,加热器温度325 ℃,鞘气流速45 arb,辅助气(N2)流速15 arb,吹扫气流速1 arb,电喷雾电压3.5 kV,毛细管温度330 ℃,透镜电压为55%,扫描模式为一级全扫描(Full Scan,m/z100~1 500)与数据依赖性二级质谱扫描(dd-MS2,TopN=5),分辨率为120 000(一级质谱)&60 000(二级质谱),碰撞模式为高能量碰撞解离。
NMR条件:用氘代甲醇与氘代三氟乙酸(9∶1,V/V)混合溶液溶解花色苷单体,进行1H NMR分析,操作温度为300 K。
1.3.8 不同纯度黑果枸杞花色苷对胰脂肪酶活性的抑制效果
参考文献[17]方法研究黑果枸杞花色苷粗提物、D101大孔树脂纯化的黑果枸杞花色苷和黑果枸杞花色苷P1、P2对胰脂肪酶的抑制作用。
1.4 数据统计分析
2 结果与分析
2.1 大孔树脂-中压制备色谱法纯化黑果枸杞花色苷
2.1.1 大孔树脂的初筛
不同大孔树脂对黑果枸杞花色苷的静态吸附和解吸能力见表1。可以看出,大孔树脂对黑果枸杞花色苷吸附具有一定的选择性,静态吸附率最好的是AB-8,静态吸附能力高达99.038%,这是因为两物质的极性越相似则范德华力越大更容易结合,AB-8型大孔树脂是弱极性,因此与弱极性的花色苷更易结合[26]。但其解吸率较低,仅为79.806%。这是由于吸附能力较强的大孔树脂在一定条件下,洗脱较困难,造成解吸能力下降。其次,吸附能力较好的是D101和D4020,吸附率分别为98.144%和98.076%。解吸率最好的树脂是ADS-7,解吸率为95.161%,但该树脂的吸附率较低,再之解吸率较好的是D101、D4020树脂,解吸率分别为91.947%和89.768%。综合考虑,选择吸附和解吸效果均较好的D101和D4020大孔树脂进行进一步的筛选。

表1 不同大孔树脂静态吸附与解吸能力对比Table 1 Comparison of adsorption and desorption capacity of different macroporous resins
2.1.2 大孔树脂静态吸附-解吸动力学
如图1a所示,两种树脂对黑果枸杞花色苷的吸附均为快速增长平稳型。两种树脂对花色苷的0~90 min内吸附率增加较为迅速。随着时间的延长,两种树脂对花色苷的吸附率逐渐平衡,且在390 min后逐渐平衡,平衡时,两种树脂的吸附率分别为96.19%和95.60%,D101树脂的吸附率相对较好。
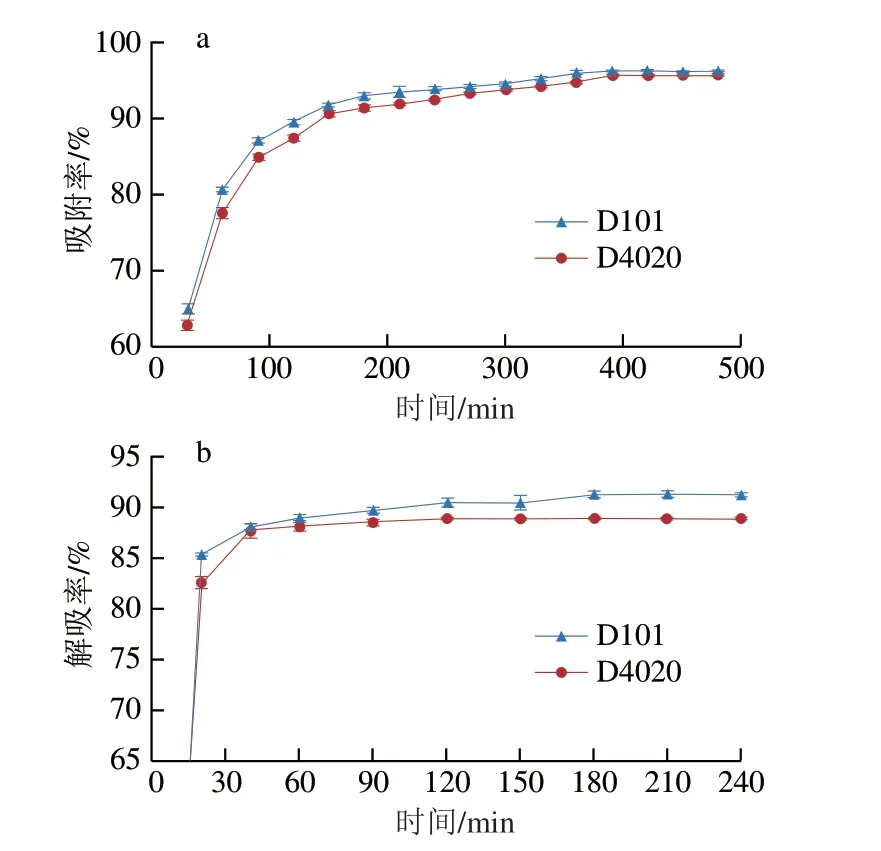
图1 大孔树脂的静态吸附(a)和解吸(b)动力学曲线Fig.1 Adsorption (a) and desorption (b) kinetic curves of macroporous resins
从图1b可以看出,在0~30 min内,D101和D4020两种树脂解吸率均为快速增长,在60 min后逐渐达到平衡,D101树脂在180 min达到平衡,平衡时解吸率为91.34%。D4020树脂在120 min基本达到平衡,平衡时解吸率为89.11%,所以D101树脂解吸率较好。因此,确定D101树脂为纯化黑果枸杞花色苷的最佳树脂。
2.1.3 D101大孔树脂的静态吸附及解吸条件优化
如图2a所示,D101树脂对黑果枸杞花色苷的吸附能力随着花色苷粗提液质量浓度的增大而增大,并在花色苷粗提物质量浓度达到0.18 mg/mL时,基本达到饱和,这一结果为后续大孔树脂-中压制备色谱分离纯化花色苷提供合适的进样质量浓度。

图2 D101大孔树脂的静态吸附及解吸条件优化Fig.2 Optimization of static adsorption and desorption conditions of macroporous resin D101
由图2b可见,在pH 1~3之间,D101大孔树脂对黑果枸杞花色苷的吸附率随着pH值的升高逐渐上升,当花色苷溶液的pH值为3时,吸附率最高,并且显著地高于其他pH值时,当pH继续升高至5时,花色苷的吸附率迅速下降,因此选择pH值为3的花色苷溶液进行上样。
由图2c可见,随着洗脱液体积分数的增大,花色苷的解吸率先升高后降低,洗脱液乙醇体积分数为70%时,花色苷的解吸率最高,解吸效果最好。因此确定洗脱液为70%乙醇溶液。
由图2d可见,随着洗脱流速的增大,花色苷回收率增大,当洗脱流速为25 mL/min时,回收率最高为92.64%,继续增大流速,回收率开始降低。因此选择最佳洗脱流速为25 mL/min。
综上,选择D101大孔树脂-中压制备色谱分离纯化黑果枸杞花色苷的工艺条件为:首先将pH 3、0.18 mg/mL的花色苷溶液在室温下进行上样,用70%乙醇溶液、流速25 mL/min进行洗脱,此时,花色苷得率为72.71%,所得纯化的花色苷命名为S1。
2.2 凝胶树脂中压制备色谱纯化黑果枸杞花色苷
将经过大孔树脂纯化后的花色苷溶液继续采用Sephadex LH-20联合中压制备色谱进行纯化,按峰收集组分,浓缩和冻干后,得到黑果枸杞花色苷组分P1和P2,得率分别为19.53%、45.34%。用UPLC在280 nm条件下检测,如图3所示,采用峰面积归一化法计算相对含量,经大孔树脂纯化后,组分P1、P2的相对含量分别为18.22%和30.77%,经Sephadex LH-20纯化后,P1、P2的相对含量分别为84.16%和81.48%,纯度分别提高了3.62 倍和1.65 倍。

图3 D101大孔树脂纯化(a)和Sephadex LH-20纯化黑果枸杞花色苷P1(b)、P2(c)的UPLC图Fig.3 UPLC chromatograms of anthocyanin fractions from L.ruthenicum Murr.purified with resin D101 (a) and Sephadex LH-20 (b and c)
2.3 花色苷结构鉴定
黑果枸杞花色苷质谱见图4。花色苷P1,紫色粉末,[M+H]+m/z1 095.32,并且含有离子碎片m/z933.26表明失去了一分子的葡萄糖(m/z162),m/z771.21表明失去了一分子的葡萄糖(m/z162),m/z479.11表明失去了一分子的香豆酸(m/z146)和一分子的芸香糖(m/z308),m/z317.06(M-308-146-162)表明P2有一个矮牵牛素配基(m/z317),1H NMR数据如表2所示,参考文献[27-29],推测所获得的黑果枸杞花色苷P1为矮牵牛素-3-O-芸香糖(反式-对香豆酰基)-葡萄糖苷-5-O-葡萄糖苷,其化学结构如图5 P1所示。

图4 黑果枸杞花色苷的一级和二级质谱图Fig.4 Primary and secondary mass spectra of L.ruthenicum Murr.anthocyanins

图5 花色苷的化学结构及其原子编号Fig.5 Chemical structures and atom number of anthocyanins
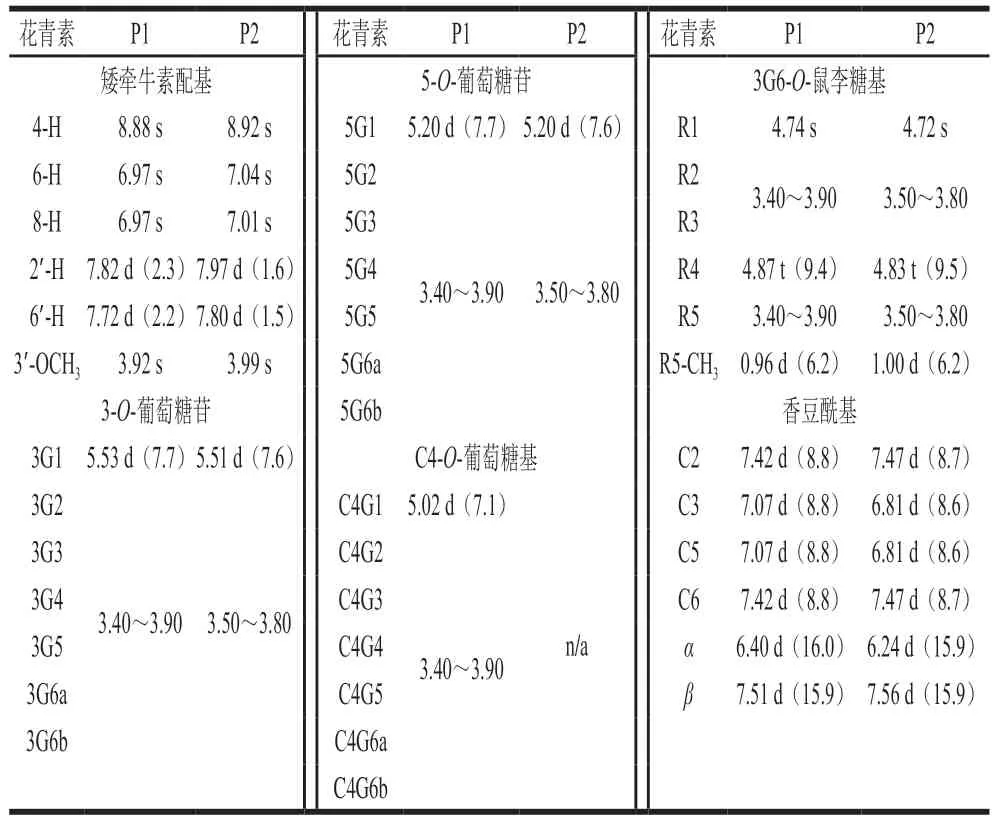
表2 花色苷的1H NMR(400 MHz)数据Table 2 1H NMR (400 MHz) data of the isolated anthocyanins
花色苷P2,紫色粉末,[M+H]+m/z933.26,并且样品含有离子碎片m/z771.21表明失去了一分子葡萄糖(m/z162),m/z479.11表明失去了一分子的香豆酸(m/z146)和一分子的芸香糖(m/z308),m/z317.06(M-308-146-162)表明P2有一个矮牵牛素配基(m/z317)。1H NMR数据如表2所示,参考文献[19,29-30],推测所获得的黑果枸杞花色苷P2为矮牵牛素-3-O-芸香糖(反式-对香豆酰基)-5-O-葡萄糖苷,其化学结构如图5 P2所示。
2.4 不同纯度黑果枸杞花色苷对胰脂肪酶的抑制效果
如图6所示,随着黑果枸杞花色苷粗提物质量浓度的增大,对胰脂肪酶的抑制率也不断增大,当质量浓度为5 mg/mL时,对胰脂肪酶的抑制率为85.3%,大孔树脂纯化后的花色苷和P1、P2在质量浓度为0.1~0.5 mg/mL时,随着质量浓度增大对胰脂肪酶抑制作用不断增大,两种纯化后的花色苷在质量浓度小于0.2 mg/mL时,抑制作用差异不显著,但质量浓度大于0.3 mg/mL时,经LH-20凝胶树脂纯化的花色苷对胰脂肪酶的抑制率显著高于D101大孔树脂纯化后的花色苷。
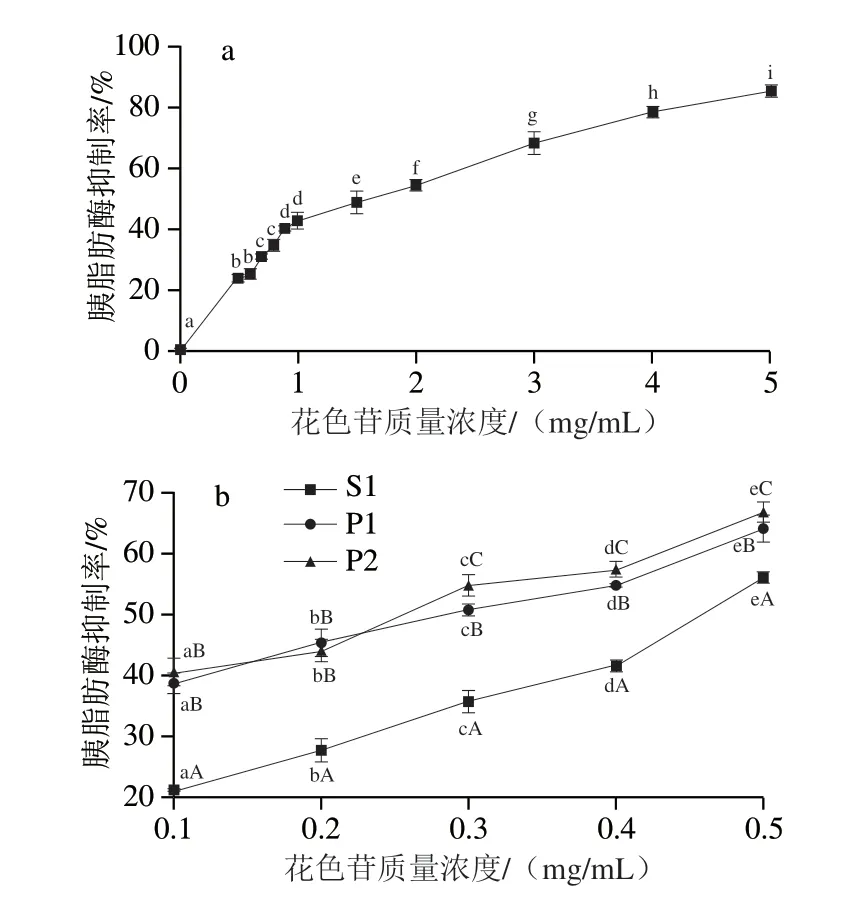
图6 黑果枸杞花色苷粗提物(a)和纯化物(b)对胰脂肪酶的抑制效果Fig.6 Inhibitory effect of crude extract (a) and purified (b)anthocyanins from L.ruthenicum Murr.against pancreatic lipase

表3 不同纯度的黑果枸杞花色苷对胰脂肪酶的IC50 Table 3 IC50 of anthocyanins of different purities fromL.ruthenicum Murr.against pancreatic lipase
由表3可见,S1和P1、P2对胰脂肪酶的半抑制浓度(IC50)分别为粗提物的34.7%、17.7%和15.9%,说明纯度较高的黑果枸杞花色苷对胰脂肪酶抑制率效果更好。P1和P2的胰脂肪酶抑制活性相当。P1和P2的IC50值分别为0.250 mg/mL和0.224 mg/mL,已报道从紫娟茶中分离的飞燕草素-3-O-β-D-(6-(E)-对香豆酸)吡喃半乳糖苷和矢车菊素-3-O-β-D-(6-(E)-对香豆酸)吡喃半乳糖苷抑制胰脂肪酶的IC50值分别为0.55 mg/mL和2.47 mg/mL[31],矢车菊素-3-O-葡萄糖苷抑制胰脂肪酶的IC50值为0.02 mg/mL[32]。可见从黑果枸杞中分离得到的矮牵牛素花色苷具有较好的胰脂肪酶抑制作用。
3 结论
用中压制备色谱与D101大孔树脂、Sephadex LH-20凝胶树脂联用,同时分离纯化出2 个较高纯度的黑果枸杞花色苷,方法便捷、成本低。大孔树脂-中压制备色谱分离纯化黑果枸杞花色苷的最佳工艺条件为进样液pH 3、花色苷粗提物质量浓度0.18 mg/mL、洗脱剂为70%乙醇溶液、流速25 mL/min,花色苷得率为72.71%。继续采用Sephadex LH-20纯化后,P1和P2的得率分别为19.53%、45.34%,相对含量分别为84.16%、81.48%,经鉴定,P1和P2分别为矮牵牛素-3-O-芸香糖(反式-对香豆酰基)-葡萄糖苷-5-O-葡萄糖苷和矮牵牛素-3-O-芸香糖(反式-对香豆酰基)-5-O-葡萄糖苷,P1和P2均具有较好的胰脂肪酶抑制活性,且显著大于大孔树脂纯化的花色苷。该研究为黑果枸杞花色苷的规模化生产提供技术参考,同时为黑果枸杞花色苷的功效研究及高附加值产品的生产提供良好基础。
