没食子酸对α-淀粉酶和α-葡萄糖苷酶的抑制作用及机理
2023-12-14沈荷玉李梦阳敖婧芳徐怀德罗安伟
沈荷玉,李梦阳,敖婧芳,王 军,徐怀德,罗安伟
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
2型糖尿病(diabetes mellitus type 2,T2DM)是由机体细胞对胰岛素正常作用抵抗引起,被公认为世界上最严重的公共卫生问题之一[1]。T2DM有多种症状,如高血糖、尿频、口渴和体质量减轻,影响人体健康和生活质量,导致严重发病和过早死亡。近年来,特别是发达国家,患有T2DM的年轻人越来越多。2019年,根据全球疾病负担研究,有4.51亿18 岁以上的成年人患有糖尿病[2]。有报告预测,到2030年,T2DM的全球患病率将达到每10万 人有7 079 人患病[3]。目前,有研究表明α-淀粉酶和α-葡萄糖苷酶是T2DM的治疗靶点[4]。α-淀粉酶和α-葡萄糖苷酶抑制剂可以通过阻碍膳食碳水化合物的消化,将餐后血糖水平维持在正常水平。近年来,基于α-淀粉酶和α-葡萄糖苷酶的抗高血糖药物已被开发出来,如阿卡波糖、伏格列糖和米格列醇[5]。然而,这些抑制剂有各种副作用,如腹泻、胀气、肝病和腹部痉挛[6]。因此,从自然资源中寻找新的α-淀粉酶和α-葡萄糖苷酶抑制剂是当前食品和药品领域的一个重要新方向。
没食子酸是自然界中广泛分布于植物性食物和药食同源中草药中的一种多酚类有机化合物,例如柑橘[7]、葡萄[8]、茶叶[9]和百合[10]中。没食子酸有良好的抗氧化、抗癌、降糖、降脂、抗菌、抗病毒和抗炎等作用[11]。目前有研究发现没食子酸对α-淀粉酶和α-葡萄糖苷酶有良好的抑制效果,但没有深入研究其具体的抑制机制[12]。因此本实验将从酶动力学、紫外光谱、荧光猝灭、圆二色谱(circular dichroism,CD)以及分子模拟这些方面研究没食子酸对α-淀粉酶和α-葡萄糖苷酶的抑制机理,以期为提高富含没食子酸的植物性食物和药食同源的中草药资源利用提供新思路,为开发含有没食子酸的降血糖药物或保健食品提供有益参考。
1 材料与方法
1.1 材料与试剂
没食子酸(纯度≥98%)、阿卡波糖(纯度≥98%)、来源于芽孢杆菌的α-淀粉酶(50 U/mg,生物技术级)、来源于酿酒酵母的α-葡萄糖苷酶(50 U/mg,生物技术级)上海源叶生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
DK-98-II A电热恒温水浴锅 天津市泰斯科仪器有限公司;Spark酶标仪 帝肯奥地利有限责任公司;UV-722紫外-可见分光光度计 上海佑科仪器仪表有限公司;F-7000荧光分光光度计 日立科学仪器(北京)有限公司;Chirascan V100圆二色光谱仪 英国应用光物理公司。
1.3 方法
1.3.1α-淀粉酶和α-葡萄糖苷酶抑制活性测定
α-淀粉酶抑制活性测定参考Shen Heyu等[13]方法,在0.1 mol/L pH值为7.0磷酸钾缓冲液的酶活力测定系统中进行。向试管中分别加入50 μL质量浓度为25、50、100、300、600、900 μg/mL的没食子酸溶液,再分别加入1 mL 0.4 g/L的淀粉溶液,37 ℃温育5 min后加入50 μL 0.01 mg/mL的α-淀粉酶溶液。37 ℃反应7.5 min后,加入1 mL的0.01 mol/L碘液进行检测,用紫外-可见分光光度计在波长660 nm处测定吸光度。
α-葡萄糖苷酶抑制活性测定参考Shen Heyu等[13]方法,在0.1 mol/L pH 6.8的磷酸钾缓冲液的酶活力测定系统中进行。在96 孔板中加入100 μL的0.2 U/mLα-葡萄糖苷酶溶液以及100 μL不同质量浓度(25、50、100、300、600、900 μg/mL)的待测样品,37 ℃孵育10 min后,加入50 μL 2.5 mmol/L的4-硝基苯基-β-D-吡喃葡萄糖苷(4-nitrophenyl-β-D-glucopyranoside,PNPG)溶液,37 ℃孵育10 min后于波长405 nm处测定吸光度。
实验均重复3 次,以阿卡波糖为阳性对照。用SPSS软件拟合计算样品对酶的半数抑制浓度(half maximal inhibitory concentration,IC50)。按式(1)计算没食子酸对α-淀粉酶和α-葡萄糖苷酶的抑制率:
式中:A样品为加入待测样品和酶反应后的吸光度;A背景为只加样品不加酶反应后的吸光度;A空白为不加样品只加酶反应后的吸光度;A缓冲液为只加磷酸钾缓冲液的吸光度。
1.3.2 酶促反应动力学分析
酶促反应动力学的测定参考Zhao Xiaohui等[14]方法。取100 μL不同质量浓度的没食子酸溶液(0、0.3、0.9 mg/mL)于试管中,固定α-淀粉酶溶液质量浓度(0.01 mg/mL)和α-葡萄糖苷酶溶液(0.2 U/mL),改变底物质量浓度,即淀粉溶液质量浓度(0.1、0.2、0.3、0.4、0.5、0.6 g/L)和PNPG溶液浓度(1、1.5、2、2.5、3、3.5 mmol/L),充分反应后测定混合溶液的吸光度以得到不同底物质量浓度的酶促反应速率。以酶的反应速率和底物质量浓度的倒数作Lineweaver-Burk双倒数曲线图,分析抑制剂对酶的抑制类型。
1.3.3 紫外光谱测定
分别移取3.0 mL 0.06 mg/mL的α-淀粉酶溶液和0.5 U/mLα-葡萄糖苷酶溶液于石英比色皿中,扫描240~310 mm的吸收光谱[15]。扫描完毕后,用微量进样器分别加入300 μL不同质量浓度(0、0.2、0.4、0.6、0.8 mg/mL)样品溶液到含有酶液的比色皿中,混匀,放置3~5 min后扫描吸收光谱。以不加酶液组作为对照观察样品是否存在干扰。
1.3.4 荧光光谱测定
0.1mL不同质量浓度的样品(0、10、50、100、150、200 μg/mL)分别和0.05 mL 0.01 mg/mLα-淀粉酶溶液、0.1 mL 0.2 U/mLα-葡萄糖苷酶溶液迅速混匀后,测定其荧光强度。激发波长为280 nm,发射波长为300~400 nm,狭缝宽度为5 nm荧光猝灭类型由Stern-Volmer方程确定[16]。
式中:F0和F分别为未加入样品和加入样品的荧光强度;Kq和Ksv分别为生物分子猝灭常数和Stern-Volmer猝灭常数;τ0为荧光团的生命周期(无猝灭剂);[Q]为样品的质量浓度。
1.3.5 三维荧光光谱
在发射波长为200~600 nm,激发波长为200~540 nm,测定在没食子酸存在下α-淀粉酶和α-葡萄糖苷酶的三维荧光光谱,其他参数与1.3.4节所述相同。
1.3.6 CD光谱测定
CD光谱条件:扫描范围200~250 nm,样品溶液(0.1 mg/mL)与α-淀粉酶溶液(2 mg/mL)和α-葡萄糖苷酶溶液(2 mg/mL)分别按不同体积比(1∶0、4∶1、2∶1、1∶1)添加于1.0 mm石英比色皿中[17]。以磷酸缓冲液和抑制剂作为空白,扣除反应体系中的空白圆二信号。根据CD光谱数据,通过CDNN软件计算二级结构含量,分析样品与消化酶反应前后二级结构变化。
1.3.7 分子对接分析
采用分子对接技术评价没食子酸与α-淀粉酶、α-葡萄糖苷酶之间潜在的结合构象。α-淀粉酶(PDB ID:1UA7)和α-葡萄糖苷酶(PDB ID:3A4A)的晶体结构从蛋白质数据库(http://www.rcsb.org/pdb)中获得。采用AutoDock 4.2软件对α-淀粉酶和α-葡萄糖苷酶进行结构预处理,包括去除所有水分子和配体,并加入氢原子和气相电荷。使用ChemBioDraw程序构建没食子酸的3D结构。采用MM2方法将分子能量最小化,并将参数Minimum RMS Gradient设置为0.01。配体结构的处理采用ADT,生成pdbqt文件进行对接。最后通过Vina程序进行分子对接,选择没食子酸与α-淀粉酶和α-葡萄糖苷酶结合能最低的结合模式进行分析。
1.4 数据统计与分析
2 结果与分析
2.1 没食子酸对α-淀粉酶和α-葡萄糖苷酶的抑制作用
如图1所示,随着没食子酸质量浓度的增加,对α-淀粉酶和α-葡萄糖苷酶的抑制作用显著增强,这表明没食子酸对酶活性的抑制作用具有显著的剂量依赖性。IC50为酶活力损失50%时所加入的抑制剂浓度[18],可以比较没食子酸和阿卡波糖(阳性对照物)对酶的抑制效果。没食子酸和阿卡波糖(阳性对照物)对α-淀粉酶的IC50分别为(0.72±0.01)mmol/L和(0.31±0.02)mmol/L,对α-葡萄糖苷酶的IC50分别为(0.59±0.02)mmol/L和(0.08±0.01)mmol/L。虽然与阿卡波糖相比,没食子酸对α-淀粉酶和α-葡萄糖苷酶的抑制效果略低,但依旧有良好的抑制效果。因此,没食子酸是潜在的α-淀粉酶和α-葡萄糖苷酶抑制剂。

图1 没食子酸对α-淀粉酶(A)和α-葡萄糖苷酶(B)的抑制活性Fig.1 Inhibitory effect of gallic acid on α-amylase (A) and α-glucosidase (B) activities
2.2 酶促反应动力学分析
如图2A所示,不同底物质量浓度所对应直线相交且交点在横坐标轴上,与纵坐标截距变大,可知Km值不变,而Vmax呈下降趋势,表明没食子酸以非竞争方式抑制α-淀粉酶[19]。因此推断没食子酸与α-淀粉酶活性中心以外的氨基酸残基进行结合,底物质量浓度不影响没食子酸对α-淀粉酶的抑制作用[20]。如图2B所示,不同底物质量浓度所对应直线相交在第2象限,与纵坐标截距变大,与横坐标截距变小,可知Km值增大,而Vmax呈下降趋势,表明没食子酸以混合竞争方式抑制α-葡萄糖苷酶,能与底物竞争α-葡萄糖苷酶的活性中心结合位点[21]。这与阿卡波糖对α-淀粉酶和α-葡萄糖苷酶抑制作用类型分别为混合竞争性抑制和竞争性抑制[22-23]不同,可能是抑制剂在化学结构上的差异导致抑制效果和类型不同,具体原因仍需进一步研究。
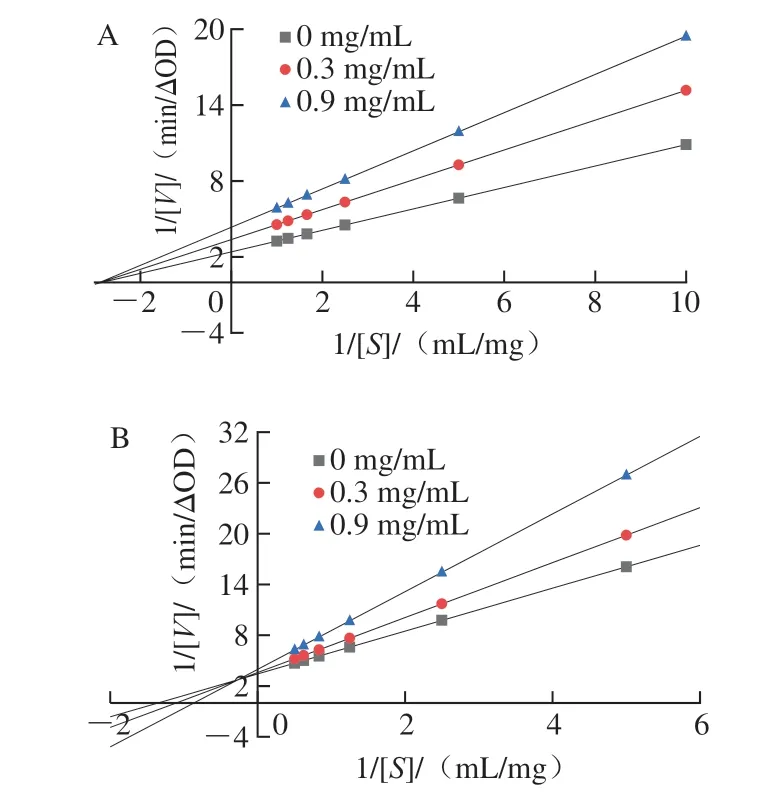
图2 没食子酸对α-淀粉酶(A)和α-葡萄糖苷酶(B)的双倒数曲线Fig.2 Lineweaver-Burk plots for the inhibition of gallic acid against α-amylase (A) and α-glucosidase (B)
2.3 没食子酸对α-淀粉酶和α-葡萄糖苷酶紫外光谱的影响
紫外光谱可以观察蛋白质与配体相互作用过程中蛋白质构象变化[18]。如图3所示,α-淀粉酶和α-葡萄糖苷酶在270 nm附近有一个特征峰,主要是由于色氨酸(tryptophan,Trp)、酪氨酸(tyrosine,Tyr)和苯丙氨酸(phenylalanine,Phe)等芳香族氨基酸残基的存在引起[24]。如图3所示,随着没食子酸质量浓度的增加,特征峰的位置没有明显移动,但α-淀粉酶和α-葡萄糖苷酶的吸收峰强度大大增加。吸收峰强度变化具有浓度依赖性,与Avwioroko等[25]研究的紫草种子提取物与α-淀粉酶结合的紫外光谱图结果相似。该现象表明α-淀粉酶/α-葡萄糖苷酶-没食子酸复合物的形成可能有利于分子间和分子内聚集,破坏了芳香族氨基酸残基的微环境空间结构,导致酶的构象变化和疏水基团的暴露。
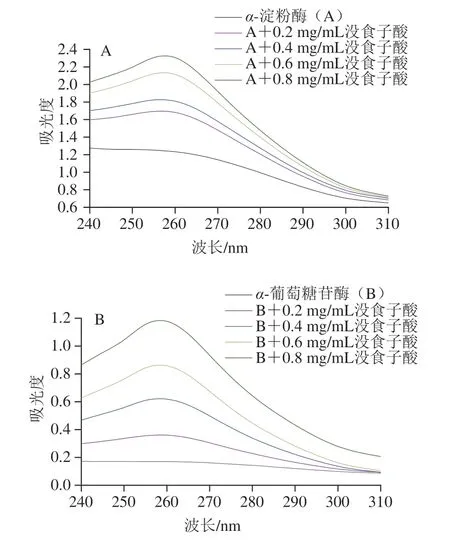
图3 没食子酸质量浓度对α-淀粉酶(A)和α-葡萄糖苷酶(B)紫外光谱的影响Fig.3 Effects of different concentrations of gallic acid on UV spectra of α-amylase (A) and α-glucosidase (B)
2.4 没食子酸对α-淀粉酶和α-葡萄糖苷酶的荧光猝灭效应
荧光猝灭效应分析可用于观察没食子酸与α-淀粉酶和α-葡萄糖苷酶分子间结合的相互作用[26]。由于Trp、Tyr和Phe等芳香族氨基酸存在,α-淀粉酶和α-葡萄糖苷酶具有内源性荧光,荧光的强度和位置与这些芳香族氨基酸残基所处的微环境密切相关[27]。如图4所示,α-淀粉酶和α-葡萄糖苷酶分别在343 nm和336 nm波长处出现最大荧光峰。随着没食子酸质量浓度的增加,酶的荧光强度逐渐下降。此外,α-淀粉酶的最大荧光发射波长位置发生轻微蓝移,而α-葡萄糖苷酶的最大荧光发射波长发生红移。结果表明没食子酸能够通过与酶的相互作用强烈地猝灭α-淀粉酶和α-葡萄糖苷酶的固有荧光,氨基酸残基的微环境发生了变化。这与Haguet等[28]研究的5 种提取物配方对α-葡萄糖苷酶的荧光光谱影响结果相似,阿卡波糖对酶荧光强度的影响也有相似趋势,但效果并不明显。Stern-Volmer图可用于计算生物分子猝灭常数(Kq),该参数与猝灭机制密切相关。没食子酸与α-淀粉酶、α-葡萄糖苷酶的猝灭反应的Kq值分别为1.08×1011L/(mol·s)和1.21×1011L/(mol·s),均大于最大散射碰撞猝灭常数2×1010L/(mol·s)[21]。因此,没食子酸对α-淀粉酶、α-葡萄糖苷酶的荧光猝灭过程为静态荧光猝灭,而不是由分子碰撞引起的动态荧光猝灭[29]。
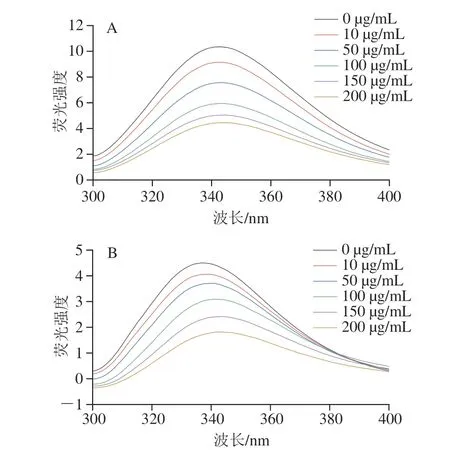
图4 没食子酸质量浓度对α-淀粉酶(A)和α-葡萄糖苷酶(B)荧光光谱的影响Fig.4 Effects of different concentrations of gallic acid on fluorescence spectra of α-amylase (A) and α-glucosidase (B)
三维荧光光谱用于观察没食子酸对α-淀粉酶、α-葡萄糖苷酶的荧光猝灭效应,如图5A、C所示,α-淀粉酶、α-葡萄糖苷酶的荧光光谱图有3 个特征峰,分别为Rayleigh散射峰(峰a)和光谱特征峰(峰1和峰2)。峰1表示酶中Tyr和Trp残基涉及π→π*转变的光谱特征[30],峰2表示多肽主链C=O涉及n-π*转变的荧光光谱特征[31]。如图5B、D所示,加入没食子酸后,峰1和峰2峰强度明显降低。图5D中α-葡萄糖苷酶的三维荧光光谱中峰2甚至消失。峰的变化表明没食子酸通过形成没食子酸-酶复合物影响α-淀粉酶和α-葡萄糖苷酶多肽链的微环境,也就是说,没食子酸倾向于通过诱导疏水基团和侧链的折叠提供疏水区域,从而导致酶的构象转化。
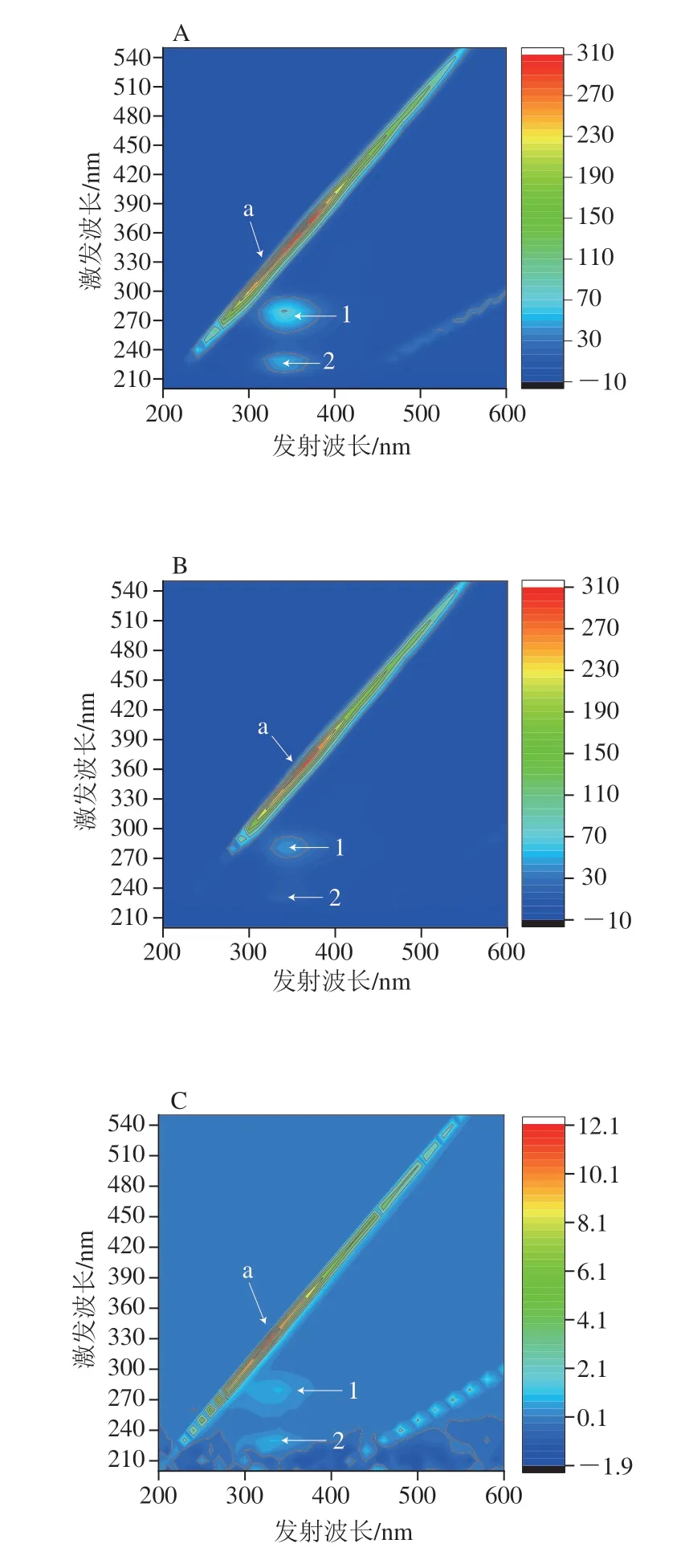
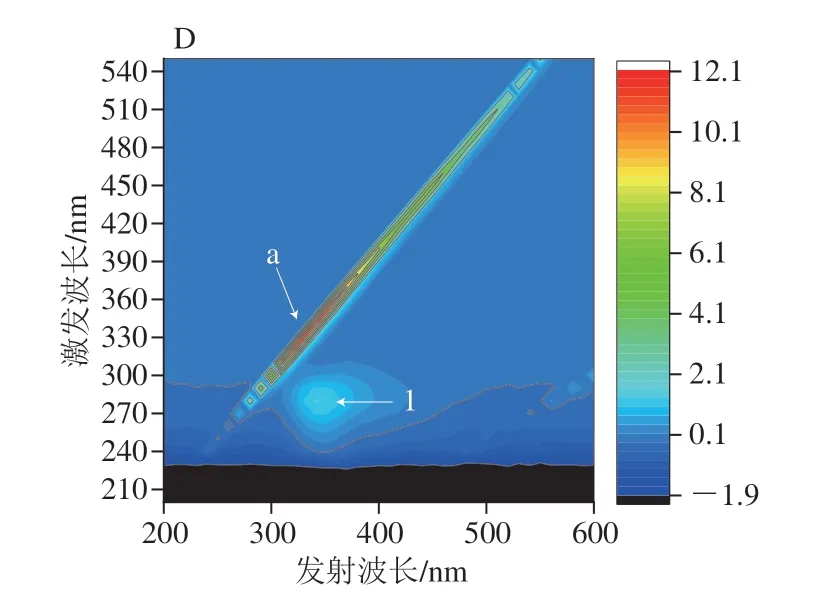
图5 α-淀粉酶、α-葡萄糖苷酶(A、C)和没食子酸存在下α-淀粉酶和α-葡萄糖苷酶(B、D)的三维荧光光谱图Fig.5 3D fluorescence spectra of α-amylase,α-glucosidase in the absence (A,C) and presence (B,D) of gallic acid
2.5 没食子酸对α-淀粉酶和α-葡萄糖苷酶二级结构的影响
如图6所示,在208 nm和226 nm波长处的负峰分布在π-π*跃迁和n-π*跃迁中,分别表征α-螺旋和β-折叠[32]。与游离的α-淀粉酶和α-葡萄糖苷酶CD光谱相比,没食子酸的加入降低了酶在208 nm和226 nm波长处的负峰强度。结果表明,没食子酸可以显著影响α-淀粉酶和α-葡萄糖苷酶的二级结构。由表1可知,随着没食子酸含量的增加,α-淀粉酶中α-螺旋结构含量(25.10%~19.70%)减少,而β-折叠结构含量(22.60%~28.00%)、β-转角结构含量(18.20%~19.80%)和无规卷曲结构含量(40.20%~44.80%)增加;α-葡萄糖苷酶中α-螺旋结构含量(43.40%~27.00%)减少,β-折叠结构(12.70%~21.30%)、β-转角结构(15.20%~18.10%)和无规卷曲结构含量(25.80%~36.90%)增加。因此,加入没食子酸可以破坏α-淀粉酶和α-葡萄糖苷酶的二级结构,从而降低酶结构的稳定性,抑制α-淀粉酶和α-葡萄糖苷酶活性。
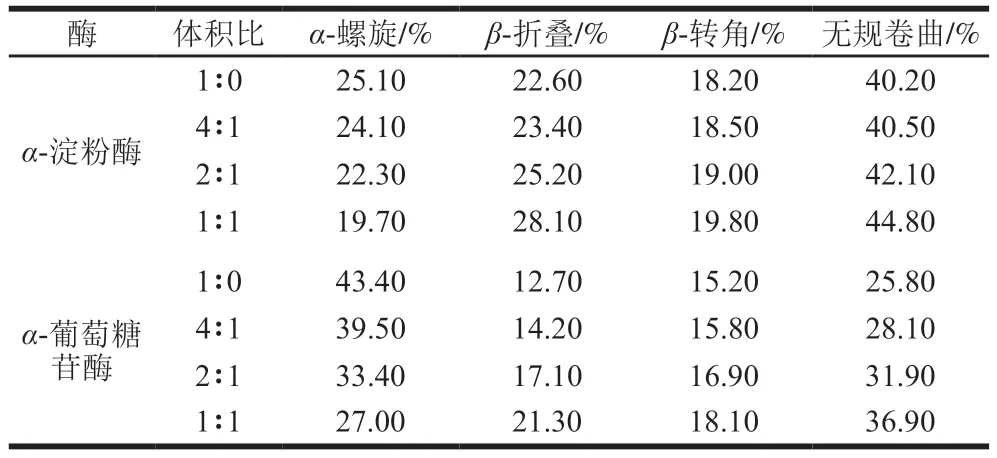
表1 没食子酸对α-淀粉酶和α-葡萄糖苷酶二级结构的影响Table 1 Effect of gallic acid on the secondary structure contents of α-amylase and α-glucosidase
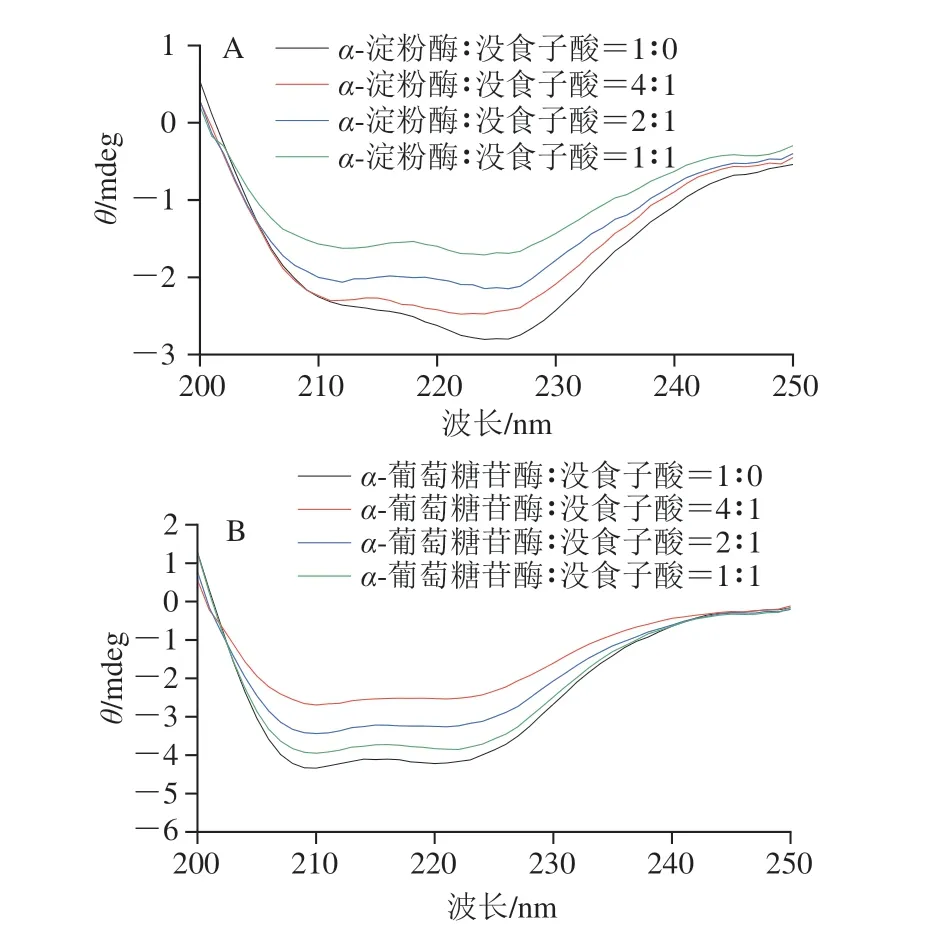
图6 没食子酸对α-淀粉酶(A)和α-葡萄糖苷酶(B)CD光谱的影响Fig.6 Effect of gallic acid on CD spectra of α-amylase (A) and α-glucosidase (B)
2.6 分子对接分析结果
分子对接技术是一种可视化小分子配体与大分子受体相互作用,确定配体可能的结合位点和空间构象的有效方法[33]。分子对接结果表明,没食子酸与α-淀粉酶、α-葡萄糖苷酶相互作用,最低结合能分别为-5.9 kcal/mol和-6.5 kcal/mol。结合能为负值表明α-淀粉酶、α-葡萄糖苷酶可能与没食子酸形成复合物。在分子对接中,没食子酸定位在α-淀粉酶、α-葡萄糖苷酶活性位点附近。如图7A和图8A所示,没食子酸与α-淀粉酶结合时,主要被Trp58、Tyr62、Gln63、His102、Leu141、Leu142、Leu144、Arg174、Ala177、Asp176、Glu208、His268、Asp269等氨基酸残基所包围。Trp58、Trp59和Tyr62为α-淀粉酶中催化活性中心的关键残基,没食子酸通过疏水相互作用与Trp58和Tyr62残基周围的疏水腔结合,进而影响其微环境的极性[34]。Meidinna等[35]报道了阳性对照物阿卡波糖与α-淀粉酶结合位点氨基酸残基Trp59相互作用形成氢键,从而以混合竞争性的方式抑制α-淀粉酶活性。而没食子酸与α-淀粉酶活性结合位点以外的氨基酸残基Lys156、Asn317、Glu422、His423之间形成4 个氢键,与抑制动力学结果一致,说明没食子酸以非竞争方式抑制α-淀粉酶活性。如图7B和图8B所示,没食子酸与α-葡萄糖苷酶结合时,主要被Lys156、Asn235、Ser236、Thr237、Phe314、Asn317、Ile419、Glu422、His423、Glu429、Lys432、Phe433等氨基酸残基所包围,且与氨基酸残基Lys156、Asn317、Glu422、His423、Glu429之间形成5 个氢键。Askarzadeh等[36]也利用分子对接技术将阿卡波糖放入α-葡萄糖苷酶的活性中心,结果显示阿卡波糖与氨基酸残基Asn241和Arg312形成氢键。没食子酸的苯环上含有3 个羟基,苯环上的电子离域作用促使酚羟基发生离子化,易与酶的结合形成氢键,氢键的形成可以增强α-淀粉酶、α-葡萄糖苷酶和配体分子结合的稳定性[29]。以上结果表明,氢键和疏水作用是没食子酸与α-淀粉酶、α-葡萄糖苷酶之间重要相互作用,可以改变酶的空间结构,对其抑制活性有重要影响。

图7 没食子酸与α-淀粉酶(A)和α-葡萄糖苷酶(B)的分子对接2D图Fig.7 2D Molecular docking model of gallic acid with α-amylase (A) or α-glucosidase (B)
3 结论
本研究探讨了没食子酸对α-淀粉酶和α-葡萄糖苷酶的抑制作用,并采用抑制动力学、紫外光谱法、荧光光谱法、CD光谱法和分子对接分析研究了没食子酸和2 种酶之间的相互作用机理。没食子酸对α-淀粉酶和α-葡萄糖苷酶有良好的抑制作用,且抑制作用都具有明显的浓度依赖性。酶促反应动力学结果显示,没食子酸分别以非竞争性抑制方式和混合竞争性抑制方式与α-淀粉酶和α-葡萄糖苷酶活性位点相互作用。紫外光谱分析结果表明,没食子酸的加入导致酶的构象变化和疏水基团的暴露。荧光谱图结果显示,没食子酸以静态猝灭的方式强烈猝灭酶的内源性荧光,改变了氨基酸残基Trp和Tyr所处的微环境。CD光谱分析表明,没食子酸显著改变酶的二级结构,从而导致酶构象发生变化。同时,采用分子对接的方式模拟没食子酸与α-淀粉酶和α-葡萄糖苷酶的结合,没食子酸通过与周围氨基酸残基相互作用,导致酶的构象发生紊乱,从而降低α-淀粉酶和α-葡萄糖苷酶的催化活性。综上所述,没食子酸可以良好抑制α-淀粉酶和α-葡萄糖苷酶的活性,有效减缓碳水化合物消化,降低血糖水平。该研究为没食子酸在α-淀粉酶和α-葡萄糖苷酶抑制剂领域的深层次研发利用提供一定参考。
