红菜苔多酚超声提取工艺优化及其抗氧化活性研究
2023-12-07翟淑红曹洪坤余诗琴朱斯豪
翟淑红,曹洪坤,余诗琴,朱斯豪
(武汉设计工程学院食品与生物科技学院,湖北 武汉 430205)
红菜苔又名芸菜苔、紫菜苔,是十字花科芸苔属芸苔种白菜亚种的一个变种,具有较高的营养价值,为人体提供丰富的蛋白质、维生素、碳水化合物、脂肪及一些必需的微量元素等[1]。由于红菜苔的茎皮和叶片中富含植物多酚,采用适当的工艺,提取红菜苔茎皮和叶片中的多酚,对于充分开发利用红菜苔具有重要的意义[2]。
植物多酚是植物的次生代谢产物,广泛分布于植物的叶、皮、根及果实等部位。多酚的抗氧化机制主要是活性多酚的酚羟基具有抗氧化性,释放氢离子破坏终止氧化链式反应。抗氧化作用分为直接抗氧化和间接抗氧化2 种,直接抗氧化效果是螯合金属离子、清除自由基、抑制氧化酶活性产生,而间接的氧化作用是由机体内源性抗氧化酶的保护引起的[3]。肉制品的腐败主要是由于微生物污染、蛋白质氧化、脂肪氧化和色素降解[4]。使用多酚作为保鲜剂可以同时起到防腐剂和抗氧化剂的作用,甚至还具有一定的护色作用。水产品的保鲜主要是通过防止脂肪氧化和细菌增殖完成[5]。除此之外,植物多酚的抗菌作用还表现在破坏细胞壁及细胞膜、抑制生物大分子合成、影响能量代谢、堵塞外膜孔蛋白[6]。
采用超声辅助的方法,从红菜苔中提取多酚[7],以提取时间、料液比、乙醇体积分数、提取温度为影响因素设计单因素试验,以总多酚含量为评价指标。在此基础上设计正交试验,对提取工艺进行优化,以最佳的提取工艺提取植物多酚进行抗氧化活性试验[8],为红菜苔植物多酚的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
红菜苔,购自红安县;没食子酸、福林酚、1,1-二苯基- 2 - 三硝基苯肼(DPPH)、水杨酸、抗坏血酸等(均为分析纯),国药集团化学试剂公司提供。
1.2 试验仪器设备
722 型可见分光光度计,天津冠泽科技有限公司产品;JP-031S 型超声清洗机,深圳市洁盟清洗设备有限公司产品;RE-2000A 型旋转蒸发器,上海亚荣生化仪器厂产品。
1.3 试验方法
1.3.1 红菜苔的预处理
新鲜菜苔茎皮、叶于50 ℃烘箱中干燥至手捏即碎后粉碎过60 目筛,置于干燥器中存放备用。
1.3.2 红菜苔各部位含水量的测定
称取红菜苔干燥前的质量记为m1,烘干后的质量记为m2。则红菜苔含水量如下式计算:
1.3.3 多酚提取流程
准确称取1.00 g 菜苔样品,加入乙醇溶液,用固定功率超声辅助提取一段时间,提取完成后,将溶液冷却后过滤,并在45 ℃条件下旋转蒸发,得到样品。
1.3.4 没食子酸标准曲线
准确称取50 mg 没食子酸,然后用少量蒸馏水对其进行溶解,转移至100 mL 容量瓶中定容,取10 mL转移定容至100 mL容量瓶,得到质量浓度为0.05 g/mL的标准溶液。精确吸取0,0.2,0.4,0.6,0.8,1.0 mL标准溶液注入25 mL 比色管中,再加入2 mL 福林酚试剂,混合均匀后加入质量分数为15%的碳酸钠溶液5 mL 定容至25 mL,于45 ℃条件下反应40 min冷却至室温,于波长765 nm 处测定吸光度,重复测量3 次取平均值,根据试验结果绘制没食子酸标准曲线[9]。
1.3.5 菜苔总多酚的测定
吸取40 μL 样品注入25 mL 比色管中,加入3.16 mL 水,再加入2 mL 福林酚试剂,混匀,加入质量分数为15%的碳酸钠溶液5 mL,混合均匀后于45 ℃条件下反应40 min 冷却至室温,于波长765 nm 处测量吸光度,重复测量3 次。根据没食子酸标准曲线公式计算样品浓度值[10]。
式中:X——根据标准曲线算得样品质量浓度,mg/mL;
V——样品液稀释体积,mL;
N——稀释倍数;
W——原料质量,g。
1.3.6 单因素试验设计
以提取时间、料液比、乙醇体积分数、提取温度为单因素,以多酚得率为评价标准优化提取工艺。提取时间选择5,10,15,20,25 min 这5 个水平;料液比选择1∶5,1∶20,1∶35,1∶50,1∶65 这5 个水平;乙醇体积分数选择35%,50%,65%,80%,95%这5 个水平;提取温度选择15,30,45,60,75 ℃这5 个水平。在确保其他因素不变的情况下,通过控制变量法改变其中一个因素,探究该因素对多酚得率的影响。
1.3.7 正交试验设计
以单因素试验得到的吸光度为参考依据,选取提取时间、料液比、乙醇体积分数和提取温度为影响因素进行正交试验优化提取工艺,以多酚得率为参考指标,每组进行3 次重复试验。
1.3.8 红菜苔多酚对DPPH·清除率的测定
试验参照胡新颖等人[11]的DPPH·比色法稍加改动。配制不同质量浓度的提取液,依次向样管中加入2 mL 的样液和醇溶DPPH;对照组依次加入2 mL样液和无水乙醇;依次向空白管中加入2 mL 的醇溶DPPH·和无水乙醇。混合均匀,避光30 min,于波长517 nm 处测量吸光度,依次记为A1,A2,A0。结果测量3 次,取平均值。同时,配制与红菜苔多酚浓度相同的维C 溶液作对照。按下式计算DPPH·的清除率。
1.3.9 红菜苔多酚基(·OH) 清除率的测定
试验参照吴琳珊[12]方法稍加改动。配制不同质量浓度的提取液,依次向试管中加入浓度为9 mmol/L的硫酸亚铁溶液1 mL,浓度为9 mmol/L 的乙醇溶解水杨酸2 mL,蒸馏水2 mL 及浓度为8.8 mmol/L 的过氧化氢溶液2 mL,混匀后避光放置30 min,于波长510 nm 处测量吸光度计为A0,此时以不加过氧化氢的体系为空白溶液。取系列试管,依次加入浓度为9 mmol/L 的硫酸亚铁溶液1 mL,浓度为9 mmol/L 的醇溶水杨酸2 mL,样品2 mL 及过氧化氢2 mL,在上述同样反应条件下测定吸光度为A1,同上以不加过氧化氢但加样品的测得吸光度记为A2。此时,以蒸馏水作参比,结果测量3 次取平均值。配制与红菜苔多酚相同质量浓度的维C 溶液作对照。按下式计算·OH 的清除率:
2 结果与分析
2.1 红菜苔的含水量
红菜苔各部位的含水量见表1。
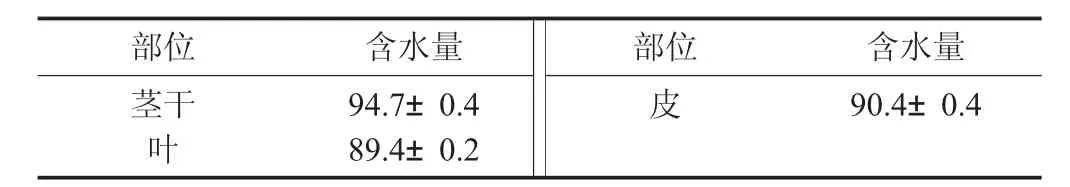
表1 红菜苔各部位的含水量/%
由表1 可知,红菜苔整体含水量较高,其中茎干含水量最高,表皮次之,叶片水含量最少。
2.2 没食子酸标准曲线
没食子酸标准曲线见图1。

图1 没食子酸标准曲线
由图1 可知,标准曲线的方程式以没食子酸质量浓度为横轴,以吸光度为纵轴,在0.01~0.05 mg/mL的范围内,Y=0.146X-0.054 4,R2=0.999 4,线性关系良好。
2.3 单因素试验
2.3.1 最佳提取时间的选择
提取时间对多酚提取量的影响见图2。
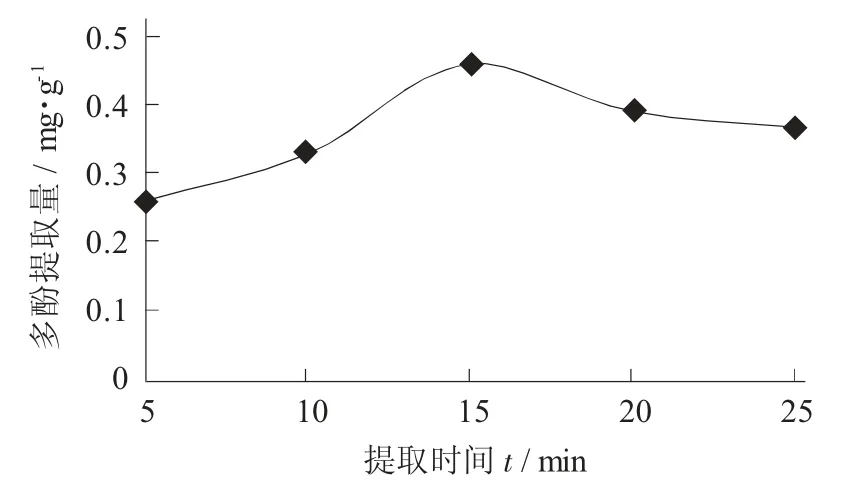
图2 提取时间对多酚提取量的影响
由图2 可知,当提取时间为5~15 min 时,随着提取时间的延长,多酚提取量逐渐增加;当提取时间到达15 min 时,提取量达到最高峰值;超过15 min时,多酚的提取逐渐降低,但降低幅度较小。提取时间过长或过短都会影响菜苔多酚的提取,时间过短提取不充分,时间过长多酚含量缓慢降低,可能是由于多酚长时间处于较高温条件下,造成部分氧化。从试验成本和时间上考虑,试验最佳的提取时间为15 min。
2.3.2 最佳料液比的选择
料液比对多酚提取量的影响见图3。

图3 料液比对多酚提取量的影响
由图3 可知,随着料液比的增加,多酚提取量逐渐增加,并在料液比为1∶35 时达到峰值,料液比在1∶20 ~1∶50 时,多酚提取量稳定在峰值附近,继续增加料液比时,多酚提取量呈现下降趋势。当料液比过小时,溶剂不足,反应物接触面积过小,多酚未完全提取,当料液比过大时,溶剂用量也增大,提取出来的多酚被稀释[13],在旋转蒸发过程中溶剂用量过高会造成提取物的损失。考虑到试验成本,溶剂用量越少越好,最终选取的最佳料液比为1∶35。
2.3.3 最佳乙醇体积分数的选择
乙醇体积分数对多酚提取量的影响见图4。

图4 乙醇体积分数对多酚提取量的影响
由图4 可知,当乙醇体积分数超过30%时,多酚提取量呈现显著增长趋势;在乙醇体积分数达到80%时,多酚提取量最高为0.436 mg/g;超过80%后,随着乙醇体积分数的增加多酚提取量缓慢下降。乙醇体积分数过高时,在后续的有机溶剂蒸发过程中会对多酚提取量产生影响。综合考虑成本和试验安全性,确定了从红菜苔中提取多酚的最佳乙醇体积分数为80%。
2.3.4 最佳提取温度的选择
提取温度对多酚提取量的影响。
由图5 可知,在试验设计的温度范围内,红菜苔多酚提取量随着温度的升高呈现先迅速增长后缓慢降低的趋势,在提取温度为45 ℃时,多酚提取量最大,为0.315 mg/g;在提取温度超过45 ℃时,持续的高温环境会使多酚存在氧化和降解现象,所以在温度持续上升时多酚提取量会缓慢下降。高温条件较难维持,因此确定了最佳提取温度为45 ℃。
2.4 正交试验
正交试验结果见表2。

表2 正交试验结果
由表2 可知,提取温度对多酚提取量的影响较大,其次是乙醇体积分数,随后是提取时间,料液比的影响最小。即影响红菜苔多酚的提取因素排序为D>C>A>B,最佳因素组合为A2B2C1D3,即提取时间为15 min,料液比为1∶35,乙醇体积分数为75%,提取温度为50 ℃。在此条件下进行验证试验,红菜苔多酚提取量为0.345 mg/g,高于正交试验所有试验结果,表明该工艺稳定可行。因红菜苔样品单因素和正交的试验样品不是同一批次购买,多酚含量明显下降,可能和季节变化有关。
2.5 红菜苔多酚对DPPH·的清除率
多酚样液和维C 对DPPH·的清除率见图6。

图6 多酚样液和维C 对DPPH·的清除率
DPPH·是一种稳定的脂性自由基,在波长517 nm处呈紫色,其氮原子上有一个游离电子可以和抗氧化剂中的一个电子配对,使紫色褪去。紫色褪去程度越大,对自由电子清除作用越强,即抗氧化能力越强[14]。由图6 可知,菜苔多酚和维C 对DPPH·清除率都随质量浓度的增加而逐渐增加,且多酚对DPPH·的半抑制质量浓度IC50为24 μg/mL,而维C在24 μg/mL 对DPPH·清除率为66%,故维C 对DPPH·的清除率高于多酚。考虑到维C 是强抗氧化剂,可知红菜苔多酚对DPPH·具有较好的清除能力。
2.6 红菜苔多酚对羟自由基(·OH) 的清除率
多酚样液和维C 对·OH 的清除率见图7。
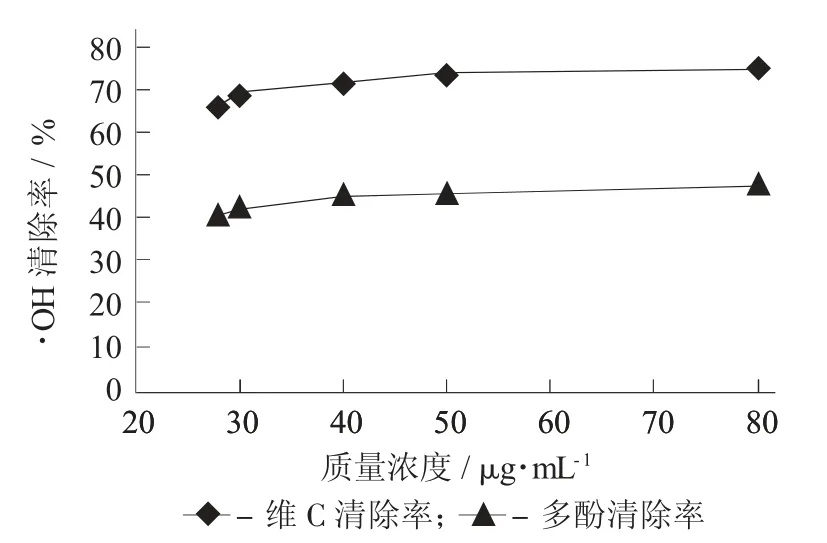
图7 多酚样液和维C 对·OH 的清除率
由图7 可知,随着质量浓度的升高,多酚和维C对·OH 的清除能力逐渐增加,且增长速率均较为平缓,由线性回归方程计算可得到多酚对羟自由基的半抑制质量浓度IC50为90 μg/mL,而维C 在90 μg/mL时对·OH 清除率为77.52%。由此可知,维C 对·OH的清除能力大于多酚,维C 的还原力较强,故多酚对·OH 具有一定的清除能力。
3 结论
以红菜苔为原材料,采用超声辅助提取多酚,以提取时间、料液比、乙醇体积分数、提取温度4 个因素为变量设计单因素试验,以总多酚提取量为评价标准。在此基础上,设计正交试验优化提取工艺。试验结果表明,各变量对多酚提取量的影响程度依次是提取温度>乙醇体积分数>提取时间>料液比,当将体积分数为75%的乙醇溶液按1∶35 的料液比,于50 ℃的温度下超声辅助提取15 min 时,多酚的提取量最大。在此提取条件下得到的多酚稳定可行,多酚提取量为0.345 mg/g。后续抗氧化试验表明,红菜苔多酚对DPPH·和·OH 均具有较好的清除能力,并呈现一定的量级效应。研究结果证实了从菜苔中提取多酚的可行性,对红菜苔的继续开发提供了一定的理论基础。
菜苔多酚提取量并非随着超声时间的增加而一直上升,而是在15 min 时到达峰值,之后随着时间的增加多酚提取量缓慢降低,提取时间过短反应不完全,而当长时间处于较高温度下时可能会使提取出来的多酚分解。当料液比过低时,反应物与溶剂接触面积过小导致反应程度低,料液比过高时,溶剂也随之增加,在后续的旋转蒸发过程中会导致提取物的损失。反应后续的旋转蒸发是利用沸点不同而去掉溶液中的乙醇,而当乙醇体积分数过高时,旋转蒸发时会造成提取物的损失。适当增加温度会使溶液反应更加剧烈,增加多酚提取量,而当温度过高时,多酚可能会因为无法适应高温环境氧化或降解。虽然未考虑到超声功率和pH 值对结果的影响,但仍具有一定的参考依据。
