低剂量BPA 和DEHP 对成年大鼠前列腺AKR1C3的影响
2023-12-04黄冬妍吴双双邵丛丛苏欣杨荣富王凯玥周萍吴建辉
黄冬妍吴双双邵丛丛苏 欣杨荣富王凯玥周 萍吴建辉*
(1.上海市生物医药技术研究院,上海 200032;2.国家卫生健康委员会计划生育药具重点实验室,上海 200032;3.复旦大学生殖与发育研究院,上海 200032)
双酚A(bisphenol A,BPA)和邻苯二甲酸二(2-乙基)己酯(di (2-ethylhexyl) phthalate,DEHP)是两种较为重要的环境内分泌干扰物(environmental endocrine disruptors,EDCs),广泛存在于填充剂原料、高分子材料、化妆品以及增塑剂中,以类激素的形式产生生物学效应,使体内原有的内分泌机能出现紊乱,从而对生物或人体的生殖、神经和免疫系统等的功能产生影响[1]。 随着工业的发展,BPA 和DEHP 环境暴露剂量及在人体内的蓄积量逐年上升。 尽管美国食品与药物管理局(Food and Drug Administration, FDA) 和 美 国 环 保 署( U.S.Environmental Protection Agency,EPA)将50 μg/kg视为每日摄入的“安全”剂量[2],但是BPA 低水平暴露仍是一种潜在的破坏剂,会对生殖系统如前列腺的生长发育产生影响。 研究表明妊娠期口服BPA(10 μg/(kg·d))会导致雄性胎小鼠背外侧前列腺导管数量和体积增加;青春期长期摄入BPA(40 μg/(kg·d))促进前列腺细胞增殖,诱导沙鼠成年前列腺增生[3]。 同样作为一种常见的EDC,DEHP 的低水平暴露研究相对较少,有学者发现,在典型的饮食方式下,育龄妇女、青少年和婴儿DEHP暴露剂量分别为5.7、8.1 和42.1 μg/(kg·d)[4]。欧洲食品安全局规定DEHP 日耐受摄入剂量为50 μg/(kg·d),而EPA 将20 μg/(kg·d)作为安全参考剂量[5]。 由于BPA 和DEHP 的广泛应用,我们想明确在环境暴露剂量下两者对前列腺的影响,为评估EDCs 潜在的健康风险提供理论基础。
我们在前期研究中发现,给予成年和老年大鼠10~90 μg/kg 的BPA 能引起或促进前列腺增生,0.01~1 nmol BPA 可以促进大鼠原代前列腺上皮细胞增殖,30~270 μg/kg DEHP 对老年大鼠前列腺有促进增生作用[6-8]。 BPA 和DEHP 促进前列腺增生的作用主要通过模拟,增强或抑制内源性雌激素活性,干扰雄激素系统,影响神经-内分泌作用以及诱导激素调控下细胞因子和通路的改变来实现[6-8],同时我们还发现在诱导成年大鼠前列腺增生中前列腺素D2合成酶基因(prostaglandin D2synthase gene,PTGDS)的转录水平上调[6],提示前列腺素合成酶基因调控可能与前列腺疾病的进展相关。
前列腺素合成酶(prostaglandin synthase,PGS)是与膜结合的多酶系统,在体内的花生四烯酸代谢途中催化底物生成各种具有生理活性的前列腺素[9],主要包括环氧化酶2(Cyclooxygenase-2,COX-2)、前列腺素E 合成酶(prostaglandin E synthase,PGES)、膜结合型前列腺素E2合成酶1(microsomal prostaglandin E2synthase-1,mPGES-1)、Lipocalin 型前列腺素D 合成酶(lipocalin-type prostaglandin D synthase, L-PGDS ) 和 前 列 腺 素 F 合 成 酶(prostaglandin F synthase,PGFS)等。 在PGS 家族中,多种前列腺素合成酶都具有激素反应性,如PGFS 是催化前列腺素H2(prostaglandin H2,PGH2)和前列腺素D(prostaglandin D,PGD)转化为前列腺素F(prostaglandin F,PGF)的末端酶,PGF 在雌性动物中的表达多与妊娠、动情周期、分娩相关,雌激素水平升高可能促进PGFS 的表达和PGF 增多[10]。醛酮还原酶1C3(aldo-keto reductase family 1 member C3,AKR1C3)是PGFS 的一种,可催化5α-二氢睾酮(强雄激素)转化为3α-雄甾烷二醇(弱雄激素),β4-雄烯-3,17 二酮(弱雄激素)转化为睾酮(强雄激素),将雌酮(弱雌激素)转化为17β 雌二醇(强雌激素)等[11]。 AKR1C3 参与睾酮和雌激素代谢,可以参与到激素敏感性组织的生长发育和疾病发生发展中,如乳腺癌、卵巢癌、前列腺癌、精子发生异常等[12]。 有研究表明,AKR1C3 位于雄激素合成通路终末端,是前列腺癌(prostate cancer,PCa)细胞合成睾酮和双氢睾酮的关键酶,在一些PCa 细胞中AKR1C3 可通过激活雄激素受体( androgen receptors,AR)信号通路放大外源低水平雄激素信号并增加自身雄激素合成[13]。
我们还发现低剂量的BPA 可以上调COX-2 和L-PGDS 的表达,影响细胞增殖和凋亡,从而诱导前列腺增生[14]。 BPA 和DEHP 作为典型的环境内分泌干扰物,是否还能影响其他前列腺素合成酶的表达? 目前还鲜少有人研究。 因此,本文将初步探讨环境暴露剂量下BPA 和DEHP 对前列腺种AKR1C3 的影响,研究结果将为前列腺疾病的发生机制提供理论支持。
1 材料和方法
1.1 实验动物
56 只成年雄性SD 大鼠(SPF 级),6~7 周龄,接收时体重140 ~160 g,购自浙江维通利华实验动物技术有限公司[SCXK(浙)2019-0001]。 在上海市生物医药技术研究院[SYXK(沪)2019-0012]屏障系统内饲养至3 月龄,室温20~26℃,相对湿度40%~70%,光照和黑暗各12 h;用大小鼠高压饲料喂养,自由饮水。 动物实验已通过上海市生物医药技术研究院动物实验伦理审查批件(2019-28),严格按照3R 原则给予人道关怀。
1.2 主要试剂与仪器
BPA(货号:239658,含量≥99%)、DEHP(货号:D201154,含量≥99.5%)均购于Sigma-Aldrich公司;羧甲基纤维素钠(CMC-Na)(货号:20140520)购于国药集团化学试剂有限公司;供试品使用前以0.5%的CMC-Na 均匀分散。 大鼠PGFS ELISA Kit(MBS9310151-96) 购 于 美 国 MyBiosource 公 司;Rabbit Anti-AKR1C3 Antibody ( ab196673) 购 于Abcam 公司;即用型免疫组化UltraSensitive TM SP试剂盒(鼠/兔)(货号:KIT9720)、粉剂型抗原修复液(货号:MVS-0066)、DAB 显色试剂(20×)(货号:DAB-0031)、苏木素体细胞染色液(货号 CTS-1090)、PBS 磷酸盐缓冲液(粉型)(货号:PBS-0060)均购自福州迈新生物科技有限公司。
低温 水 平 式 离 心 机( Allegra-12R, 美 国Beckman);恒温振荡培养箱(SI-600R,韩国杰奥特); 电 脑 洗 板 机(DNX-9620, 北 京 普 朗 新);Multiskan GO 全波长酶标仪(1510-04177C,Thermo Fisher Scientific);Leica 石蜡切片机(RM2126,德国徕卡);Leica 全自动染色机(Leica ST5010 德国徕卡);光学显微镜(DM3000,德国徕卡)。
1.3 实验方法
1.3.1 分组和给药
56 只3 月龄雄性SD 大鼠按照体重随机分为7组,依次为对照组、BPA 10 μg/kg、30 μg/kg、90 μg/kg 剂量组和DEHP 30 μg/kg、90 μg/kg 及270 μg/kg 剂量组,每组8 只动物,分别灌胃(intragastric administration,i.g.)给予10 mL/kg 溶媒,相应剂量的BPA 和DEHP,连续4 周。 动物体重每周称量1次,根据体重调整给药剂量,于第4 周末次给药24 h后,腹腔注射3%戊巴比妥钠,麻醉大鼠,腹主动脉采血,处死动物。
1.3.2 前列腺取材
动物处死后,剖取前列腺组织,并将其分为腹侧叶和背侧叶,将各叶前列腺组织分为三部分,一部分用10%的福尔马林溶液固定,用于病理分析;另外两部分均保存于液氮中,用于进一步的分析。
1.3.3 ELISA 法检测AKR1C3 水平
腹主动脉采血,静置两小时后离心(3590 r/min,15 min),分离出血清。 前列腺组织称重后剪碎按照1 ∶10(w ∶v)比例加入生理盐水,用手动匀浆器在冰上超声匀浆,重复3 次,充分匀浆后离心(3590 r/min,15 min),收集匀浆上清液。 ELISA 法检测血清和前列腺中AKR1C3 水平。 将所有的试剂平衡至室温;蒸馏水稀释浓缩洗涤液,用去离子水重配标准品至相应的浓度,室温放置10 min 备用。 测定步骤如下:
加样:加入标准品、样品、和样品稀释液(空白孔)至相应的孔中。
孵育:每孔加入结合剂,混合均匀,封板膜封板后37℃孵育1 h。
洗涤:撕掉封板膜后弃去液体,设置洗板机注水量为400 μL,浸润10 s,震荡5 s,洗板5 次,洗涤后用吸水纸拍干。
显色:每孔依次加入显色试剂,封板膜封板后37℃避光孵育10 min。
终止:每孔加入50 μL 的终止液,混合均匀,终止反应(颜色由蓝色变为黄色)。
测定:15 min 以内用酶标仪进行测定(450 nm波长)。
计算:拟合出标准曲线并生成曲线方程,带入样本OD 值计算样本浓度。
1.3.4 免疫组化法检测AKR1C3 表达情况
取前列腺腹侧叶和背侧叶组织,按照免疫组化试剂盒说明书进行如下操作:脱蜡水化:二甲苯(5 min/次,2 次)→无水乙醇(5 min/次,2 次)→95%乙醇(5 min/次,2 次)→75%乙醇(5 min/次,2 次)去离子水(3 min/次,3 次);抗原修复:切片浸没于0.01 mol 原修复液中,微波修复20 min,室温冷却,取出后PBS 浸洗2 min/次,3 次;内源性过氧化物酶阻断:每张切片滴加一滴试剂A,室温孵育10 min,PBS 浸洗3 min/次,3 次;血清封闭:每张切片滴加一滴试剂B,室温孵育10 min;加一抗:每张切片加50 μL 一抗(阴性对照用PBS 替代),4℃孵育过夜,PBS 浸洗3 min/次,3 次;加二抗:每张切片滴加一滴试剂C,室温孵育10 min;PBS 浸洗3 min/次,3次,每张切片滴加一滴试剂C,室温孵育10 min;PBS浸洗3 min/次,3 次;显色:配制DAB 溶液(现用现配)每张切片加100 μL 显色液,显微镜下观察显示棕黄色颗粒即终止显色;复染:苏木素复染4 min,水化1 min,盐酸分化4 s,流水洗11 min;干燥透明:75%乙醇(5 min/次,2 次)→95%乙醇(5 min/次,2次)→无水乙醇(5 min/次,2 次)→二甲苯(5 min/次,2 次);封片:中性树胶封片,显微镜下观察。
每组选取6 个动物组织切片,随机观察每张切片的10 个视野,切片出现的棕黄色颗粒为阳性反应,用Image-Pro Plus 6.0 测定切片图像的平均光密度,进行蛋白表达的半定量统计,组间比较采用单因素方差分析,以P<0.05 表示差异具有显著性。
1.4 统计学方法
2 结果
2.1 AKR1C3 水平变化
ELISA 检测结果显示(图1),给予BPA 后,与对照组相比,各剂量组血清AKR1C3 水平无显著性变化;腹侧前列腺AKR1C3 的水平无明显变化,但90 μg/kg 剂 量 组 略 高 于 对 照 组;背 侧 前 列 腺AKR1C3 的水平升高,10 μg/kg 剂量组有显著性差异(P<0.01)。 给予DEHP 后,随着剂量增加血清AKR1C3 的水平上升,270 μg/kg 剂量组显著性高于对照组(P<0.001);腹侧前列腺AKR1C3 水平均显著性高于对照组(P<0.05,P<0.01);背侧前列腺中,30 μg/kg 和90 μg/kg 剂量组AKR1C3 的水平高于对照组。 (表1)
表1 BPA 和DEHP 对SD 大鼠AKR1C3 水平的影响(±s,n=8)Table 1 Effects of BPA and DEHP on AKR1C3 level in SD rats

表1 BPA 和DEHP 对SD 大鼠AKR1C3 水平的影响(±s,n=8)Table 1 Effects of BPA and DEHP on AKR1C3 level in SD rats
注:与对照组相比, *P<0.05, **P<0.01, ***P<0.001。Note.Compared with the control group, *P<0.05, **P<0.01, ***P<0.001.
组别Groups 剂量(μg/kg)Doses血清(ng/mL)Serum腹侧前列腺叶(ng/g)Ventral prostatic lobe背侧前列腺叶(ng/g)Dorsal prostatic lobe对照组Control group 0 1.18±0.09 18.08±3.55 11.60±3.78 BPA 10 0.96±0.13 17.61±1.24 18.10±4.57*30 0.98±0.11 17.84±2.22 12.30±0.73 90 1.13±0.08 19.84±1.06 16.52±2.43 DEHP 30 1.14±0.17 21.66±1.36* 16.62±6.79 90 1.31±0.18 21.25±0.51* 14.39±3.75 270 2.76±0.38*** 22.03±1.21** 11.67±0.82
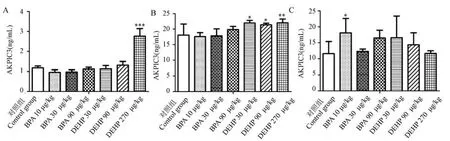
注:A:血清;B:腹侧前列腺;C:背侧前列腺。 与对照组相比, *P<0.05, **P<0.01, ***P<0.001。图1 BPA 和DEHP 对SD 大鼠血和前列腺组织中AKR1C3 水平的影响Note.A, Serum.B, Ventral prostatic lobe.C, Dorsal prostatic lobe.Compared with the control group, *P<0.05, **P<0.01, ***P<0.001.Figure 1 Effects of BPA and DEHP on the level of AKR1C3 in serum and prostate of SD rats
2.2 前列腺组织中AKR1C3 的表达情况
免疫组化结果显示,给予BPA 后,与对照组相比,腹侧前列腺中,30 μg/kg 和90 μg/kg 剂量组AKR1C3 表达升高,且90 μg/kg 剂量组有统计学意义(P<0.05),背侧前列腺中,各剂量组AKR1C3 表达均升高,10 μg/kg 剂量组有统计学意义(P<0.001);给予DEHP 后,与对照组相比,腹侧前列腺中,各剂量组AKR1C3 表达均升高,270 μg/kg 剂量组有统计学意义(P<0.05),背侧前列腺中,各剂量组AKR1C3 表达也均升高,30 μg/kg 和90 μg/kg 剂量组有统计学意义(P<0.001,P<0.05)(见表2,图2~图4)。
表2 BPA 和DEHP 对SD 大鼠前列腺AKR1C3表达的影响(±s,n=8)Table 2 Effects of BPA and DEHP on the expression of AKR1C3 in prostateOf SD rats
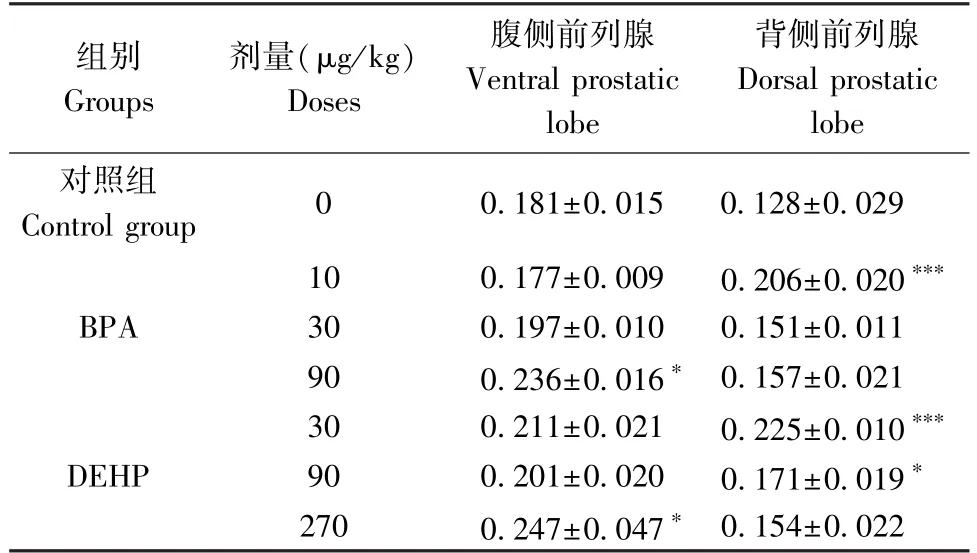
表2 BPA 和DEHP 对SD 大鼠前列腺AKR1C3表达的影响(±s,n=8)Table 2 Effects of BPA and DEHP on the expression of AKR1C3 in prostateOf SD rats
注:与对照组相比, *P<0.05, ***P<0.001。Note.Compared with the control group, *P<0.05, ***P<0.001.
组别Groups剂量(μg/kg)Doses腹侧前列腺Ventral prostatic lobe背侧前列腺Dorsal prostatic lobe对照组Control group 0 0.181±0.015 0.128±0.029 BPA 10 0.177±0.009 0.206±0.020***30 0.197±0.010 0.151±0.011 90 0.236±0.016* 0.157±0.021 DEHP 30 0.211±0.021 0.225±0.010***90 0.201±0.020 0.171±0.019*270 0.247±0.047* 0.154±0.022
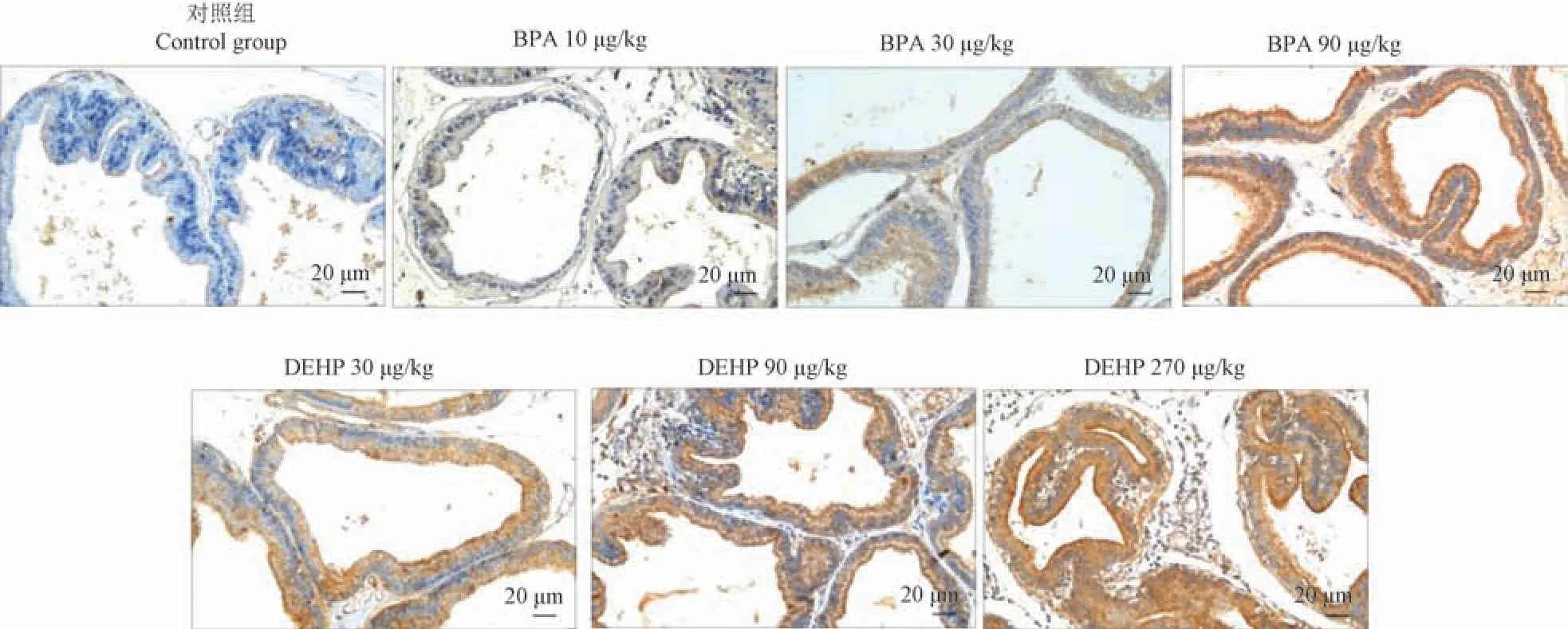
图2 BPA 和DEHP 对SD 大鼠腹侧前列腺AKR1C3 表达的影响Figure 2 Effects of BPA and DEHP on the expression of AKR1C3 in ventral prostate of SD rats
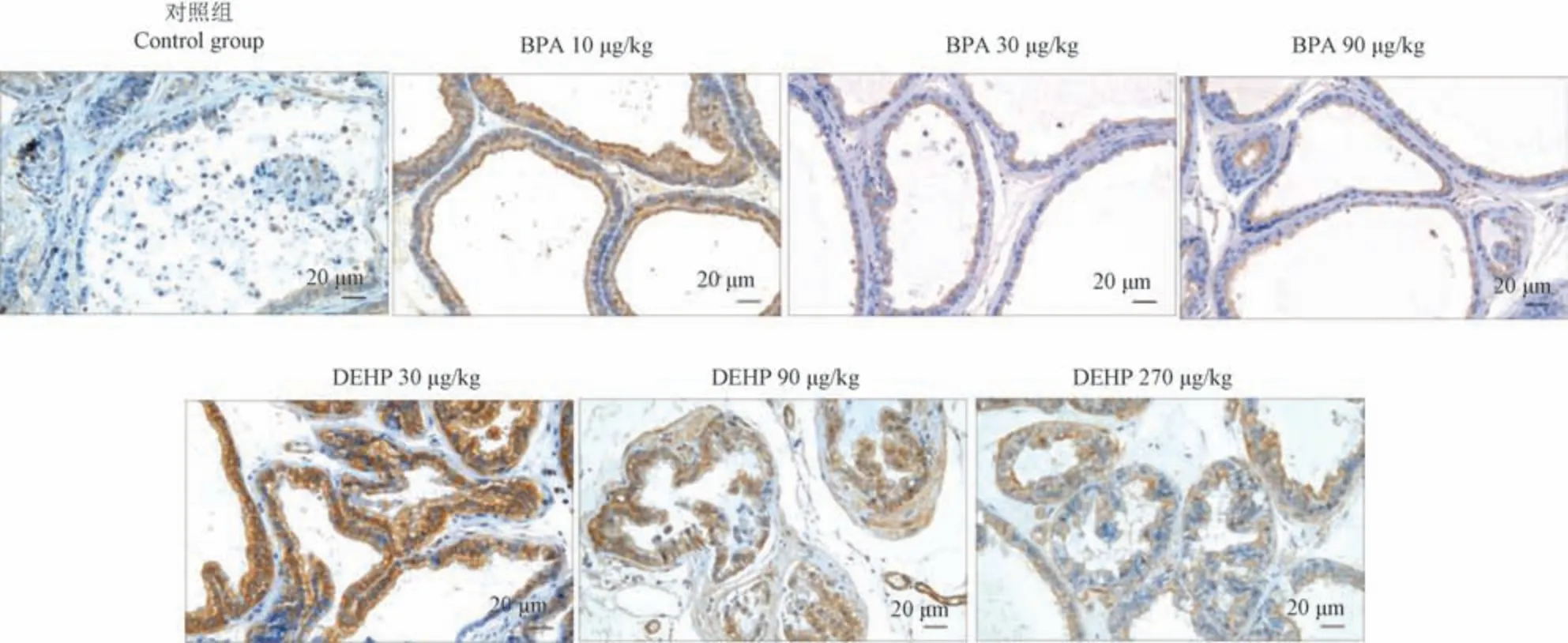
图3 BPA 和DEHP 对SD 大鼠背侧前列腺AKR1C3 表达的影响Figure 3 Effects of BPA and DEHP on the expression of AKR1C3 in dorsal prostate of SD rats
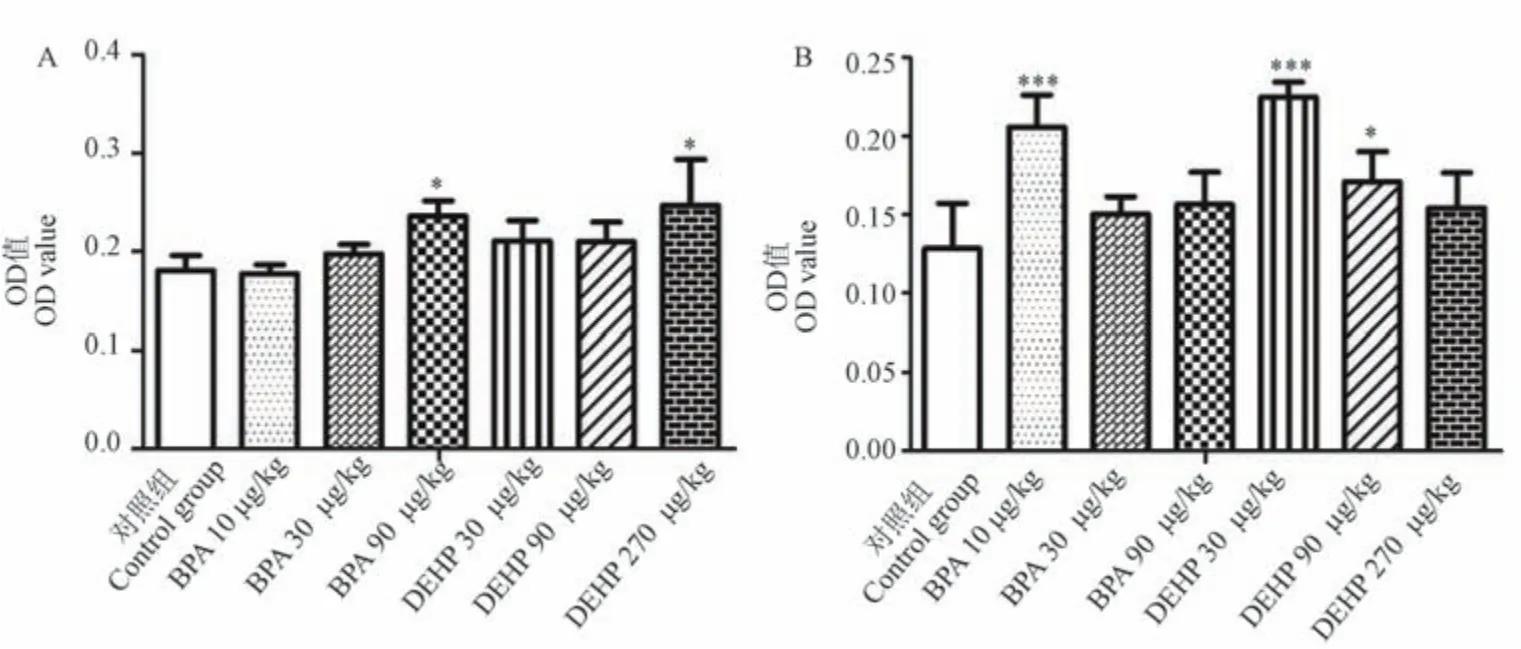
注:A:腹侧前列腺;B:背侧前列腺。 与对照组相比, *P<0.05, ***P<0.001。图4 BPA 和DEHP 对SD 大鼠前列腺AKR1C3 表达的影响Note.A, Ventral prostatic lobe.B, Dorsal prostatic lobe.Compared with the control group, *P<0.05, ***P<0.001.Figure 4 Effects of BPA and DEHP on the expression of AKR1C3 in prostate of SD rats
3 讨论
BPA 和DEHP 应用广泛,人们可以通过摄取、吸入、皮肤接触等多种途径暴露其中。 本次研究发现,给予10~90 μg/kg 的BPA 和30 ~270 μg/kg 的DEHP 后,AKR1C3 水平和蛋白表达均升高,腹侧前列腺叶中高剂量组表现比较明显,而背侧前列腺叶中低剂量组表现更为明显,提示背侧前列腺叶对BPA 和DEHP 更敏感。 曾有报道称在成纤维细胞生长因子-2(fibroblast growth factor-2,FGF-2)表达的转基因小鼠中,背侧前列腺上皮增生比腹侧叶明显,小鼠背侧前列腺可能与人前列腺周围带同源,而前列腺增生和前列腺癌几乎都源于移行带和周围带[15]。 有研究发现雌激素通过细胞核内受体途径促进奶牛输卵管平滑肌组织中PGFS 的表达,而植物雌激素及其代谢物可以刺激PGF2α 的分泌,明显增加前列腺素FL2(prostaglandin FL2,PGFL2)基因的表达,从而促进生殖细胞的活力和增殖[16-17],BPA 和DEHP 作为2 种植物雌激素,与雌激素作用类似,可能通过同样的途径对AKR1C3 的表达产生影响。
AKR1C3 是PGFS 的一种,可催化强弱雄激素之间的转化以及弱雌激素转化为强雌激素,这种调节靶组织中雌雄激素局部浓度的作用使其成为多种激素依赖性病变的研究靶点。 AKR1C3 可以激活AR 信号诱导雄激素合成,不仅调节雄激素的生成,还可以作为AR 的共激活因子以浓度依赖性方式激活AR。 AKR1C3 在前列腺素化合物合成中也有重要作用,分别催化PGH2 和PGD2 生成前列腺素PGF2α、PGF9α 和11β-PGF2,尤其对PGD2 的催化活性最高[18]。 前列腺作为雄性生殖系统中重要的附属性腺器官,其生长发育与雌雄激素调节密切相关。 在前列腺癌中,AKR1C3 过表达,能调节类固醇类激素,与前列腺腺素受体结合,激活依赖于生长因子的MAP 激酶途径促进细胞增殖,还能促进肿瘤的侵袭性[10]。 此外,PGD2 和NF-κB 信号通路相关,AKR1C3 介导的PGD2 缺失会抑制NF-κB 通路,AKR1C3 还可以直接与NF-κB 和雌激素受体α(estrogen receptor-α,ERα)的DNA 结构域残基反应,使NF-κB 和ERα 依赖性基因转录增加,从而促进肿瘤的发生[11]。
综上所述,低剂量BPA 和DEHP 可以促进成年SD 大鼠前列腺AKR1C3 的表达,我们之前有关环境内分泌干扰物促进前列腺增生的研究,发现AR 信号通路和NF-κB 信号通路在BPH 的发展中均发挥重要作用[19-20],提示AKR1C3 的过表达可能是BPA和DEHP 引起前列腺增生的作用机制之一。 但是,前列腺素合成酶在前列腺细胞增殖中的作用机制以及与雌雄激素受体之间的调控关系还需要进一步的研究。
