左向右分流减缓肺动脉高压大鼠心脏重构
2023-12-04爽潘慧李天骐叶梦婷马铭婕张学佳王晓建杨晓敏
纪 爽潘 慧李天骐叶梦婷马铭婕张学佳王晓建*杨晓敏
(1.内蒙古科技大学包头医学院,内蒙古 包头 014040;2.中国医学科学院,北京协和医学院,阜外医院肺血管医学重点实验室,心血管疾病国家重点实验室,国家心血管病中心,北京 100037;3.包头医学院第二附属医院心内科,内蒙古 包头 014030;4.浙江大学医学院附属邵逸夫医院全科医学科,杭州 310016;5.衢州市柯城区人民医院,浙江 衢州 324000)
肺动脉高压(pulmonary arterial hypertension,PAH) 是 第 一 大 类 肺 高 血 压 ( pulmonary hypertension,PH),根据病因不同可分为先心病相关肺动脉高压( congenital heart disease-associated pulmonary arterial hypertension,CHD-PAH)、特发性肺动脉高压(idiopathic pulmonary hypertension,IPAH)、遗传性肺动脉高压、药物和毒素相关肺动脉高压等多种亚型[1]。 CHD-PAH 和IPAH 是我国排名前两位的肺动脉高压类型,分别占第一大类肺动脉高压43.4%~56.1%、30.8%~35.4%[2-3]。 这两种肺动脉高压预后差异很大,CHD-PAH 的1 年、5年和10 年生存率分别是99%、91%和85%,而IPAH只有90%、63%和46%[4]。 为何CHD-PAH 患者的预后优于IPAH,具体机制尚不十分清楚。
本课题组在之前的研究中发现,单纯左向右分流手术不会诱导大鼠产生肺动脉高压,但会在术后1 周诱导大鼠出现快速的左心代偿性重构,并在术后8 周持续存在[5]。 有研究表明,严重的CHD-PAH患者尽管会产生右心结构的改变,但右心收缩功能却可以在数十年内保持正常。 这种改变可能是由于分流的存在,导致左心部分分担了右心的压力[6]。 在先天性心脏病的早期关闭心脏内左向右的分流,使肺血流动力学和血管回到正常环境,这些患者仍有部分会发展成肺动脉高压且预后明显比未进行矫治的CHD-PAH 患者差[7-10]。 所以,我们推断左向右分流引起的左心代偿是心脏整体的“预适应”,可能在先心病合并肺动脉高压患者的预后中起积极的作用。
本项目中,我们利用大鼠颈部分流手术叠加野百合碱(monocrotaline,MCT)来模拟左向右分流型CHD-PAH,设置单纯MCT 组来模拟IPAH,比较两组肺动脉高压大鼠在表型差异,进而探究两种不同类型肺动脉高压患者预后不同的可能原因。
1 材料和方法
1.1 实验动物
24 只SPF 级雄性SD 大鼠(150 ~200 g,8 周龄),购买自北京维通利华动物实验技术有限公司[SCXK(京)2021-0006]。 动物饲养条件为12 h/12 h 的明/暗交替、湿度(50±10)%、温度(22±1)℃,自由获取饮食,饲养在清洁环境,饲养于心血管疾病国家重点实验室[SYXK(京)2022-0052]。 所有动物实验严格遵守3R 原则,本项目研究方案通过阜外医院动物伦理委员会批准(FW-2022-0028)。
1.2 主要试剂与仪器
异氟烷(广州硕恒生物科技有限公司,批号:20221001);野百合碱(MCT)(美国Sigma 公司,批号:mfcd00084656);4%多聚甲醛溶液(北京雷根生物技术有限公司,批号:0111A23);EVG 染色试剂盒(上海碧云天生物技术有限公司,批号:GR3382140-1)。 小动物超声仪(加拿大VisualSonics 公司,序列号:041QPR);小动物气麻醉机(美国Matrx 公司,序列号:V1643859);多导生理记录仪(Powerlab 8/30)及其配套的压力换能器(北京华睿宝科技有限公司,序列号:DB763);全景玻片扫描系统(厦门精艺兴业科技有限公司,序列号:17490957)。
1.3 实验方法
1.3.1 动物分组
将大鼠随机分为3 组:对照组(control,n=8);单纯野百合碱组(simple MCT,n=8),皮下注射MCT(50 mg/kg);手术+MCT 组(operation+MCT,n=8),颈部动静脉吻合术的同时注射MCT(50 mg/kg)。造模后3 周为实验终点,各组大鼠进行超声心动图检查、右心导管检测和肺组织病理学分析。
1.3.2 颈部动静脉吻合术
吸入异氟烷麻醉后,大鼠仰卧固定于手术台,颈部剃毛备皮后,做一斜形切口。 分离颈部动、静脉,腹腔注射肝素200 U,夹住动、静脉近端,绑扎远端,剪断动、静脉,吻合动、静脉残端。动静脉吻合后,拔除血管夹,立即可见静脉搏动,吻合口无漏血,手术成功。 缝合颈部皮肤,消毒伤口表面。
1.3.3 MCT 皮下注射
在大鼠后颈背部皮下注射MCT(50 mg/kg)。
1.3.4 超声心动图检查
将大鼠吸入异氟烷麻醉,仰卧于测量台上,暴露胸部皮肤并涂抹耦合剂,使用小动物超声装置(Vevo 2100 成像系统)检测主动脉短轴切面上右心室流出道宽度,在多普勒模式下的主动脉短轴图像上测量肺动脉血流量,在四腔切面上观察三间瓣环收缩期位移,舒张期右心室游离壁厚度和管腔直径是在胸骨旁右心短轴切面上测量的。
1.3.5 左右心导管检查
当大鼠吸入异氟烷麻醉后,在胸骨上方1 cm 处切开皮肤,暴露颈外静脉。 剥离并切断颈外静脉,结扎远端,近端打松结,拉紧近端结扎线以防止出血。 用针刺破颈外静脉,将导管插入血管,将近心端结扎线扎紧以固定导管。 导管缓慢推进,导管穿过右心进入肺动脉。 用波形验证导管位置,并记录右心室和肺动脉压力。 取3 个稳定波形,每个波形由10 个心动周期组成,记录平均肺动脉压和右心室收缩压。 保存3 组数据的平均值作为大鼠的压力值,并采用相同的方法测量左心。
1.3.6 病理检查
取出完整的大鼠左叶肺组织,在室温下用4%多聚甲醛固定2 周,然后脱水并包埋在石蜡中。 HE和EVG 染色后计算肺小动脉(<50 μm 和50 ~100 μm)中膜厚度(肌层厚度/血管外径)的百分比。 每组至少计数5 只大鼠,每只大鼠至少有15 只血管。
1.4 统计学方法
采用GraphPad Prism 8.0 软件进行分析,连续变量表示为平均数±标准差(±s)。 多组间均值比较采用单因素方差分析,两组间均值比较采用独立样本t检验两组比较,P<0.05 认为差异有统计学意义。
2 结果
2.1 手术+MCT 组大鼠的左心室重构优于单纯MCT 组大鼠
与对照组相比,单纯MCT 组和手术+MCT 组的舒张期右室前壁厚度(right ventricular wal,RVAW;d) 和 舒 张 期 右 室 腔 径(right ventricular internal diameter,RVID;d)显著增加(表1,P<0.01);三尖瓣环收缩期位移(tricuspid annular plane systolic excursion,TAPSE)和肺动脉血流加速时间/肺动脉射血时间(acceleration time of pulmonary blood flow/pulmonary ejection time,PAT/PET)均降低,提示两组大鼠均出现右心重构和右心功能障碍(表1,P<0.01)。 单纯MCT 组与手术+MCT 组两组之间在右心重构指标上无明显差异。 单纯MCT 组大鼠的左心受扩张的右心室压迫,舒张期左室腔径(left ventricular internal diame, LVID;d)减小,左心射血分数(ejection fraction, EF)升高,显著高于对照组(图1,P<0.05)。 与单纯MCT 组相反,手术+MCT组大鼠虽然右心室也发生重构,但是LVID;d 未降低,EF 值未升高,总体上更接近正常对照组,提示左向右分流手术部分缓解了MCT 引起的左心重构。

注:A:对照组(n =5);B:单纯MCT 组(n =8);C:手术+MCT 组(n =8);D:舒张期左室腔径统计图;E:左心射血分数统计图。 与对照组相比, *P<0.05, **P<0.01。图1 实验终点大鼠胸骨旁右心短轴切面M 模式检测图及结果统计图Note.A, Control group(n =5).B, Simple MCT group (n =8).C, Operation+MCT group (n =8).D, Statistical diagram of left ventricular cavity diameter in diastole.E, Statistical diagram of left ventricular ejection fraction.Compared with control group, *P<0.05, **P<0.01.Figure 1 M-mode detection diagram and result statistics of parasternal right heart short-axis section in rats at the end of the experiment

表1 实验终点三组大鼠超声结果Table 1 Ultrasonic results of rats in three groups at the end of the experiment
2.2 手术+MCT 组大鼠的右心室功能处于代偿期
与对照组相比,其余两组的平均肺动脉压(mean pulmonary artery pressure,mPAP)和右室收缩压(right ventricular systolic pressure,RVSP)均升高(表2,P<0.01),提示两组大鼠均发生肺动脉高压。与单纯MCT 组相比,手术+MCT 组的mPAP 和RVSP 稍低,左室收缩压(left ventricular systolic pressure,LVSP) 显 著 升 高(71.2 vs 105.1,P<0.05)(表2,P<0.01),在右心功能方面,单纯MCT 大鼠的右心等容收缩期心室内压上升最大速率(maximal ventricular pressure rising rate,dp/dt Max) 和等容舒张期心室内压下降最大速率(maximal rate of decrease of ventricular pressure,dp/dt Min)均显著高于对照组,提示肺动脉压力升高使该组大鼠右心室处于功能代偿期。 如图2所示,MCT+分流组大鼠右心代偿虽然高于对照组,但显著低于单纯MCT 组,提示该组大鼠右心后负荷和代偿反应明显低于单纯MCT 组(P<0.05)。 这与MCT+分流组大鼠肺血管压力稍低于单纯MCT 组相一致。
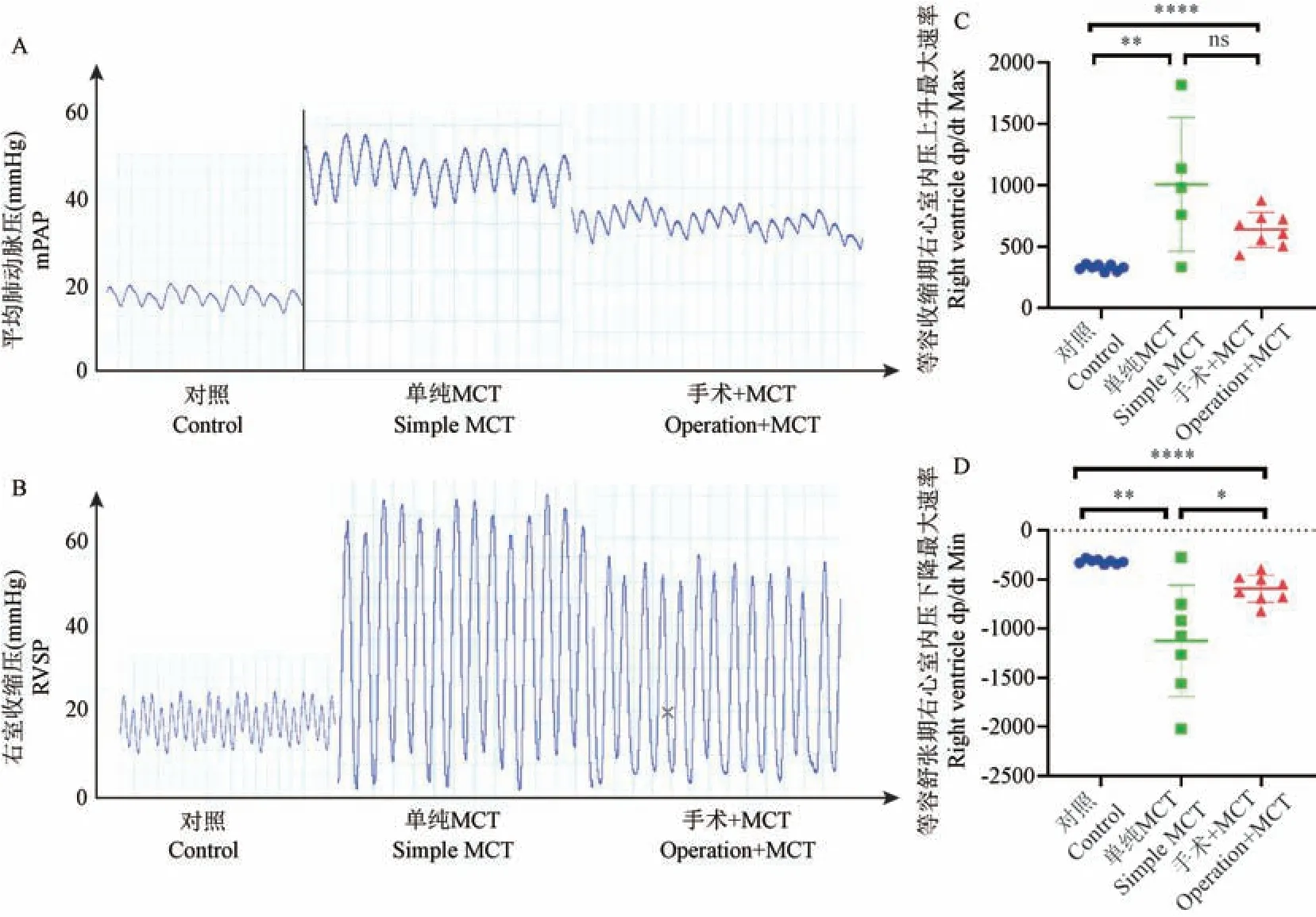
注:A:各组大鼠平均肺动脉压力波形图(n=8);B:各组大鼠右室收缩压波形图(n=8);C:右心等容收缩期心室内压力上升最大速率(dp/dt Max)统计图;D:右心等容舒张期心室内压下降最大速率(dp/dt Min)统计图。 与对照组相比, *P<0.05, **P<0.01, ****P<0.0001。图2 各组大鼠右心导管测压波形图Note.A, Waveform of mean pulmonary artery pressure of rats in three groups (n=8).B, Right ventricular systolic pressure waveform of rats in three groups (n=8).C, Statistical diagram of the maximum rate of ventricular pressure rise (dp/dt Max) during isovolumic contraction of the right heart.D,Maximum rate of decrease of ventricular internal pressure (dp/dt Min) of right heart during isovolumic relaxation.Compared with control group, *P<0.05, **P<0.01, ****P<0.0001.Figure 2 Waveform of right ventricular catheter pressure measurement of rats in each group
2.3 MCT 注射诱导严重肺血管重构
在明确右室重构和肺动脉压力变化的前提下,对三组大鼠肺组织病理学染色,分析肺血管病变程度(图3)。将肺小动脉分为直径<50μm和直径50 ~100 μm 两组,分别统计中膜厚度百分比。 与对照组相比,单纯MCT 组和手术+MCT 组肺小动脉中膜增厚,肺血管明显重构(表3,P<0.001)。 单纯MCT 组和手术+MCT 组两组之间肺小动脉重构程度没有明显差异(图3G、3H,P<0.05),提示左向右分流不影响肺血管重构,主要影响心脏重构,进而影响预后。
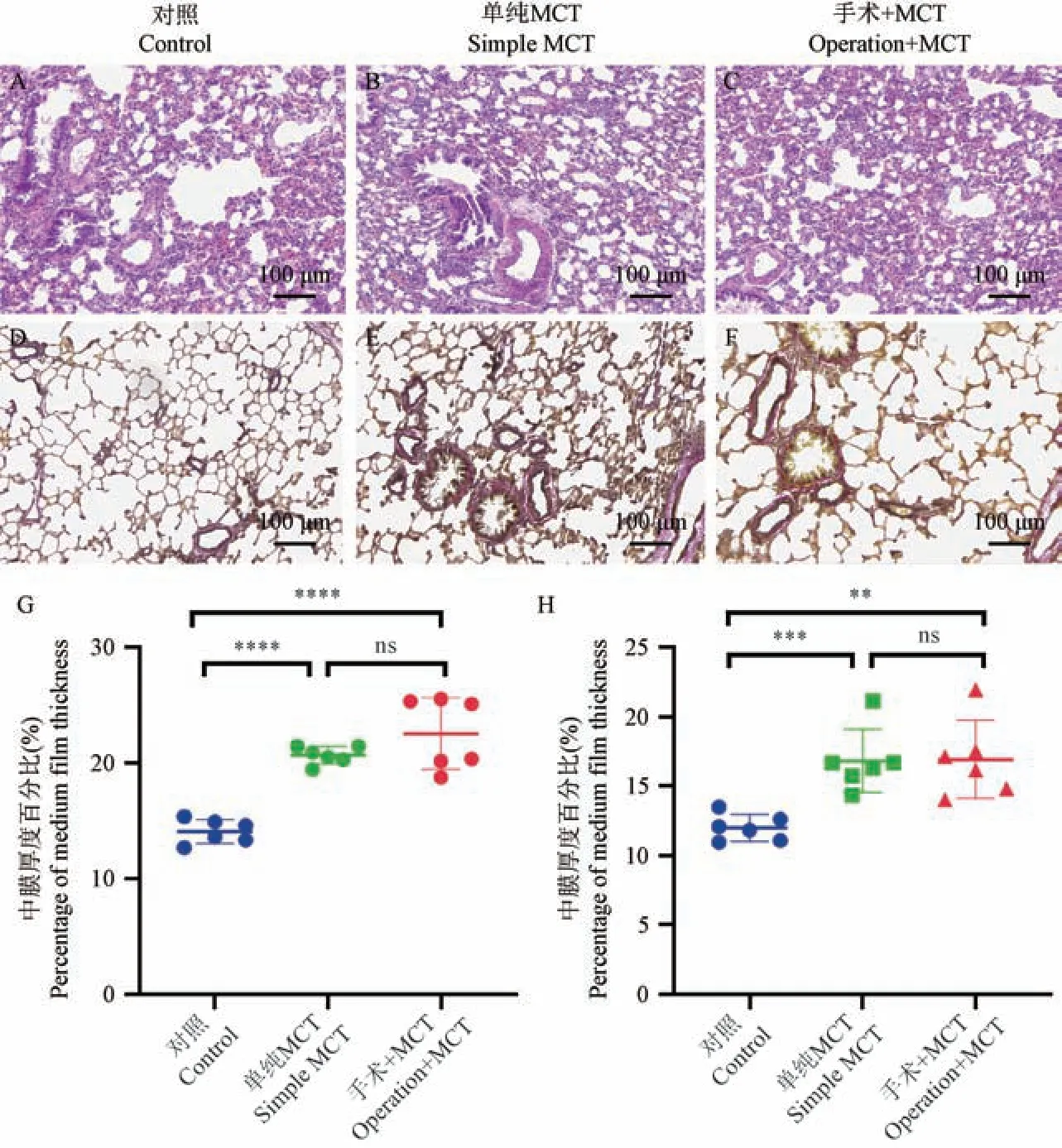
注:A~C:对照组、单纯MCT 组、手术+MCT 组大鼠肺小动脉HE 染色图;D~F:对照组、单纯MCT 组、手术+MCT 组大鼠肺小动脉EVG 染色图;G:直径50 μm 以下血管中膜厚度百分比统计图(n =8);H:直径50~100 μm 血管中膜厚度百分比统计图(n=8)。 与对照组相比, **P<0.01, ***P<0.001, ****P<0.0001。图3 各组大鼠肺组织病理染色及统计图Note.A~C, HE staining of pulmonary arterioles of rats in control group, simple MCT group and operation+MCT group.D~F, EVG staining of pulmonary arterioles in rats of control group, simple MCT group and operation +MCT group.G, Statistical chart of percentage of vascular media thickness below 50 μm (n =8).H, Statistical chart of the percentage of vascular media thickness 50~100 μm (n =8).Compared with control group, **P<0.01, ***P<0.001, ****P<0.0001.Figure 3 Pathological staining and statistical diagram of lung tissue of rats in each group

表3 实验终点三组大鼠肺小动脉中膜厚度百分比结果Table 3 Percentage results of pulmonary arteriolar media thickness of rats in three groups at the end of the experiment
3 讨论
本研究中,单纯MCT 组和手术+MCT 组大鼠术后3 周均出现肺动脉高压和右心室重构,且两组大鼠之间无明显差异。 但对更多表型数据进行分析后,发现手术+MCT 组大鼠的LVID;d、EF、右心dp/dt Max 和dp/dt Min 均明显优于单纯MCT 组,提示CHD-PAH 与IPAH 在心脏重构方面有很大的不同。
注射MCT 是制造肺动脉高压动物模型的经典方法,单次皮下注射剂量范围为40 ~80 mg/kg 体重,最常用的的剂量为60 mg/kg 体重[11-12]。 本研究中,我们将MCT 的注射量从常规的60 mg/kg 体重降低到50 mg/kg 体重,更好地展示了左向右分流在CHD-PAH 中所起的作用。 与腹主动脉-腔静脉分流术模型相比[13-14],本研究采用的颈部分流更靠近大鼠心脏,所产生的分流也更加强烈,更加符合患者的临床特征。 本研究所模拟的CHD-PAH 在肺动脉压力、右室重构、肺血管病理重构等多方面与IPAH 大鼠没有明显差别,但CHD-PAH 大鼠的左室功能更好,右室因肺动脉压力升高引起的代偿性反应性更低。 这些发现与临床研究相一致。 2013 年一项针对不同类型肺动脉高压患者临床特征的研究表明,CHD-PAH 患者肺动脉压力和肺血管阻力最高,但患者肺动脉高压功能分级(WHO-FC)和运动耐量较好,提示CHD-PAH 患者心功能与肺动脉压力和肺血管阻力并不一致[15]。 关于中国肺动脉高压特征的多中心人群队列研究结果显示,与IPAH患者相比CHD-PAH 组患者更容易延误诊断导致肺动脉压力更高,但心脏的性能更好,生存率明显优于其他病因组[16-17]。
真实世界中,CHD-PAH 与IPAH 患者病程很长。 本次实验时间较短,仅观察了造模后3 周的表型变化,并且未设计多个实验终点对各组大鼠进行超声心动图、左右心导管和肺组织病理学检测,观察左心代偿作用产生的时间点。 后续我们将做更多研究,明确这两个模型在长期预后和各个时间点心肺功能的改变。
肺动脉高压患者的病灶部位在肺血管,但预后主要取决于心脏整体功能和代偿能力。 本研究比较了IPAH 和CHD-PAH 两种不同病理情况大鼠模型心脏结构、肺动脉压力和肺小动脉病理变化,发现先心病合并肺动脉高压与特发性肺动脉高压的心脏重构有着很大不同,在肺血管重构相似的情况下,左向右分流的先心病显著改变了心脏整体对肺动脉压力升高的代偿反应。 我们的初步实验结果为后续研究这两种不同肺动脉高压亚型的病理机制打下基础。
