ADAM10 在骨髓间充质干细胞成骨分化及胫骨骨折愈合中的作用及可能机制
2023-12-04唐晓旭张志乾李福琴
唐晓旭,张志乾,李福琴,王 楠
(1.郑州澍青医学高等专科学校临床医学系,郑州 450064;2.河南省洛阳正骨医院脊柱外科,郑州 457000;3.郑州大学第一附属医院感染管理科,郑州 450052;4.郑州大学第一附属医院急诊外科,郑州 450052)
胫骨骨折是临床常见的四肢骨折类型,多由高能量暴力引起,容易造成局部软组织及血供的破坏,进而增加内固定手术后骨折不愈合或延迟愈合的发生风险[1-2]。 骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)在骨折愈合过程中发挥重要作用,骨折断端趋化和浸润的BMSCs 能够发生成骨分化,进而促进骨质形成、加速骨折愈合[3];BMSCs 的浸润及成骨分化受阻时,对骨折愈合产生不利影响[4]。 BMSCs 成骨分化的影响因素复杂,通过有效的干预手段促进BMSCs 的成骨分化有助于增强BMSCs 在骨折愈合中的作用。
近些年,基因治疗在干细胞成骨分化、骨折愈合中的应用备受关注,解整合素金属蛋白酶10(a disintegrin and metalloproteinase 10,ADAM10)基因的编码产物定位于细胞膜,在调控细胞黏附、运动、分化中均起到作用[5-7]。 一项口腔科相关的研究证实在牙周膜干细胞成骨分化过程中ADAM10 的表达逐步降低,通过慢病毒感染的方式进行ADAM10 过表达对牙周膜干细胞的成骨分化具有抑制作用且这一作用与抑制Notch1 信号通路有关[8],但该基因在BMSCs 成骨分化中的作用及其在骨折愈合中的潜在效应尚不清楚。 因此,本实验通过稳定敲低ADAM10 表达的细胞实验及胫骨骨折的动物实验分析ADAM10 基因对BMSCs 成骨分化及胫骨骨折愈合的影响,同时也分析Notch1 信号通路在ADAM10基因调控BMSCs 成骨分化及胫骨骨折愈合中的作用,旨在深入认识BMSCs 成骨分化的调控机制,发现促进胫骨骨折愈合的新治疗靶点。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF 级雄性SD 大鼠购自上海杰思捷实验动物有限公司[SCXK(沪)2018-0004],共20 只,8 ~10周龄,体重180~200 g,实验动物于郑州澍青医学高等专科学校动物房饲养[SYXK(豫)2022-0004],温度20~22℃,湿度50%~55%,12 h/12 h 光照/黑暗交替,自由饮食摄水。 实验经郑州市澍青医学高等专科学校医学伦理委员会批准(2021KYLL-Y-019),动物实验遵循3R 原则。
1.1.2 细胞
SD 大鼠BMSCs(货号:RASMX-01001)购自广州赛业生物科技有限公司。
1.2 主要试剂与仪器
阴 性对 照(negative control,NC) shRNA 及ADAM10 shRNA 的pGFP-V-RS 载体、NC shRNA 及ADAM10 shRNA 的pCMV5.0 载体(北京傲锐东源生物公司);转染试剂Lipo2000(美国Invitrogen 公司,批号:11668027);地塞米松(批号:D1756)、β-甘油磷酸钠(批号:G6251)、维生素C(批号:A7506)、茜素红(批 号: A5533)、 Notch1 激动 剂丙戊 酸(Valproic acid,VPA) (批号:P4543) (储存液用DMSO 配置、浓度1.0 mol/L)(美国Sigma 公司);碱性磷酸酶(ALP)活力检测试剂盒(北京索莱宝公司,批号:BC2145);HE 染色试剂盒(上海碧云天公司,批号:C0105);ADAM10(批号:ab124695)、骨钙素(osteocalcin,OCN)(批号:ab133612)、Runt 相关转录因子2 (Runt-related transcription factor 2,Runx2)(批号:ab76956)、I 型胶原(Type I collagen,Col-I)(批号:ab34710)、Notch 受体胞内部分(Notch intracellular domain,NICD)(批号:ab52627)、发状分裂相关增强子1(hairy and enhancer of split 1,Hes1)(批号:ab108937)的特异性一抗(美国Abcam 公司)。 HERAcell 150i 型细胞培养箱(美国Thermo 公司);Tanon4800 型凝胶成像系统(上海天能仪器公司);VISION90 型小动物科研X 光机检测仪(丹东奥龙射线仪器集团有限公司)。
1.3 实验方法
1.3.1 细胞实验
BMSCs 在完全培养基中贴壁培养,消化传代后接种在培养皿内进行分组转染,转染5 mg/L NC shRNA 的pGFP-V-RS 载体、5 mg/L ADAM10 shRNA的pGFP-V-RS 载体,48 h 后更换为含有1 g/L 嘌呤霉素的筛选培养基,筛选得到稳定转染的BMSCs。
稳定转染的BMSCs 分组:为验证ADAM10 的调控作用,不进行转染的BMSCs 作为对照组,稳定转染NC shRNA 的BMSCs 作为sh-NC 组、稳定转染ADAM10 shRNA 的BMSCs 作为sh-ADAM10 组;为验证Notch1 在ADAM10 发挥调控作用中的生物学意义,稳定转染NC shRNA 的BMSCs 加入体积分数0.1%的DMSO 作为sh-NC +DMSO 组,稳定转染ADAM10 shRNA 的BMSCs 加入体积分数0.1%的DMSO 作 为 sh-ADAM10 +DMSO 组, 稳 定 转 染ADAM10 shRNA 的BMSCs 加入终浓度1.0 mmol/L的VPA 作为sh-ADAM10+VPA 组。
各组BMSCs 按照1×105个/孔加入6 孔培养板,待细胞密度达到约80%后更换为含有0.1 μmol/L 地塞米松、10 mmol/L β-甘油磷酸钠、50 mg/L 维生素C、10%胎牛血清的成骨诱导培养基,每2 d 更换1 次培养基,连续进行成骨诱导14 d。
1.3.2 动物分组、造模及给药
SD 大鼠随机分为sh-NC 组和sh-ADAM10 组,每组各10 只,均参照文献[9]进行胫骨骨折造模,方法如下:腹腔注射2%戊巴比妥钠、30 mg/kg 麻醉,在左下肢前外侧、胫骨中上1/3 处做纵行切口,显露胫骨骨干,手术刀来回横截造成骨折,术中能够明显听到骨头断裂的裂纹声且术后进行胫骨X 线摄片检查、出现骨折线判断为造模成功。 用长度17 mm 的克氏针固定骨折的胫骨,完成造模后在骨折局部进行pCMV5.0 载体的注射。 sh-NC 组注射5 mg/kg NC shRNA 的pCMV5.0 载体、sh-ADAM10 组注射5 mg/kg ADAM10 shRNA 的pCMV5.0 载体,4周后评价骨折愈合情况。
1.3.3 细胞的茜素红染色
成骨诱导14 d 时,收集细胞并在0.1%茜素红中染色30 min,在显微镜下观察茜素红阳性染色的钙结节,拍照记录后每孔加入10%氯化十六烷基吡啶500 μL,充分震荡使钙结节溶解,将50 μL 液体移入96 孔培养板的培养孔内,在酶标仪上检测405 nm 的波长值。
1.3.4 细胞ALP 活性的检测
成骨诱导14 d 时,收集细胞并采用细胞ALP 活性检测试剂盒进行实验,裂解细胞后分别检测ALP活性(以U/L 表示)及蛋白浓度(以mg/L 表示),计算每mg 蛋白对应的ALP 活性。
1.3.5 细胞及组织中蛋白表达的检测
收集成骨诱导14 d 时的BMSCs 和胫骨骨折处骨组织,加入裂解液后进行细胞裂解或组织匀浆,提取得到蛋白后检测浓度,将含有30 μg 蛋白样本用于Western blot 检测,电泳、电转PVDF 膜、5%脱脂牛奶室温封闭1 h 后4℃孵育1 ∶1000 稀释的ADAM10、OCN、Runx2、Col-I、NICD、Hes1 一抗或1 ∶5000 稀释的β-actin 一抗过夜。 次日,室温孵育二抗1 h,最后在凝胶成像仪中显影得到蛋白条带,根据条带的灰度值、以β-actin 为内参,计算ADAM10、OCN、Runx2、Col-I、NICD、Hes1 的表达水平。
1.3.6 骨折愈合的评价
首先采用VISION90 型小动物科研X 光机检测仪进行X 线检查,观察骨折局部的影像学变化;而后收集胫骨骨折处的骨组织,4%多聚甲醛固定后制作组织蜡块及病理切片,采用HE 染色试剂盒完成染色操作,封片后在显微镜下观察骨折局部的骨痂及骨小梁特征。
1.4 统计学方法
采用SPSS 23.0 软件对实验数据进行统计学处理,计量资料以平均数±标准差(±s)表示,组间比较均采用单因素方差分析,两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 BMSCs 成骨诱导后不同时间点ADAM10 表达水平的比较
BMSCs 成骨诱导后不同时间点ADAM10 表达水平的比较均有统计学差异(P<0.05),随着成骨诱导时间延长,BMSCs 中ADAM10 的表达水平呈逐步降低趋势,提示在BMSCs 成骨分化的过程中ADAM10 的表达受到抑制。 见图1。

注:与诱导0 d 时比较, *P<0.05;与诱导7 d 时比较, &P<0.05。图1 BMSCs 成骨诱导后不同时间点ADAM10表达水平的比较Note.Compared with 0 d of induction, *P<0.05.Compared with 7 days after induction, &P<0.05.Figure 1 Comparison of ADAM10 expression levels at different time points after osteogenesis induction of BMSCs
2.2 不同转染组BMSCs 中ADAM10 表达水平的比较
对照组与sh-NC 组BMSCs 中ADAM10 表达水平的比较无显著差异(P<0.05);sh-ADAM10 组BMSCs 中ADAM10 表达水平均低于对照组和sh-NC组,差异有统计学意义(P<0.05),表明稳定转染sh-ADAM10 使BMSCs 中ADAM10 表达降低。 见图2。
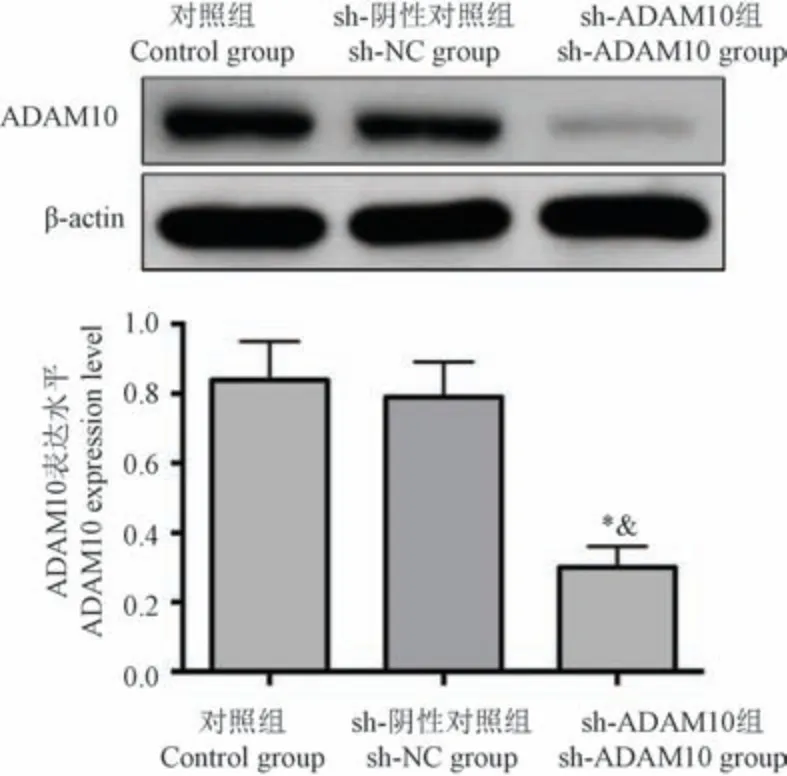
注:与对照组比较, *P<0.05;与sh-NC 组比较, & P<0.05。图2 不同转染组BMSCs 中ADAM10 表达水平的比较Note.Compared with the control group, *P<0.05.Compared with sh0NC group, &P<0.05.Figure 2 Comparison of ADAM10 expression levels in BMSCs among different transfection groups
2.3 抑制ADAM10 表达对BMSCs 成骨分化的影响
sh-ADAM10 组BMSCs 成骨诱导后茜素红染色的405 nm 吸光值、ALP 的活性均高于对照组和sh-NC 组,差异有统计学意义(P<0.05),表明敲低ADAM10 表达促进BMSCs 的成骨分化。 见图3。
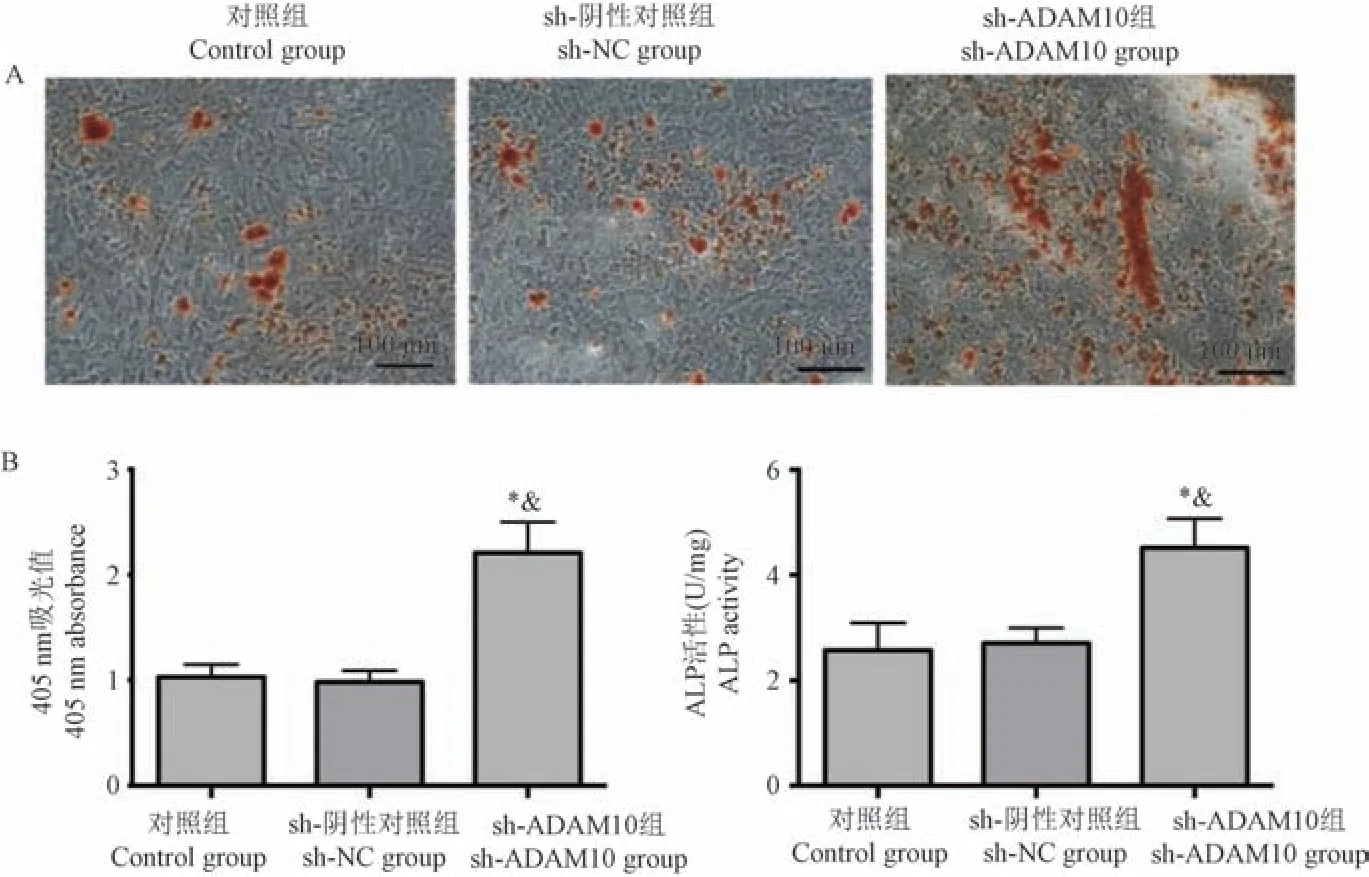
注:A:茜素红染色;B:405 nm 吸光值的比较; C:LP 活性的比较。 与对照组比较, *P<0.05;与sh-NC 组比较, &P<0.05。图3 不同转染组BMSCs 中ADAM10 表达水平的比较Note.A, Alizarin red staining.B, Comparison of absorbance at 405 nm.C, Comparison of ALP activity.Compared with the control group, *P<0.05.Compared with sh-NC group, &P<0.05.Figure 3 Comparison of ADAM10 expression levels in BMSCs among different transfection groups
2.4 抑制ADAM10 表达对BMSCs 成骨诱导后成骨标志基因表达的影响
sh-ADAM10 组BMSCs 成骨诱导后OCN、Runx2、Col-I 的表达水平均高于对照组和sh-NC 组,差异有统计学意义(P<0.05),表明敲低ADAM10表达促进BMSCs 中成骨标志基因的表达。 见图4。

注:与对照组比较, *P<0.05;与sh-NC 组比较, &P<0.05。图4 不同转染组BMSCs 中OCN、Col-I 和Runx2 表达水平的比较Note.Compared with the control group, *P<0.05.Compared with sh-NC group, &P<0.05.Figure 4 Comparison of OCN, Col-I and Runx2 expression levels in BMSCs among different transfection groups
2.5 抑制ADAM10 表达对BMSCs 成骨诱导后Notch1 通路的影响
sh-ADAM10 组BMSCs 成骨诱导后NICD、Hes1的表达水平均低于对照组和sh-NC 组,差异有统计学意义(P<0.05),表明敲低ADAM10 表达抑制BMSCs 中Notch1 信号通路的激活。 见图5。

注:与对照组比较, *P<0.05;与sh-NC 组比较, &P<0.05。图5 不同转染组BMSCs 中NICD、Hes1 表达水平的比较Note.Compared with the control group, *P<0.05.Compared with sh-NC group, &P<0.05.Figure 5 Comparison of NICD, Hes1 expression levels in BMSCs among different transfection groups
2.6 Notch1 通路激动剂VPA 对抑制ADAM10 表达促进BMSCs 成骨分化的影响
sh-ADAM10+DMSO 组BMSCs 成骨诱导后茜素红染色的405 nm 吸光值、ALP 的活性均高于sh-NC+DMSO 组(P<0.05);sh-ADAM10 +VPA 组BMSCs成骨诱导后茜素红染色的405 nm 吸光值、ALP 的活性均低于sh-ADAM10+DMSO 组(P<0.05),表明激活Notch1 通路使敲低ADAM10 表达促进BMSCs 成骨分化的作用减弱。 见图6。

注:A:茜素红染色;B:405 nm 吸光值的比较;C:ALP 活性的比较。 与sh-NC+DMSO 组比较, *P<0.05;与sh-ADAM10+DMSO 组比较, &P<0.05。图6 Notch1 通路激动剂VPA 对抑制ADAM10 表达促进BMSCs 成骨分化的影响Note.A, Alizarin red staining.B, Comparison of absorbance at 405 nm.C, Comparison of ALP activity.Compared with the sh-NC+DMSO group, *P<0.05.Compared with sh-ADAM10+DMSO group, &P<0.05.Figure 6 Effect of Notch1 pathway agonist VPA on the inhibition of ADAM10 expression promoting osteogenic differentiation of BMSCs
2.7 Notch1 通路激动剂VPA 对抑制ADAM10 表达促进BMSCs 中成骨标志基因表达的影响
sh-ADAM10+DMSO组BMSCs成骨诱导后OCN、Runx2、Col-I 的表达水平均高于sh-NC+DMSO 组(P<0.05);sh-ADAM10 +VPA 组BMSCs 成骨诱导后OCN、Runx2、Col-I 的表达水平均低于sh-ADAM10+DMSO 组(P<0.05),表明激活Notch1 通路使敲低ADAM10 表达促进BMSCs 中成骨标志基因表达的作用减弱。 见图7。
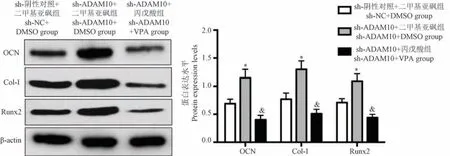
注:与sh-NC+DMSO 组比较, *P<0.05;与sh-ADAM10+DMSO 组比较, &P<0.05。图7 Notch1 通路激动剂VPA 对抑制ADAM10 表达促进BMSCs 中成骨标志基因表达的影响Note.Compared with the sh-NC+DMSO group, *P<0.05.Compared with sh-ADAM10+DMSO group, &P<0.05.Figure 7 Effect of Notch1 pathway agonist VPA on the inhibition of ADAM10 expression promoting osteogenic marker genes expression of BMSCs
2.8 抑制ADAM10 表达对大鼠胫骨骨折愈合的影响
经X 射线检查,sh-NC 组胫骨骨折大鼠的骨折线清晰,sh-ADAM10 组胫骨骨折大鼠的骨折线几乎消失;经HE 染色,sh-NC 组大鼠的骨痂纤维较多、成熟的小梁骨较少,sh-ADAM10 组大鼠的骨痂明显增多、且形成成熟的小梁骨,表明敲低ADAM10 表达促进胫骨骨折愈合。 见图8。
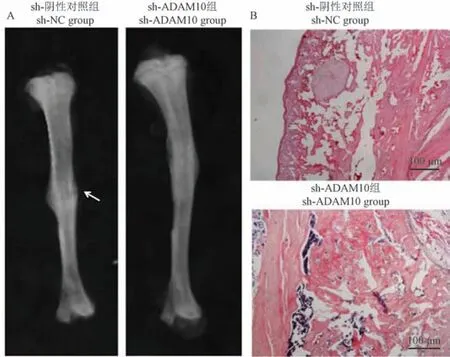
注:A:胫骨骨折的X 射线检查,箭头所指为骨折线;B:胫骨骨折的HE 染色。图8 抑制ADAM10 表达对大鼠胫骨骨折愈合的影响Note.A, X-ray examination of tibial fracture.B, HE staining of tibial fracture.Figure 8 Effect of the inhibition of ADAM10 expression on tibial fracture healing in rats
2.9 抑制ADAM10 表达对大鼠胫骨骨折中成骨标志基因表达的影响
sh-ADAM10 组胫骨骨折大鼠骨折部位中OCN、Runx2、Col-I 的表达水平均高于sh-NC 组,差异有统计学意义(P<0.05),结果表明敲低ADAM10 表达促进胫骨骨折愈合过程中的成骨标志基因表达。见图9。
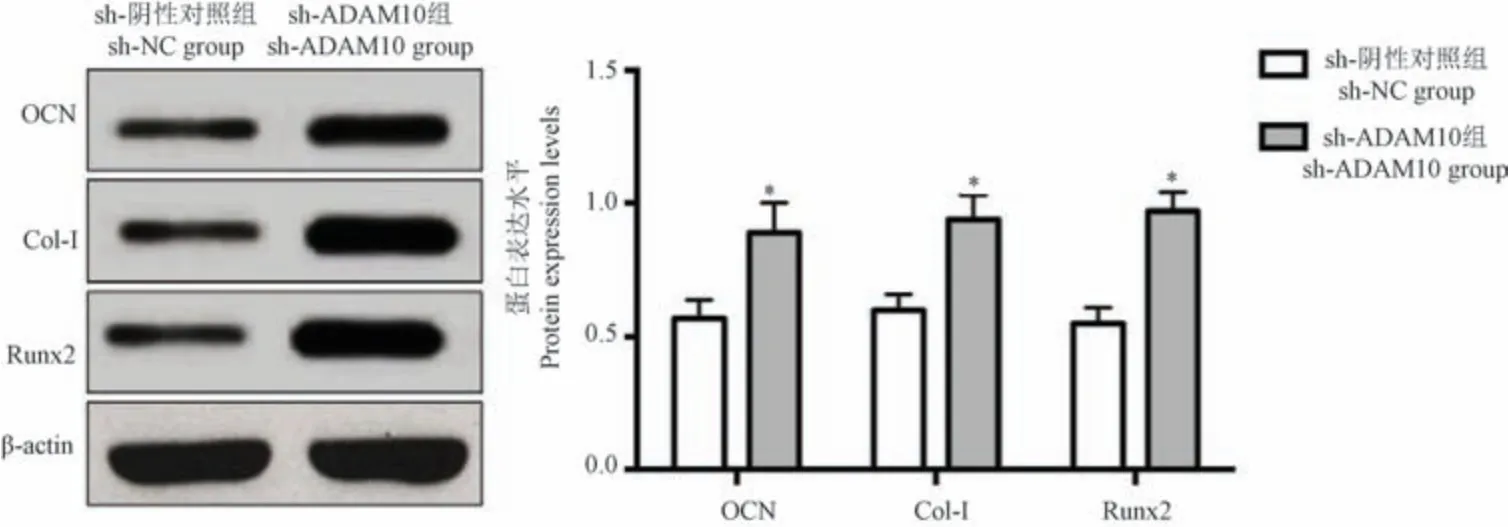
注:与sh-NC 组比较, *P<0.05。图9 抑制ADAM10 表达对大鼠胫骨骨折中成骨标志基因表达的影响Note.Compared with the sh-NC group, *P<0.05.Figure 9 Effect of the inhibition of ADAM10 expression on osteogenic marker genes expression in rat tibia fracture
2.10 抑制ADAM10 表达对大鼠胫骨骨折中Notch1 通路的影响
如图10所示,sh-ADAM10组胫骨骨折大鼠骨折部位中NICD、Hes1 的表达水平均低于sh-NC 组,差异有统计学意义(P<0.05),表明敲低ADAM10表达促进胫骨骨折愈合过程中Notch1 信号通路的激活。

注:与sh-NC 组比较, *P<0.05。图10 抑制ADAM10 表达对大鼠胫骨骨折中Notch1 通路的影响Note.Compared with the sh-NC group, *P<0.05.Figure 10 Effect of the inhibition of ADAM10 expression on Notch1 pathway in rat tibia fracture
3 讨论
胫骨骨折多由交通事故、高处坠落等高能量暴力引起,胫骨局部存在软组织薄弱、穿支血管少的解剖特点,高能量暴力容易引起局部软组织缺损及血供损害,进行切开复位内固定治疗后的不愈合或延迟愈合发生风险较高。 国内葛向荣等[10]和赵国平等[2]的临床研究分别报道胫骨骨折后延迟愈合的发生率为34.31%和27.16%。 骨折延迟愈合或不愈合不仅影响肢体功能、降低生活质量,还增加二次手术风险、加大经济负担,因此需要进行积极防治[11-12]。 本研究通过细胞实验和动物实验分析了ADAM10 基因对BMSCs 成骨分化及胫骨骨折愈合的影响。
ADAM10 的主要生物学功能是对各种细胞因子及受体、结构蛋白实现剪切,进而调控不同的生物学过程[5-7]。 本研究对BMSCs 进行成骨诱导分化,在分化过程中ADAM10 的表达水平也呈逐步降低趋势,与朱永翠等[8]的研究结果一 致。 为了验证ADAM10 基因在BMSCs 成骨分化中的调控作用,本研究在成骨诱导前先构建了稳定转染pGFP-V-RS载体的BMSCs,而后进行成骨诱导分化并检测,结果显示,敲低ADAM10 表达使BMSCs 成骨诱导分化后的钙结节数量及ALP 活性均明显增加。 干细胞的成骨分化过程涉及多种标志基因的变化,Col-I 和OCN 分别是骨基质中主要的胶原成分和非胶原成分,Runx2 是调控成骨分化的关键基因[13-14],本研究在稳定敲低ADAM10 的BMSCs 进行成骨诱导后检测到Col-I、OCN、Runx2 的表达水平增加,与成骨诱导后钙结节数量及ALP 活性增加的结果吻合。以上结果表明敲低ADAM10 基因显著抑制BMSCs的成骨分化。
根据朱永翠等[8]的研究,ADAM10 对牙周膜干细胞中Notch1 通路具有调控作用。 Notch1 通路在成骨分化及骨折愈合中起重要作用,有研究报道抑制Notch1 通路对干细胞的成骨分化具有促进作用,在骨折愈合过程中Notch1 表达下调是骨形成的必备条件[15-16]。 Notch1 是一类膜受体,与配体结合后通过三次酶切反应将胞内结构域NICD 释放进入胞浆,作用与Hes1 并调控细胞增殖及分化。 ADAM10具有水解细胞膜受体胞内或胞外结构域的功能,多项研究证实ADAM10 能够水解Notch1 的胞内结构域并产生NICD[17-19]。 本研究在稳定敲低ADAM10的BMSCs 进行成骨诱导后检测到NICD 及Hes1 的表达均明显降低,在成骨诱导的过程中持续给予Notch1 激动剂VPA 干预后、稳定敲低ADAM10 促进成骨分化的作用被削弱,表明敲低ADAM10 促进成骨分化的作用与抑制Notch1 通路有关。
在胫骨骨折的愈合过程中,BMSCs 在骨折局部迁移、浸润并发生成骨分化对新骨形成具有重要意义。 为了更深入认识ADAM10 基因调控BMSCs 成骨分化在胫骨骨折愈合中的生物学意义,本研究建立了胫骨骨折大鼠模型,在骨折局部注射ADAM10 shRNA 的pCMV5.0 载体以敲低ADAM10,通过观察骨折愈合情况可知:敲低ADAM10 后加速了胫骨骨折的愈合,骨折部位的骨折线几乎消失且胶原形成、ALP 活性及OCN、Runx2、Col-I 的表达水平均明显增加,同时还观察到Notch1 通路中NICD、Hes1 的表达降低。 以上动物实验结果与干细胞实验的结果吻合,表明敲低ADAM10 显著促进胫骨骨折的愈合。
综上所述,本研究通过细胞实验及动物实验证实敲低ADAM10 促进BMSCs 的成骨分化及胫骨骨折的愈合,这一促进作用与抑制Notch1 通路有关,这为今后胫骨骨折后不愈合及延迟愈合的防治提供了新思路。
