罗汉果皂苷提取物通过调控miR-199a-3p对高糖诱导的肾小管上皮细胞损伤的影响
2023-11-27邹方鹏孟昭慧黄雯静吴俊荣
邹方鹏 孟昭慧 黄雯静 吴俊荣
(1济南市中西医结合医院肾病风湿科,山东 济南 271100;2济南市莱芜医院药剂科)
糖尿病肾病是由肾小球硬化引起的糖尿病微血管病变的常见并发症,通常导致终末期肾病,这是糖尿病患者的常见死亡原因〔1,2〕。众所周知,肾小管细胞损伤是糖尿病肾病的主要特征之一,且证据表明在肾小管细胞损伤过程中涉及炎症和细胞凋亡〔3〕。异常炎症会直接破坏肾脏结构,并增加炎症细胞因子的水平,如白细胞介素(IL)-6、IL-8和肿瘤坏死因子(TNF)-α等〔4〕。因此,迫切需要抑制肾小管上皮细胞凋亡和炎症的治疗策略。罗汉果皂苷是罗汉果的主要活性成分,罗汉果是我国首批批准的药食两用的材料,其具有多种药理学功能,如润肺止咳、降血糖、抗炎等〔5〕。近期研究显示,罗汉果皂苷提取物能够有效降血糖,在抗糖尿病中起一定的作用〔6〕。但是,尚不清楚罗汉果皂苷提取物是否对糖尿病肾病中肾脏具有保护作用。本研究建立了高葡萄糖引起的肾小管上皮细胞损伤模型,探讨罗汉果皂苷提取物在预防高糖引起的肾小管上皮细胞损伤中的作用及机制。
1 材料与方法
1.1材料 人肾小管上皮细胞HK-2(中国细胞资源库);罗汉果皂苷提取物,总皂苷含量≥80%(桂林莱茵生物科技);DMEM培养基、胎牛血清(FBS,美国Gibco);miR-199a-3p inhibitors和inhibitors control、miR-199a-3p mimics和mimics control(上海吉玛制药技术有限公司);LipofectamineTM2000脂质体转染试剂(美国Invitrogeng);CCK-8检测试剂(日本同仁化学研究所);RNA提取试剂盒和逆转录试剂盒(赛默飞世尔);TNF-α、IL-6和IL-8酶联免疫吸附试验(ELISA)检测试剂盒(上海酶联生物科技);膜联蛋白(Annexin)Ⅴ-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒(日本TaKaRa);B细胞淋巴瘤/白血病(Bcl)-2和Bcl-2相关X蛋白(Bax)单克隆抗体(美国Abcam);辣根过氧化酶标记的二抗(北京中杉金桥生物);RIPA裂解液、二喹啉甲酸(BCA)蛋白定量检测试剂盒和电化学发光(ECL,美国Sigma)。
1.2细胞培养和分组处理 HK-2细胞培养在含有10%FBS的DMEM培养基中,并在37 ℃、5%CO2培养箱中培养。待细胞呈单层融合时,使用胰蛋白酶消化并传代培养。取对数期的HK-2细胞,实验分为:正常对照(NG)组:DMEM培养基+5 mmol/L葡萄糖;高糖干预(HG)组:DMEM培养基+30 mmol/L葡萄糖;低、中、高剂量组:DMEM培养基+30 mmol/L葡萄糖+10、20、40 μg/ml罗汉果皂苷提取物。
1.3细胞转染 对数期的HK-2细胞种植于6孔板中,待细胞达60%融合时行转染,按照说明书采用无血清的Opti-MEM培养液分别稀释LipofectamineTM2000脂质体和miR-199a-3p inhibitors和inhibitors control、miR-199a-3p mimics、mimics control,将稀释的脂质体和质粒等体积混合,孵育20 min后滴加至6孔板HK-2细胞中,孵育6 h更换成完全培养液,48 h后收集细胞。HK-2细胞按上述方法转染mimics control和miR-199a-3p mimics后用含30 mmol/L葡萄糖的DMEM培养基培养,记为HG+miR-NC组和HG+miR-199a-3p组;HK-2细胞转染inhibitors control和miR-199a-3p inhibitors后用含30 mmol/L葡萄糖和20 μg/ml罗汉果皂苷提取物的DMEM培养基培养,记为anti-miR-NC+中剂量组和anti-miR-199a-3p+中剂量组。
1.4实时荧光定量聚合酶链式反应(RT-qPCR)技术 使用RNA提取试剂盒从HK-2细胞中提取总RNA,采用逆转录试剂盒进行逆转录以合成cDNA。使用SYBR Green试剂盒在CFX96 Manager系统上进行qPCR。通过2-△△Ct方法计算相对基因表达,并以U6将其标准化。引物:miR-199a-3p上游5′-GCCCAGTGTTCAGACTACCTG-3′,下游5′-GTGCAGGGT-CCGAGGTATTC-3′;U6上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGAATTTGCGT-3′。
1.5CCK-8检测 将HK-2细胞(1×104细胞/孔)接种到96孔板中,培养24 h,然后将100 μl CCK-8添加到每个孔中,并在37 ℃下孵育2 h,最后使用酶标仪在570 nm的波长处测量吸光度(A)值。细胞活力(%)=实验组A值/对照组A值×100%。
1.6ELISA检测 分别收集各组处理后HK-2细胞上清液,按照TNF-α、IL-6和IL-8 ELISA检测试剂盒说明书分别测定含量,操作参照试剂盒使用说明。
1.7流式细胞术 收集经处理的各组HK-2细胞,并使用AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒染色,在黑暗中孵育30 min后,使用FACScan流式细胞仪测量细胞凋亡率。
1.8Western印迹检测 使用裂解缓冲液提取各组HK-2细胞中的蛋白质,BCA法测定浓度后在沸水中变性,取等量蛋白通过12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离。随后将蛋白质转移到硝酸纤维素膜上,并用5%的脱脂牛奶在TBST缓冲液中封闭1 h。将膜与抗Bax和Bcl-2的一抗(稀释度1∶500)在4 ℃孵育过夜。然后,将膜与辣根过氧化物酶耦联的二抗(稀释度1∶2 000)在37 ℃孵育2 h。最后,使用ECL试剂显影,凝胶系统采集图像,采用ImageJ软件分析条带灰度值,计算Bax和Bcl-2的相对表达水平。
1.9统计学分析 采用SPSS21.0软件进行单因素方差分析、SNK-q检验。
2 结 果
2.1罗汉果皂苷提取物对高糖诱导的HK-2细胞活力的影响 CCK-8检测结果发现,与NG组比较,HG组HK-2细胞活力明显降低(P<0.05);与HG组相比,低、中、高剂量组细胞活力明显升高(P<0.05),中剂量组与高剂量组细胞活力差异无统计学意义,因而选用罗汉果皂苷提取物20 μg/ml进行后续实验。见表1。
2.2罗汉果皂苷提取物对高糖诱导的HK-2细胞凋亡的影响 流式细胞术检测结果发现,与NG组比较,HG组HK-2细胞凋亡率明显上升(P<0.05);与HG组相比,低、中、高剂量组细胞凋亡率明显下降(P<0.05);Western印迹检测结果发现,与NG组比较,HG组HK-2细胞中Bax的表达明显上升(P<0.05),而Bcl-2的表达明显下降(P<0.05);与HG组相比,低、中、高剂量组中Bax的表达明显下降(P<0.05),而Bcl-2的表达明显上升(P<0.05)。见表1、图1、图2。
2.3罗汉果皂苷提取物对高糖诱导的HK-2细胞炎症因子TNF-α、IL-6和IL-8分泌的影响 ELISA检测结果发现,与NG组比较,HG组中炎症因子TNF-α、IL-6和IL-8的表达明显增多(P<0.05);与HG组相比,低、中、高剂量组TNF-α、IL-6和IL-8的表达明显减少(P<0.05)。见表1。
表1 各组HK-2细胞活力、凋亡率、Bax、Bcl-2、miR-199a-3p及炎症因子TNF-α、IL-6和IL-8的含量表达比较
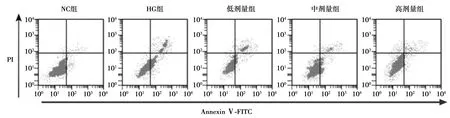
图1 流式细胞术检测HK-2细胞凋亡
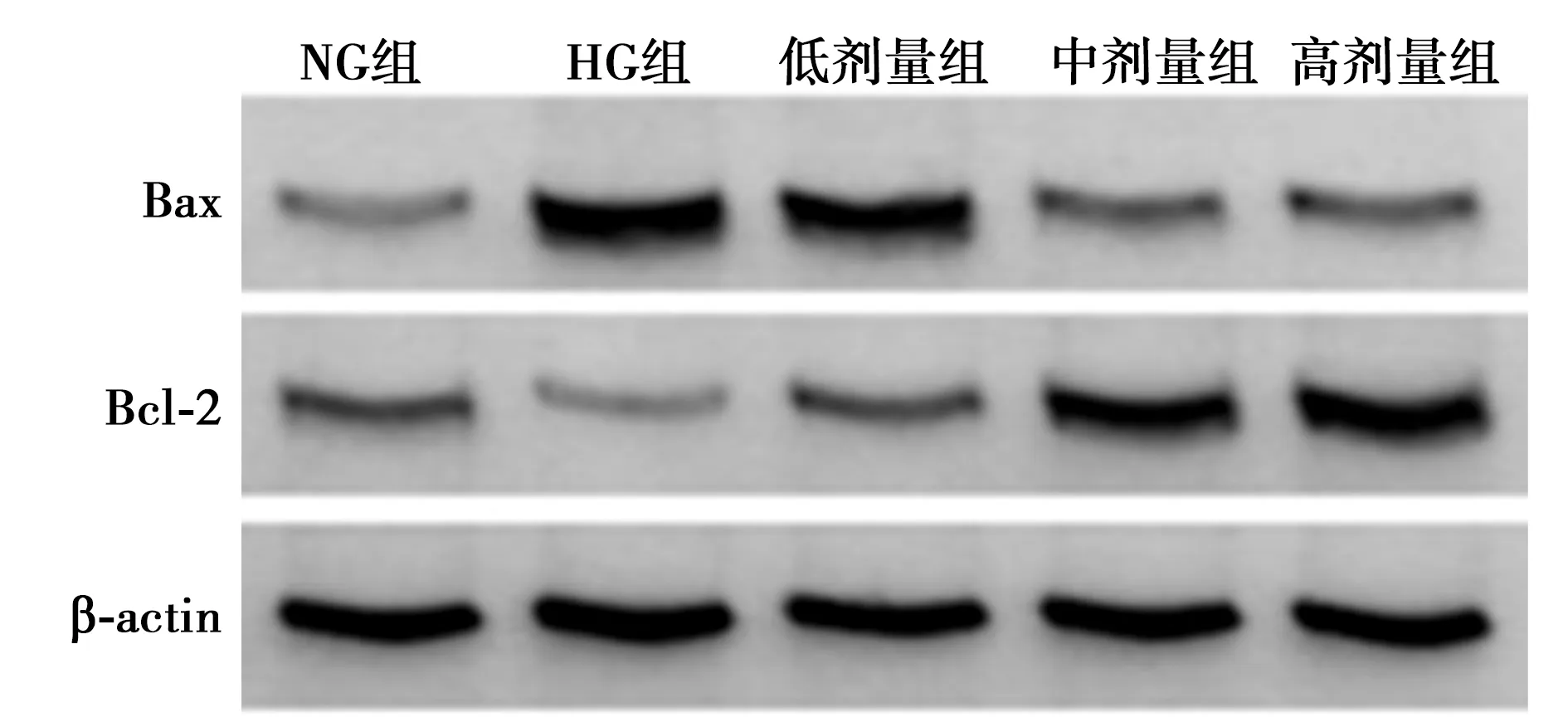
图2 Western印迹检测各组Bax和Bcl-2的表达
2.4罗汉果皂苷提取物对高糖诱导的HK-2细胞中miR-199a-3p表达的影响 qPCR检测结果发现,与NG组比较,HG组HK-2细胞中miR-199a-3p的表达明显下调(P<0.05);与HG组相比,低、中、高剂量组miR-199a-3p的表达明显上调(P<0.05)。见表1。
2.5过表达miR-199a-3p抑制高糖诱导的HK-2细胞损伤 CCK-8检测结果显示,与HG+miR-NC组比较,HG+miR-199a-3p组HK-2细胞活力显著升高(P<0.05),凋亡率显著降低(P<0.05),TNF-α、IL-6和IL-8的含量及Bax、Bcl-2表达显著减少(P<0.05)。见图3、图4、表2。
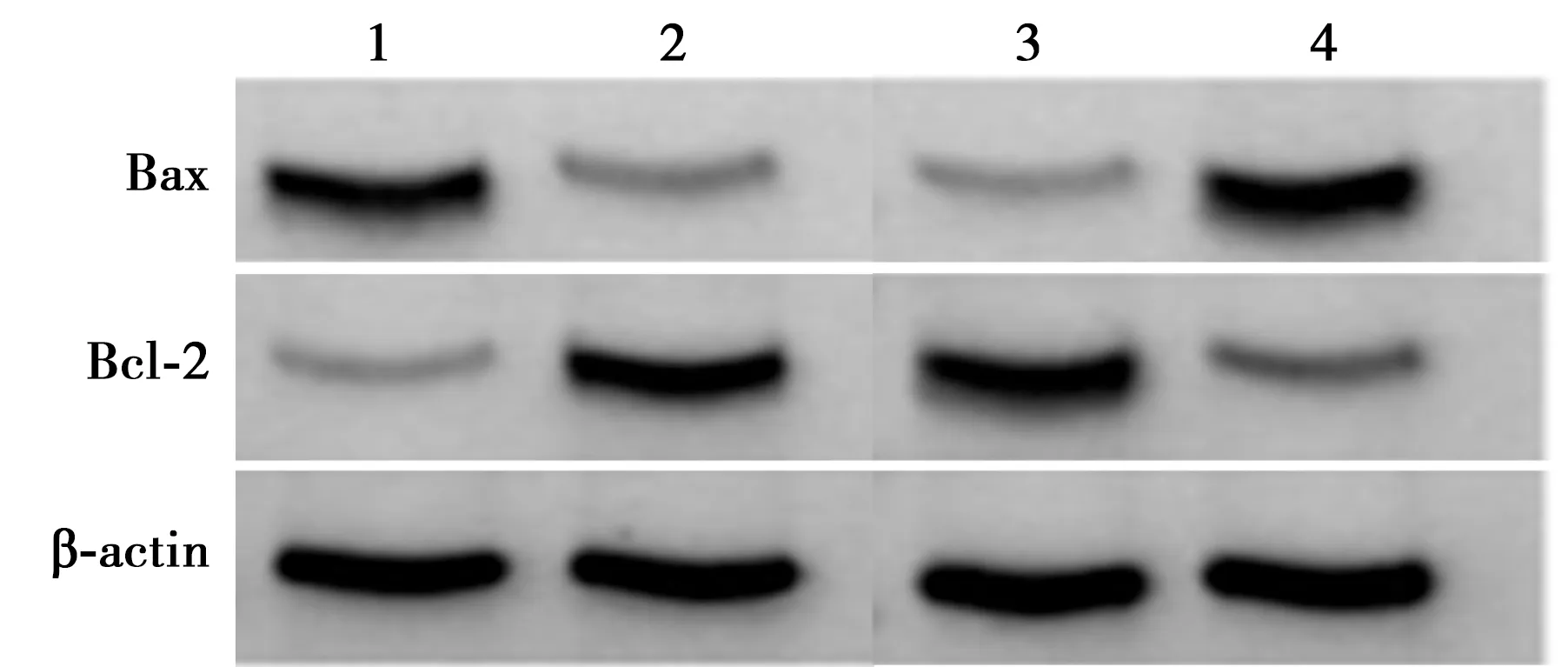
1~4:HG+miR-NC组、HG+miR-199a-3p组、anti-miR-NC+中剂量组、anti-miR-199a-3p+中剂量组图3 miR-199a-3p对Bax、Bcl-2蛋白表达的影响
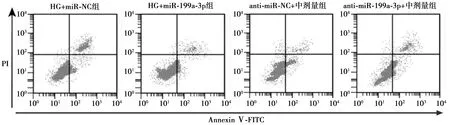
图4 miR-199a-3p对HK-2细胞凋亡的影响
表2 过表达miR-199a-3p对高糖诱导的HK-2细胞活力、凋亡率、TNF-α、IL-6和IL-8的含量的影响
2.6下调miR-199a-3p逆转罗汉果皂苷提取物对高糖诱导的HK-2细胞损伤的作用 与anti-miR-NC+中剂量组比较,anti-miR-199a-3p+中剂量组HK-2细胞活力显著降低(P<0.05),凋亡率显著升高(P<0.05),TNF-α、IL-6和IL-8的含量及Bax、Bcl-2表达显著增多(P<0.05)。见图3、图4、表3。
表3 抑制miR-199a-3p对罗汉果皂苷提取物干预的高糖诱导的HK-2细胞活力、凋亡率、TNF-α、IL-6和IL-8的含量、Bax、Bcl-2表达的影响
3 讨 论
葡萄糖水平升高是糖尿病肾病发生和发展的主要危险因素之一。高血糖可能导致晚期糖基化终产物的形成,从而导致肾脏炎症并促进糖尿病肾病的发展〔7〕。肾近端肾小管上皮细胞是慢性高血糖不良反应的重要靶标。肾小球滤过液中的葡萄糖过多会促使近端小管中的葡萄糖重吸收增加,并激活肾小管上皮细胞内的一系列适应不良的途径,从而促进糖尿病肾病的发生〔8〕。因此,高浓度的葡萄糖诱导肾小管上皮细胞通常用于建立糖尿病肾病的体外模型〔9,10〕。先前的研究表明,高葡萄糖干预可显著降低HK-2细胞的细胞活力并诱发肾小管上皮损伤〔11〕。本研究发现,高葡萄糖(30 mmol/L)抑制了HK-2细胞的活力。有研究显示,罗汉果皂苷提取物能够有效改善高糖高脂诱导的胰岛β细胞损伤,进而发挥抗糖尿病的作用〔12〕。本实验结果显示,罗汉果皂苷提取物能够有效提高高糖诱导的HK-2细胞的活性。糖尿病肾病的发展与多种因素有关,但是肾小管上皮细胞的炎性细胞因子和凋亡可能在该疾病中起关键作用〔13〕。高血糖会导致肾小管上皮细胞的炎性细胞因子增加,这些炎性细胞因子可以直接损害肾小管上皮细胞〔14〕。本实验结果提示,30 mmol/L葡萄糖诱导的HK-2细胞构建糖尿病肾病的体外模型成功,罗汉果皂苷提取物能够减少高糖诱导的HK-2细胞凋亡,并减少炎性因子TNF-α、IL-6和IL-8的分泌,提示罗汉果皂苷提取物能够减轻高糖诱导的HK-2细胞损伤。
研究表明,微小RNA(miRNA)与肾小管细胞的炎症反应和细胞凋亡有关〔15~17〕。如miR-140-5p通过抑制Toll样受体(TLR)4/核转录因子(NF)-κB信号通路改善高糖诱导的人肾小管上皮细胞的凋亡和炎症反应〔18〕。miR-125b通过阻止活性氧(ROS)的形成和凋亡改善了高糖诱导的HK-2细胞损伤〔19〕。以往研究使用微阵列测定法分析了糖尿病肾病患者外周血中的miRNA表达谱,提示miR-199a-3p可能参与糖尿病肾病的发展,此外该研究显示高糖诱导的肾小管上皮细胞中miR-199a-3p的表达显著下调〔20〕。本实验结果与以往研究一致,高糖刺激的HK-2细胞中miR-199a-3p的表达受到抑制。此外,本实验结果还提示,罗汉果皂苷提取物可能通过调控miR-199a-3p的表达参与糖尿病肾病的进展,过表达miR-199a-3p可抑制高糖诱导的HK-2细胞损伤,抑制miR-199a-3p可逆转罗汉果皂苷提取物对高糖诱导的HK-2细胞损伤保护作用。
综上,罗汉果皂苷提取物能上调miR-199a-3p表达对高糖诱导的肾小管上皮细胞损伤起保护作用。
