帕金森病患者肠易激综合征临床分析
2023-11-20马宇敏张玲玲沈丽华刘肇修陈伟观
马宇敏 张玲玲 沈丽华 刘肇修 陈伟观
[摘 要] 目的:分析帕金森病(Parkinsons disease,PD)患者肠易激综合征(intestinal bowel syndrome,IBS)的发生率及相关影响因素。方法:PD患者83例,根据罗马Ⅳ诊断标准,分为IBS组21例(25.3%)和非IBS组62例(74.7%)。比较两组患者一般资料、相关量表评分及每日左旋多巴等效剂量,分析发生IBS的相关因素。结果:IBS组非运动症状评估量表(non-motor symptoms scale,NMSS)评分、匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)评分、汉密尔顿抑郁量表(Hamilton depression scale,HAMD)-17评分、汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)-14评分高于非IBS组,差异均具有统计学意义(P<0.05)。焦虑是PD患者发生IBS的独立危险因素(P<0.001)。IBS组中9例IBS出现在运动症状前,12例出现在运动症状后。IBS出现在运动症状前患者NMSS评分高于IBS出现在运动症状后患者,差异具有统计学意义(P=0.034)。结论:IBS是PD患者的常见症状,合并IBS的PD患者睡眠障碍、焦虑及抑郁等非运动症状更严重,焦虑与PD患者发生IBS相关,IBS发生在运动症状前的PD患者焦虑症状更严重。
[关键词] 帕金森病;肠易激综合征;风险因素;焦虑
[中图分类号] R742.5 [文献标志码] B [DOI] 10.19767/j.cnki.32-1412.2023.03.010
帕金森病(Parkinsons disease,PD)作为常见的神经系统变性疾病,以运动功能障碍为主要表现,而胃肠道症状作为PD患者最常见的非运动症状之一逐步受到重视[1]。胃肠道功能障碍可以出现在PD病程各个阶段,甚至是PD首发症状[2],可能引起患者体重下降、腹痛、吸入性肺炎甚至肠梗阻等一系列并发症,严重影响生活质量[1]。肠易激综合征(intestinal bowel syndrome,IBS)是以腹痛或腹部不适、排便习惯改变为主要症状的临床综合征,在PD患者病程中往往被忽视。本研究选择南通市第二人民医院及南通大学附属医院神经内科和消化内科2019年1月—2021年12月就诊的PD患者83例,通过问卷调查形式,分析PD患者IBS发生率及相关影响因素,为及时诊断及治疗PD患者IBS提供依据。
1 资料与方法
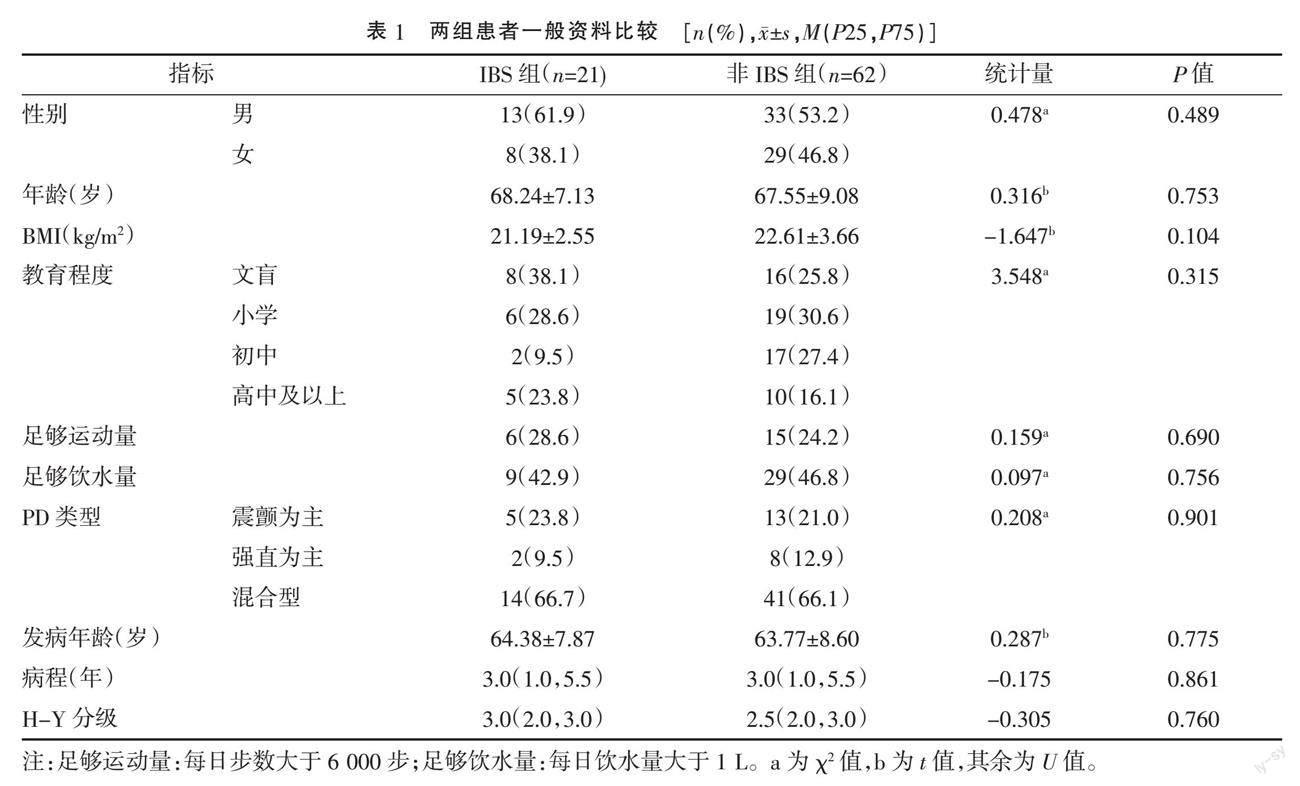
1.1 一般资料 PD患者83例,分为IBS组21例(25.3%)和非IBS组62例(74.7%)。两组性别、年龄、体质量指数(body mass index,BMI)、受教育程度、运动量、饮水量、PD类型、发病年龄、病程、Hoehn-Yahr(H-Y)分级比较,差异均无统计学意义(P>0.05)。见表1。纳入标准:(1)符合2016年中华医学会神经病学分会帕金森病及运动障碍学组制定的帕金森病临床诊断标准[3];(2)IBS符合罗马IV诊断标准[4],即诊断前症状至少出现6个月,近3个月反复发作的腹痛平均每周至少1次,肠道习惯的改变;(3)患者和(或)家属签署知情同意书。排除标准:(1)继发性帕金森综合征、帕金森叠加综合征、遗传性帕金森综合征;(2)严重心肺疾病或肝肾功能明显异常;(3)消化道器质性疾病。本研究通过南通市第二人民医院和南通大学附属医院伦理委员会批准。
1.2 观察指标 (1)患者一般资料:包括人口学资料、生活习惯、PD类型、病程、H-Y分级。(2)相关量表评分:统一帕金森病运动评分(unified Parkinson disease rating scale,UPDRS)Ⅲ量表:每项亚症状0~4分,总分为各项亚症状之和。非运动症状评估量表(non-motor symptoms scale,NMSS):每项亚症状按严重程度分为0~3分,发生频率1~4分,计算每项亚症状得分(严重程度×发生频率),总分为各项亚症状得分之和。自主神经症状量表(scale for outcomes in PD for autonomic symptoms,SCOPE-AUT):共6个维度23个项目,按严重程度分为0~3分,总分为各项之和。匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI):总分21分,分值越高,睡眠质量越差。汉密尔顿抑郁量表(Hamilton depression scale,HAMD)-17:总共17項,每项按严重程度分为5个等级,其中0分为无,4分为极重度,总分为各项之和。汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)-14:共14项,每项按严重程度分为5个等级,其中0分为无,4分为极重度,总分为各项之和。帕金森病生活质量问卷(Parkinson disease quality of life questionnaire,PDQ)-39:包括8个维度39个项目,每项按严重程度分为5个等级,其中0分为从不,4分为根本无法做,总分为各项之和。(3)嗅觉减退:通过回答NMSS中“是否存在嗅觉减退”对患者进行嗅觉评估。(4)每日左旋多巴等效剂量(Levodopa equivalent dose,LED):左旋多巴标准片×l+左旋多巴控释片×0.75+(左旋多巴标准片×1+左旋多巴控释片×0.75)×0.25(同时服用恩他卡朋片)+吡贝地尔缓释片×1+盐酸普拉克索片×100+盐酸司来吉兰片×10。
1.3 统计学处理 应用SPSS 22.0统计学软件对数据进行统计分析。符合正态分布的计量资料以■±s表示,组间比较采用t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Wilcoxon秩和检验;计数资料以频数和率表示,组间比较采用χ2检验;采用二分类Logistic回归分析模型进行影响因素的多因素分析。P<0.05为差异有统计学意义。
2 结 果
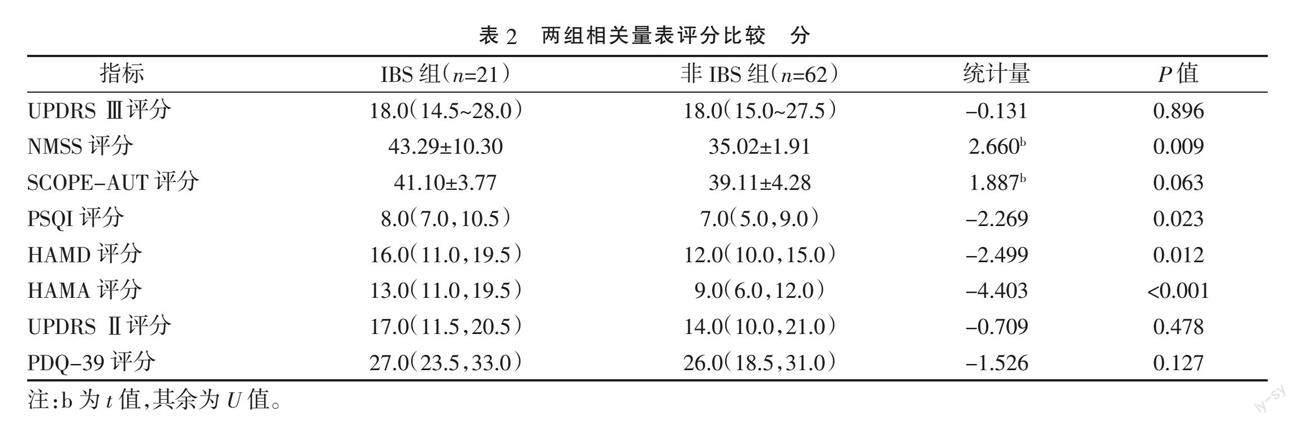
2.1 两组嗅觉减退、LED及各量表评分比较 IBS组嗅觉减退15例(71.4%),LED 285.0(200.0,350.0)mg/d,非IBS组嗅觉减退31例(50.0%),LED 300.0(250.0,362.3)mg/d,两组差异均无统计学意义(P>0.05)。IBS组NMSS评分(P=0.009)、PSQI评分(P=0.023)、HAMD评分(P=0.012)、HAMA评分(P<0.001)高于非IBS组,差异均具有统计学意义(P<0.05)。两组UPDRS Ⅲ评分、SCOPE-AUT评分、UPDRS Ⅱ评分及PDQ-39评分比较,差异均无统计学意义(P>0.05)。见表2。
2.2 影响PD患者发生IBS相关因素分析 以NMSS评分、PSQI评分、HAMD评分、HAMA评分为自变量,IBS为因变量,应用有序Logistic回归进行分析,结果显示焦虑是PD患者发生IBS的独立危险因素(OR 1.284,95%CI 1.130~1.459,P<0.001)。
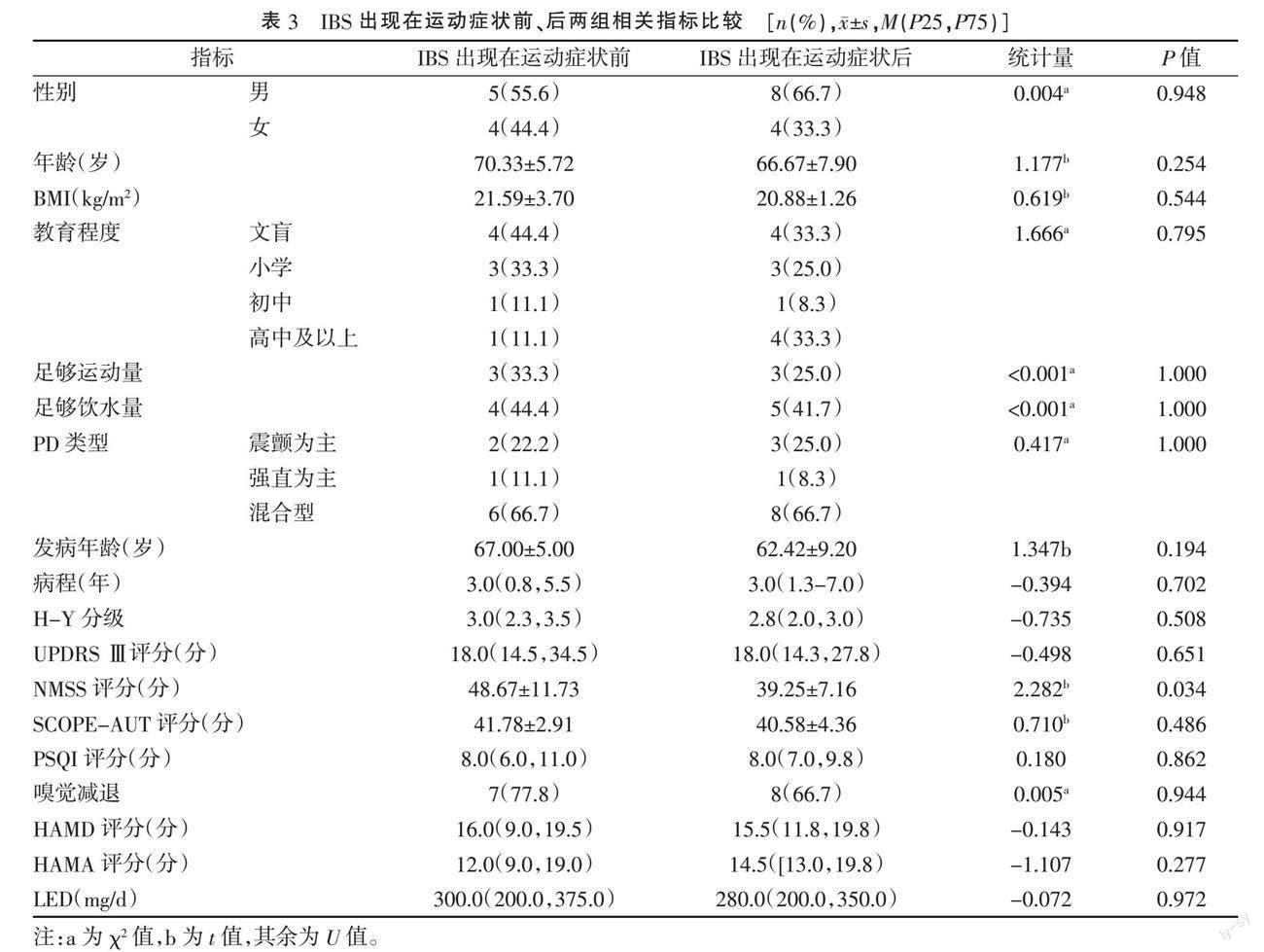
2.3 IBS出现在运动症状前、后两组相关指标比较 IBS组中9例IBS出现在运动症状前,12例IBS出现在运动症状后。IBS出现在运动症状前患者NMSS评分高于IBS出现在运动症状后患者,差异具有统计学意义(P=0.034)。见表3。
3 讨 论
本研究根据目前诊断IBS公认的罗马Ⅳ诊断标准,纳入的PD患者IBS患病率为25.3%,明显高于中国普通人群6.5%[5],与MISHIMA等[6]报道的17.0%相仿。PD患者IBS发生率高可能与患者疼痛阈值下降、肠道功能障碍及脑-肠轴异常有关[7]。
本文研究结果显示,IBS组非运动症状NMSS评分、睡眠质量PSQI评分、抑郁HAMD评分、焦虑HAMA评分高于非IBS组,差异均具有统计学意义(P<0.05),提示IBS组患者睡眠障碍、焦虑及抑郁等非运动症状更严重。有研究指出PD合并便秘患者非运动症状更严重[8]。随着PD病情进展,黑质损害加重,多巴胺水平降低,运动功能受到影响,同时也加重胃肠道功能障碍。α-突触核蛋白沉积在与肠道功能相关大脑区域的同时,也广泛沉积在与运动症状、非运动症状相关的其他大脑区域。睡眠障碍是PD常见的非运动症状,明显影响患者日常生活能力和生活质量。IBS组PSQI评分高于非IBS组,表明伴有IBS患者睡眠障碍更加严重。一方面腹痛、腹胀等症状影响患者睡眠,另一方面睡眠障碍又会加重肠道功能紊乱[9]。本研究IBS组抑郁及焦虑评分高于非IBS组,差异均具有统计学意义(P<0.05);Logistic回归分析结果显示,焦虑是PD患者发生IBS的独立危险因素(OR 1.284,95%CI 1.130~1.459,P<0.001)。提示焦虑与IBS的发生密切相关。有研究表明IBS患者焦虑及抑郁的发病率为正常人的2倍,而25%~30%抑郁症患者、10%~45%焦虑患者合并有IBS[10-11]。IBS与焦虑、抑郁互为因果,相互影响。随着PD病程进展,与情绪相关脑区(如边缘系统和新皮质)出现路易小体,这可能是PD患者发生情绪障碍的病理机理之一。5-羟色胺(5-HT)是与情绪维持密切相关的神经递质,5-HT缺乏可引起患者发生抑郁和焦虑,同时5-HT也具有增強胃肠动力作用[12]。因此,PD患者IBS和情绪障碍可能与5-HT功能受损有关。此外,焦虑、抑郁与IBS的密切关系可能与微生物-肠-脑轴有关,认为肠道微生物通过免疫和自主神经途径与中枢神经系统联系,调节胃肠道功能和大脑活动[13]。肠道微生物群失调引起黏膜免疫细胞功能障碍,肠道通透性增加,导致患者发生情绪障碍和肠道功能紊乱[14]。也有研究认为PD的发生与肠道微生物群失调引起的肠道炎症有关[15]。
本研究中21例IBS患者中有9例IBS出现在运动症状之前,提示除了嗅觉减退外,IBS也可能是PD前驱症状,早期识别非运动症状有助于诊断PD。IBS出现在运动症状前患者NMSS评分高于IBS出现在运动症状后患者,差异有统计学意义(P=0.034),提示前者非运动功能障碍更严重。BRAAK等[16]提出PD最早病理改变出现在肠道自主神经系统,迷走神经背核中可见病理性路易小体,随着病情进展,病理改变通过脑干延伸到黑质,从而出现运动功能障碍。研究发现,在PD患者整个肠道系统中均可发现α-突触核蛋白,毒素可能通过肠黏膜屏障以逆行方式向迷走神经核运输,最终累及中枢神经系统导致运动症状[17]。之前有研究提出便秘及IBS可以作为PD前驱症状[7],但诊断PD的特异性不强[18]。RODR?魱GUEZ-VIOLANTE等[19]提出将IBS与便秘、焦虑抑郁与睡眠障碍作为PD前驱期症状,共同预测PD的发生,但预测效果需要进一步验证。
综上所述,IBS是PD患者的常见症状,合并IBS的PD患者睡眠障碍、焦虑及抑郁等非运动症状更严重,焦虑与PD患者发生IBS相关,IBS发生在运动症状前的PD患者焦虑症状更严重。
[参考文献]
[1] BLOEM B R,OKUN M S,KLEIN C. Parkinsons disease[J]. Lancet,2021,397(10291):2284-2303.
[2] WARNECKE T,SCH?魧FER K H,CLAUS I,et al. Gastrointestinal involvement in Parkinsons disease: pathophysiology,diagnosis,and management[J]. NPJ Park Dis,2022,8(1):31.
[3] 中华医学会神经病学分会帕金森病及运动障碍学组,中国医师协会神经内科医师分会帕金森病及运动障碍专业. 中国帕金森病的诊断标准(2016版)[J]. 中华神经科杂志,2016,49(4):268-271.
[4] DROSSMAN D A. Functional gastrointestinal disorders: history,pathophysiology,clinical features and Rome IV[J]. Gastroenterology,2016,150(6):1262-1279.
[5] 张璐,段丽萍,刘懿萱,等 中国人群肠易激综合征患病率和相关危险因素的Meta分析[J]. 中华内科杂志,2014,
53(12):969-975.
[6] MISHIMA T,FUKAE J,FUJIOKA S,et al. The Prevalence of Constipation and Irritable Bowel Syndrome in Parkinsons Disease Patients According to Rome III Diagnostic Criteria[J]. J Parkinsons Dis,2017,7(2):353-357.
[7] FU P,GAO M,YUNG K. Association of intestinal disorders with Parkinsons disease and Alzheimers disease: a systematic review and meta-analysis[J]. ACS Chem Neurosci,2020,11(3):395-405.
[8] YU Q J,YU S Y,ZUO L J,et al. Parkinson disease with constipation: clinical features and relevant factors[J]. Sci Rep,2018,8(1):567.
[9] CREMONINI F,CAMILLERI M,ZINSMEISTER A R,et al. Sleep disturbances are linked to both upper and lower gastrointestinal symptoms in the general population[J]. Neurogastroenterol Motil,2009,21(2):128-135.
[10] LEE Y T,HU L Y,SHEN C C,et al. Risk of psychiatric disorders following irritable bowel syndrome: a nationwide population-based cohort study[J]. PLoS One,2015,10(7):e0133283.
[11] PINTO-SANCHEZ M I,FORD A C,AVILA C A,et al. Anxiety and depression increase in a stepwise manner in parallel with multiple FGIDs and symptom severity and frequency[J]. Am J Gastroenterol,2015,110(7):1038-1048.
[12] ROBERTS A,GRAFTON G,POWELL A D,et al. CSTI-300(SMP-100); a novel 5-HT3 receptor partial agonist with potential to treat patients with irritable bowel syndrome or carcinoid syndrome[J]. J Pharmacol Exp Ther,2020,
373(1):122-134.
[13] TANG H,CHEN X,HUANG S,et al. Targeting the gut-microbiota-brain axis in irritable bowel disease to improve cognitive function-recent knowledge and emerging therapeutic opportunities[J]. Rev Neurosci,2023,doi:10.1515/revneuro-2022-0155.
[14] POZUELO M,PANDA S,SANTIAGO A,et al. Reduction of butyrate-and methane-producing microorganisms in patients with irritable bowel syndrome[J]. Sci Rep,2015,5:12693.
[15] LI Y,CHEN Y,JIANG L,et al. Intestinal inflammation and parkinsons disease[J]. Aging Dis,2021,12(8):2052-2068.
[16] BRAAK H,DEL TREDICI K,R?譈B U,et al. Staging of brain pathology related to sporadic Parkinsons disease[J]. Neurobiol Aging,2003,24(2):197-211.
[17] CHEN Q Q,HAIKAL C,LI W,et al. Gut inflammation in association with pathogenesis of parkinsons disease[J]. Front Mol Neurosci,2019,12:218.
[18] ZHANG X,SVN Z,LIV M,et al. Association between irritable bowel syndrome and risk of parkinsons disease: a systematic review and meta-analysis[J]. Front Neurol,2021,12:720958.
[19] RODR?魱GUEZ-VIOLANTE M,ZER?魷N-MART?魱NEZ R,CERVANTES-ARRIAGA A,et al. Who can diagnose Parkinsons disease first? role of pre-motor symptoms[J]. Arch Med Res,2017,48(3):221-227.
[收稿日期] 2022-11-03
(本文編辑 赵喜)
