NLR、LDH、CEA、NSE及CYFRA21-1单独及联合检测对非小细胞肺癌患者预后的预测价值*
2023-11-18赵丽楠王昆仑魏明乔卢倩楠李树敏
赵丽楠,王昆仑,魏明乔,卢倩楠,李树敏**
(1.赤峰学院附属医院 检验科,内蒙 赤峰 024000; 赤峰学院附属医院 消化科,内蒙 赤峰 024000)
肺癌是全球范围内较为常见的癌症之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的80%~85%,多数患者就诊时已处于晚期,5年生存率较低[1-2]。有研究表明,中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)是全身性炎症反应的潜在生物标志物,参与多种肿瘤的发生发展,且与多种肿瘤的临床结局紧密相关;乳酸脱氢酶(lactate dehydrogenase,LDH)能够反映恶性肿瘤缺氧及代谢状态,在多种恶性肿瘤中表达升高,与多种恶性肿瘤的发生、进展和预后密切相关[3]。近年来,肺癌相关肿瘤标志物癌胚抗原(carcino-embryonic antigen,CEA)、神经元特异性烯醇化酶(neuron-specific enolase,NSE)及细胞角蛋白片段19(cytokeratin 19-fragments,CYFRA21-1)已被广泛应用于肺癌临床辅助诊断和疗效监测中[4-5],但关于NLR、LDH联合预测NSCLC根治性放化疗预后效能的报道较少,本研究选取行根治性放化疗治疗的进展期NSCLC患者作为研究对象,根据患者3年生存预后分为生存组和死亡组,采用单因素及多因素logistic回归分析评价影响NSCLC根治性放化疗预后的相关因素,同时探究NLR、LDH、CEA、NSE及CYFRA21-1联合检测对NSCLC根治性放化疗预后的预测价值,现报道如下。
1 对象与方法
1.1 研究对象
选择2017年4月—2019年4月行根治性放化疗的进展期NSCLC患者125例。纳入标准:满足NSCLC诊断标准[6],初次确诊,病情处于进展期;根据国际肺癌研究协会第八版肿瘤淋巴结转移(tumor node metastasis,TNM)分期标准判定为Ⅲ~Ⅳ期[7],患者治疗方案选择根治性放化疗,美国东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分0~2分;有记录完整的临床病历资料。排除重要脏器功能损害、其他器官恶性肿瘤患者,急性缺血性脑卒中、糖尿病肾病,免疫系统、血液系统疾病患者,急或慢性感染、炎症性疾病及相关用药患者,非肿瘤原因死亡或失访患者。
1.2 研究方法
1.2.1临床信息采集 采集患者入院确诊时基本临床信息,包括年龄、性别、体质量指数(body mass index,BMI)、是否吸烟或嗜酒、ECOG评分、肿瘤类型、肿瘤直径、分化程度、TNM分期、是否接受靶向治疗等资料。
1.2.2NLR、LDH和肿瘤标志物检测 于入院次日早晨,采集患者空腹外周静脉血5 mL,室温静置0.5 h,3 000 r/min离心15 min,上层血清分离后于-20 ℃环境下保存备测。使用全自动五分类血细胞分析仪(深圳迈瑞公司,BC-5500型)及配套试剂检测中性粒细胞计数和淋巴细胞计数,计算NLR;使用全自动生化分析仪(日本Olympus公司,AU2700型),酶测速率法(试剂盒由北京普朗新技术有限公司提供)检测LDH;使用全自动化学发光免疫分析仪(美国雅培公司,Architect i2000型),采用电化学发光分析法(试剂盒由四川迈克生物科技股份有限公司提供)检测CEA、NSE及CYFRA21-1水平。
1.2.3治疗方案 患者均接受根治性放化疗:(1)放疗方案,选择调强适型放疗技术,根治性放疗剂量维持60~70 Gy、2 Gy/次,若患者治疗期间出现不耐受或并发症,及时实施针对性处理;(2)化疗方案,培美曲塞(广州白云山明兴制药有限公司,国药准字H20110059,500 mg/m2)+顺铂(山东凤凰制药股份有限公司,国药准字H20056422,75 mg/m2)或长春瑞滨(长春远大国奥制药有限公司,国药准字H20041927,5 mg/m2)+顺铂(75 mg/m2)化疗。
1.2.4随访与分组 患者出院后1个月开始展开随访,以电话访谈、门诊复诊等形式随访3年,随访率达100%,以随访期间患者死亡或至随访结束为随访终点,末次随访截止时间为2022年4月,中位随访时间为18(1~36)个月。根据患者3年生存预后分为生存组44例、死亡组81例。
1.3 统计学分析

2 结果
2.1 NSCLC根治性放化疗预后的单因素分析
结果显示,2组患者年龄、性别、BMI、吸烟、嗜酒、ECOG评分、肿瘤类型、肿瘤直径、分化程度(中分化)比较,差异无统计学意义(P>0.05);生存组的分化程度为高分化、靶向治疗占比高于死亡组(P<0.05),TNM分期为Ⅳ期占比低于死亡组(P<0.05),NLR、LDH、CEA、NSE及CYFRA21-1低于死亡组(P<0.05)。见表1。

表1 NSCLC根治性放化疗预后的单因素分析
2.2 NSCLC根治性放化疗预后的多因素logistic回归分析
将分化程度、TNM分期、靶向治疗和外周血NLR、LDH、CEA、NSE、CYFRA21-1纳入多因素logistic回归模型予量化赋值,结果显示TNM分期和NLR、LDH、CEA、NSE、CYFRA21-1是NSCLC根治性放化疗预后的独立危险因素(P<0.05),分化程度、靶向治疗是NSCLC根治性放化疗预后的独立保护因素(P<0.05)。见表2和表3。

表2 NSCLC根治性放化疗预后危险因素赋值

表3 NSCLC根治性放化疗预后的多因素logistic回归分析
2.3 外周血NLR、LDH、CEA、NSE、CYFRA21-1单独及联合预测NSCLC根治性放化疗预后的效能
结果显示,外周血NLR、LDH、CEA、NSE、CYFRA21-1对NSCLC根治性放化疗预后均有一定预测效能,AUC分别为0.780、0.886、0.863、0.766、0.779;五项指标联合预测NSCLC根治性放化疗预后的AUC为0.946。见表4和图1。

图1 外周血NLR、LDH、CEA、NSE、CYFRA21-1单独及联合预测NSCLC根治性放化疗预后的ROC曲线
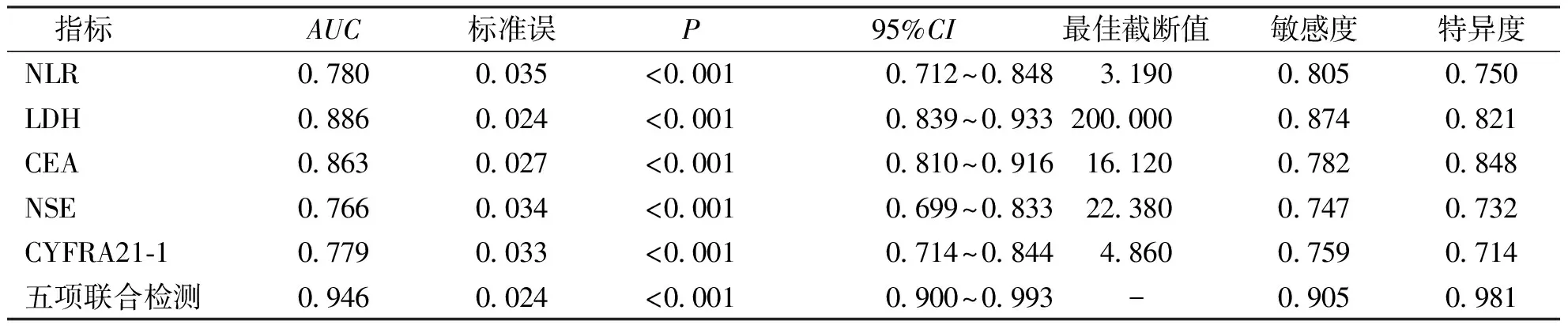
表4 NLR、LDH、CEA、NSE、CYFRA21-1单独及联合预测NSCLC根治性放化疗预后的效能分析
3 讨论
肺癌已成为全世界恶性肿瘤死亡的主要原因,其中NSCLC占多数,虽然近年来多学科综合治疗模式在NSCLC治疗中发挥着重要作用,但其总体预后仍较差,早期寻找可靠的NSCLC预后评估指标尤为必要。尽管目前临床已证实NLR、LDH、CEA、NSE、CYFRA21-1可能参与了肺癌进展过程[8-9],但关于上述指标联合预测NSCLC根治性放化疗预后的效能未见相关临床报道,而本文创新之处在于绘制NLR、LDH、CEA、NSE、CYFRA21-1联合预测NSCLC根治性放化疗预后的ROC曲线,为NSCLC预后判断提供更多依据。
NLR是中性粒细胞激活程度的可靠反映指标,通常在炎症反应激活或炎症细胞浸润情况下肿瘤细胞增殖活性可显著升高,促使癌细胞复发风险增加;而NLR过度升高可诱导肿瘤细胞生物学特征恶化,导致肺癌病灶组织坏死与邻近正常组织浸润[10]。有研究表明,NLR在肺癌中呈异常表达,是肺癌不良预后的危险因素[11]。还有研究指出,治疗前NLR与进展期NSCLC患者总生存期显著相关,且是进展期NSCLC患者总生存期的独立预测因素[12]。本研究中,生存组NLR明显低于死亡组,提示NLR升高可能与NSCLC根治性放化疗预后相关;进一步多因素logistic回归分析显示NLR是NSCLC根治性放化疗预后的独立危险因素,且ROC曲线分析显示其对NSCLC根治性放化疗预后有一定预测效能,提示NLR可作为预测NSCLC根治性放化疗预后的生物标记物。推测原因,NLR升高间接反映体内可能有一种利于肿瘤侵袭转移的炎症微环境形成,通过抑制细胞凋亡、促血管生成等途径推动肿瘤发生发展;而基于此种环境下,中性粒细胞大量增殖并被释放入血,致使外周血中粒细胞计数显著升高,导致炎症反应增强、淋巴细胞受抑,促进肿瘤细胞浸润、转移,导致抗肿瘤免疫反应受抑,这可能是该指标预测预后的可能机制。
LDH作为糖酵解途径中一种重要的酶,参与丙酮酸和乳酸的相互转化,与肿瘤细胞增殖和存活紧密相关[13]。通常受基因突变、外界环境因素等影响容易导致正常细胞发生恶变,加快细胞新陈代谢速度,促使能量代谢较为活跃,继而增大细胞膜通透性并加快细胞增殖速度,最终导致细胞对能量的需求增加,可能经LDH上调来增加糖酵解途径,加速必要的大分子产物和能量供应;而伴随着疾病进展,外周血中LDH表达水平呈逐渐上升态势[14]。近年来,有研究表明,在多种实体性肿瘤中血清LDH表达异常升高,且与肿瘤组织高代谢、远处转移和不良预后有关[15]。Yang等[16]报道血清LDH异常升高是影响晚期NSCLC患者化疗预后生存的独立危险因素。本研究中,LDH是NSCLC根治性放化疗预后的独立危险因素,进一步ROC曲线分析显示LDH对NSCLC根治性放化疗预后有良好预测作用,证实LDH可作为预测NSCLC根治性放化疗预后的生物标记物。推测原因,在相对乏氧环境中,NSCLC患者LDH表达异常升高,催化丙酮酸转化为乳酸,生成大量大分子物质以供肿瘤细胞增殖代谢所需;而癌基因激活可上调其M亚基组成LDHA表达,影响癌基因致癌活性,二者共同参与细胞恶变过程;此外,LDHA可通过调节细胞能量代谢刺激细胞增殖、侵袭、迁移和凋亡,最终影响预后。
近年来肿瘤标志物CEA、NSE、CYFRA21-1已被广泛应用于肺癌早期诊断,虽有研究对上述3项指标预测肺癌的准确度、灵敏度及特异度进行了报道[17-19],但关于上述3项指标与NSCLC根治性放化疗预后的关系鲜有报道分析。本研究中,生存组CEA、NSE、CYFRA21-1低于死亡组,提示CEA、NSE、CYFRA21-1升高可能与NSCLC根治性放化疗预后相关,这与既往报道[20]相似;进一步研究显示上述3项指标是NSCLC根治性放化疗预后的影响因素,且对NSCLC根治性放化疗预后有良好预测效能,提示上述三项指标可作为预测NSCLC根治性放化疗预后的生物标记物。CEA、NSE、CYFRA21-1在NSCLC患者血清中的表达水平明显上升,可诱导肿瘤细胞生长、增殖,加速肿瘤细胞侵袭和转移,影响预后。此外,本研究中,NLR、LDH、CEA、NSE、CYFRA21-1联合预测NSCLC根治性放化疗预后的AUC为0.946,敏感度和特异度均达90%以上,优于上述5项指标单独预测时所获敏感度和特异度,提示联合上述五项指标对NSCLC根治性放化疗预后具有较高的预测效能。
综上所述,NLR、LDH、CEA、NSE、CYFRA21-1对NSCLC根治性放化疗预后均有重要的预测价值,而联合预测效能更高,可作为预测患者根治性放化疗预后的生物标记物,值得临床验证。
