氧化苦参碱对TGF-β1诱导肺成纤维细胞MRC-5的增殖和分化的作用*
2023-11-18肖一佳赵素娥周若兰
肖一佳,赵素娥,周若兰
(南华大学附属长沙中心医院 呼吸与危重症医学科,湖南 长沙 410001)
肺纤维化(pulmonary fibrosis,PF)是多种原因所致的肺功能进行性、不可逆性下降,是多种急性和慢性肺损伤最常见的临床结果,其主要病理特征包括肺泡结构破坏、肺成纤维细胞异常增殖和细胞外基质(extracellular matrix,ECM)沉积,从而导致肺顺应性降低和气体交换障碍,最终导致广泛的瘢痕形成、肺功能丧失,甚至死亡[1]。PF不是单一病因引起的疾病,而是由多种原因引起,如自身免疫/结缔组织疾病(如类风湿关节炎或硬皮病)、药物相关(如抗心律失常胺碘酮或化疗药物博来霉素)、职业暴露(如长期粉尘接触、放射线接触)或一些过敏原接触等,临床上有一部分PF患者因找不到确切病因,称之为特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)。IPF主要发生在50岁以上的人群中,诊断时2/3的患者年龄超过60岁,男性多于女性[2]。在美国和欧洲,IPF的患病率估计为10~20/10万人,而诊断后的中位生存期只有3~5年[3-4]。目前临床上治疗PF药物主要为吡非尼酮和尼达尼布,但它们不能阻止或逆转疾病进展或降低死亡率,只是小幅降低肺功能恶化的发生率[5-6];且由于脱靶效应导致恶心、疲劳和腹泻等症状,患者通常也难以耐受这些药物,因此临床迫切需要深入研究PF的发病机制,寻找更有效的治疗策略。豆科槐属植物苦参是我国的传统中草药,氧化苦参碱(oxymatrine,OMT)是从苦参中提取分离出的一种活性生物碱成分。累积证据表明OMT具有多种生物学和药理学特性,例如抗炎、抗肿瘤、抗凋亡、抗纤维化、抗氧化等[7-9]。Xu等[10]证明OMT能够减轻博来霉素诱导的小鼠肺纤维化,这种有益作用与抑制博来霉素诱导的肺部炎症和脂质过氧化以及减少成纤维细胞增殖和胶原合成有关。尽管如此,OMT在肺纤维化过程中发挥抗纤维化作用的确切机制尚未完全阐明。Notch信号通路是一个高度保守的信号转导通路,广泛表达于哺乳动物组织中,参与哺乳动物胚胎细胞和成体细胞的增殖、分化、凋亡和细胞周期调控等多个细胞生理过程。研究发现Notch信号可直接导致肺纤维化,可能还与其下游因子Hes1过表达导致α-SMA及Ⅰ型胶原表达增加相关[11]。还有文献报道,TGF-β1是Notch信号通路激活的关键细胞因子,可通过Smad3上调Notch受体相应配体Jagged1和Notch信号靶基因Hey1的表达,两者共同作用于Notch信号通路的靶基因,诱导上皮间质转化(epithelial mesenchymal transition,EMT)发生[12]。目前关于OMT是否可调控Notch信号抑制PF发生发展的研究较少,本研究以人胚肺成纤维细胞(MRC-5)为PF细胞模型,以Notch信号为靶点深入研究OMT抑制PF作用机制,探讨OMT防治PF的作用及机制,为PF肺纤维化的防治发掘新的药物。
1 材料与方法
1.1 实验材料
OMT(纯度,98%)购自上海绿谷制药有限公司,MRC-5细胞购自北京鼎国长生生物技术有限公司,重组人TGF-β1购自美国PeproTech公司,Notch信号通路抑制剂DAPT (N-[N-(3,5-二氟苯乙酰基)-l-丙氨酰]-s-苯基甘氨酸叔丁基酯)购自美国BioGems;Dulbecco改良Eagle培养基(DMEM)来自美国GIBCO公司,ELISA试剂盒来自上海迪泽生物工程公司。
1.2 实验方法
1.2.1实验分组与造模 MRC-5细胞分为空白对照(Control)组、TGF-β1组(TGF-β1 20 μg/L作用24 h)、OMT低剂量(OMT-L)组(0.05 g/L)、OMT高剂量(OMT-H)组(0.1 g/L)和DAPT组(1 μmol/L),其中OMT高、低剂量组及DAPT组实验时与TGF-β1同时加药处理24 h。
1.2.2CCK8细胞增殖实验 将MRC-5细胞根据一定细胞密度均匀铺于96孔板,根据实验分组加入不同药物处理24 h,再进行细胞吸光度检测。
1.2.3细胞免疫荧光实验 处理后的MRC-5细胞用4%多聚甲醛固定15 min,0.5%Triton-X 100通透20 min,室温下用10%牛血清白蛋白封闭1.5 h,4 ℃与兔抗α-SMA单克隆抗体(1∶50稀释度)孵育过夜,次日回收一抗、并在室温下与二抗(fitc标记的羊抗小鼠IgG,1∶50稀释)孵育1 h,再予以4-6-二脒基-2-苯基吲哚(DAPI,5 g/L)孵育10 min,最后使用荧光显微镜(尼康公司,东京,日本)检测荧光吸光度。
1.2.4苏木精-伊红染色 按实验分组要求分组加药处理,取6孔板上的MRC-5细胞,用4%多聚甲醛固定15 min,苏木精染10 min,多余染料用自来水洗涤,伊红染色2 min,光镜下观察细胞形态学变化。
1.2.5酶联免疫吸附实验(Elisa) 按试剂盒要求操作步骤,标准品的加样:设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL(样品最终稀释度为5倍)。将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。加酶:每孔加入酶标试剂100 μL,空白孔除外。温育:使用封板膜封板后置37 ℃温育60 min。配液:将20倍浓缩洗涤液用蒸馏水20倍稀释后备用。洗涤:揭掉封板膜,弃去液体,甩干,每孔加满洗。
1.2.6聚合酶联反应(PCR) RNA提取:从-80 ℃冰箱中取出待测细胞样本,加入Trigol液1 mL、剧烈震荡混匀,室温放置5 min,使其充分裂解,4 500 r/min离心5 min,吸上清转入无RNase的1.5 mL EP管中;向EP管中加入200 μL氯仿,漩涡震荡仪震荡混匀15 s(无分层现象),4 ℃静置5 min,4 ℃ 4 500 r/min离心15 min,吸取上清液(约600 μL),转移至新的无RNase的1.5 mL EP管中;再按等体积加入异丙醇,上下颠倒充分混匀,静置30 min,4 ℃ 4 500 r/min 离心10 min,弃上清,RNA沉于管底,加入1 mL 75%乙醇(无RNase水配置),悬浮沉淀,4 ℃ 3 500 r/min离心5 min,弃上清。室温晾干或真空干燥5~10 min,最后将获得的总RNA溶于30 μL无RNase水中。反转录体系:总RNA 2.5 μL、10×Buffer 4 μL、dNTPs(10 mmoL) 1 μL、Oligo(dT)18(50 μmoL) 1 μL、引物(100 μmoL)0.5 μL、MMLV逆转录酶(200 U/μL)1 μL、DEPC H2O 10.5 μL,总体系20 μL。
1.3 统计学分析

2 结果
2.1 MRC-5细胞增殖
CCK-8实验显示,与Control组相比,TGF-β1组显著增加MRC-5细胞的增殖,DAPT和OMT组抑制了TGF-β1对MRC-5细胞的增殖作用,差异有统计学意义(P<0.05)。见图1。

注:(1)与Control组比较,P<0.01;(2)与TGF-β1组比较,P<0.05。
2.2 MRC-5中的α-SMA表达
α-SMA是上皮间充质转化特异标志物,是细胞模型造模成功的关键。细胞免疫荧光染色显示,与Control组比较,TGF-β1组α-SMA明显增高,而OMT-L、OMT-H组及DAPT组可减少α-SMA表达。苏木精伊红染色结果显示,与TGF-β1组比较,OMT及DAPT组减少TGF-β1诱导MRC-5的细胞增殖。见图2、图3。

注:(1)与Control组比较,P<0.05;(2)与TGF-β1组比较,P<0.05。
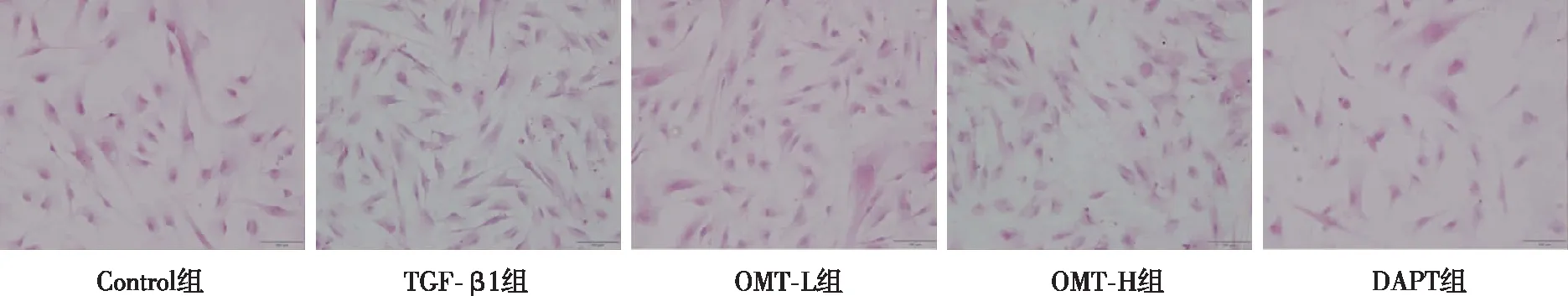
图3 各组MRC-5细胞(苏木精伊红,×20)
2.3 MRC-5中Ⅰ型胶原和Ⅲ型胶原表达
Ⅰ型和Ⅲ型胶原是细胞外基质的主要成分,通过Elisa试剂盒检测Ⅰ、Ⅲ型胶原的分泌。与Control组比较,TGF-β1组细胞裂解液和细胞上清液中Ⅰ型和Ⅲ型胶原的水平显著增加,而OMT和DAPT组降低TGF-β1诱导的细胞裂解液和细胞上清液中Ⅰ型和Ⅲ型胶原水平,差异有统计学意义(P<0.05)。见图4。
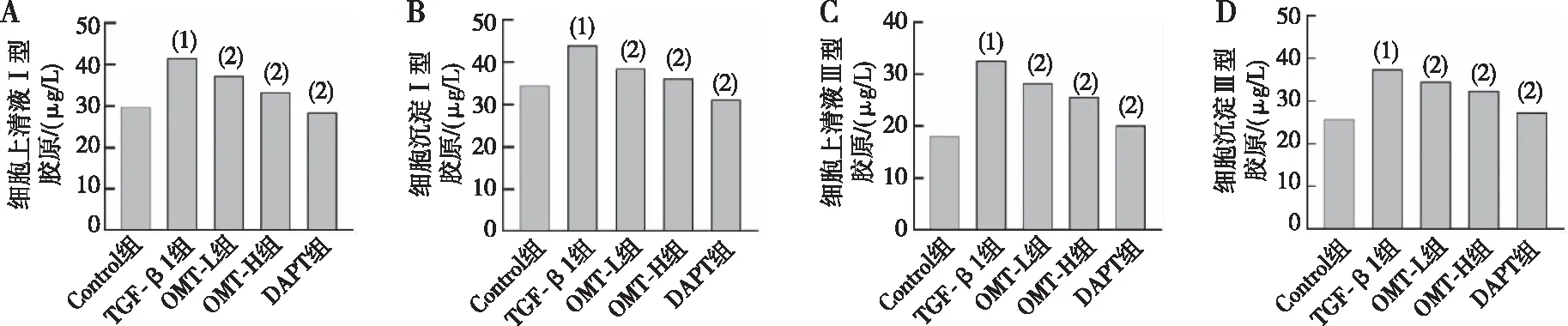
注:A~B为细胞上清液及细胞沉淀Ⅰ型胶原表达含量,C~D为细胞上清液及细胞沉淀Ⅲ型型胶原表达含量;(1)与Control组比较,P<0.05;(2)与TGF-β1组比较,P<0.05。
2.4 Smad2、Smad3、Notch3和Hey1的基因表达
Notch信号通路主要通过受体与配体结合及后续靶蛋白的激活来介导。PCR分析显示,与Control组相比,TGF-β1组中Smad2、Smad3、Hey1和Notch3的基因表达水平显著升高,OMT和DAPT组降低了TGF-β1诱导上述基因表达水平,差异有统计学意义(P<0.05)。见图5。

注:A为Smad2 mRNA表达含量,B为Smad3 mRNA表达含量,C为Notch3 mRNA表达含量,D为Hey 1mRNA表达含量;(1)与Control组比较,P<0.05;(2)与TGF-β1组比较,P<0.05。
3 讨论
PF是一种进行性慢性肺部疾病,其特征是ECM过度积累、胶原蛋白沉积异常,导致组织结构丧失并限制其气体交换功能[13]。EMT是最重要的肺纤维化的病理过程,也是纤维化疾病发生、发展的起始和可逆步骤。TGF-β1是导致纤维化的关键调控因子,其介导的Smads信号通路在EMT过程中起重要作用[14]。在正式实验之前,通过预实验CCK8实验发现,TGF-β1刺激MRC-5细胞呈浓度依赖及时间依赖促进细胞增殖,而DAPT以剂量依赖抑制细胞增殖,最后根据相关文献以及本研究前期基础,最后确定TGF-β1 20 μg/L作用24 h为肺纤维化细胞模型,并确定DAPT工作剂量为1 μmol/L。实验发现,DAPT组和OMT组处理后可减弱TGF-β1诱导的细胞增殖。苏木精-伊红染色证实,OMT 和 DAPT 显著降低TGF-β1诱导的MRC-5 细胞增殖,以上提示OMT及DAPT可以在体外抑制TGF-β1诱导MRC-5细胞增殖,然而确切机制不明。
Ⅰ型胶原和Ⅲ型胶原主要由ECM组成,PF最重要的病理特征是ECM的过量产生[15-16]。α-SMA是评价EMT的常用指标,也是肌成纤维细胞的特征,可通过ECM的过度分泌导致气道重塑和纤维化[17-18]。通过细胞免疫荧光,TGF-β1促进MRC-5细胞分化和且α-SMA表达增加,而OMT和DAPT组降低了α-SMA的表达,提示OMT组及DAPT组可以抑制TGF-β1诱导MRC-5细胞EMT。另外通过Elisa检测Ⅰ及Ⅲ型胶原表达,无论是在细胞上清液还是细胞裂解液中TGF-β1组可促进Ⅰ及Ⅲ型胶原表达,而OMT组和DAPT组均可减少胶原表达。但OMT是否通过抑制 Notch 信号传导来促进胶原蛋白合成尚不清楚。据报道,Notch1的激活直接刺激α-SMA表达并诱导肌成纤维细胞分化,而Notch的缺失减少肺中的肌成纤维细胞转化和胶原蛋白分泌,表明Notch1信号传导在纤维化的发展中起重要作用,升高的Notch3水平导致 PDGFRb 1成纤维细胞增殖。因此,Notch 信号在肺泡形成过程中的上皮-间充质相互作用中也起着重要作用[19-20]。
Notch3是Notch信号关键受体[21-22],Hey1是Notch信号下游关键靶基因[23-24],TGF-β1促进MRC-5细胞中Notch信号通路相关基因Notch3、Hey1的表达,同时也促进TGF-β通路相关蛋白Smad2、Smad3的基因表达,这表明TGF-β1可激活Notch信号通路以诱导PF。然而DAPT组可以减少Smad3、Notch3、Hey1表达,这提示抑制Notch信号也可间接抑制TGF-β信号Smad3表达,这提示TGF-β信号与Notch信号之间可能存在交叉作用[25]。与TGF-β1处理相比,OMT组可减少上述相关基因的的表达,提示OMT可抑制TGF-β1诱导MRC-5细胞增殖并可能与介导Notch信号通路来防止纤维化。
