基于通量测序的CXCL12、IL-6和IDO基因在去势抵抗性前列腺癌细胞中的表达及意义*
2023-11-18金宏亮宣睿许立军
金宏亮,宣睿*,许立军
(苏州大学附属第二医院 泌尿外科,江苏 苏州 215004)
前列腺癌(prostate cancer,PCa)是男性泌尿生殖系统中常见的恶性肿瘤,亦是男性第6大常见肿瘤,在中老年男性中更为常见。PCa在2020年美国男性中的发病率最高,致死率第2[1]。临床常用直肠指检、前列腺特异性抗原(prostate-specific antigen,PSA)水平检测、前列腺穿刺等手段筛查发现PCa,并采用根治性前列腺切除术或放射线治疗[2]。大部分 PCa患者在初次就诊时已是晚期、无法手术切除,内分泌治疗是治疗转移性PCa的重要方法,并且治疗初期的效果良好。然而,在内分泌治疗18—24个月,PCa大多数会进展为去势抵抗性前列腺癌(castration resisant prostate cancer,CRPC),患者预后不佳。细胞因子超家族包含趋化因子CXC配体L12(C-X-C motif ligand 12,CXCL12)等多个成员,其作用是诱导、激活和控制不同白细胞亚型的运动,通过影响肿瘤细胞增殖、侵袭而参与肿瘤发生发展[3-5]。白细胞介素6(interleukin 6,IL-6)是一种促炎症细胞因子,与PCa的发展有关[6-8],其除了促进PCa细胞增殖和抗凋亡外、能使PCa细胞发生上皮-间质转化(epithelial-mesenchymal transition,EMT)[9-11];最新研究表明,IL-6与CRPC的发展有直接关系,还发现PCa细胞可自分泌IL-6来推进其恶性程度[6,9]。在临床治疗前列腺的过程中发现,对不同PCa患者使用同一种治疗方案后,存在明显的个体差异性,尤其在CRPC患者和激素敏感性PCa患者中尤为明显。本研究选取CRPC细胞C4-2和激素敏感性PCa细胞LNCaP为研究对象,采用通量测序观察CXCL12、IL-6和IDO基因和蛋白在CRPC细胞和激素敏感性PCa细胞中的表达。
1 材料与方法
1.1 实验材料
1.1.1细胞株 LNCaP细胞株是激素敏感性人PCa细胞株,C4-2细胞株是renCRPCa细胞株,均购自南京凯基生物科技有限公司。
1.1.2主要试剂与仪器 TRIzol(美国Invitrogen,15596-026),SYBR Green RT-PCR 试剂盒(日本TaKaRa,RR086B),rabbit Anti-GAPDH (中国江苏凯基生物技术股份有限公司,KGAA002),分子量37 kDa,稀释比例1∶5 000,蛋白电泳胶浓度10%。羊抗兔IgG-HRP(中国江苏凯基生物技术股份有限公司,KGAA35),Rabbit Anti-IL-6(abcam,ab233706),分子量21 kDa,稀释比例1∶1 000,蛋白电泳胶浓度10%。Rabbit Anti-CXCL12(abcam,ab155090),分子量11 kDa,稀释比例1∶10 000,蛋白电泳胶浓度15%。Rabbit Anti-吲哚胺-2,3-双加氧酶(IDO))武汉三鹰,13268-1-AP),分子量42 kDa,稀释比例1∶1 000,蛋白电泳胶浓度10%。si-NC、si-IL-6和si-CXCL12均由南京凯基生物科技公司设计合成,MTT和流式细胞术试剂盒均购自南京凯基生物科技公司,序列如下:si-NC,上游5′-UUCUCCGAACGUGUCACGU-3′,下游5′-ACGUGACACGUUCGGAGAA-3′;si-IL-6,上游5′-AGACUUGCCUGGUGAAAAU-3′,下游5′-AUUUUCACCAGGCAAGUCU-3;si-CXCL12,上游5′-GGACAUUUCUCUAAGAGAACA-3′,下游5′-UUCUCUUAGAGAAAUGUCCUG-3′。
1.2 研究方法
1.2.1细胞培养 LNCaP和C4-2细胞系培养在含10%胎牛血清、100 ng/L青、链霉素的RPMI1640 培养基中,待细胞密度达到90%以上时,进行传代。
1.2.2高通量mRNA测序 使用featureCounts和StringTie软件进行基因和转录本表达量readcount的计算样本间基因表达水平,随后计算基因和转录本的FPKM。利用limma包和DESeq包进行差异表达基因分析比较,筛选标准为|log2FC|>=1且P≤0.05。将目标基因集合和背景基因向GO数据库(http://www.geneontology.org/)映射,差异表达基因GO功能富集分析,利用超几何分布进行假设检验,得到Corrected P-Value值,数值越低富集结果越显著。差异表达基因KEGG信号通路分析利用超几何分布进行假设检验,得到Corrected P-Value值,数值越小富集结果越显著。差异表达基因蛋白互作(PPI)分析,蛋白质互作通常包括物理互作和遗传互作,分析采用STRING数据库,以combined score进行筛选。
1.2.3转染及分组 使用Lipofectamine®3000根据分组要求分别将si-NC(阴性对照),si-IL-6(或)si-CXCL12转染入LNCaP(或)C4-2(2×108个/L)。Control组细胞给予常规培养;si-NC组细胞在常规培养条件下将si-NC转染入细胞内;si-IL-6组细胞在常规培养条件下将si-IL-6转染入细胞内;si-CXCL12组细胞在常规培养条件下将si-CXCL12转染入细胞内。在培养48 h后,收获细胞用于进一步的实验。
1.2.4qRT-PCR法检测两种细胞中IDO、CXCL12和IL-6基因表达 采用TRIzol试剂提取总RNA,通过反转录获取cDNA,随后用荧光定量试剂盒进行检测,操作步骤按照试剂盒说明书进行,用2-ΔΔCt法计算基因相对表达量。
1.2.5Western-blot检测LNCaP或C4-2细胞中CXCL12、IL-6和IDO蛋白表达 加入蛋白酶抑制剂,用BCA试剂盒进行蛋白定量,加入上样缓冲液,并煮沸5 min,用SDS-PAGE分离蛋白并将其转移至PVDF膜上,5%脱脂牛奶封闭1 h,加入一抗,孵育过夜;洗膜3次后,加入二抗,孵育1 h后洗膜3次,最后进行ECL显色,使用Gel-Pro32软件对结果进行灰度分析。
1.2.6MTT法检测LNCaP或C4-2细胞增殖 取各组处于对数生长期细胞,将MTT(5 g/L,20 μL)溶液加入各组细胞中,常温孵育4 h后,将培养基去除后,加入二甲基亚砜(150 μL,振荡处理10 min后,使用酶标仪在490 nm处检测各组吸光度,计算细胞增殖率。
1.2.7流式凋亡术检测LNCaP或C4-2细胞凋亡 取各组处于对数生长期细胞,将细胞悬液用离心机离心(1 200 r/min) 5 min后,除去上清液,1× Binding buffer 50 μL重悬,再加入Annexin V-FITC和PI各5 μL轻摇混匀,避光常温孵育10 min,加入Binding Buffer 400 μL轻轻混匀,1 h内进流式细胞仪分析。
1.2.8Transwell实验检测 LNCaP或C4-2细胞侵袭能力 在半透膜上方涂覆一层Matrigel基质,将下腔室装满含有微量补充物的培养基,Transwell插入下腔室,并在上腔室中添加经处理后的LNCaP或C4-2细胞悬液(1×108个/L)。将Transwell系统放入细胞培养箱中孵育48 h后,去除上腔室中的细胞悬液、用PBS洗涤,将下室取出后,加入800 μL甲醇,室温固定30 min后,PBS洗3次。将小室放置于预先加有0.1%结晶紫的溶液中,室温下反应30 min;PBS 漂洗3 次,于倒置显微镜下计数,并拍照。
1.2.9划痕恢复实验检测LNCaP或C4-2细胞迁移能力 取各组处于对数细生长期细胞,使用枪头垂直于细胞培养板划痕,然后使用PBS 溶液冲洗细胞3次,在0、48 h进行拍照并测量划痕宽度。
1.3 统计学方法
采用SPSS 22.0统计软件对数据进行统计学分析,计量资料比较用t检验;计数资料比较用χ2检验;P<0.05表示数据差异有统计学意义。
2 结果
2.1 高通量mRNA测序结果
生物信息学分析结果显示,激素敏感性前列腺癌细胞株LNCaP和去势抵抗性前列腺癌细胞株C4-2细胞株之间共有3 505个差异基因,其中上调基因1 695个,下调的基因1 810个。
2.2 IDO、CXCL12和IL-6基因表达
与激素敏感性前列腺癌细胞LNCaP比较,去势抵抗性前列腺癌细胞C4-2中CXCL-12 mRNA表达水平显著升高、而IL-6和IDO mRNA表达水平显著降低,差异有统计学意义(P<0.01)。见图1。
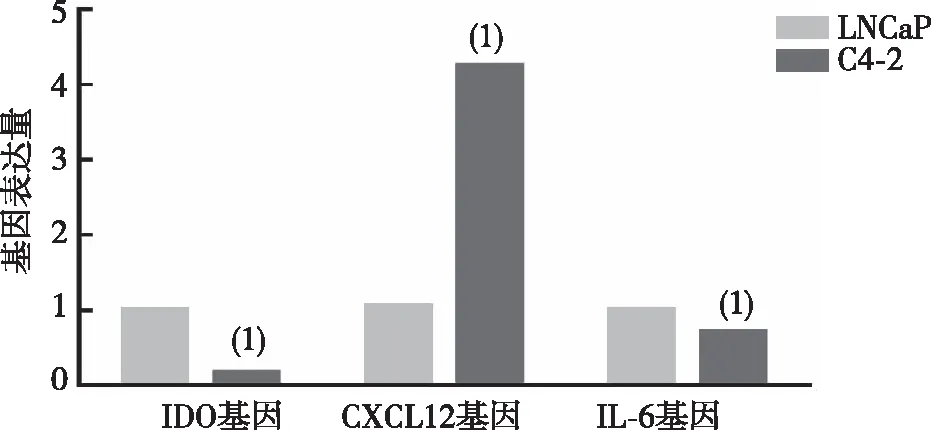
注: (1)与LNCap细胞比较,P<0.01。
2.3 LNCaP或C4-2细胞中CXCL12、IL-6和IDO蛋白表达
与激素敏感性前列腺癌细胞LNCaP比较,去势抵抗性前列腺癌细胞C4-2中CXCL12蛋白表达水平显著升高、而IL-6和IDO蛋白表达水平显著降低,差异有统计学意义(P<0.01)。见图2。
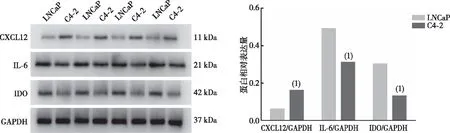
注:(1)与LNCaP细胞比较,P<0.01。
2.4 si-IL-6敲低对LNCaP或C4-2细胞增殖及细胞凋亡的影响
MTT和流式凋亡术检测结果显示,两种细胞的control组、si-NC组LNCaP、C4-2细胞增殖率和凋亡率比较,差异均无统计学意义(P>0.05),提示转染过程未对细胞增殖和凋亡造成影响;使用si-IL-6将LNCaP或C4-2细胞中IL-6敲除后,与si-NC组比较,LNCaP细胞的si-IL-6组细胞增殖率显著降低、而细胞凋亡率显著升高,差异有统计学意义(P<0.01);而C4-2细胞中,si-IL-6组细胞增殖率和凋亡率虽有一定变化,但差异无统计学意义(P>0.05)。见图3。
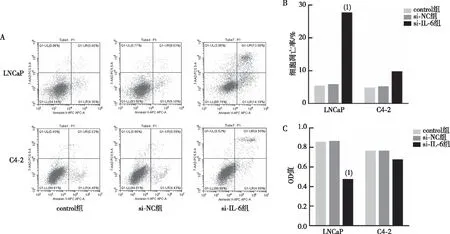
注:A为流式细胞术检测细胞凋亡率情况,B为IL-6对LNCaP或C4-2细胞凋亡的影响,C为IL-6对LNCaP或C4-2细胞增殖的影响;(1)与si-NC组比较,P<0.01。
2.5 si-IL-6敲低后对LNCaP或C4-2细胞侵袭和迁移能力的影响
Transwell实验结果显示,两种细胞的control组和si-NC组的LNCaP或C4-2细胞侵袭细胞数、迁移恢复率比较,差异无统计学意义(P>0.05),提示转染过程中未对细胞侵袭能力造成影响;使用si-IL-6将LNCaP或C4-2细胞中IL-6敲除后,与si-NC组比较,LNCaP细胞的si-IL-6组侵袭细胞数、迁移恢复率均显著降低,差异有统计学意义(P<0.01);而C4-2细胞的si-IL-6组侵袭细胞数和迁移恢复率虽有一定降低,但差异无统计学意义(P>0.05)。见图4。
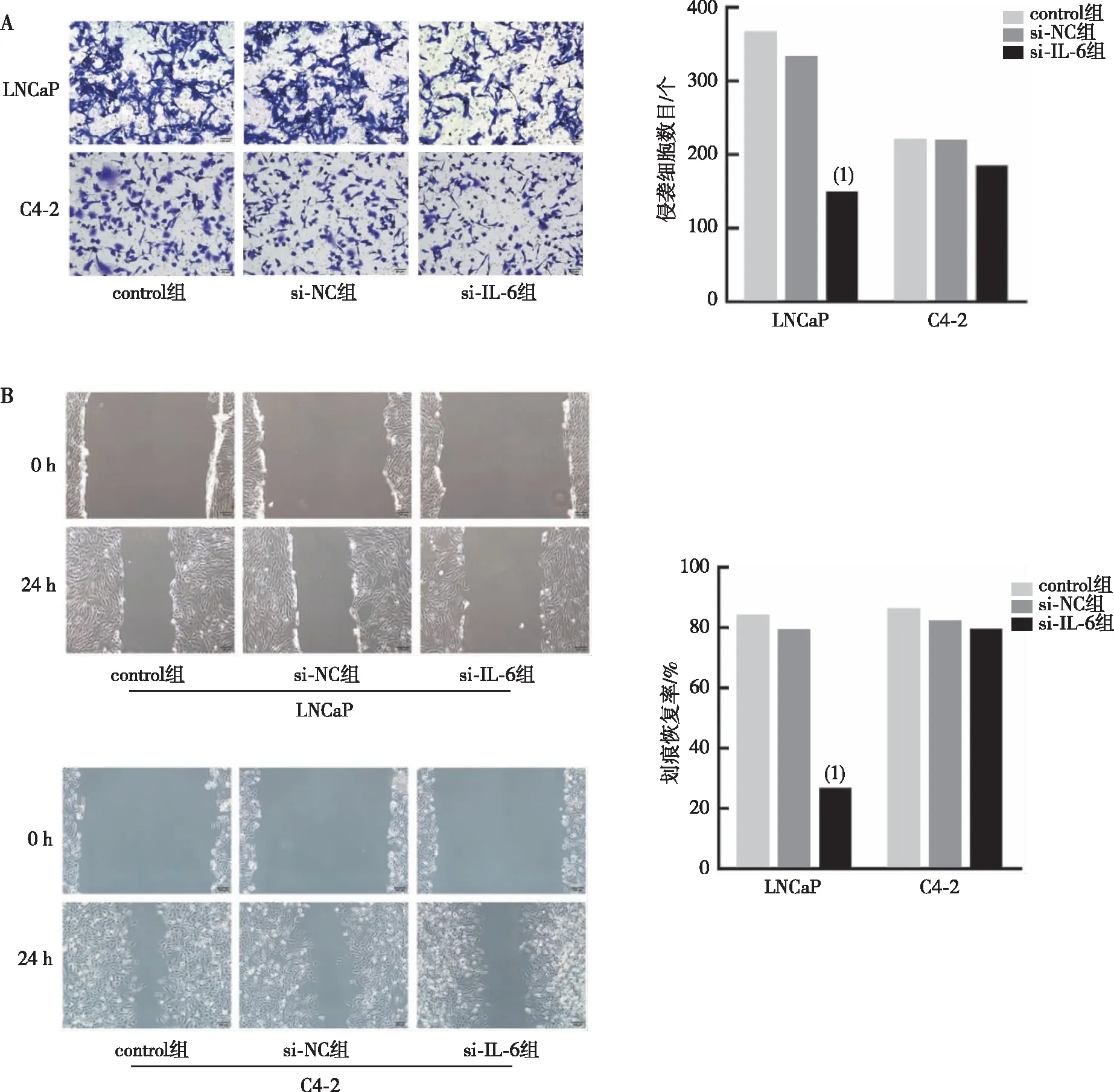
注:A为IL-6对LNCaP或C4-2细胞侵袭能力的影响,B为IL-6对LNCaP或C4-2细胞迁移能力的影响;(1)与si-NC组比较,P<0.01。
2.6 si-IL-6敲低后对IL-6、IDO和CXCL12基因和蛋白的影响
qRT-PCR和WB结果显示,两种细胞的control组和si-NC组IL-6、IDO和CXCL12 mRNA和蛋白表达比较,差异均无统计学意义(P>0.05),提示转染过程未对IL-6、IDO和CXCL12mRNA和蛋白表达造成影响;与si-NC组比较,LNCaP细胞或C4-2细胞中IL-6和IDOmRNA和蛋白表达均显著降低,差异有统计学意义(P<0.01),而CXCL12mRNA和蛋白表达差异无统计学意义(P>0.05)。见图5。
2.7 si-CXCL12敲低后对LNCaP或C4-2细胞增殖和凋亡的影响
MTT和流式调亡术检测结果显示,两种细胞的control组、si-NC组LNCaP或C4-2细胞增殖率比较,差异无统计学意义(P>0.05),提示转染过程中未对细胞增殖能力造成影响;使用si-CXCL12将LNCaP和C4-2细胞中CXCL12敲除后,与si-NC组比较,C4-2细胞的si-CXCL12组细胞增殖率显著降低,差异有统计学意义(P<0.01);而LNCaP细胞的si-CXCL12组细胞增殖率虽有一定降低,但差异无统计学意义(P>0.05)。见图6。

注:A为流式细胞术检测细胞凋亡率情况,B为CXCL12对LNCaP或C4-2细胞凋亡的影响,C为CXCL12对LNCaP或C4-2细胞增殖的影响;(1)与si-NC组比较,P<0.01。
2.8 si-CXCL12敲低后对LNCaP或C4-2细胞侵袭和迁移能力的影响
Transwell实验结果显示,两种细胞的control组、si-NC组的侵袭细胞数和划痕愈合率比较,差异无统计学意义(P>0.05),提示转染过程中未对细胞侵袭和迁移能力造成影响;使用si-CXCL12将LNCaP或C4-2细胞中CXCL12敲除后,与si-NC组比较,C4-2细胞的si-CXCL12组侵袭细胞数和划痕愈合率均显著降低(P<0.01);而LNCaP细胞中的si-CXCL12组侵袭细胞数虽有一定降低,但差异无统计学意义(P>0.05)。见图7。
2.9 si-CXCL12敲低后对相关基因和蛋白的影响
qRT-PCR实验结果显示,两种细胞的control组和si-NC组IL-6,IDO和CXCL12mRNA和蛋白表达比较,差异均无统计学意义(P>0.05),提示转染过程未对相关mRNA和蛋白表达造成影响;与si-NC组相比,LNCaP细胞和C4-2细胞中的CXCL12mRNA和蛋白表达均显著降低,差异有统计学意义(P<0.01),而IL-6和IDOmRNA和蛋白表达差异均无统计学意义(P>0.05)。见图8。
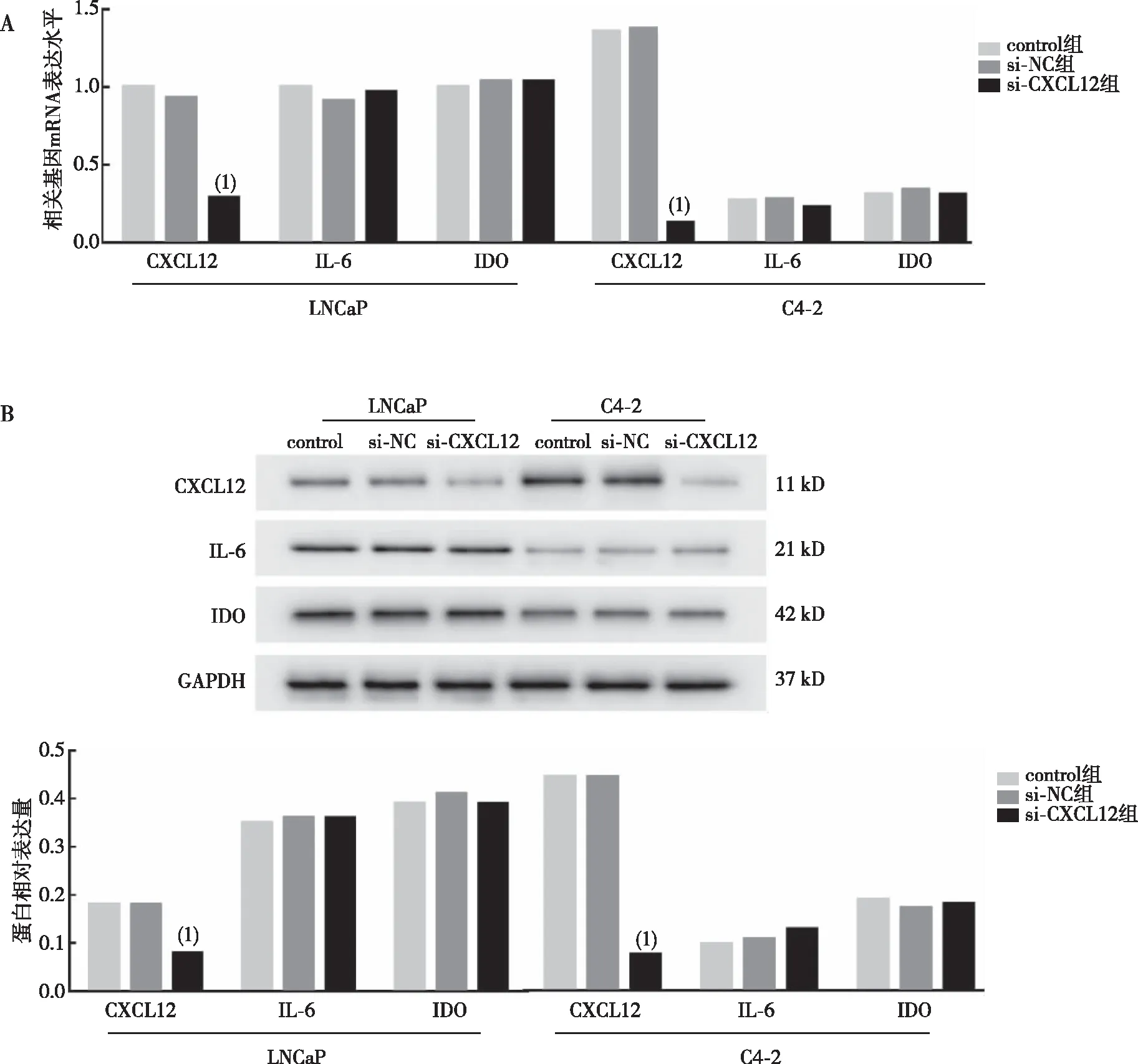
注:A为CXCL12对相关mRNA表达的影响,B为CXCL12对相关蛋白表达的影响;(1)与si-NC组比较,P<0.01。
3 讨论
长期持续的慢性炎症也可能引发肿瘤等多种疾病[12-13]。有学者认为,炎症是全球约25%的癌症发生发展的主要诱因[14]。越来越多的研究表明,趋化因子不仅在炎症和免疫反应中刺激、招募和控制粒细胞运动,还与肿瘤的增殖、侵袭、转移和血管生成有关[15,16]。CXCL12是CXCR4的唯一配体。在部分恶性肿瘤中,包括小细胞肺癌、卵巢癌和脑胶质瘤,CXCL12对表达CXCR4的肿瘤细胞均有促进增殖和生存的作用[17-19]。本研究结果显示,在去势抵抗性PCa细胞株C4-2中CXCL12表达水平显著高于激素敏感性前列腺癌细胞LNCaP,由此可以推断,对激素敏感性PCa细胞使用有效的抗癌药物更多的有可能是导致CXCL12的失活;细胞实验结果显示,将去势抵抗性PCa细胞株C4-2中CXCL12表达敲低后,C4-2细胞的生物活性显著降低;而将激素敏感性PCa细胞株LNCaP中CXCL12表达敲低未见对LNCaP生物活性造成影响,此结果提示,临床中针对激素敏感性PCa患者使用CXCL12拮抗剂,其治疗效果可能更佳。CRPC细胞可分泌IL-6和IL-6R。两者结合后,促进CRPC细胞增殖并抑制其凋亡,保障CRPC细胞持续分泌IL-6,最终形成恶性循环[18-21]。IL-6已是激素敏感性PCa恶化为CRPC的重要预测标记物,有助于判断患者预后。色氨酸是必需氨基酸之一,主要用于合成大分子蛋白质,如血清素、免疫球蛋白和褪黑激素等。IDO参与催化色氨酸合成犬尿喹啉,对色氨酸代谢至关重要[22,23]。色氨酸代谢可激活氨基酸敏感基因GCN2,进而激活酪氨酸激酶途径。这将引发细胞周期停滞和自噬,并最终引起免疫细胞失效,而犬尿喹啉酸的堆积可阻碍免疫效应细胞生存[24]。肿瘤微环境中IDO表达增加引发低色氨酸水平和有毒物质犬尿喹啉堆积,抑制免疫细胞的增殖与活性,这是癌细胞免疫逃逸并发生无限增殖的可能机制之一[25]。本研究结果推断,激素敏感性PCa细胞LNCaP生物活性的发挥可能与IDO和IL-6表达的异常增高密切相关,细胞水平验证结果显示,将LNCaP细胞中IL-6敲除后,LNCaP细胞的生物活性(增殖、侵袭和迁移)能力显著降低,而凋亡率显著升高,同时IDO表达水平也显著降低。然而在C4-2细胞中,将si-IL-6敲除后,IDO表达也显著降低,但对C4-2细胞的生物活性虽有抑制,但无显著变化。此结果提示,临床治疗中使用IL-6/IDO通路拮抗剂对激素敏感性PCa患者治疗效果可能更加有效。
综上所述,CXCL12、IDO以及IL-6在去势PCa细胞和激素敏感性PCa细胞中存在显著差异,此差异可能是导致临床用药存在明显个体差异性的重要因素。
