大分割电离辐射对放射抗性鼻咽癌细胞免疫原性死亡的影响*
2023-11-18龙金华冷吉曾宪琳金仙槐
龙金华,冷吉,曾宪琳,金仙槐
(1.贵州医科大学附属肿瘤医院 头颈肿瘤科,贵州 贵阳 550004; 2.贵州医科大学 生物与工程学院,贵州 贵阳 550004;3.贵州医科大学 基础医学院,贵州 贵阳 550004)
鼻咽癌(nasopharyngeal carcinoma,NPC)发病率为我国头颈部恶性肿瘤之首,放疗是NPC的主要治疗手段[1]。有研究表明,放疗后非转移性NPC患者的5年生存率可达到67%[2],但仍有30%左右的患者出现放射抗性,发生局部复发和远端转移,导致治疗失败[3]。放疗是一种利用电离辐射破坏肿瘤细胞的DNA结构,从而抑制肿瘤细胞增殖的治疗手段[4]。Riva等[5]发现,大剂量放疗可增加肿瘤部位CD8+T细胞的浸润,抑制肿瘤细胞的增殖并延长模型小鼠的生存期;多位学者发现,大分割电离辐射可增强机体的免疫应答[6-9],还发现电离辐射剂量与免疫原性细胞死亡(immunogenic cells death,ICD)有关[10]。ICD能够在具有免疫能力的宿主中诱导适应性免疫应答的细胞死亡方式[11-12],以钙网蛋白(calreticulin,CRT)、高迁移率族蛋白1(high mobility group protein 1,HMGB1)、热休克蛋白70(heat shock protein 70,HSP70)和腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)等的表达上调为标志[11-13],ICD的发生与肿瘤放疗的临床疗效密切相关[14]。目前,大分割放疗是否能诱导放射抗性NPC细胞发生ICD尚不明确,本研究选取高转移性Epstein-Barr病毒阳性细胞株C666-1和对应的放射抗性细胞株C666-1R作为实验对象,研究大分割电离辐射对细胞周期和ICD相关标志物的影响,为进一步优化NPC患者的临床治疗方案提供实验依据。
1 材料与方法
1.1 实验材料
NPC细胞株C666-1和C666-1R细胞为广西医科大学王仁生教授惠赠。RPIM-1640培养基和胰蛋白酶均购于Gibco,胎牛血清购于Gemini Bio,CCK-8试剂盒购于索莱宝,细胞周期试剂盒购于美仑生物,引物序列购于上海生工,cDNA逆转试剂盒购于Takara,GAPDH、HMGB1、CRT和HSP70的特异性抗体均购于Abcam公司,HMGB1、CRT和HSP70的ELISA检测试剂盒均购于深圳子科,ATP含量检测试剂盒购于索莱宝。
1.2 研究方法
1.2.1细胞培养和放射处理 C666-1和C666-1R细胞均培养于含10% FBS的RPIM-1640完全培养基中,待细胞密度生长至80%~90%,进行放射处理,放射剂量为0、2、4、6、8、10、12及14 Gy。
1.2.2细胞活力检测 收集生长至对数期的NPC细胞,以1×103个/孔将细胞种植于96孔板中,常规培养12 h后进行放射处理;每次每个实验组重复3次,用不加细胞的完全培养基作为空白孔。放射处理后常规培养0、24及48 h,每孔加入CCK-8试剂100 μL,37℃孵育2 h,酶标仪检测450 nm处的OD值。
1.2.3细胞周期检测 NPC细胞照射后继续常规培养48 h,收集细胞,用70%的乙醇固定过夜,1 000 r/min离心5 min,弃上清,PBS洗3次,加入PI染料常温孵育15 min,流式细胞仪检测,分析细胞周期。
1.2.4细胞HMGB1、CRT及HSP70 mRNA表达 采用定量RT-PCR分析法检测,NPC细胞照射后继续常规培养48 h,收集细胞并提取细胞总RNA,检测浓度后,取1 μg总RNA逆转录为cDNA;RT-PCR利用SYBR Green进行,特异性引物见表1。

表1 RT-PCR引物序列
1.2.5细胞HMGB1、CRT及HSP70蛋白表达 采用蛋白印迹(Western blot)检测,NPC细胞照射后继续常规培养48 h,收集细胞并提取细胞总蛋白,BCA法测定蛋白浓度后,取50 μg总蛋白进行SDS-PAGE电泳、转膜和封闭处理。TBST洗涤3次,加入GAPDH、HMGB1、CRT、HSP70的特异性抗体4℃孵育过夜,TBST洗涤3次后加入HRP标记的山羊抗兔IgG二抗,室温孵育1 h,TBST洗涤3次,加入ECL发光液于化学发光成像仪检测蛋白条带。
1.2.6细胞培养上清液HMGB1、CRT及HSP70表达 采用酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)实验检测,收集放射后常规培养48 h的NPC细胞培养上清液,根据ELISA检测试剂盒的说明书进行HMGBI、CRT和HSP70的含量检测,最后用酶标仪检测450 nm处读值。
1.2.7细胞内ATP含量检测 收集放射后常规培养48 h的NPC细胞于EP管内,细胞密度调整为5×109个/L,根据ATP检测试剂盒的说明书检测ATP的含量,最后用酶标仪检测340 nm处的OD值。
1.3 统计学分析

2 结果
2.1 不同分割电离辐射照射对NPC细胞活力的影响
为了确定NPC细胞株对电离辐射应答的时量效关系,本研究用CCK-8法检测不同分割电离辐射照射结束后不同时间(0、24及48 h)C666-1和C666-1R细胞的活力,结果(图1)显示,C666-1R细胞活力均高于C666-1细胞(P<0.05);在常规分割(2 Gy)照射结束后48 h,2种NPC的细胞活力均降低(P<0.05);经大分割8 Gy电离辐射照射后,C666-1和C666-1R活力仅有71.6%和74.3%,处于最低水平。因此,后续实验的条件设定为,对照组(0 Gy),常规分割组(2 Gy)和大分割组(8 Gy),照射后培养时间为48 h。
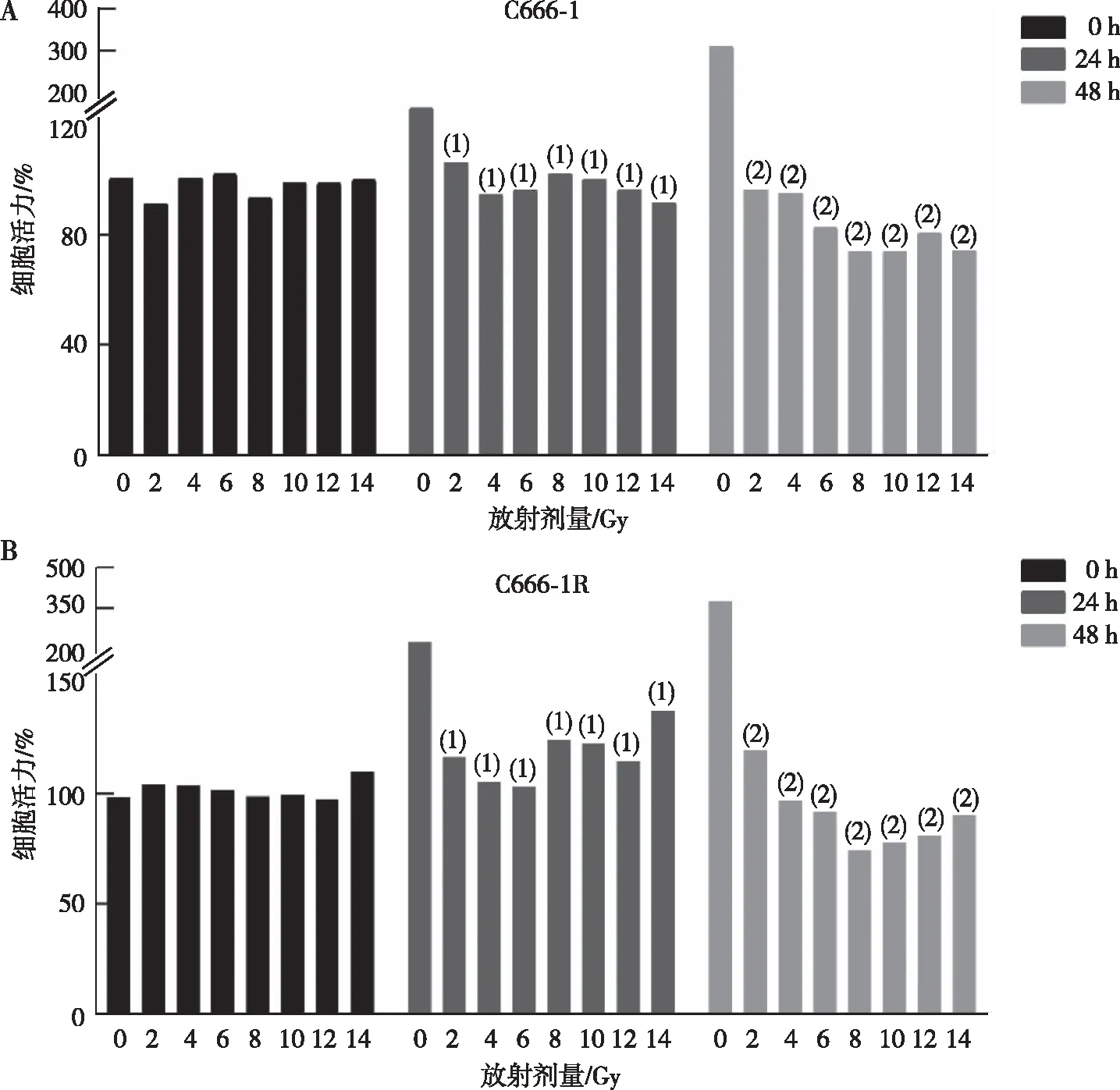
注:A为C666-1细胞活力统计图,B为C666-1R细胞活力统计图;(1)与24 h的0 Gy组比较,P<0.05;(2)与48 h的0 Gy组比较,P<0.05。
2.2 大分割电离辐射照射对NPC细胞周期的影响
经不同分割电离辐射照射后48 h,C666-1和C666-1R细胞的细胞周期如图2所示,与0 Gy期细胞比较G2期的细胞约为23%,经8 Gy电离辐射照射后,62%的C666-1细胞、72%的C666-1R细胞停留在G2期(P<0.05)。

注:A为C666-1和C666-1R的细胞周期流式图,B、C为C666-1和C666-1R的细胞周期统计图,(1)与0 Gy组比较,P<0.05,(2)与2 Gy组比较,P<0.05。
2.3 大分割电离辐射照射对2种NPC细胞ICD相关基因和蛋白表达水平的影响
与对照组相比,经常规分割照射后,2种NPC细胞中CRT、HMGB1和HSP70 mRNA的表达均无显著变化(P>0.05);经大分割照射后,2种NPC细胞中上述mRNA的表达均明显上调(P<0.05,图3A)。如图3B所示,C666-1分泌的CRT随着电离辐射照射剂量的增加而增加,HMGB1随着电离辐射照射剂量的增加而减少(P<0.05);C666-1R分泌的CRT、HMGB1及HSP70均随着电离辐射照射剂量的增加而增加(P<0.05)。Western blot结果显示(图3C),经8 Gy大分割照射后的2种NPC细胞中CRT、HMGB1和HSP70 蛋白表达均较对照组上调(P<0.05)。经8 Gy大分割照射后,C666-1R分泌的ATP较对照组和常规分割照射增多(P<0.05,图3D)。

注:A为细胞中ICD相关基因mRNA表达,B为细胞中相关分泌蛋白的表达,C为细胞中ICD相关蛋白表达,D为细胞上清中ATP含量,(1)与0 Gy组比较,P<0.05,(2)与2 Gy组比较,P<0.05。
3 讨论
越来越多的研究发现,不同电离辐射剂量对多种肿瘤具有不同的疗效和预后[6-7]。放疗作为NPC重要的治疗手段,局部复发和远端转移是NPC患者常见的治疗失败原因,这可能与NPC细胞放射抗性获得有关。因此,本研究首先检测不同剂量(0~14 Gy)电离辐射对NPC细胞株C666-1及其放射抗性细胞株C666-1R细胞活力的影响,结果发现,经不同剂量放射处理后的C666-1R细胞活力均高于C666-1细胞,表明C666-1R具有更高的放射抗性,这与Huang等[15]的结果一致。经2~14 Gy电离辐射照射后,8 Gy分割能够导致两种细胞株的活力降至最低,而大于8 Gy的分割使NPC细胞的活力显著增加,这可能是由于电离辐射照射后死亡细胞脱落,残存细胞之间的接触抑制现象消失,使少数残存的细胞分裂增殖加快,最终表现为细胞活力的增加[16-17],这与“4R理论”中的细胞再增生作用相符,即放射损伤的修复(repair)、再氧合作用(reoxygenation)、细胞周期的再分布(redistribution)和细胞再增殖(repopulation),可能与NPC细胞逐步获得放射抗性有关。
电离辐射诱导细胞的DNA损伤与细胞死亡密切相关[18],细胞出现可修复的DNA损伤时,细胞会停滞细胞周期的进程并进行损伤修复[19]。本研究发现NPC细胞的细胞周期进程与电离辐射分割剂量呈依赖性关系,大分割照射后停留在G2期的NPC细胞明显增加,G2/M检查点阻断了细胞周期的进程[20-21]。
大量研究表明,电离辐射照射损伤肿瘤细胞,从而释放CRT、HMGB1、HSP70和ATP等分子,诱导肿瘤细胞发生ICD,增强免疫系统对肿瘤细胞的敏感性[13],进而产生抗肿瘤免疫应答。肿瘤细胞释放CRT诱导内质网应激,导致肿瘤细胞死亡[22-23]。本研究发现,与C666-1相比,经2 Gy电离辐射照射后的C666-1R中CRT、HMGB1和HSP70基因的表达较低,这可能与C666-1R中脂肪含量和肥胖相关蛋白(fat mass and obesity associated,FTO)表达显著上调有关[15],FTO的增多能促进DNA修复,从而抑制促ICD相关基因的表达[24]。与对照组和常规分割组相比,经8 Gy电离辐射照射后的NPC细胞表达的CRT明显上调,这与细胞活力和细胞周期的结果相一致。此外,大分割电离辐射照射后的NPC细胞表达的HMGB1、HSP70和ATP明显上调。HMGB1可以介导NF-κB的激活和下游炎症细胞因子的应答,放大炎症反应[25-26];HSP70和ATP可促进DCs成熟和TNF-α的分泌[11],表明经大分割电离辐射处理的NPC细胞可能会促进抗肿瘤免疫反应。
综上所述,本研究结果表明,经不同分割电离辐射照射后,正常NPC细胞C666-1的细胞活力均明显低于其放疗抗性细胞C666-1R;与常规分割组相比,大分割电离辐射能更好的促进NPC放射抗性细胞C666-1R的细胞周期阻滞,并诱导ICD的发生,启动抗肿瘤免疫应答,进而抑制肿瘤的进展。
