IL-33通过miR-19a-3p/MAPK6通路影响心肌缺氧/复氧损伤的机制研究
2023-11-11姬林娟郭俊芳陶艾彬姚永伟
高 旺,田 欣,姬林娟,郭俊芳,陶艾彬,芮 涛,姚永伟
0 引言
白细胞介素-33(Interleukin-33,IL-33)是白介素-1家族成员,在组织受损时从坏死或凋亡的细胞中释放出来[1],通过与其受体生长刺激表达因子2(Growth stimulation expressed gene 2,ST2)结合,抑制细胞凋亡[2]。既往研究表明,IL-33在许多心血管疾病中具有心脏保护作用。在压力超负荷模型中,IL-33治疗可明显改善ST2野生型小鼠心肌肥厚和纤维化,并提高其存活率[3]。在大鼠心肌梗死模型中,IL-33通过诱导抗凋亡因子的表达,抑制心肌细胞凋亡,改善预后[4]。在阿霉素诱导的心肌损伤中,IL-33抑制活性氧簇(Reactive oxygen species,ROS)的释放,调节ASK1/JNK信号通路,减轻心肌细胞凋亡[5]。尽管近年来对IL-33进行了广泛的研究,但其心脏保护作用的潜在机制尚不明确,尤其是IL-33对心肌缺血/再灌注(Ischemia/reperfusion,I/R)损伤的影响。本研究旨在探讨IL-33在心肌细胞缺氧/复氧(Hypoxia/reoxygenation,H/R)损伤中的作用,并进一步揭示其作用机制,为治疗心肌I/R损伤开拓新的思路。
1 材料和方法
1.1 主要实验试剂 10% 胎牛血清购自美国Gibco公司。M199 培养基购自美国Sigma公司。Liberase、细胞凋亡ELISA检测试剂盒和原位细胞凋亡染色检测试剂盒购自美国 Roche公司。miR-19a-3p 模拟物(mimic)、miR-19a-3p 抑制剂(inhibitor),pc DNA-MAPK6质粒及其相应阴性对照(pcDNA) 购自美国 Thermo Fisher Scientific 公司。Lipofectamine 2000 转染试剂、TRIZOL 试剂购自美国Invitrogen公司。Prime ScriptTMRT 逆转录试剂盒购自日本Takara公司。SYBR®Green Supermix 试剂盒购自美国Bio-Rad公司。miScript SYBR Green PCR试剂盒购自德国Qiagen公司。MAPK6和β-actin抗体均购自美国Abcam公司。双荧光素酶报告基因测定试剂盒购自美国Promega公司。Caspase-3活性检测试剂盒购自美国Enzo公司。
1.2 心肌细胞培养与转染 取新生小鼠(1~3日龄)心脏切碎,Liberase (10 mg/ml) 消化心脏组织,反复轻柔吹打后收集悬浮细胞,150 g离心5 min。将沉淀细胞重新悬浮于含有10% 胎牛血清的M199培养基中。37 ℃预培养2 h后,去除非贴壁细胞,将贴壁细胞重悬于培养基中,继续培养48~72 h,直至心肌细胞达到80%融合。按照Lipofectamine 2000转染试剂盒说明书所示的转染步骤,分别将miR-19a-3p mimic、miR-19a-3p inhibitor、miR-NC、pcDNA-MAPK6重组质粒或pcDNA质粒转入心肌细胞内。首先使用Opti-MEM培养基稀释拟转染的miRNA,将其按1∶1的体积比加入到Lipofectamine 2000转染试剂中。在室温下孵育5 min,再将该(miRNA-脂质体)混合物加入到心肌细胞培养基中,37 ℃继续孵育1~3 d。通过RT-qPCR法检验转染效果。
MAPK6序列插入pcDNA载体,以构建 pcDNA-MAPK6质粒,并将空pcDNA质粒作为阴性对照。将 pcDNA-MAPK6和pcDNA质粒通过Lipofectamine 2000转染心肌细胞。具体方法同上。37 ℃下继续孵育1~3 d用于后续实验。
1.3 缺氧复氧模型 心肌细胞在无血清DMEM和厌氧条件(95%N2和5%CO2)中孵育6 h以诱导缺氧。随后,将细胞在常氧条件下培养24 h以诱导复氧,构建缺氧/复氧(H/R)模型。常氧条件下的细胞 (常氧/复氧,N/R)作为对照。
1.4 细胞处理及分组 (1)用不同浓度IL-33(0,1,5,10,20 ng/ml)预处理,每组各取样本3例,样本总量为15例。根据实验结果选取适当IL-33预处理浓度进行后续实验,然后根据是否进行H/R处理分为对照组(NC)、H/R组、IL-33+H/R组、IL-33组,每组各取样本4例,样本总量为16例;根据是否使用IL-33预处理和不同的复氧时间(0,30,60,120,240 min)将心肌细胞进行分组,每组各取样本3例,样本总量为30例;根据是否转染miR-19a-3p mimic、IL-33预处理或H/R处理将心肌细胞分为miR-NC组、IL-33+miR-NC组、miR-19a-3p mimic组、IL-33+miR-19a-3p mimic组、H/R+miR-NC组、H/R+IL-33+miR-NC组、H/R+miR-19a-3p mimic组、H/R+IL-33+miR-19a-3p mimic组,每组各取样本3例,样本总量24例。
(2)用miR-19a-3p mimic、miR-19a-3p inhibitor及miR-NC分别转染心肌细胞,将其分为miR-19a-3p mimic组、miR-19a-3p inhibitor组及miR-NC组,每组各取样本3例,样本总量为9例。
(3)经H/R处理后,根据是否使用IL-33预处理,将其分为N/R组、H/R组、H/R+IL-33及IL-33组,每组各取样本3例,样本总量为12例;用pcDNA-MAPK6或pcDNA转染心肌细胞,将其分为对照组(NC)、pcDNA-MAPK6组及pcDNA组,每组各取样本3例,样本总量为9例;根据是否使用IL-33预处理、pcDNA-MAPK6转染心肌细胞或者H/R处理,将其分为pcDNA组、IL-33+pcDNA组、pcDNA-MAPK6组、IL-33+pcDNA-MAPK6组、H/R+pcDNA组、H/R+IL-33+pcDNA组、H/R+pcDNA-MAPK6组、H/R+IL-33+pcDNA-MAPK6组,每组各取样本3例,样本总量为24例。
(4)根据是否使用miR-19a-3p mimic转染心肌细胞或H/R处理,分为对照组、H/R组、H/R+miR-NC组、H/R+miR-19a-3p mimic组,每组各取样本3例,样本总量为12例;根据是否使用miR-19a-3p inhibitor转染心肌细胞、IL-33预处理或H/R处理,将其分为对照组、H/R组、H/R+IL-33组、H/R+IL-33+miR-19a-3p inhibitor组、H/R+IL-33+miR-NC组,每组各取样本3例,样本总量为15例。
1.5 实时荧光定量PCR 用TRIZOL试剂处理,从心肌细胞中提取总RNA,使用Prime ScriptTMRT 试剂盒对 cDNA 进行逆转录,并通过 iTaqTM通用SYBR®Green Supermix测定 mRNA 水平。按照说明,用miScript SYBR Green PCR试剂盒对miR-19a-3p的表达进行定量。通过2-ΔΔCt法计算mRNAs和miR-19a-3p的相对表达水平,分别以GAPDH和U6作为内参。miR-19a-3p上游引物:5′-CTGGAGTGTGCAAATCTATGC-3′,下游引物:5′-GTGCAGGGTCCGAGGT-3′;MAPK6 上游引物:5′-ACTTGGTGCTGAAGATAG-3′,下游引物:5′-TGAGAAGCTCCTGACGAT-3′;GAPDH上游引物:5′-AGCCACATCGCTCAGACAC-3′,下游引物:5′-GCCCAATACGACCAAATCC-3′;U6上游引物:5′-CTCGCTTCGGCAGCAGCACATATA-3′,下游引物:5′-AAATATGGAACGCTTCACGA-3′。
1.6 双荧光素酶基因报告检测 将MAPK6 mRNA序列的3′UTR插入PMIRGLO双荧光素酶miRNA靶向表达载体,构建野生型PMIRGLO-MAPK6 3′UTR (MAPK6-3′UTR-WT)。同时,通过定点突变MAPK6 3′UTR中的miR-19a-3p结合位点,构建PMIRGLO-MAPK6 3′UTR突变体(MAPK6-3′UTR-MUT)。在miRNA过表达实验中,用miR-19a-3p mimic或miR-NC转染心肌细胞;在miRNA抑制实验中,用miR-19a-3p inhibitor或miR-NC共转染心肌细胞。根据双荧光素酶报告基因试剂盒说明书所述步骤检测荧光素酶活性。
1.7 蛋白表达检测 从每个细胞培养孔中裂解并刮取心肌细胞,离心后获得蛋白质样品,并测定其浓度。通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),将蛋白质转移到硝酸纤维素膜上。分别与MAPK6抗体 (1∶1 000)和β-actin抗体 (内参,1∶6 000)在4 ℃下孵育过夜。然后将膜与HRP偶联的二抗在室温下孵育1 h。最终,通过ECL发光液,在凝胶成像系统中曝光,获得可视化特异条带,通过Image-J系统分析条带的灰度值。
1.8 细胞凋亡检测 Caspase-3 活性试剂盒测定Caspase-3活性,待细胞裂解后,把5 μl 4 mM DEVD-p-NA底物、50 μl反应缓冲液和细胞上清液(50 μl/孔)在37 ℃下孵育2 h。借助微孔板读取器测定405 nm处光密度值(OD)。Caspase-3活性(%)=(实验组OD值/control组OD值)×100%。
通过细胞凋亡ELISA检测试剂盒测定片段化DNA。用试剂盒内裂解液把细胞裂解充分,离心后转移裂解液上清到链霉素包裹的96孔板,然后加入试剂盒内生物素标记抗组蛋白抗体、过氧化物酶标记的抗DNA单克隆抗体,放置室温下孵育2 h,最后分光光度计检测405 nm处的细胞凋亡状态。
原位细胞凋亡染色实验中,收集实验组、对照组贴壁及漂浮的所有细胞,PBS清洗2次,之后加入PBS制作细胞悬液,涂在载玻片上自然晾干,然后放置于4%多聚甲醛中,室温固定30 min,0.1% Triton X-100浸润,使用原位细胞凋亡染色检测试剂盒对凋亡DNA片段进行DAPI末端标记。荧光显微镜观察DAPI标记的TUNEL阳性细胞并拍照,随机选择5个区域,计算凋亡细胞百分比。
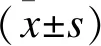
2 结果
2.1 IL-33通过调节miR-19a-3p减轻H/R诱导的心肌细胞凋亡 与对照组相比,H/R增加心肌细胞凋亡,IL-33单独作用不影响心肌细胞的凋亡,但是以剂量依赖的方式减少了H/R诱导的细胞凋亡(P<0.05,图1A、1B),并选择IL-33浓度为10 ng/ml进行后续实验。H/R后miR-19a-3p水平降低,然而与不同复氧时间的H/R组相比,IL-33预处理组中miR-19a-3p的降低消失 (P<0.05,图1C)。与H/R组的心肌细胞相比,无论转染miR-19a-3p mimic或IL-33预处理,都可以减轻H/R诱导的细胞凋亡 (P<0.05,图1D)。
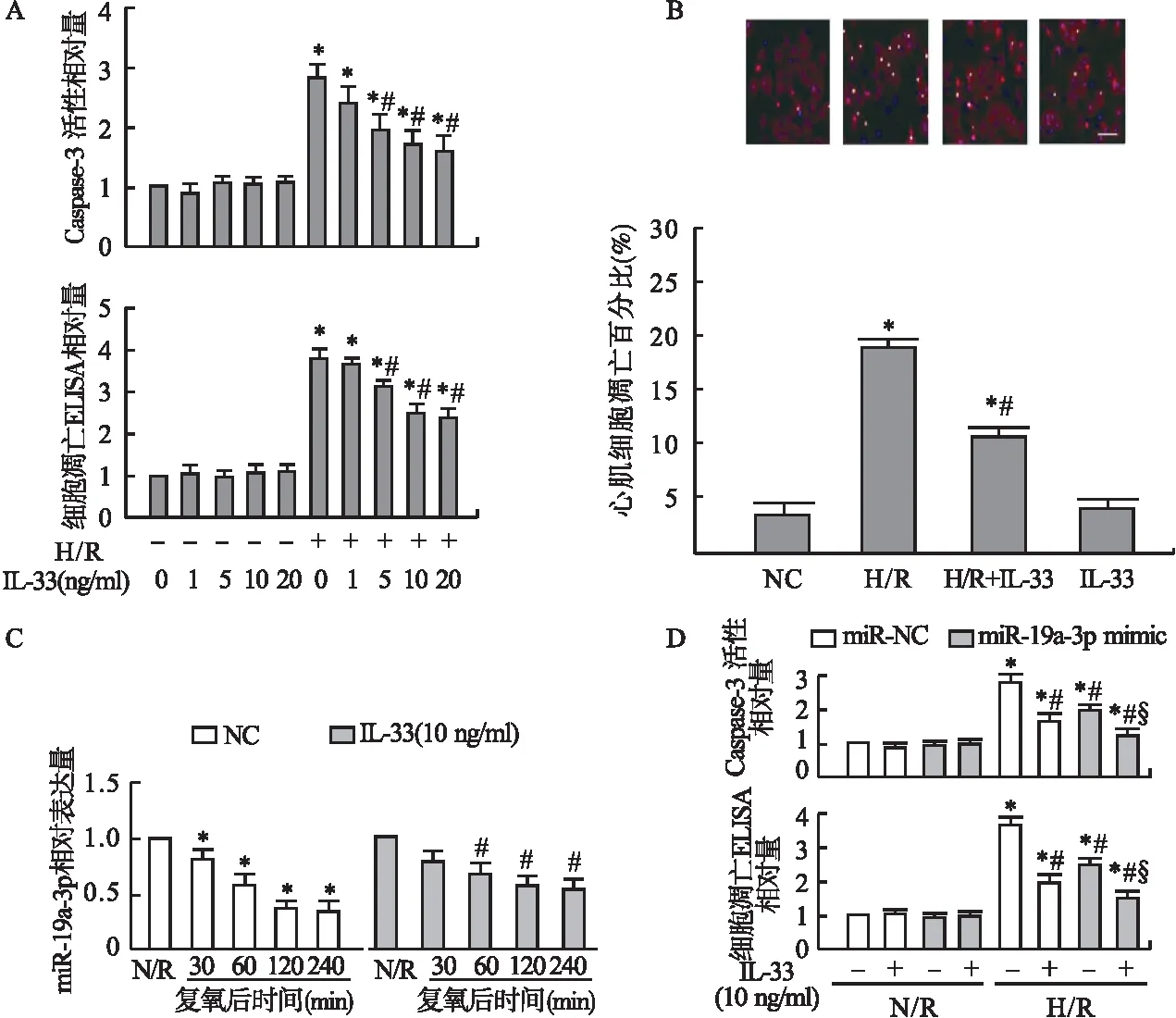
图1 IL-33通过miR-19a-3p影响H/R诱导的心肌细胞凋亡
2.2 MAPK6是miR-19a-3p的靶基因 检索TargetScan数据库,发现MAPK6与miR-19a-3p存在潜在的结合位点(图2A)。双荧光素酶报告基因检测显示,miR-19a-3p mimic可抑制MAPK6-WT组的荧光素酶活性,而不影响MAPK6-MUT 组荧光素酶活性 (t=10.22,P<0.05) (图2B)。miR-19a-3p mimic抑制了心肌细胞中MAPK6 mRNA(t=3.65,P<0.05)和蛋白表达(t=3.38,P<0.05)(图2C)。miR-19a-3p inhibitor可增加MAPK6-WT组的荧光素酶活性,而不影响MAPK6-MUT组荧光素酶活性 (t=8.48,P<0.05) (图2D)。且miR-19a-3p inhibitor促进了MAPK6 mRNA (t=4.29,P<0.05)和蛋白表达(t=3.74,P<0.05)(图2E)。结果表明,miR-19a-3p可以负向调控 MAPK6。
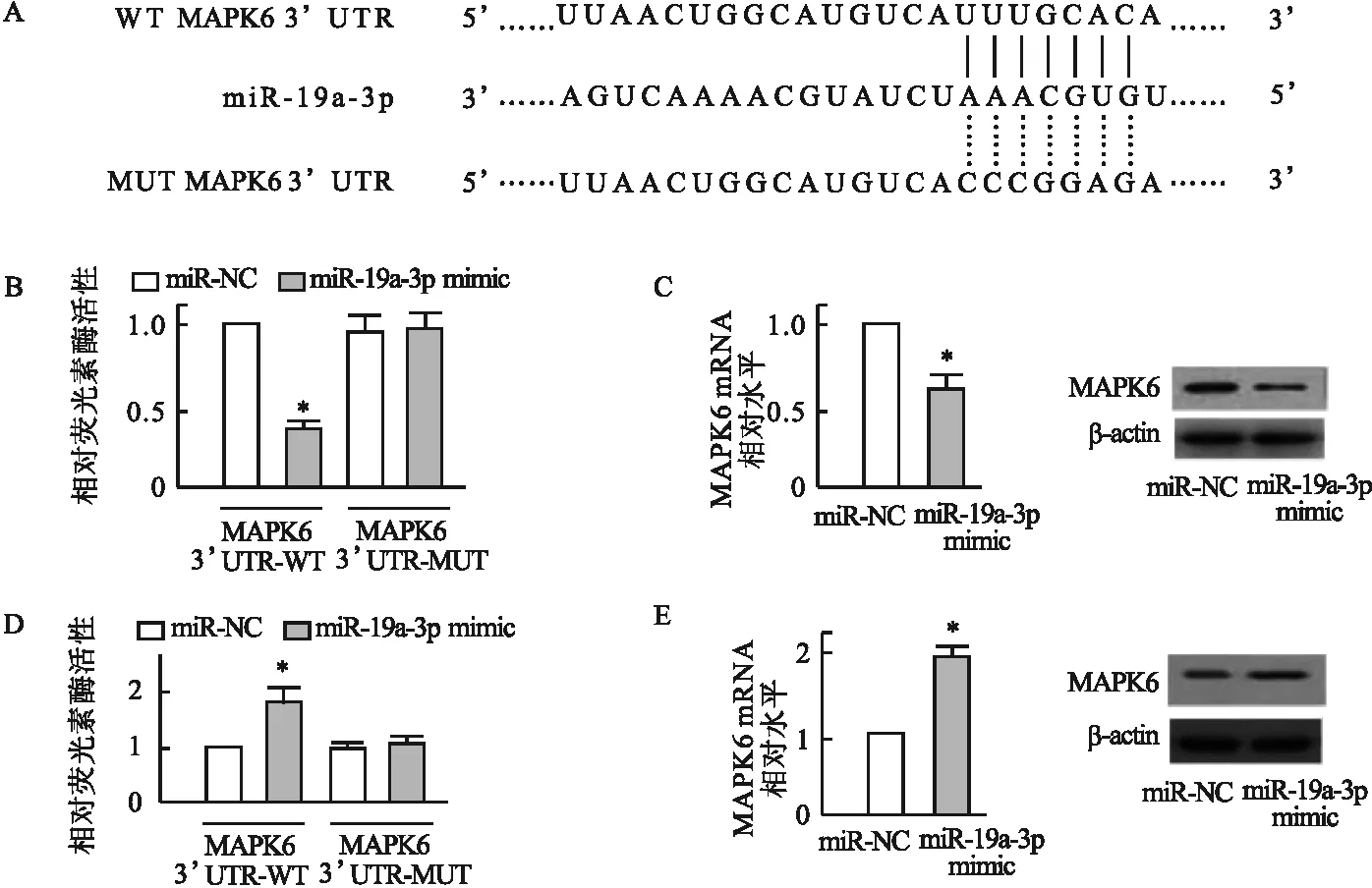
图2 miR-19a-3p对靶基因MAPK6的影响
2.3 IL-33通过MAPK6影响心肌细胞凋亡 与对照组相比,H/R组心肌细胞MAPK6的表达上调。此外,IL-33单独作用并不影响MAPK6的表达,但逆转了H/R诱导的MAPK6 mRNA (t=4.41,P<0.05,图3A)和蛋白 (t=2.74,P<0.05,图3B)的表达上调。经H/R处理后,与转入空载pcDNA质粒的心肌细胞相比,转入pcDNA-MAPK6重组质粒后,心肌细胞MAPK6蛋白表达上调 (t=9.70,P<0.05,图3C)。IL-33能抑制H/R诱导的心肌细胞凋亡,而转入pcDNA-MAPK6的心肌细胞,由于MAPK6表达增加,减弱了IL-33对H/R的抗凋亡作用(P<0.05,图3D)。结果表明,IL-33通过下调MAPK6表达,减弱H/R诱导的心肌细胞凋亡。
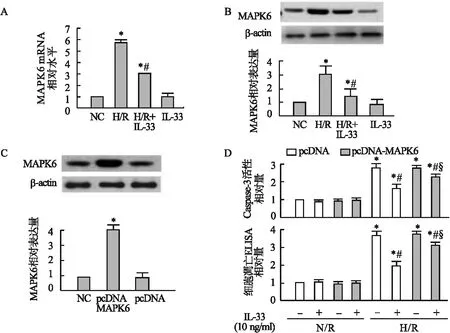
图3 IL-33通过MAPK6减少心肌细胞凋亡
2.4 IL-33在H/R损伤中参与调控miR-19a-3p/MAPK6通路 与转入miR-NC的心肌细胞相比,转入miR-19a-3p mimic后,抑制了H/R诱导的MAPK6 mRNA (t=8.42,P<0.05,图4A) 和蛋白(t=5.79,P<0.05,图4B)表达上调。与单纯H/R处理的心肌细胞相比,IL-33预处理可以抑制H/R诱导的MAPK6 mRNA和蛋白的表达上调 (P<0.05)。与IL-33预处理相比,IL-33预处理的心肌细胞转入miR-NC后,MAPK6表达无明显变化。而IL-33预处理的心肌细胞转入miR-19a-3p inhibitor后,MAPK6 mRNA和蛋白的表达增加 (P<0.05,图4C、4D),即敲低miR-19a-3p消除了IL-33对H/R诱导MAPK6表达上调的影响。
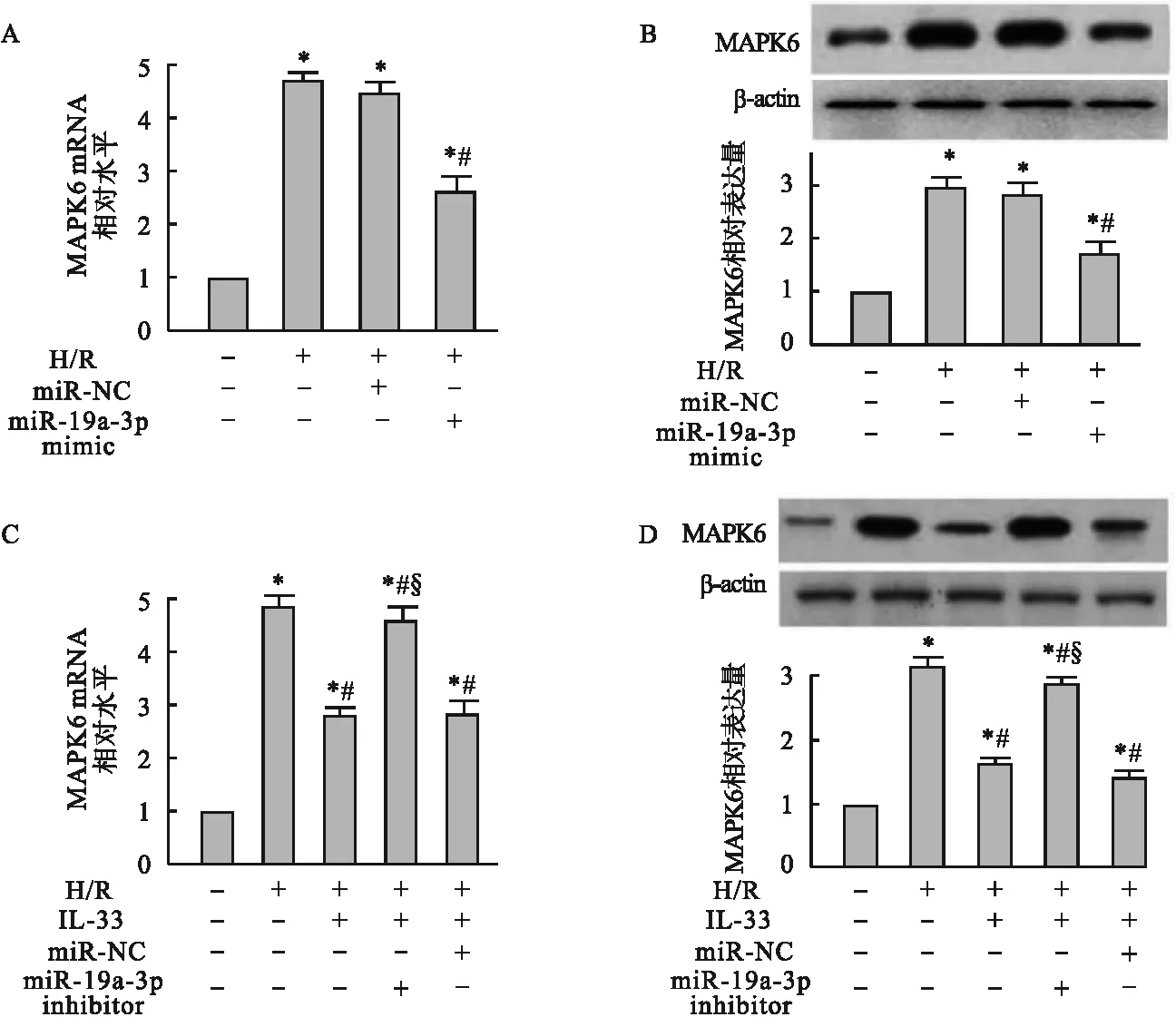
图4 IL-33在H/R损伤中参与调控miR-19a-3p/MAPK6通路
3 讨论
急性心肌梗死是导致我国居民死亡的主要原因之一,尽早达到有效的心肌再灌注是急性心肌梗死救治的核心。然而,血流的突然开通往往会引起恶性心律失常、无复流,从而导致心肌损伤进一步加重,即心肌缺血/再灌注损伤[6-7]。目前认为,缺血心肌在血流恢复后,由于能量代谢障碍、钙离子超负荷和自由基大量生成等原因,导致心肌超微结构、功能、代谢及电生理等方面的进一步损害,这是导致心肌缺血/再灌注损伤的主要原因[8-9],但其机制尚不明确。
Micro RNAs(miRNAs)是一类非编码的单链小分子RNA,通过与靶基因mRNAs的3′-非翻译区(UTR)结合来负性调控基因表达[10]。越来越多的证据表明,miRNAs在心肌I/R损伤中起关键作用[11]。Hinkel等[12]发现,在猪I/R损伤模型中,抗miRNA-21治疗可预防I/R损伤引起的心力衰竭。另有研究发现,在经H/R诱导的H9c2细胞中,miR-374a-5p水平降低,而miR-374a-5p过表达可减少心肌H/R损伤[13]。作为miR-17-92基因簇的重要成员,miR-19a首先被发现与肿瘤的发生、发展密切相关[14]。一系列研究证实了miR-19a在心力衰竭、心肌梗死、心肌纤维化和心肌肥厚等病理生理机制中起重要作用[15-18]。Sun等[19]研究表明,与阴性对照组相比,心肌H/R损伤后,miR-19a的表达明显减少。本研究也显示,在H/R损伤后,miR-19a-3p的表达水平降低。此外,miR-19a-3p mimic转染能增加miR-19a-3p的表达,从而有效抑制H/R诱导的心肌细胞凋亡。上述结果表明,H/R损伤可降低miR-19a-3p,而miR-19a-3p水平的升高可以减轻H/R诱导的心肌细胞凋亡。已知H/R损伤可以诱导心肌细胞凋亡,而IL-33同时具有抗氧化和抗凋亡等心肌保护作用。在心肌I/R损伤模型中,Rui等[20]证明了外源性IL-33通过抑制PKCβ/JNK通路,减轻I/R诱导的氧化应激,最终减弱心肌细胞凋亡。Ruisong等[21]研究表明,IL-33通过调控p38 MAPK和HMGB1信号通路,抑制心肌细胞凋亡,减轻心肌I/R损伤。本研究结果表明,H/R损伤增加心肌细胞的凋亡,而IL-33以剂量依赖性的方式显著逆转了这一趋势,这与之前发表的研究结论相一致[4]。此外,IL-33增加了心肌miR-19a-3p的表达,这是导致减少H/R损伤的重要原因。既往研究显示,IL-33对多种miRNAs具有调节作用。Lopetuso等[22]发现,IL-33能够刺激miR-320的表达,从而促进急性结肠炎中结肠上皮细胞的修复。Zhou等[23]研究显示,IL-33调节miR-128-3p的表达,从而促进非小细胞肺癌细胞的增殖。本研究中,IL-33增加了心肌miR-19a-3p的表达,但其发生机制尚不明确。有研究表明,IL-33可抑制I/R损伤中ROS的释放,而ROS可通过转录因子p53和NF-κB来调控某些特定的miRNAs的表达[24-25]。据此,推测IL-33可能通过调控ROS的激活而影响miR-19a-3p的表达,或直接干预miR-19a-3p的转录过程。
MAPKs属于丝氨酸/苏氨酸蛋白激酶,能被细胞外多种炎症因子刺激,进而调节基因表达、细胞存活和凋亡[26]。尽管MAPK6在多种细胞中均有表达,但由于其缺乏经典MAPKs通路中保守的Thr-x-Tyr基序,导致有关MAPK6激活的确切分子机制研究甚少[27]。研究表明,IL-33通过抑制p38 MAPK信号通路,减少心肌I/R损伤[21],而MAPK6作为非典型MAPK成员之一,其过表达可促进H/R损伤诱导的细胞凋亡[28]。本研究显示,H/R损伤增加了MAPK6表达,而IL-33预处理可逆转MAPK6的过表达。根据生物信息学分析,本研究,预测MAPK6为miR-19a-3p的靶基因,并通过双荧光素酶报告基因实验加以证实。此外,转染miR-19a-3p mimic可显著抑制MAPK6的表达,减轻心肌细胞凋亡,而转染miR-19a-3p inhibitor结果相反。结果表明,miR-19a-3p通过抑制MAPK6的表达,减轻H/R诱导的心肌细胞凋亡。
综上所述,本研究证实了miR-19a-3p/MAPK6通路在IL-33抗H/R诱导的心肌细胞凋亡中的重要作用,为心肌H/R损伤提供了新的潜在治疗靶点和理论依据。
