丹参酮ⅡA抑制STAT3通路调节食管癌EC109细胞的周期与凋亡*
2023-11-09陈星周哲旭尚艺婉刘洋刘娅茹胡啸博樊李妍陈玉龙
陈星,周哲旭,尚艺婉,刘洋,刘娅茹,胡啸博,樊李妍,陈玉龙
河南中医药大学/河南省中医方证信号传导重点实验室,河南 郑州 450046
食管癌是世界上常见的恶性肿瘤之一,在全球癌症相关死亡原因中排第六位,我国食管癌的发病率与病死率较高[1-2]。目前,针对食管癌患者的主要治疗手段是放化疗及联合手术,但由于大多数患者在晚期确诊,导致其5年生存率极低[3-4]。多项研究表明,信号传导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)信号通路参与了食管癌的发生和发展,促进肿瘤细胞的增殖、迁移、抗凋亡、抗耐药等,严重影响其预后,已成为食管癌治疗的潜在靶点[5-9]。丹参酮ⅡA作为中药丹参的有效成分之一,具有抗炎、抗氧化、抗过敏、抗纤维化、抗动脉粥样硬化、抗癌等作用[10-11]。研究证实,丹参酮 ⅡA 可以通过抑制上皮间质转化促进食管癌EC9706和KYSE70细胞凋亡,抑制其侵袭、迁移[12]。同时,丹参酮ⅡA可以通过下调p-STAT3抑制人胃癌细胞的增殖[13]。前期预实验发现,不同浓度的丹参酮ⅡA能够有效抑制STAT3、p-STAT3的表达,并且随浓度梯度抑制食管癌Ec109细胞的增殖。但是丹参酮ⅡA能否通过抑制STAT3通路促进食管癌细胞周期阻滞进而促进其凋亡尚未见报道。基于此,本实验拟从丹参酮ⅡA抑制食管癌细胞Ec109增殖的基础上,探讨其能否通过抑制STAT3信号通路发挥其抗肿瘤作用,为食管癌的临床治疗提供新的思路与靶点。
1 材料
1.1 动物与细胞人食管癌Ec109细胞,由本实验室传代冻存。70只4周龄SPF级BALB/c雌鼠,体质量11~15 g,购于北京维通利华实验动物技术有限公司,合格证号:NO.110011220106561335,实验动物许可证号:SCXK(京)2021-0006。动物饲养于河南中医药大学动物实验中心(23±2) ℃的SPF动物房中,动物实验经河南中医药大学实验动物伦理委员会批准,伦理编号:ZWLL202003215。
1.2 药物与试剂STAT3抑制剂stattic(Selleckchem公司,批号:S7024);丹参酮ⅡA(质量分数≥98%,成都曼斯特公司,批号:568-72-9);RPMI Medium1640培养基(美国Gibico公司,批号:2357161);胰蛋白酶-EDTA消化液、胰蛋白酶不含EDTA消化液、四甲基偶氮唑盐(thiazolyl blue tetrazolium bromide,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、高效RIPA裂解液、PMSF、蛋白磷酸酶抑制剂混合物(北京索莱宝科技有限公司,批号:T1300、T1350、M8180、D8370、R0010、P0100、P1260);胎牛血清(Hyclone公司,货号:RB39736);STAT3鼠抗人抗体、半胱氨酸蛋白酶-9(caspase-9)鼠抗人抗体、c-Myc兔单克隆抗体、CyclinB1抗体、α-tublin兔单克隆抗体、山羊抗小鼠IgG二抗、山羊抗兔IgG二抗(美国CST公司,货号:9145S、9508S、18583S、4138S、2125S、7056S、7074S);p-STAT3兔抗人抗体、caspase-3兔抗人抗体(英国Abcam公司,货号:ab76315、ab32351);细胞周期检测试剂盒、细胞凋亡检测试剂盒(杭州联科生物技术股份有限公司,货号:A20533、A10642);Trizol试剂(美国invitrogen公司,批号:390202);逆转录试剂盒(东洋纺公司,批号:117000);2×SYBRGreen(ABclonal公司,批号:9620031031C)。
1.3 仪器CO2培养箱(美国Thermo Fisher Scientific公司,型号:170R);超净工作台(苏净集团安泰公司,型号:37997);倒置显微镜(德国Leica公司,型号:DFC450C);酶标仪(美国Bio-Tek公司,型号:ELx-800);离心机(美国Thermo Fisher Scientific公司,型号:LABOFUGE 400);垂直电泳仪(美国Bio-Rad公司,型号:PowerPac Basic);垂直湿转膜仪(美国Bio-Rad公司,型号:Criterion Blotter);低温高速离心机(美国Thermo Fisher Scientific公司,型号:X1R);凝胶成像扫描仪(美国Bio-Rad公司,型号:ChemiDoc XRS+);流式细胞仪(美国BD公司,型号:FACSVantageSE);冷冻型高通量组织研磨器(宁波新芝生物科技股份有限公司,型号:Scientz-48L);电子天平(上海精科天美科学仪器有限公司,型号:XB120A);实时荧光定量 PCR 仪(美国Thermo Fisher Scientific公司,型号:QuantStudio 6)。
2 方法
2.1 细胞培养食管癌Ec109细胞置于5%CO2,37 ℃恒温培养箱中用含10%血清的1640完全培养基培养,每2~3天传代一次,取对数生长期细胞进行下一步实验。
2.2 药物配置采用电子天平称取适量stattic、丹参酮ⅡA粉末,用DMSO分别配置成20 mmol·L-1、10 g·L-1工作液,-20 ℃避光保存1个月,用于后续实验。
2.3 MTT法检测丹参酮ⅡA、stattic及联合用药对Ec109细胞增殖的影响取对数生长期的Ec109细胞,用含EDTA的胰酶消化重悬计数,每孔1×104个细胞接种于96孔板,每孔200 μL,置于5%CO2,37 ℃恒温培养箱中培养24 h,分别设置空白组、丹参酮ⅡA组、stattic组。丹参酮ⅡA的浓度分别为0 mg·L-1、0.5 mg·L-1、1 mg·L-1、2 mg·L-1、4 mg·L-1、8 mg·L-1,stattic的浓度分别为0 μmol·L-1、3 μmol·L-1、6 μmol·L-1、12 μmol·L-1、15 μmol·L-1、24 μmol·L-1,联合用药分析时又分为空白组、丹参酮ⅡA 2 mg·L-1组、丹参酮ⅡA 8 mg·L-1组、stattic 7 μmol·L-1组、丹参酮ⅡA 2 mg·L-1+static 7 μmol·L-1组、丹参酮ⅡA 8 mg·L-1+static 7 μmol·L-1组,每组均设置3个复孔。继续培养48 h后,将5 g·L-1MTT与1640培养基以19比例进行配置后,每孔加入100 μL,4 h后,每孔加入150 μL DMSO,采用酶标仪测定490 nm波长下各孔吸光值(optical density,OD),计算各组药物抑制率。
药物抑制率=(空白组OD值-用药组OD值)/空白组OD值×100%
2.4 流式细胞术检测细胞周期及凋亡取对数生长期的Ec109细胞,以3×106个/孔接种于6孔板,分为空白组、丹参酮ⅡA低浓度组、丹参酮ⅡA高浓度组、stattic组、stattic+丹参酮ⅡA低浓度组、stattic+丹参酮ⅡA高浓度组,加药48 h后,使用不含EDTA的胰酶消化,收集各孔细胞,1 500 r·min-1离心5 min,1 mL PBS洗涤一次,按照说明书进行检测。细胞周期检测时,每组加入1 mL Staining solution与10 μL Permeabilization solution,混匀,避光孵育 30 min,上机检测。细胞凋亡检测时,每组加入 500 μL 使用无菌去离子水稀释的1×Binding Buffer、5 μL AnnexinV-FITC与10 μL PI,混匀,避光孵育5 min,上机检测。
2.5 动物分组、造模与干预从70只4周龄SPF级BALB/c雌鼠中随机抽取10只作为空白组,其余每只小鼠均与右胁部皮下注射2×106个对数生长期的Ec109细胞,1周后观察皮下移植瘤体积,当移植瘤直径约5 mm时造模成功。将造模成功的小鼠随机分为模型组、丹参酮ⅡA低浓度组(20 mg·kg-1)、丹参酮ⅡA高浓度组(40 mg·kg-1)、stattic组(25 mg·kg-1)、stattic(25 mg·kg-1)+丹参酮ⅡA高浓度(40 mg·kg-1)组、顺铂组(1 mg·kg-1),腹腔注射给药,每2天进行1次,连续35 d,末次给药24 h后麻醉处死,称量瘤体大小与质量。
2.6 绘制体质量增长、瘤体生长图给药期间每 7 d 测量一次瘤体大小与小鼠体质量,考察药物对小鼠肿瘤生长的抑制作用,瘤体大小按照V=a×b2×0.52计算,其中a为瘤体长,b为瘤体宽。
2.7 ELISA法检测移植瘤裸鼠血清白细胞介素-6(interleukin-6,IL-6)的水平末次给药24 h后,摘眼球采血,离心后取血清,按照ELISA试剂盒说明书的操作要求检测各组小鼠血清中IL-6的水平。
2.8 免疫印迹法检测细胞周期、凋亡相关蛋白表达水平细胞分组同2.4,加药培养48 h后,以RIPA裂解液:蛋白磷酸酶抑制剂:PMSF=10011的比例配制细胞裂解液混合物,每孔加入130 μL进行细胞裂解;动物分组同2.5,按照1 mg组织加入 4 μL 裂解液比例,采用低温高速组织破碎仪进行组织破碎。BCA蛋白浓度测定试剂盒测定各组蛋白浓度,98 ℃变性8 min,取20 μg蛋白上样,用10%SDS-PAGE凝胶电泳,200 mA转膜60 min,5%脱脂牛奶室温封闭4 h,加一抗(STAT3、c-Myc、CyclinB1、Caspase-9、α-tublin的稀释比例为11 000,p-STAT3的稀释比例为110 000,Caspase-3的稀释比例为15 000)4 ℃孵育过夜,TBST漂洗3次,加二抗(稀释比例为11 000)室温孵育1 h,漂洗3次,配制ECL发光显影液,显影拍照。以α-微管蛋白(α-tubulin)为内参,使用ImageLab分析每组条带的光密度值,以目的条带光密度值/内参条带光密度值计算各组蛋白相对表达量。
2.9 PCR法检测细胞周期、凋亡相关基因mRNA的表达细胞分组同2.4,动物分组同2.5,TRIZOL法提取各组总RNA,按照说明书进行逆转录,采用SYBR Green染料法以10 μL体系(cDNA+无菌无酶水7 μL,5×RT Buffer 2 μL,Enzyme mix 0.5 μL,Primer mix 0.5 μL)对cDNA进行扩增,β-actin为内参,用2-△△Ct计算各个样品中目的mRNA相对表达量。引物序列由GENEWIZ公司设计合成。见表1。

表1 引物序列
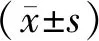
3 结果
3.1 丹参酮ⅡA、stattic及联合用药对Ec109细胞增殖的影响与空白组比较,不同浓度丹参酮ⅡA对Ec109细胞的增殖均有明显的抑制作用(P<0.01),且抑制率随丹参酮ⅡA浓度的升高而升高,选取2 mg·L-1、8 mg·L-1分别为后续实验中丹参酮的低、高浓度剂量。与空白组比较,当stattic浓度≥6 μmol·L-1时,对Ec109细胞增殖均有明显抑制作用(P<0.01),且抑制率随stattic浓度的升高而升高,选取7 μmol·L-1为后续实验联合用药中的stattic浓度。与空白组比较,丹参酮ⅡA低浓度组、丹参酮ⅡA高浓度组、stattic组、stattic+丹参酮ⅡA低浓度组、stattic+丹参酮ⅡA高浓度组对Ec109细胞的增殖均有明显抑制作用(P<0.01),但与单独用药组比较,联合用药组对Ec109细胞增殖的抑制作用无统计学差异(P>0.05)。见表2。
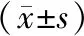
表2 丹参酮ⅡA、stattic及联合用药对Ec109细胞增殖的影响
3.2 丹参酮ⅡA、stattic及联合用药对Ec109细胞周期的影响与空白组比较,丹参酮ⅡA高浓度组G0/G1期细胞比例显著降低(P<0.01),G2/M期细胞比例显著升高(P<0.01);stattic组G0/G1期细胞比例显著降低(P<0.01),S期细胞比例显著升高(P<0.01);stattic+丹参酮ⅡA低浓度组、stattic+丹参酮ⅡA高浓度组G0/G1期细胞比例显著降低(P<0.01),S期细胞比例显著升高(P<0.05),G2/M期细胞比例显著升高(P<0.05)。与stattic组比较,stattic+丹参酮ⅡA高浓度组G2/M期细胞比例显著升高(P<0.05)。见表3、图1。

注:A:空白组;B:丹参酮ⅡA低浓度组;C:丹参酮ⅡA高浓度组;D:stattic组;E:stattic+丹参酮ⅡA低浓度组;F:stattic+丹参酮ⅡA高浓度组。图1 丹参酮ⅡA、stattic及联合用药对Ec109细胞周期的影响
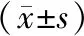
表3 丹参酮ⅡA、stattic及联合用药对Ec109细胞周期的影响
3.3 丹参酮ⅡA、stattic及联合用药对Ec109细胞凋亡的影响与空白组比较,丹参酮ⅡA高浓度组早期凋亡、晚期凋亡细胞比例及总凋亡率均显著升高(P<0.01);stattic组、stattic+丹参酮ⅡA低浓度组、stattic+丹参酮ⅡA高浓度组早期凋亡细胞比例及总凋亡率显著升高(P<0.01)。见表4、图2。

注:A:空白组;B:丹参酮ⅡA低浓度组;C:丹参酮ⅡA高浓度组;D:stattic组;E:stattic+丹参酮ⅡA低浓度组;F:stattic+丹参酮ⅡA高浓度组。图2 丹参酮ⅡA、stattic及联合用药对Ec109细胞凋亡的影响
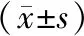
表4 丹参酮ⅡA、stattic及联合用药对Ec109细胞凋亡的影响
3.4 丹参酮ⅡA、stattic及联合用药对Ec109细胞凋亡、周期相关蛋白表达的影响与空白组比较,各给药组p-STAT3、STAT3、CyclinB1蛋白相对表达量均显著降低(P<0.05);stattic组、stattic+丹参酮ⅡA低浓度组、stattic+丹参酮ⅡA高浓度组c-Myc蛋白表达量显著降低(P<0.05)。见表5、图3。

注:A:空白组;B:丹参酮ⅡA低浓度组;C:丹参酮ⅡA高浓度组;D:stattic组;E:stattic+丹参酮ⅡA低浓度组;F:stattic+丹参酮ⅡA高浓度组。图3 丹参酮ⅡA、stattic及联合用药对Ec109细胞凋亡、周期相关蛋白的影响
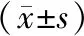
表5 丹参酮ⅡA、stattic及联合用药对Ec109细胞凋亡、周期相关蛋白表达的影响
3.5 丹参酮ⅡA、stattic及联合用药对Ec109细胞凋亡、周期相关基因mRNA表达的影响与空白组比较,各给药组c-MycmRNA、CyclinB1mRNA相对表达量明显降低(P<0.05);丹参酮ⅡA低浓度组Caspase-9mRNA相对表达量明显升高(P<0.01);丹参酮ⅡA高浓度组STAT3mRNA相对表达量明显降低(P<0.01),Caspase-3mRNA相对表达量明显升高(P<0.05);stattic组STAT3mRNA相对表达量明显降低(P<0.01),Caspase-9mRNA相对表达量明显升高(P<0.01);stattic+丹参酮 ⅡA 低浓度组和stattic+丹参酮ⅡA高浓度组STAT3mRNA相对表达量明显降低(P<0.05),Caspase-3mRNA、Caspase-9mRNA相对表达量明显升高(P<0.01)。与stattic组比较,stattic+丹参酮ⅡA高浓度组c-MycmRNA相对表达量明显降低(P<0.05)。见表6。
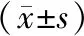
表6 丹参酮ⅡA、stattic及联合用药对Ec109细胞凋亡、周期相关基因mRNA表达的影响
3.6 丹参酮ⅡA、stattic及联合用药对小鼠体质量及瘤体大小的影响随着用药时间的延长,模型组与各药组小鼠的体质量均会降低。末次体质量比较发现,与空白组比较,模型组、stattic组、stattic+丹参酮ⅡA高浓度组小鼠体质量显著下降(P<0.01);与模型组比较,stattic组、stattic+丹参酮ⅡA高浓度组小鼠体质量显著下降(P<0.01);与stattic组比较,stattic+丹参酮ⅡA高浓度组小鼠体质量明显升高(P<0.01)。见图4。与模型组比较,各给药组均可显著抑制移植瘤的生长(P<0.01)。见图5、图6。

注:KB:空白组;M:模型组;L:丹参酮ⅡA低浓度组;H:丹参酮ⅡA高浓度组;S:stattic组;S+H:stattic+丹参酮ⅡA高浓度组;SHUN:顺铂组。图4 各实验组小鼠体质量变化
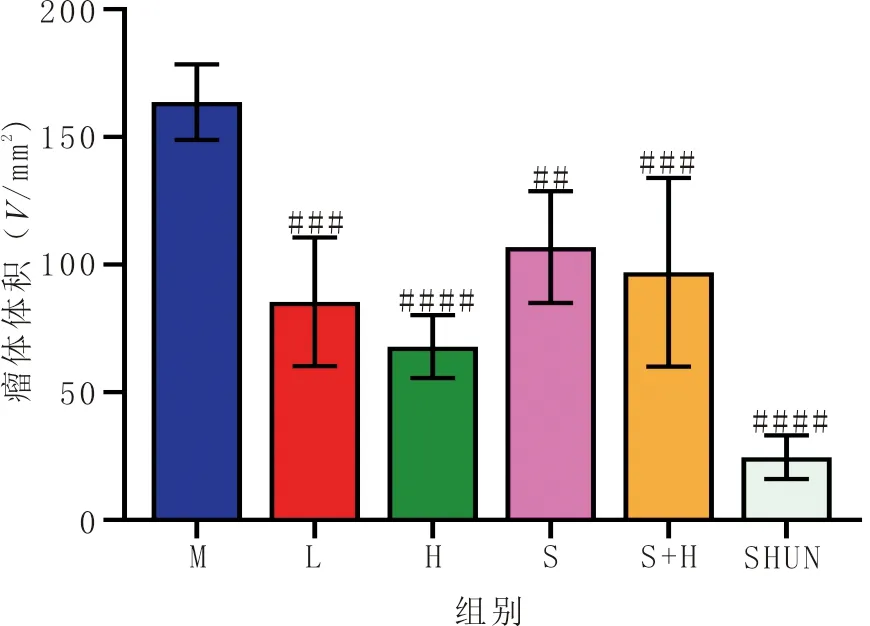
注:M:模型组;L:丹参酮ⅡA低浓度组;H:丹参酮ⅡA高浓度组;S:stattic组;S+H:stattic+丹参酮ⅡA高浓度组;SHUN:顺铂组;与模型组比较,##P<0.01,###P<0.001,####P<0.000 1。图5 各组小鼠移植瘤瘤体大小比较

注:M:模型组;L:丹参酮ⅡA低浓度组;H:丹参酮ⅡA高浓度组;S:stattic组;S+H:stattic+丹参酮ⅡA高浓度组;SHUN:顺铂组。图6 各实验组末次测量瘤体大小示意图
3.7 丹参酮ⅡA、stattic及联合用药对小鼠血清中IL-6水平的影响与空白组比较,模型组IL-6表达水平明显升高(P<0.01);与模型组比较,除丹参酮ⅡA低浓度外,其余各用药组IL-6表达水平显著降低(P<0.05)。见表7。
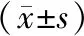
表7 丹参酮ⅡA、stattic及联合用药对小鼠血清中IL-6水平的影响
3.8 丹参酮ⅡA、stattic及联合用药对移植瘤细胞周期、凋亡相关蛋白表达的影响与模型组比较,各给药组STAT3、c-Myc蛋白表达水平显著降低(P<0.05);丹参酮ⅡA低浓度组Caspase-9蛋白表达水平显著升高(P<0.01);丹参酮ⅡA高浓度组、stattic组p-STAT3蛋白表达水平显著降低(P<0.05),Caspase-3、Caspase-9蛋白表达水平显著升高(P<0.05);stattic+丹参酮ⅡA高浓度组p-STAT3蛋白表达水平显著降低(P<0.01)。与stattic组比较,stattic+丹参酮ⅡA高浓度组Caspase-9蛋白表达水平明显升高(P<0.01)。见表8、图7。

注:A:模型组 B:丹参酮ⅡA低浓度组 C:丹参酮ⅡA高浓度组 D:stattic组;E:stattic+丹参酮ⅡA高浓度组。图7 丹参酮ⅡA、stattic及联合用药对移植瘤细胞周期、凋亡相关蛋白表达的影响
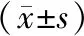
表8 丹参酮ⅡA、stattic及联合用药对移植瘤周期、凋亡相关蛋白表达的影响
3.9 丹参酮ⅡA、stattic及联合用药对移植瘤细胞周期、凋亡相关基因mRNA表达的影响与模型组比较,各给药组STAT3mRNA、c-MycmRNA表达水平显著降低(P<0.05),Caspase-3mRNA表达水平明显升高(P<0.05);除stattic组,其余各组CyclinB1mRNA表达水平明显降低(P<0.05);除丹参酮ⅡA低浓度组外,其余各给药组Caspase-9mRNA表达水平明显升高(P<0.05)。与stattic组比较,联合用药组Caspase-3mRNA、Caspase-9mRNA表达水平显著降低(P<0.05),其余均无统计学差异(P>0.05)。见表9。
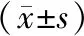
表9 丹参酮ⅡA、stattic及联合用药对移植瘤周期、凋亡相关基因mRNA表达的影响
4 讨论
食管癌的发生和转移是一个复杂的、多步骤的过程[14],其潜在机制尚不清楚。然而,已知食管癌的发展与过度增殖、细胞凋亡减少和运动能力增强有关。STATs主要由转录激活因子和信号转导因子组成,在调控细胞增殖和分化、调控细胞凋亡和血管生成等多种细胞功能中起着重要作用[15]。STAT3作为这个家族的一员,与恶性转化和肿瘤发生密切相关,尽管STAT3在甲状腺肿瘤发生中起着抑制作用,但在许多人类癌症如乳腺癌、胃癌和结肠癌等多种恶性肿瘤中表达异常活跃[16-19],尤其是食管癌[20-21],STAT3可以上调抗凋亡蛋白的表达、调节细胞周期相关基因的表达,促进肿瘤细胞的生存和增殖[22-23]。Myc为STAT3的下游靶标,研究证实STAT3可通过调控c-Myc来抑制肿瘤细胞增殖,促进其凋亡[24]。有研究表明,下调STAT3基因表达能够抑制Bcl-2抗凋亡蛋白、原癌蛋白 c-Myc 的表达,促进食管癌TE-1细胞凋亡,抑制细胞周期蛋白CyclinB1表达使TE-1细胞产生G2/M期阻滞[25]。同时JAK/STAT3 抑制剂可以通过诱导 PARP、Caspase-3、Caspase-9等的裂解导致结肠癌细胞的凋亡[26]。
中药丹参具有活血祛瘀、通经止痛、清心除烦、凉血消痈等功效。丹参酮ⅡA是从传统中药丹参中提取的菲醌类衍生物,可以通过多种机制有效抑制多种肿瘤细胞的增殖,调控其周期,促进肿瘤细胞凋亡[27]。有研究表明,丹参酮ⅡA可通过上调肿瘤细胞内活性氧的表达促进凋亡蛋白Caspase-3的表达和自噬发生[28],并且可通过p53、细胞周期蛋白 B1/ 细胞分裂周期基因2和Caspase-3介导的信号传导通路抑制人鼻咽癌细胞的增殖,诱导其凋亡[29]。此外,丹参酮ⅡA也可以通过抑制β-arrestin1 表达,从而抑制c-Myc和Cyclin D1的表达,进而抑制结直肠癌细胞的转移[30]。
本课题组前期研究发现,丹参酮ⅡA对食管癌Ec109细胞的生长有显著的抑制作用,并随着浓度的升高而升高,且对于Ec109细胞中p-STAT3、STAT3有显著抑制作用,并呈剂量-时间相关性。基于此,本课题组提出假设,丹参酮ⅡA通过抑制STAT3而发挥其抗肿瘤作用。实验选取IC30(2 mg·L-1)、IC50(8 mg·L-1)作为丹参酮ⅡA的低、高浓度,并联合STAT3抑制剂stattic探讨丹参酮ⅡA与stattic联合使用后能否继续发挥其抑癌作用。MTT结果表明,与stattic比较,stattic联合丹参酮ⅡA低、高浓度对细胞的抑制率无明显差别。细胞凋亡检测结果显示,随着丹参酮ⅡA浓度的升高,凋亡率也随之增加,与stattic比较,当stattic与丹参酮ⅡA低、高浓度组联用时,凋亡率无明显差异,表明当抑制STAT3时,丹参酮ⅡA没有发挥其促进肿瘤细胞凋亡的作用。根据细胞周期结果发现,丹参酮ⅡA将Ec109细胞周期明显阻滞在G2期,提示丹参酮ⅡA可能是通过诱导Ec109细胞发生G2/M期阻滞引起细胞凋亡,而stattic则可能是通过诱导G2/M、S期阻滞引起细胞凋亡;与stattic比较,stattic与丹参酮ⅡA联用后,细胞凋亡无显著差异。通过Western Blot实验检测给药后Ec109细胞周期、凋亡相关蛋白水平的变化,结果显示,与模型组比较,丹参酮ⅡA低、高浓度组及stattic组均可以抑制p-STAT3、STAT3、c-Myc及Cyclin B1的蛋白表达,促进凋亡蛋白Caspase-3、Caspase-9的表达,stattic与丹参酮ⅡA联用后,与stattic比较,相关蛋白表达水平均无统计学差异。PCR结果显示,丹参酮ⅡA、stattic均能显著抑制STAT3mRNA、c-MycmRNA、CyclinB1mRNA的表达。丹参酮ⅡA低浓度对Caspase-3mRNA的表达有轻微抑制作用,无统计学差异;而高浓度则显著上调Caspase-3mRNA的表达,这与前面细胞凋亡结果相符合;丹参酮ⅡA低浓度虽然对于STAT3、c-Myc及Cyclin B1的表达有抑制作用,但差异较小,甚至STAT3mRNA表达水平无统计学差异,因此,丹参酮ⅡA低浓度对于凋亡基因Caspase-3作用不明显。而研究发现,Caspase-9mRNA表达水平虽然升高,但并没有随着药物浓度的增加而增加,推测其可能无剂量依赖性。
基于上述体外实验结果,为了更好地证明丹参酮ⅡA是通过抑制STAT3通路诱导细胞发生G2期阻滞,促进肿瘤细胞凋亡,课题组进行了体内验证。将肿瘤鼠分为空白组、模型组、丹参酮ⅡA低浓度组(20 mg·kg-1)、丹参酮ⅡA高浓度组(40 mg·kg-1)、stattic组(25 mg·kg-1)、stattic+丹参酮ⅡA高浓度组、顺铂组(1 mg·kg-1)。结果表明,用药组裸鼠体质量明显轻于空白组,甚至stattic组、stattic+丹参酮ⅡA高浓度组体质量显著下降,单用stattic组裸鼠状态明显急躁、消瘦,甚至出现死亡,而丹参酮ⅡA组与顺铂组则无明显差异,甚至丹参酮ⅡA可以减缓小鼠体质量的下降。stattic与丹参酮ⅡA联用后,裸鼠极度消瘦、急躁状态有所缓解。对于移植瘤的治疗效果,以顺铂最佳,其次是丹参酮ⅡA高浓度组,丹参酮ⅡA低浓度组、stattic与联合用药组次之,且三者无明显差异。IL-6免疫细胞调节因子与炎症、造血,甚至多种肿瘤的进展和细胞凋亡密切相关[31]。小鼠血清IL-6水平测定结果显示,模型组显著促进了小鼠IL-6因子的分泌,而丹参酮ⅡA低、高浓度组和stattic组都显著降低 IL-6 的水平,联合用药组与stattic组比无显著差异。由于顺铂治疗效果佳,移植瘤体积较小,后期蛋白验证结果可能存在误差,因此,只针对顺铂组作血清IL-6水平分析,不进行蛋白与mRNA检测。与模型组比较,丹参酮ⅡA低、高浓度组均可抑制STAT3、p-STAT3、c-Myc、Cyclin B1蛋白及mRNA的表达,促进Caspase-3、Caspase-9蛋白及mRNA的表达。联合用药组与stattic组比较,除Caspase-3、Caspase-9的mRNA及蛋白有明显降低外,其余均无显著差异,考虑可能两药物之间存在拮抗作用,刺激相关因子产生竞争性抑制所致。
综上所述,丹参酮ⅡA可能通过抑制STAT3通路诱导食管癌细胞Ec109发生G2期阻滞,抑制肿瘤细胞的增殖,促进肿瘤细胞凋亡,抑制肿瘤组织的生长。但STAT3调控机制较为复杂,涉及多个信号轴,丹参酮ⅡA抑制STAT3通路以及细胞周期阻滞及凋亡的发生机制都有待进一步深入研究。
