缺氧诱导因子-1α与X染色体连锁凋亡抑制蛋白在人卵巢癌中的表达及意义
2023-11-08肖贵华彭星辰
肖贵华, 彭星辰
(1.四川锦欣西囡妇女儿童医院病理科,四川 成都 610011; 2.四川大学华西医院生物治疗科,四川 成都 610041)
缺氧诱导因子1(hypoxia-inducible factor-1,HIF-1) 在哺乳动物细胞中广泛表达,是缺氧诱导的全局性调控缺氧应答的因子[1,2]。HIF-1属于DNA结合蛋白,是由氧调控性表达的α亚基(HIF-1α)与构成型表达的β亚基(HIF-1β)组成的异源二聚体,α亚基是HIF-1的功能单位, 它的表达和活性决定了HIF-1的生物活性,而HIF-1α的稳定性随氧浓度的变化而变化[3]。X染色体连锁的凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)是新发现的凋亡抑制蛋白家族(inhibitor of apoptosis proteins, IAP)新成员[4],被认为是IAP家族中抑制Caspases最强的因子之一。已经证实,XIAP在正常组织中几乎不表达,而在乳腺癌、结肠癌、膀胱癌和急性白血病等肿瘤中都是高表达,主要是通过抑制Caspase家族活性而发挥抑制凋亡的作用[5]。本研究探讨缺氧诱导因子-1α(HIF-1α)与XIAP的关系,为卵巢癌的早期诊断提供新思路。
【基金项目】中华医学会基金项目(编号:22-482)
【通讯作者】彭星辰
1 材料与方法
1.1 组织标本来自四川锦欣西囡妇女儿童医院病理科2023年1~6月手术切除、临床病理资料完整的石蜡包埋组织。其中:①原发性恶性上皮性卵巢癌组织30例;年龄24~73岁[(49.0 ± 9.2)岁];其中浆液性囊腺癌27例、粘液性囊腺癌3例;2例有淋巴结转移,28例无淋巴结转移;根据国际抗癌协会(UICC)临床分期标准,即TNM分期法,Ⅰ期、Ⅱ期共21例,Ⅲ期、Ⅳ期共9例;②正常卵巢组织10例(来源于卵巢活检、多发性子宫肌瘤或功能性子宫出血、子宫脱垂等病例行全子宫切除,同时行卵巢切除,且病理证实卵巢组织无异常);年龄45~66[(54.9 ± 6.4)岁];③良性卵巢肿瘤10例,全为浆液性囊腺瘤,年龄16~63岁[(49.4 ± 12.9)岁];④交界性卵巢肿瘤10例,其中6例浆液性囊腺瘤,4例粘液性囊腺癌,年龄18~75岁[(49.2 ± 14.2)岁]。所选病例临床、病理资料完整,且患者术前未进行任何放、化疗及其它抗肿瘤治疗,由高年资病理科医师复习阅片后重新制备切片。
1.2 标本及试剂本实验所用细胞为人卵巢浆液性乳头状囊腺癌细胞系SKOV-3,购自中国科学院昆明细胞库。XIAP多克隆抗体购自武汉博士德生物试剂公司即用型;HIF-1α单克隆抗体购自北京中杉金桥试剂公司即用型;Envision试剂盒购自福州迈新生物技术开发有限公司。XIAP、HIF-1α及β-actin引物购自上海捷瑞生物工程有限公司。PCR试剂盒购自赛默飞世尔科技公司。
1.3 方法
1.3.1免疫组化 采用Envision法。标本连续切片,脱蜡、水化,用3%H2O2阻断内源性过氧化物酶活性。在pH9.0的柠檬酸钠缓冲液中高压修复抗原后加 入 已 稀 释 的 一 抗HIF-1α(1∶50)、XIAP(1∶50),4 ℃孵育过夜;加入生物素标 记 的 二 抗,滴加DAB显色剂显色。将阳性的卵巢癌切片作为阳性对照,用PBS代替一抗作为阴性对照。
1.3.2卵巢癌SKOV-3细胞培养 将SKOV-3细胞培养在含10%胎牛血清的RPMI 1640培养液,37 ℃、5%CO2混合空气中。将生长状态良好(细胞长满瓶底80%左右)的细胞放进无氧培养小室里,向小室里灌以1%氧气+5%二氧化碳+94%氮气的混和气体,充气约5分钟,模拟细胞在小室里一个低氧环境,分别将细胞培养瓶在小室里放置12、24、36 h培养,以使癌细胞的HIF-1α基因量随缺氧时间延长而增加;将在以上3个时间段培养的SKOV-3细胞用Trizol法提取,按照试剂说明书正确操作。
1.3.3RT-PCR检测HIF-1α和 XIAP mRNA表达水平 取不同条件下培养的细胞RNA样本,用核酸测定仪对RNA定量分析,采用Trizol法处理SKOV3细胞RNA,并测定RNA浓度。按TaKaRa RNAPCR(AMV) Ver3.0试剂盒说明书进行操作,PCR引物序列HIF-1α(5′-CCCTAACGTGTTATCTGTCGCT-3′,5′-ATGTTCCATTTTTCGCTTTCTCT-3′,112 bp);XIAP(5′-GCTCACCTAACCCCAAGAGAG-3′,5′-AATATTAAGATTCCGGCCCAA-3′,183 bp);β-actin(5′-CCAGGGCGTTATGGTAGGCA-3′, 5′-TTCCATATCGTCCCAGTTGGT-3′,130 bp)。PCR反应条件:95 ℃预变性3min;95 ℃ 30 s; Tm ℃ 30 s; 72 ℃; 1 min/kb;33个循环; 72 ℃终延伸10 min。取PCR产物10 μl进行琼脂糖凝胶电泳后拍照,测量吸光度值,mRNA表达水平以每一样品与β-actin吸光度比值表示。
1.3.4卵巢癌细胞低氧培养 12、24、36 h后检测XIAP mRNA随HIF-1α mRNA的光密度值(MOD)变化。
1.4 结果判定标准在切片中细胞质染成淡黄色至棕黄色为阳性标志,将阳性细胞数和显色强度分为3级:弱阳性(+),阳性细胞数<10%,显色强度为淡黄色或仅个别细胞为黄至棕黄色;强阳性(+++),阳性细胞数>60%,多数细胞为黄至棕黄色;中度阳性(++),阳性细胞数及强度介于前两者之间。
1.5 图像分析每张切片用美国MediaCybe-metics 公司生产的Image-ProPlusz图像分析软件(Version6.0)(IPP6.0)进行图像分析平均光密度值(mean optical density,MOD)。
1.6 统计学方法数据采用SPSS 24.0统计学软件。所有图像分析结果用均数±标准差表示;两组阳性表达率比较采用χ2检验、Fisher确切概率法等;各指标相关性表达用Spearman相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 凋亡抑制因子XIAP在各组织标本中阳性表达率的比较XIAP的阳性信号表达主要见于细胞浆,呈棕黄色(见图1),其在恶性上皮性卵巢癌、交界性卵巢肿瘤及良性卵巢肿瘤中的阳性表达率分别为60%(18/30)、70%(7/10)、20%(2/10);在正常卵巢组织中无表达0%(0/10)。恶性上皮性卵巢癌中XIAP阳性表达率明显高于良性卵巢肿瘤组,差异有统计学意义(χ2=4.900,P=0.028);交界性组XIAP阳性表达率明显高于良性卵巢肿瘤组,差异有统计学意义(χ2=4.798,P=0.028);交界性与恶性组比较,差异无统计学意义(P=0.85)。
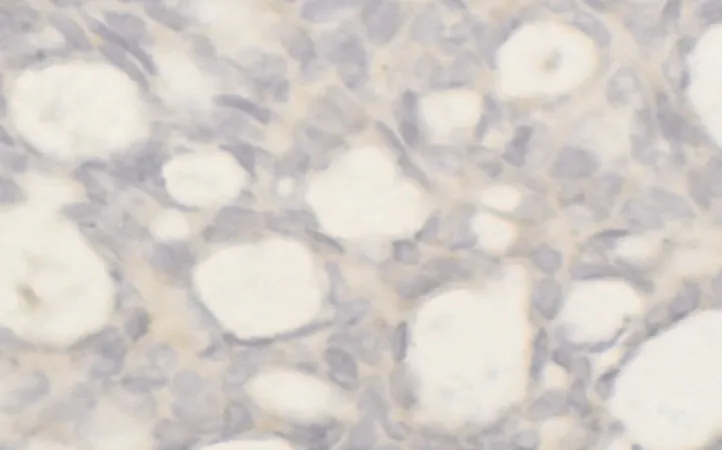
图1 XIAP在人恶性上皮性卵巢癌组织中的阳性表达(EnVision,×400)
2.2 HIF-1α在各实验组中阳性表达率的比较HIF-1α阳性信号定位于细胞浆和(或)细胞核,主要见于细胞浆,呈棕黄色(见图2)。HIF-1α在恶性上皮性卵巢癌、交界性卵巢肿瘤、良性卵巢肿瘤及正常卵巢组织中的阳性表达率分别为60.3%(19/30)、70%(7/10)、20%(2/10)、10%(1/10)。恶性上皮性卵巢癌中HIF-1α阳性表达率明显高于良性卵巢肿瘤组,差异有统计学意义(χ2=4.043,P=0.044);交界性组HIF-1α阳性表达率明显高于良性卵巢肿瘤组,差异有统计学意义(χ2=4.798,P=0.028);交界性与恶性组比较,差异无统计学意义(P=1.000)。
2.3 XIAP与HIF-1α在不同临床病理特征的上皮性卵巢癌组织中的表达临床分期越晚(Ⅲ期+Ⅳ期)组XIAP蛋白的表达水平明显高于临床分期早期(Ⅰ期+Ⅱ期)组(P=0.007);XIAP蛋白表达水平与患者年龄、病理分型及淋巴结转移无关(P>0.05)。见表1。
2.4 恶性上皮性卵巢癌组织中XIAP与HIF-1α表达的相关性在30例恶性上皮性卵巢癌组织中XIAP蛋白与HIF-1α蛋白的阳性表达率呈正相关(r=0.359,P=0.035)。
2.5 卵巢癌细胞低氧培养12、24、36 h后XIAP mRNA及HIF-1α mRNA的MOD变化低氧24 h时,SKOV3细胞系中HIF-1αmRNA表达量达高峰,36 h时HIF-1αmRNA表达量有所回落。见图3。
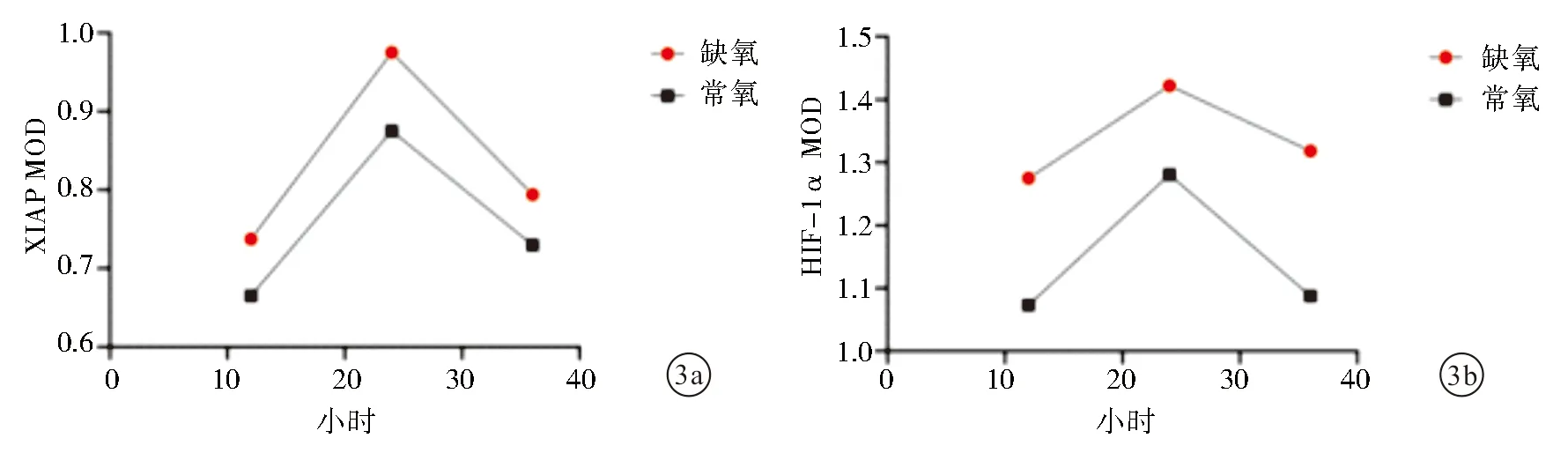
图3 卵巢癌细胞缺氧培养12、24、36 h后XIAP mRNA及HIF-1α mRNA的MOD值 a:XIAP mRNA;b:HIF-1α mRNA
2.6 缺氧组12、24、36 h,XIAP mRNA与HIF-1α mRNA相关性分析随缺氧时间的变化,XIAP mRNA与HIF-1α mRNA呈正相关(P<0.01)。见表2。

表2 低氧12、24、36 h,XIAP mRNA与HIF-1α mRNA相关性分析
3 讨论
卵巢癌占女性卵巢恶性肿瘤的90%,是妇科恶性肿瘤中死亡率最高的,近年来发病率呈明显上升趋势。大量研究表明,肿瘤细胞的异常增殖、浸润及其恶性转化与细胞凋亡调控紊乱有密切联系。近年来对肿瘤治疗的研究热点已转移到检测抗凋亡因子所致的凋亡受阻在肿瘤发生、发展中的作用,进一步探讨阻断肿瘤浸润、转移的新方法。
XIAP是新发现的IAP新成员,被认为是IAP家族中抑制Caspases最强的因子之一,是作用最强的内源性凋亡抑制蛋白[6,7]。XIAP在正常组织中几乎不表达,而在多种恶性肿瘤中其表达明显升高,已经证实在乳腺癌、结肠癌、膀胱癌和急性白血病等肿瘤中XIAP都是高表达,这是导致肿瘤细胞凋亡下降、预后差的重要原因。国内外研究证实XIAP的高表达与多种肿瘤的耐药性相关,下调其表达可促进肿瘤细胞的凋亡,增强癌细胞对化疗药物的敏感性[8~10]。本研究结果发现, XIAP在正常卵巢组织中无阳性表达,而在良性卵巢肿瘤、交界性卵巢肿瘤和恶性上皮性卵巢癌中的阳性表达率逐渐升高(P<0.01)。XIAP在恶性上皮性卵巢癌中的表达明显高于良性,提示XIAP有可能成为诊断卵巢上皮肿瘤的一个有价值的标记物。多数学者均认为 XIAP、HIF-1α与肿瘤组织病理分型、患者年龄以及淋巴结转移无相关性,而与肿瘤的临床分期相关[11]。表明XIAP、HIF-1α是高度侵袭性疾病的生物标志,更加证实XIAP、HIF-1α蛋白在卵巢癌发生的不同阶段的表达逐渐增高,提示预后不良。本研究结果显示:临床分期晚期(Ⅲ期和Ⅳ期)组的XIAP和HIF-1α的蛋白表达水平明显高于临床分期早期(Ⅰ期和Ⅱ期)组(P<0.05)。同时在上皮性卵巢癌中患者的年龄及有无淋巴结的转移中发现,上皮性卵巢癌与患者的年龄、淋巴结的转移无关(P>0.05)。进一步说明了二者高表达与肿瘤的发生发展密切相关。
HIF-1在哺乳动物细胞中广泛表达,是缺氧诱导的全局性调控缺氧应答的因子。HIF-1属于DNA结合蛋白,是由氧调控性表达的α亚基(HIF-1α)与构成型表达的β亚基(HIF-1β)组成的异源二聚体,α亚基是HIF-1的功能单位, 它的表达和活性决定了HIF-1的生物活性,而HIF-1α的稳定性随氧浓度的变化而变化。受到HIF-1调控的HRG称为HIF-1的靶基因。缺氧时,活化的HIF-1与其靶基因结合,并促进靶基因表达。这些表达产物在肿瘤新生血管的形成、肿瘤代谢和肿瘤的转移等方面发挥着重要作用[12]。研究者用免疫组化方法检测19种类型的人实质性肿瘤,发现其中有13种过表达HIF-1α,而且90%的肾癌、前列腺癌、肺癌及结肠癌组织中HIF-1α高表达[13]。另有研究显示,在乳腺纤维腺瘤、子宫平滑肌瘤等良性肿瘤中无HIF-1α表达。可见HIF-1α的表达与肿瘤原发性、良恶性以及转移性有密切关系。在本研究中我们用免疫组化技术检测卵巢上皮性肿瘤组织中HIF-1α蛋白的表达情况,发现HIF-1α在细胞核和细胞浆都有表达,但主要表达于细胞浆。在恶性卵巢癌组HIF-1α的阳性表达率为60.3%,交界性肿瘤组阳性表达率为70%,良性肿瘤组为20%,组间比较差异有统计学意义。
大量研究表明,PI3K活化以后促进下游Akt磷酸化,然后促进下游靶蛋白GSK-3磷酸化,抑制HIF-1α降解,使得HIF-1α表达增加[14~17]。Akt还可通过激活下游mTOR基因的表达促进HIF-1α基因的转录[18]。IAPs家族中XIAP是最强有力的Caspase抑制物。XIAP有3个BIR结构域(BIR-1, -2, -3),BIR-2与BIR-1和BIR-2之间的连接区参与抑制caspase-3,-7的活性。单独的BIR-3结构域即可抑制caspase-9,且其自身RING指结构域具有泛素连接酶活性,自身可被泛素化而降解[19]。Zhou等[20]研究还发现,XIAP的Ser87位点可被Akt磷酸化,磷酸化后的XIAP可保护其免于泛素化和降解,且Akt还可抑制XIAP的自动泛素化,增强其稳定性和在细胞内的水平,改善细胞生存,发挥抑制凋亡的作用。XIAP是Akt的新下游信号传递者,它在Akt的凋亡抑制作用中发挥重要作用。失去Akt磷酸化位点的突变XIAP在细胞中被迅速降解, 细胞凋亡加速。由此可见PI3K/Akt信号通路对于HIF-1α和XIAP介导的卵巢肿瘤的发生、发展关系密切,临床可通过干预PI3K/Akt信号通路治疗卵巢癌,这将成为卵巢癌治疗的新靶点。
