多发性硬化与脑小血管病的脑白质高信号特征的差异比较
2023-11-08董芳宇吴权宏张再强李少武
董芳宇,吴权宏,张再强,李少武,付 莹
(1.福建医科大学附属第一医院神经内科,福建 福州 350005;2.天津市津南区小站镇卫生院,天津 300000;3.首都医科大学附属北京天坛医院神经内科,北京 100050;4.北京神经外科研究所神经影像科,北京 100050)
与多发性硬化症相关的局灶性炎性脱髓鞘病变和脑小血管病的缺血性脱髓鞘病变可在T2图像和磁共振系列图像上引起类似的白质高信号[1]。虽然多发性硬化主要影响静脉和小静脉,而脑小血管病主要影响小动脉[2~4],但在某些情况下,很难准确诊断多发性硬化或脑小血管病[5~7]。慢性炎症、年龄和血管危险因素等可导致包括小动脉在内的微血管系统损伤,导致低灌注和组织缺氧,这有助于多发性硬化相关病理的范围和分布[8]。毫无疑问,这种血管损伤的病理机制增加了阻碍MRI 区分多发性硬化和脑小血管病的混杂因素的数量,特别是在伴有血管危险因素的中老年患者[9~11]。此外,血管并发症已被证明会促进多发性硬化的进展,降低预期寿命,并增加白质高信号区病变和脑萎缩的负荷,所有这些都表明多发性硬化病理与血管损伤之间有重要的关系[12,13]。因此,针对微血管系统的药物可能不仅对脑小血管病患者有益,对多发性硬化患者也有益[14,15]。由于炎症所致脱髓鞘与缺血所致脱髓鞘的影像学特征尚不清楚,可供患者选择的治疗方案可能有限。本研究试图确定无高血压的年轻多发性硬化患者和症状性脑小血管病患者在白质高信号的分布模式、病变形态或受累具体解剖结构的差异。此外,我们研究了是否可以建立特定的放射学标准来更可靠地分类个别病例。
1 资料与方法
1.1 一般资料本前瞻性横断面研究经北京天坛医院伦理委员会批准,并获得患者的知情同意书,所有患者都是2013~2017年在北京天坛医院连续住院的患者中招募的。被纳入的多发性硬化患者符合2010 McDonald临床标准,年龄18~45岁,缺乏AQP4抗体,无高血压病史[16]。症状性脑小血管病被定义为有既往临床腔隙综合征或头痛或认知损伤,并具有四种影像学特征之一(腔隙、白质疏松、血管周围间隙增大和微出血)[17,18]。记录以下血管危险因素:年龄,性别,糖尿病,酒精,吸烟现状,高胆固醇血症。排除可能有心源性栓塞(房颤或瓣膜假体)或同侧颈动脉狭窄≥50%的脑小血管病或多发性硬化患者。最后的多发性硬化或症状性脑小血管病诊断是在神经免疫和中风专家小组回顾所有临床和调查信息后,基于临床和放射学发现的[19,20]。
1.2 方法
1.2.1神经影像学的获取与分析 所有患者经过有32通道头线圈的3.0-T扫描仪(Magnetom Trio Tim;西门子) 的脑部磁共振检查.序列包括轴向弥散加权成像(DWI)、T2、FLAIR、磁敏感加权成像(SWI)和矢状 t1加权序列(见表 1)。所有MRIs均评估病变的存在、位置和大小[白质高信号区、血管周围空间(PVS)、腔隙、微出血]是根据两名有经验的神经放射学家所推荐的《神经影像学血管变化报告标准》(STRIVE)[21]。放射科医生对任何临床资料都不知情。白质高信号区(100次扫描)的组内相关系数为0.94, PVS为0.85,腔隙为 0.90,微出血为 0.82。根据个体影像学特征计算SVD总分(0~4分),评分如下:1分为腔隙,1分为微出血,1分为基底节区中至重度PVS, 1分为白质高信号区(深层组织:Fazekas 评分2或3分和/或脑室周围:Fazekas评分3分)[22]。
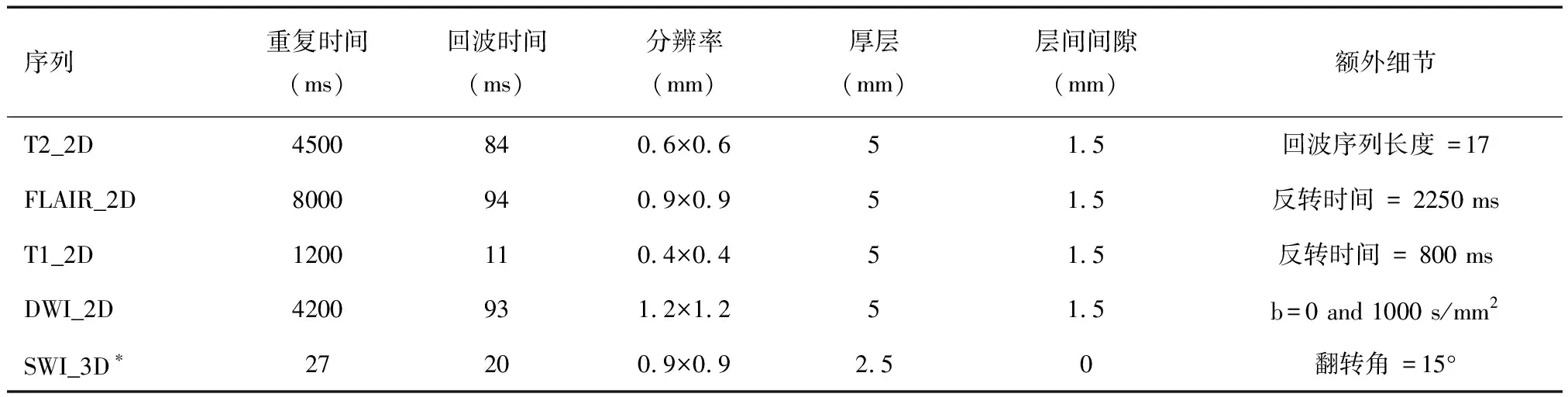
表1 磁共振成像方案
1.2.2白质高信号区在多发性硬化和脑小血管病中的病变负荷及分布特征 根据T2图像手工勾画单个白质病变掩膜,全白质高信号区损伤,脑室周围白质高信号区病变(距离脑室3 mm以内)、皮质旁白质高信号区病变(距离皮层3 mm以内)、皮质下白质高信号区病变(位于幕上白质但不在皮质旁和室周白质内)、幕下白质高信号区病变(位于脑干或小脑内)[23],和分水岭白质高信号区病变被计算为掩模内的体积或数量[24,25]。这些计算是由两位经验丰富的且对临床细节不知情的神经放射学家(S.W.L.和W.H.)进行的,使用MRIcro 软件(http://www.cabiatl.com/mricro/ MRIcro /)计算。然后我们应用年龄相关白质变化(ARWMC)评定量表对白质高信号区分布进行半定量估计[26]。最后,利用FMRIB工具库(University of Oxford, UK)对病灶概率图进行分析。T2图像采用蒙特利尔神经学研究所(MNI) 2 mm标准空间模板,采用非线性变换方法[FNIRT (FMRIB的非线性图像配准工具)]进行配准。然后将非线性变换矩阵应用于相应的病灶分割掩模,将这些掩模转换为标准模板空间。转化后,病灶掩模阈值为50%,再次二值化,以避免三线性插值的体积增加。然后对每个受试者组的掩膜进行求和和平均,以创建病变概率图。使用非参数排列检验工具Randomise进行病变分布的组水平比较,并进行基于聚类的阈值处理和多重比较校正[27]。
1.2.3多发性硬化或脑小血管病的典型病变 预测记录了白质高信号区病变的特征。Barkhof标准的多发性硬化病变空间传播仅适用于脑无增强扫描[28]。这些标准是:a.T2加权图像上至少有9个病灶;b.至少3个脑室周围病变;c.至少1个皮层旁病变;d.至少1个幕下病变。4个标准中的出现3个即为阳性。队列扫描还检查了病变的形态或位置,以预测多发性硬化或脑小血管病 (多发性硬化: u -纤维,Dawson’s 手指,颞叶,胼胝体,脑干和小脑脚的软脑膜表面;脑小血管病:丘脑、脑干中央横纤维、皮层下多点、基底节区周围、皮质下后斑、皮质下前斑)[29]。计算Barkhof标准和典型病灶鉴别多发性硬化与脑小血管病的敏感性和特异性,建立了个体病例分型的影像学标准。
1.3 统计学方法应用SPSS 17.0统计学软件进行数据分析。符合正态分布的计量资料以均数±标准差表示,比较采用t检验;不符合正态分布的数据以中位数(四分位数范围)表示,比较采用Mann-WhitneyU检验;计数资料以例数(%)表示,比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 患者临床特征最终队列包括72例多发性硬化患者(70例复发缓解型多发性硬化, 2例继发性进展型多发性硬化, 81%的患者OB阳性)和88例脑小血管病(70 例动脉硬化,2例遗传CAA, 13例CADASIL, 3例炎症介导型;SVD总评分中位数为3)。人口学、临床和影像学特征见表2。多发性硬化患者更年轻,男性和血管危险因素的比例均更低。在病程相似的情况下,校正后的年龄和性别的多发性硬化患者有更多的发病次数和更高的残疾水平(P<0.05)。

表2 MS和 CSVD患者的人口学和临床特征比较
2.2 白质高信号区在多发性硬化和脑小血管病中的负担及分布特征白质高信号区病变定义为T2上高强度和FLAIR上无空化,在图1中,对多发性硬化和脑小血管病患者的T2影像上的白质高信号区病变进行了分析。比较了病变的总体积、数量和大小。每个框内的水平线表示中间值,框的顶部和底部表示四分位数范围。错误条表示5%到95%的范围。白质高信号区负担负荷在多发性硬化患者中较低(总病变数:28 vs 39;病变总体积:8.5 vs. 21.8 ml;平均病变大小:0.4 vs. 0.5 ml;多发性硬化和脑小血管病患者弥散在皮质旁(JC)、皮质下(SC)、室周(PV)和幕下(IT)区的白质高信号区病变数量如图1b所示,通过卡方检验比较了在不同脑区域中的白质高信号区病变数量,结果用概率表示。在图1c部分,研究了分水岭内白质高信号区病变的分布数量,根据不同的分水岭区域进行了分类。白质高信号区病变(100次扫描)的评价者间一致性:κ值= 0.85;次区域数量的评估者间一致性(20例患者):近皮质区,κ值= 0.71;皮质下,κ值= 0.88;脑室周围,κ值= 0.74;幕下,κ值= 0.80;分水岭,κ值= 0.66。多发性硬化患者在皮质旁(JC)和室周(PV)区病变的百分比较高,在皮质下(SC)和分水岭区病变的百分比较低(JC: 12% vs.5%;PV: 42%对16%;SC: 42% vs. 78%;分水岭:27% vs. 36%)

图1 白质高信号病变负荷及其亚区分布 a: T2上白质高信号区病变负荷;b:弥散在皮质旁(JC)、皮质下(SC)、室周(PV)和幕下(IT)区的白质高信号区病变数量;c:分水岭范围内白质高信号区病变分布数量
ARWMC的视觉评分显示两种疾病的白质高信号区分布有差异。额叶和基底节区多发性硬化得分较低,颞叶区多发性硬化得分较高(额叶:2.4 vs. 3.5;基底神经节0.4 vs. 3.2;颞叶:1.6 vs. 0.6)。我们使用了半定量的ARWMC评定量表来评估多发性硬化和脑小血管病患者T2影像上白质高信号区病变的严重程度和分布。根据评定结果,与脑小血管病患者相比,多发性硬化患者在颞叶的病变较重,在额叶和基底节区的病变较轻。在图2中,大黄色框表示颞区,小黄色框表示额区,黄色椭圆表示基底节区。ARWMC评分的评估者间一致性(20例患者):额叶,κ值= 0.82;顶枕区,κ值= 0.85;颞叶,κ值= 0.72;小脑幕下,κ值= 0.70;基底神经节,κ值= 0.73。

图2 用视觉评定量表评估白质高信号区病变分布 a: T2影像上白质高信号区病变的严重程度;b: T2影像上白质高信号区病变的分布
多发性硬化和脑小血管病患者组病变概率分布分别见图3a。72例多发性硬化患者的病变概率分布:颜色刻度(0%~20%)代表病变在特定空间位置发生的最小到最大的概率。MNI 标准空间模板Z坐标以毫米表示)和图3b。88例脑小血管病患者的病变概率分布:颜色刻度(从0%~40%)代表病变在特定空间位置发生的最小到最大的概率。多发性硬化症患者多数病灶体积小、数量少。在多发性硬化症和脑小血管病患者中,病变在整个大脑的分布是广泛变化的,但在多发性硬化症患者中更为突出。多发性硬化组病变发生概率最高的区域为枕部和颞部脑室周围白质,概率为20%。对于脑小血管病患者,有40%的概率在额叶出现皮质下白质。图3c是一幅减法图,将平均脑小血管病病变图减去平均多发性硬化病变图,以便直接比较病变分布; 黄色至红色表示多发性硬化病变比脑小血管病病变更可能发生的位置,浅黄色到蓝色代表脑小血管病病变比多发性硬化病变更可能发生的位置。值得注意的是,多发性硬化组的显著特征包括在皮质旁和脑室周围区域有更多的病变。图3d显示了各组病变分布的体素排列检验对比,其显示脑小血管病病变明显比多发性硬化病变更容易出现在额叶皮层下区,如图黄色所示(P<0.05)。脑小血管病病变较多发性硬化病变更容易位于额皮质下区(P<0.05)。

图3 使用自动化基于像素的病变概率图评估白质高信号区分布 a:多发性硬化患者的病变概率分布;b:脑小血管病患者的病变概率分布;c:从平均脑小血管病图中减去平均多发性硬化病变图的减法图;d:病变概率图的体素比较
2.3 Barkhof标准和典型病变预测多发性硬化或脑小血管病的患病率76%的多发性硬化患者和66%的脑小血管病患者(P=0.166),其中仅基于未增强的脑部MRI,符合多发性硬化病灶在空间中播散的Barkhof标准。但两种疾病在病变的具体形态和部位上有重要差异,Dawson’s 手指形态病变、颞叶病变、脑干软膜表面(BS_软膜表面)病变、小脑脚病变是典型的多发性硬化病变,在鉴别多发性硬化与脑小血管病时更为敏感和特异(Dawson’s 手指:敏感性71%,特异性68%;颞叶:敏感性50%,特异性90%;BS_凝胶表面:灵敏度13%,特异性100%;小脑脚:敏感性36%,特异性97%)。此外,丘脑病变、脑干中央横纤维病变(BS_中央横纤维)、基底节区周围病变和腔隙,这些是典型的脑小血管病病变,在区分多发性硬化和脑小血管病时也更敏感和特异(丘脑非病变:94%的敏感性,49%的特异性;无BS_中心横纤维病变:敏感性99%,特异性35%;基底节区周围无病变:敏感性99%,特异性25%;无腔隙:灵敏性86%,特异性78%)。此外,联合使用典型的多发性硬化病变(联合标志- I:至少1个Dawson’s 指病变,或颞叶病变或脑干病变或小脑脚病变)可识别多发性硬化患者,敏感性83%,特异性66%。联合使用典型的脑小血管病病变(联合标记- II:丘脑无病变、脑干中央横纤维无病变、基底节区周围无病变或陷窝)识别多发性硬化患者的敏感性81%,特异性64%。结合典型的多发性硬化病变与典型的脑小血管病典型病变(联合标记-III: 联合标记-I 和II)作为本患者队列中区分多发性硬化与脑小血管病的标准,敏感性64%,特异性99%,一致性率83%。
3 讨论
脑小血管病常被误诊为多发性硬化,因为其临床表现及T2图像上白质高信号区病变的类型和多发性硬化有很大重叠。然而,及时和可靠的诊断对于适当的治疗方法至关重要。例如,脑小血管病需要微血管治疗,而多发性硬化需要长期的免疫调节治疗。因此,有必要提供可靠的诊断参数,以便早期鉴别脑小血管病和多发性硬化。本研究发现,多发性硬化白质高信号区病变体积较小,数量较少,且多出现在脑室周围和皮质旁的白质,尤其是枕骨和颞叶区域。而脑小血管病白质高信号区病灶体积较大,数量较多,多见于皮质下白质,尤其是额叶和基底节区。本研究中,仅使用无增强脑扫描,Barkhof标准无法区分多发性硬化和脑小血管病,但典型的多发性硬化病变(Dawson’s 指、颞叶、脑干软膜表面、小脑脚)和典型的脑小血管病病变(丘脑、脑干中央横纤维病变、基底神经节周围和腔隙)对多发性硬化和脑小血管病的鉴别更加具有特异性和敏感性。建议将典型的多发性硬化病变与典型的脑小血管病病变(联合标记-III)作为放射学标准,区分血管危险因素较低的多发性硬化患者与脑小血管病患者(敏感性64%,特异性99%,一致性率83%),结合典型的多发性硬化病变(联合标记-I)作为放射学标准区分多发性硬化患者与高血管危险因素的脑小血管病患者。
血管危险因素最近被认为与多发性硬化的快速进展有关[12,13,30]。由于很少有研究探讨血管危险因素对多发性硬化成像的影响,导致这一现象的病理生理机制尚不清楚。靶向免疫调节和神经血管系统的治疗药物可能对双重病理的患者有益,因为它们对炎症和血管病理均有作用[14,15]。然而,在老年多发性硬化症患者中区分血管性脑病变和炎症性脑病变是一项具有挑战性的工作,因此,可能会限制治疗多发性硬化症的治疗选择。为了解决这一问题并减少多发性硬化患者血管危险因素中可能剩余的混杂变量,只纳入了没有高血压的年轻多发性硬化患者(小于45岁)。将少有血管危险因素的年轻多发性硬化患者与典型的脑小血管病患者进行了比较。基于三种方法(分区域病变描述、半定量视觉评分量表和自动像素定量),发现额基神经节区域皮层下病变可能与血管效应相关,可作为多发性硬化患者血管病变监测的潜在指标。多发性硬化患者的丘脑病变或脑干病变或基底节区周围病变或腔隙的出现也支持血管因素可能参与了疾病的病理生理过程。
多发性硬化和脑小血管病中病变分布的差异可能反映了导致这些病变发生发展的不同的病理生理机制。在人类中,大脑白质的血液供应几乎完全由髓动脉提供。这些动脉又长又细,特别是在额叶,与脑膜动脉成直角,垂直穿过皮层,进入脑白质,到达室旁区域。这些动脉末端区域形成特别容易发生由于脑血流变化引起的缺血性损伤的分水岭区域。与普遍的看法相反,在深部白质动脉的末端之间存在着脑室周围动脉的吻合。此外,近皮质u -纤维区白质束由更短的动脉供应,包括皮质下动脉和髓动脉的短侧支[31]。本研究在脑小血管病患者中观察到与皮质接触的皮质旁区和与脑室接触的室周区保留白质高信号区病变(图 1,3),这些病变由吻合动脉或更短的动脉供应,也符合这一机制。相比之下,本研究中脑小血管病患者的额叶作为特别容易发生缺血性损伤的区域,白质高信号区损伤负荷明显(图3),这进一步支持了脑低灌注机制,长穿通动脉介导灌注,灌注压最低,更容易发生缺血性损伤。
Binswanger 病患者髓质动脉管壁直径的形态测量分析显示大叶性差异;主要作用在额叶动脉,最少的作用在颞叶动脉[32]。本研究成像结果支持这一观察。脑小血管病患者颞叶白质病变评分较低,额叶白质病变评分较高(图 2、3)。而在脑小血管病中有8例出现颞叶白质高信号区病变,均为CADASIL。本研究中62%的CADASIL患者存在颞叶白质高信号区病变,这与其他研究发现CADASIL患者颞叶白质病变负荷更高的结果一致[33]。多发性硬化与CADASIL患者颞叶白质高信号区病变相似,更容易误诊。临床特征或基因检测可能有助于区分这两种情况,这需要在未来进行验证。
本研究的局限性:由于横断面研究设计,结果可能被高估。因此,在我们的放射学标准下,高血管危险因素的老年多发性硬化患者是否更不容易被误诊为脑小血管病,以及监测多发性硬化患者血管病变的指标是否可行,尚不清楚。这需要在一项针对多发性硬化和脑小血管病患者的纵向研究中进行确定和验证。
本研究确定了具有罕见血管危险因素的年轻多发性硬化患者与有症状的脑小血管病患者在白质高信号区特征上的差异。通过分区病变描述、视觉评定量表和参数映射组分析,确定症状性脑小血管病的皮质下白质,特别是额叶和基底神经节区域的高信号强度。相比之下,多发性硬化患者在皮质和脑室周围白质区有更多的病变,主要在颞枕叶。此外,典型病变(Dawson’s fingers、颞叶、脑干软脑膜表面、小脑脚)对多发性硬化和其他典型病变(丘脑、脑干中央横纤维、基底节周围和腔隙)对脑小血管病的诊断也有明显的敏感性和特异性。这些发现提高了鉴别多发性硬化和脑小血管病的能力。更重要的是,我们提供的证据可以根据病变的位置和典型病变的存在,对血管脱髓鞘病变和炎性脱髓鞘病变进行更大的区分。
