DCE-MRI与DWI在乳腺癌诊断中的应用及预后评估价值
2023-11-06张智翔李天云董军强魏梦绮
崔 博,张智翔,解 非,李天云,董军强,魏梦绮
(空军军医大学第一附属医院放射诊断科,陕西 西安 710032)
乳腺癌发病率占据全身恶性肿瘤的4%,是一种发生在乳腺上皮组织的恶性肿瘤[1],虽然早期特征有乳头凹陷和溢乳、皮肤水肿、乳腺肿块,但均较为隐匿,不易被察觉,故大部分女性确诊是均已处于中晚期,需接受手术、放化疗干预[2]。通过一系列治疗虽能够缩小病灶,尽可能保留乳腺完整性,但晚期乳腺癌患者体内已出现癌细胞扩散,风险性较大,预后不佳,故需早期诊断、发现、治疗,对预后改善具有重要意义[3]。目前诊断乳腺癌影像方式较多,包括磁共振(magnetic resonance imaging,MRI)、X线摄影、超声,其中MRI因组织分辨率高、准确率高等特点成为首选方式,且随着磁共振扫描仪发展和多技术的运用,弥散加权成像(diffusion weighted imaging,DWI)、动态增强成像(dynamic contrast enhanced-MRI,DCE-MRI)逐渐推广于临床,其中DCE-MRI能够通过评估对比剂在组织和毛细血管间隙中动态信息,获取局部血流动力学特征,从而判定疾病类型,具有一定诊断效能[4];DWI是借助水分子不规则布朗运动而成像,通过反映水分子弥散情况,判定良恶性病变情况[5]。DWI、DCE-MRI均具有各自诊断优势,为了进一步探索科学、有效的诊断技术,本研究比较了DWI、DCE-MRI在乳腺良恶性分辨中诊断价值和预后评估效能。现报告如下。
1 资料与方法
1.1一般资料 回顾性分析在2017年2月—2022年2月我院收治的乳腺肿块患者80例的基本资料。患者均为已婚女性,年龄38~67岁,平均(51.32±4.33)岁,体重48~78 kg,平均(62.34±4.74)kg。纳入标准:①均因乳腺肿块就诊,且部分伴有乳头溢液、局部疼痛、乳头内陷等症状;②首次发病,无癌症病史;③均无手术、化疗禁忌证;④临床资料齐全。排除标准:①依从性差或精神疾病史者;②合并其他恶性肿瘤者;③佩戴心脏起搏器者;④对比剂过敏者。
本研究经医学伦理委员会批准通过,且符合《赫尔辛基宣言》。
1.2检查方法
1.2.1DCE-MRI检查 使用3.0T超导型磁共振扫描仪(Philips Achieva)及乳腺多通道专用采集相控阵线圈。检查时,保持俯卧位,双侧乳腺垂直于2个线圈凹槽处,定位后,先自旋回波T1WI,回波时间(echedelay time,TE) 2 ms,重复时间(repetition time,TR) 5 ms及脂肪抑制序列T2WI,TE 60 ms,TR 5 000 ms。扫描层面50,层间距3 mm,层厚3 mm,矩阵324×265,FOV 340 mm×340 mm×150 mm。随后行动态增强扫描,经肘静脉注射钆喷酸葡甲胺注射液,注射速率2.0 mL/s,剂量0.2 mmol/kg,注射完毕后10 s,无间隔时间扫描,共分为9组扫描,每组49 s,层间距1.5 mm,层厚3 mm。
1.2.2DWI检查 在使用磁共振扫描时,需使用单次激发回波平面成像序列,b值扩散敏感系数选择800 s/mm2;层间距3 mm,层厚3 mm,矩阵136×136,FOV 340 mm×340 mm×150 mm,TE 50 ms,TR 7 803 ms。
1.2.3图像处理和分析 所有图像由2名高年资诊断医师采用双盲分析。①DCE-MRI分析:记录早期强化率=[(SI1-SI0)/SI0]×100%;SI0为病灶增强前信号强度;SI1为注药后90 s内信号强度增加最大值。绘制时间-信号强度曲线(time-signal intensity curve,TIC):避开出血、钙化、坏死等区域,在肿块实质区内选择感兴趣区域(region of interest,ROI),使用mean cuive强化曲线,将TIC分为三型[6],Ⅲ型:流出型,增强信号强度达到峰值后迅速降低;Ⅱ型:平台型,信号强度快速达到高峰后,呈高水平维持;Ⅰ型:流入型,信号强度虽时间延长而增强。②DWI:b=800 s/mm2时,在表观弥散系数(apparent diffusion coefficient,ADC)图上手动确定ROI,连续测量3次,取平均值。
1.3治疗方法和预后评估 对于确诊的乳腺癌64例患者,需在行改良根治手术前给予EC-T化疗方案治疗,具体措施:第1天静脉注射75 mg/m2表柔比星(H20030260,北京康万佳医药)+600 mg/m2环磷酰胺(H32020857,江苏恒瑞医药)+35 mg/m2多西他赛(H20093092,浙江海正药业),21 d为1个疗程,期间注意给予营养支持、护肝、护胃、止吐等综合治疗。
并在治疗完成后,通过电话、来院复查、上门拜访等形式随访3年,以患者是否存活为最终研究终点,分为预后不良组(死亡/病情进展,n=6)和预后良好组(生存/无进展,n=58)。
1.4统计学方法 应用SPSS 20.0统计软件处理数据。计量资料比较采用t检验,计数资料比较采用χ2检验,等级资料比较采用秩和检验。DCE-MRI、DWI、两项联合分别与临床最终诊断结果的一致性采用Kappa检验,绘制受试者工作特征曲线(receiver operating characteristic curve,ROC)曲线分析各项诊断指标的效能。P<0.05为差异有统计学意义。
2 结 果
2.1各项诊断模式与病理检查对照比较 80例乳腺肿块患者,经病理检查确诊,恶性肿块64例,其中浸润性导管癌25例,浸润性小叶癌26例,髓样癌13例;良性肿块16例,其中导管内乳头瘤6例,纤维瘤10例。与病理检查结果比较,DCE-MRI诊断准确率为70.00%(56/80),一致性较低(Kappa=0.211,P=0.051);DWI诊断准确率为81.25%(65/80),一致性一般(Kappa=0.476,P<0.001);两项联合诊断准确率为96.25%(77/80),一致性较好(Kappa=0.885,P<0.001)。DWI的诊断准确率高于DCE-MRI(χ2=32.661,P=0.001),两项联合的诊断准确率高于DCE-MRI和DWI(χ2=40.129,34.247,P<0.001)。见表1。
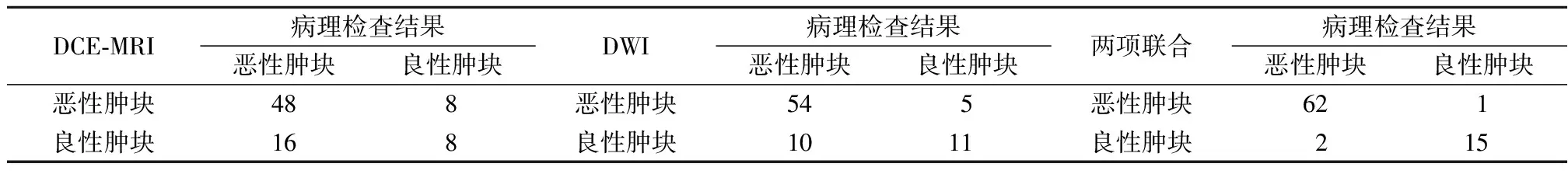
表1 不同诊断模式与临床最终诊断结果比较
2.2良恶性肿块DCE-MRI、DWI特征比较 恶性肿块早期强化率高于良性肿块,ADC值低于良性肿块,恶性肿块TIC类型以Ⅱ型、Ⅲ型为主;良性肿块TIC类型以Ⅰ型、Ⅱ型为主,差异有统计学意义(P<0.05)。见表2。

表2 良恶性肿块强化率、TIC类型、ADC值比较
2.3分析各项诊断方式预测效能 绘制ROC曲线,DCE-MRI、DWI、两项联合诊断乳腺恶性肿块的AUC分别为0.625、0.766、0.953。两项联合诊断乳腺恶性肿块的效能优于DCE-MRI、DWI(Z=3.646、2.285,P<0.001)。见表3,图1。

图1 DCE-MRI、DWI、两项联合分辨乳腺良恶性肿块ROC曲线
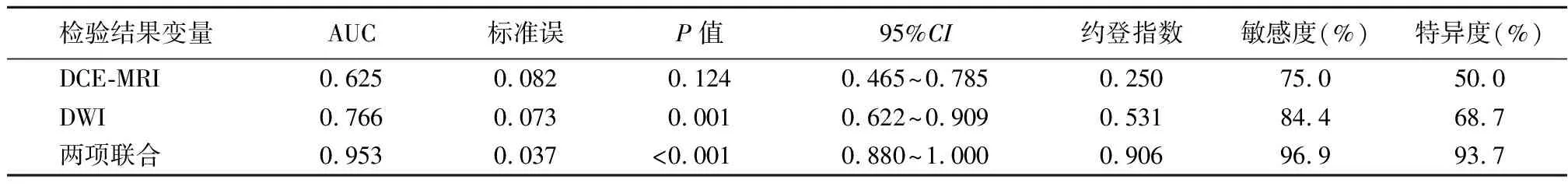
表3 各项诊断方式分辨乳腺良恶性肿块效能
2.4比较不同预后情况患者ADC值、强化率 治疗前MIP图:左乳2点钟不规则肿块,大小约3.2 cm×3.0 cm×2.3 cm;新辅助化疗后MIP图:左乳2点钟不规则肿块,大小约1.0 cm×0.8 cm×0.7 cm,肿块较治疗前明显缩小(图2)。新辅助化疗前动态增强早期减影图:左乳2点钟不规则肿块,早期明显快速强化;新辅助化疗后动态增强早期减影图:左乳2点钟不规则肿块,明显强化。较治疗前范围明显减小(图3)。治疗前DWI图:左乳2点钟不规则肿块弥散图明显增高;新辅助化疗后DWI图:左乳2点钟不规则肿块弥散图明显增高,较治疗前明显减小(图4)。治疗前ADC图:左乳2点钟不规则肿块ADC图明显减低,ADC值 0.648;新辅助化疗后ADC图:左乳2点钟不规则肿块ADC图明显减低,ADC值 0.948,数值较治疗前明显增高(图5)。预后良好组早期强化率低于预后不良组,ADC值高于预后不良组(P<0.05)。见表4。
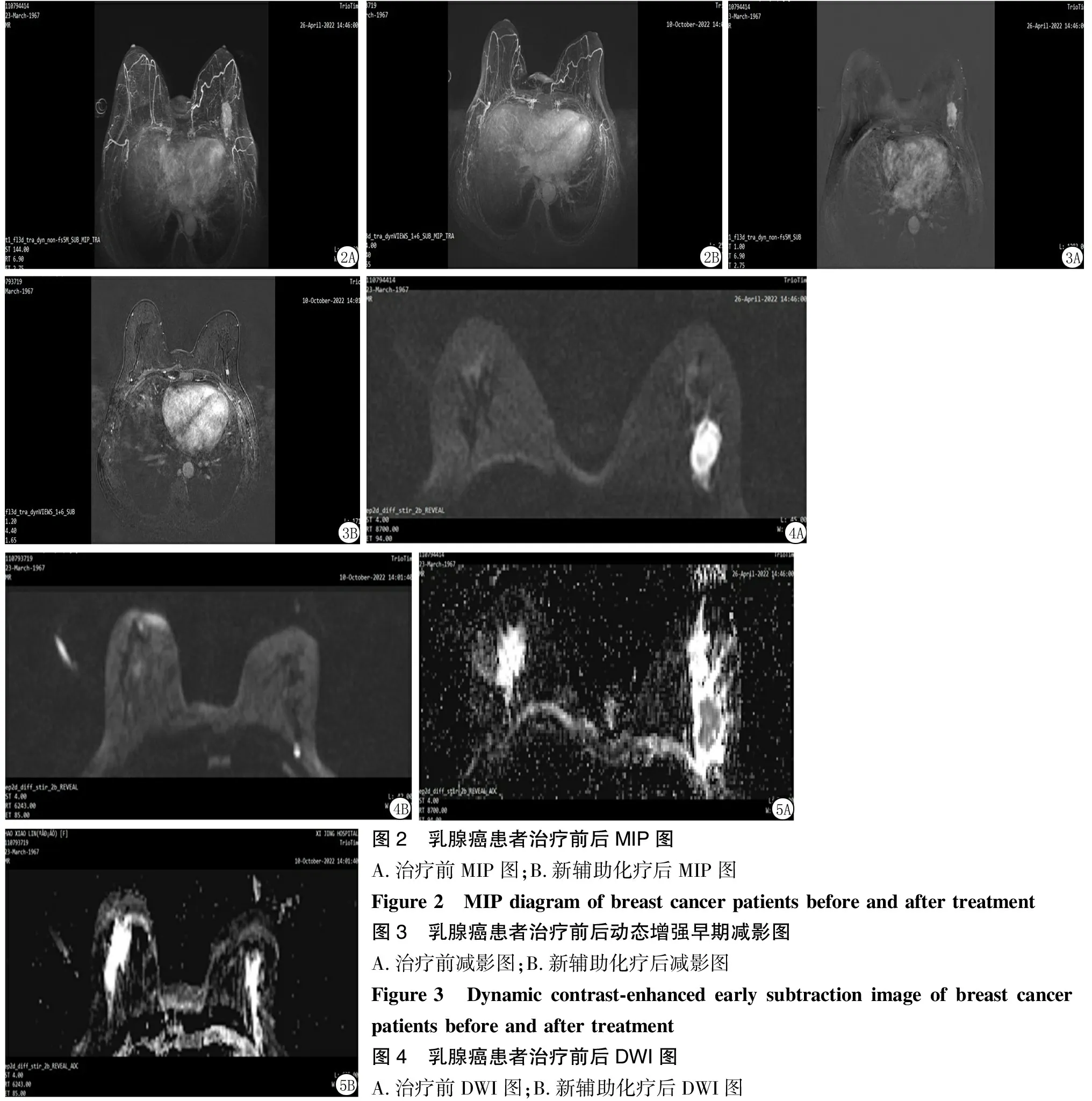
图2 乳腺癌患者治疗前后MIP图A.治疗前MIP图;B.新辅助化疗后MIP图Figure 2 MIP diagram of breast cancer patients before and after treatment图3 乳腺癌患者治疗前后动态增强早期减影图A.治疗前减影图;B.新辅助化疗后减影图Figure 3 Dynamic contrast-enhanced early subtraction image of breast cancer patients before and after treatment图4 乳腺癌患者治疗前后DWI图A.治疗前DWI图;B.新辅助化疗后DWI图

表4 乳腺癌患者不同预后情况患者强化率、ADC值比较
2.5ROC曲线分析 绘制ROC曲线,早期强化率、ADC值预测患者预后的AUC分别为0.816、0.763。将两项纳入Logistic回归分析,根据回归结果中的回归系数值拟合两项联合诊断的数值计算公式:两项联合=早期强化率+(-7.976)/0.140×ADC值,两项联合预测患者预后的AUC为0.945。两项联合预测患者预后的效能优于早期强化率和ADC值(Z=1.685、1.953,P值=0.045、0.040)。见表5,图6。
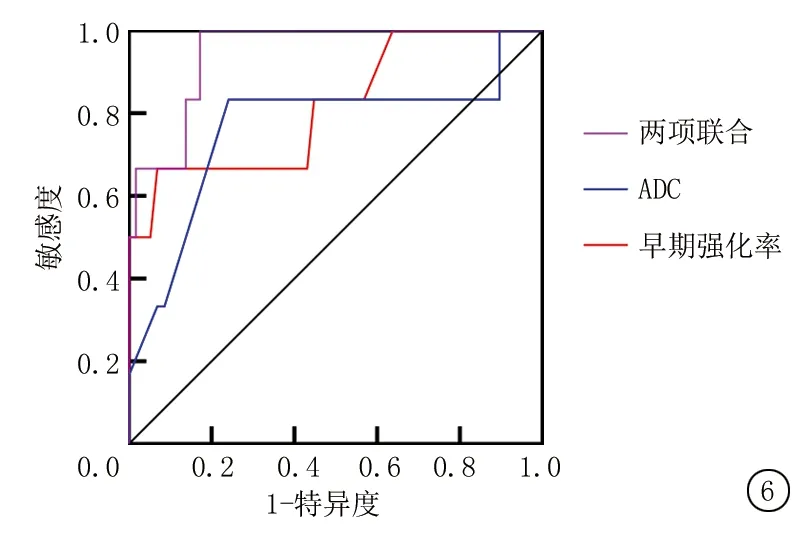
图6 早期强化率、ADC值及两项联合预测预后的ROC曲线

表5 分析各项指标在预测乳腺癌患者预后中效能
3 讨 论
乳腺癌是由多种高危因素和致癌因子联合作用,激活原癌基因,致使乳腺上皮细胞基因突变,从而诱发癌细胞无限增殖、分裂的疾病[7]。乳腺癌发病率占据女性恶性肿瘤的首位,由于风险性大,故需尽早发现、治疗[8]。目前诊断乳腺癌的金标准为病理活组织检查,虽准确率较高,但需多次采样,且操作复杂,会给患者带来巨大疼痛、损伤,且部分患者穿刺活组织检查会引起癌细胞转移、扩散,因此,寻找新的特异度、敏感度高的无创性诊断方式对疾病判断至关重要[9]。
MRI能够多序列、多参数、多方位成像,具有软组织分辨率高、空间分辨率高等优势,可通过任何角度和方向进行图像重建,明显显示边缘病灶、细小病灶形态,利于判断乳腺病灶良恶性,随着乳腺线圈不断改进,DCE-MRI、DWI得到大力推广[10]。其中DCE-MRI不仅能够动态观察病变血流灌注情况,还可清晰显示乳腺病变形态学特征,目前常通过TIC、早期强化率鉴别良恶性肿块,其中早期增强率是反映病灶血流灌注情况、血管丰富程度的良好指标[11]。本研究结果显示,恶性肿块早期强化率高于良性肿块,预后良好组早期强化率低于预后不良组,此与病灶血管密度、细胞间隙渗透程度有关,也方面说明早期强化率在分辨良恶性肿块中具有一定价值,且可用于预判预后情况。分析原因,恶性肿块的主要病理基础为动静脉瘘和毛细血管通透性增加,肿瘤血管数量异常增多,故表现出明显早期强化率[12-13]。而从TIC分型来看,良性肿块TIC类型以Ⅰ型、Ⅱ型为主,恶性肿块TIC类型以Ⅱ型、Ⅲ型为主,虽存在一定差异,但Ⅱ型曲线在良恶性肿块中有一定重叠,故需结合瘤内钙化灶、肿瘤形态学特点鉴别[14]。DWI是检测活体组织中水分子微观运动最佳方法,可通过分子变化体现人体内水分含量,为早期诊断提供可靠依据[15]。目前主要依据ADC值量化分析,本研究结果显示,恶性肿块ADC值偏低,良性病灶ADC值偏高,与细胞密度、繁殖情况有关。进一步分析原因是恶性肿瘤细胞复制能力强,相应的增大了细胞密度,导致细胞内水分子运动受限,导致ADC值偏低;良性肿瘤密度相对低,增生速度慢,水分子运动便更快速[16],但DWI图像欠清晰,单独诊断无明确诊断意义,且空间分辨率低,对磁场要求较高,故推广联合诊断。为了进一步探索DCE-MRI、DWI诊断效能,本研究采用ROC曲线模型分析,结果显示,两项联合诊断乳腺恶性肿块的AUC为0.953,预测预后的AUC为0.945,均具有较高效能,故在条件允许下首选联合技术。
综上所述,DCE-MRI、DWI对于乳腺癌患者均具有一定诊断价值,两项联合具有更高特异度和敏感度,可为疾病早期诊断、病情预后预测提供可靠影像依据。
