宫颈癌外照射对肠道菌群的影响
2023-11-06梁钰霞
梁钰霞,高 琨
(1.广西壮族自治区人民医院产科,广西 南宁 530021;2.广西医科大学附属肿瘤医院妇瘤科,广西 南宁 530021)
微生物菌群出现菌群失调会增加有害代谢产物产生和有害的抗原微生物表达,通过促进黏膜炎症或系统失调、或可能改变抗癌免疫治疗,而肿瘤内、肿瘤附近和肿瘤远处的微生物可以通过多种机制改变癌症的易感性和进展,如调节炎症、诱导DNA损伤和产生与肿瘤发生或肿瘤抑制相关的代谢物[1]。已有研究表明,宫颈癌患者和健康人的肠道菌群有显著差异,肠道菌群的变化对妇科癌症诊疗有影响[2]。目前关于16S基因测序对接受盆腔放射治疗的宫颈癌患者肠道菌群变化的研究结论不一,且尚不清楚肠道菌群的变化与放射性肠炎、放射治疗效果是否存在相关性。为避免宫颈癌内照射治疗阴道及宫腔操作带来的影响,本研究将前瞻性探讨外照射对宫颈癌患者肠道菌群的影响。
1 资料与方法
1.1一般资料 收集2019年5月—2021年12月期间广西医科大学附属肿瘤医院妇瘤科初诊病理检查证实为宫颈癌ⅡA2~Ⅳ期患者67例的粪便样本,年龄31~77岁,平均(52.8±9.9)岁;所有患者入组前7 d未使用类固醇、抗菌药物者,且治疗过程中未使用抗菌药物及免疫抑制剂。排除标准:合并高血压、糖尿病、炎症性肠病者及自身免疫性疾病者、曾有消化道手术史者;既往有盆腔放射治疗或全身治疗史者。所有患者均采用6 mVX线进行调强放射治疗和后装治疗,每周顺铂(40 mg/m2)同期化疗。
本研究经医院伦理委员会审批通过,所有患者知情同意并签署知情同意书。
1.2方法
1.2.1样本收集加工、基因测序 用引物341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)在2720热循环仪(美国应用生物系统公司)上扩增出16SrRNA基因V3~V4高变区。PCR扩增程序为:98 ℃保温2 min,98 ℃保温30 s,50 ℃保温30 s,72 ℃保温1 min,共20个循环,最后在72 ℃孵育5 min。反应一式三份。反应混合物(共50 mL)由2×TransStart FastPfu Fly PCR SuperMix(25 mL)、每个引物(1 mL/10 mm)、无酶水(20 mL)和模板DNA(10 Ng)组成。PCR产物用VAHTS DNA清洁珠纯化。使用特殊的索引引物,在不同条件下进行二次PCR。PCR扩增程序为:98 ℃ 30 s,98 ℃ 10 s,65 ℃ 30 s,72 ℃ 30 s,共10个循环,72 ℃孵育5 min。反应混合物(共50 mL)包括Phusion DNA聚合酶(25 mL)、I5/I7指数引物(1 mL/2.5 mmol/L)、超纯水(13 mL)和纯化的PCR产物(10 mL)。在1.8%琼脂糖凝胶上分析反应以确保扩增成功。不成功的反应在初始模板浓度稀释10倍后重复,如果再次不成功,则从实验中移除。从琼脂糖凝胶中提取PCR产物,用AxyPrep DNA Gel Extract Kit(Axygen Biosciences,USA)进一步纯化,并用Tris-HCl洗脱。用Image J(美国马里兰州贝塞斯达国立卫生研究院)对电泳结果进行量化。文库以等摩尔浓度混合,在1.8%琼脂糖凝胶上溶解,提取目标大小400~490 bp的条带。在Illumina NovaSeq 6000平台进行配对末端测序(2×250)[3]。
1.2.2临床资料采集 收集所有患者临床信息(姓名、年龄、卡氏(Karnofsky performance status)评分、病理类型、人乳头瘤病毒(human papillomavirus,HPV)状态、分期、外照射开始和结束时间)、疗效指标(治疗前后血清肿瘤标志物水平、放射治疗后胃肠道反应评分、MRI肿瘤大小、近期疗效评价等),通过自身对照,将患者分为治疗前组(T0组)与治疗后组(T1组)。放射性肠炎诊断标准参考2018《放射性直肠炎诊断标准》。所有患者无出现3~4级放射性肠炎者,故将患者分为无放射性肠炎组(non-radioactive enteritis group,E0)和1~2级放射性肠炎组(radio-enteritis group,E1)。根据外照射前后MRI行近期疗效评价,肿瘤消退率=(放射治疗前肿瘤体积V1-外照射治疗结束前肿瘤体积V2)/放射治疗前肿瘤体积V1×100%;Nam等[4]发现宫颈癌经过外照射放射治疗,肿瘤消退率≥75%是能区别除患者预后差异的最佳阈值。因此将肿瘤消退率≥75%视为有效组(the response to effective group,R1),肿瘤消退率<75%视为效果欠佳组(the response to ineffective group,R0)。
1.3生物信息学分析 将双端测序数据加载到qiime2(version 2021-11)[5],用dada2(denoise-paired)进行数据处理。最终生成扩增子序列变体(amplicon sequence variants,ASV)丰度表和序列文件[6]。物种分类基于朴素贝叶斯方法(classify-sklearn)并以Greengenes数据库参考序列(V201308)为训练集。过滤掉只在一个样本并且丰度小于10(reads)的ASV,同时也过滤掉比对到非细菌的ASV。利用MAFFT方法进行多序列比对,构建系统进化树。基于过滤后的ASV丰度表计算α多样性和β多样性。在PCoA中绘制了UniFrac距离矩阵,并使用R包“ADE4”进行统计与作图。对于患病率>10%的分类群,在门、纲、目、科、属、种水平上采用Wilcoxon秩和检验进行差异丰度分析。使用QIIME2(version 2021-11)进行计算出α多样性指数(包括Simpson指数、Shannon-entropy指数、Pielou-evenness指数、Chao1指数、Faith-pd指数、Observed-features指数)、β多样性指数(包括Bray-Curtis,jaccard、weighted UniFrac,unweighted UniFrac),其中,Observed species指数、Chao指数、Pielou-evenness指数、Faith-pd反映样品中群落的丰富度,即简单指群落中物种的数量,而不考虑群落中每个物种的丰度情况,shannon指数以及simpson指数反映群落的多样性;除simpson指数指数外,其余指数越大,说明样本中物种的多样性越丰富。
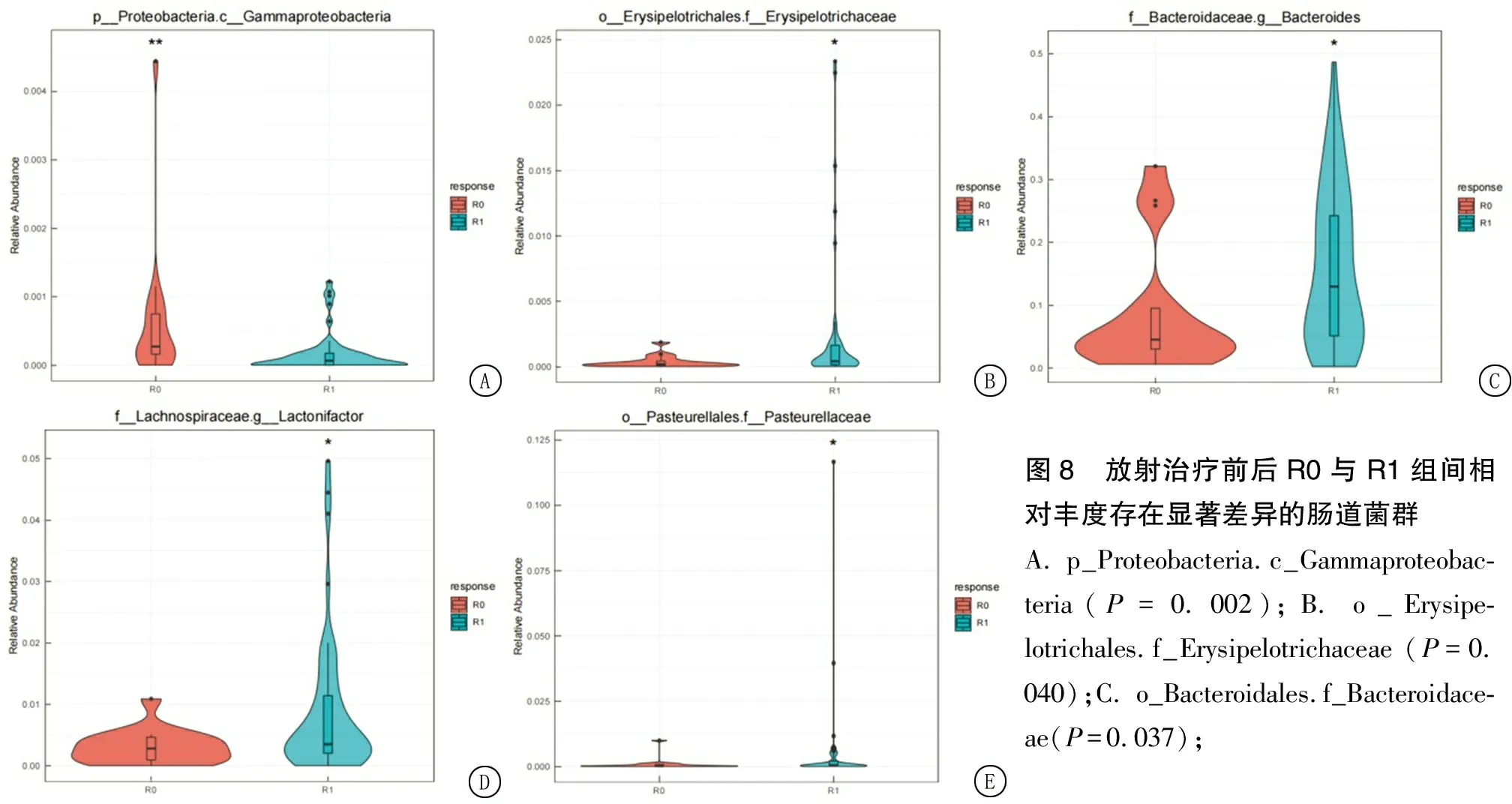
图8 放射治疗前后R0与R1组间相对丰度存在显著差异的肠道菌群A. p_Proteobacteria.c_Gammaproteobac-teria(P=0.002);B. o_Erysipe-lotrichales.f_Erysipelotrichaceae (P=0.040);C. o_Bacteroidales.f_Bacteroidace-ae(P=0.037);
1.4统计学方法 应用R统计学软件分析数据。计量资料比较采用t检验和Kruskal-Wallis秩和检验,计数资料比较采用χ2检验或Fisher确切率概率法。采用Wilcoxon秩和检验计算Simpson指数、Shannon-entropy指数、Pielou-evenness指数、Chao1指数、Faith-pd指数、Observed-features指数。Bray-Curtis矩阵算法是考虑物种在组间的绝对丰度,其所反映的是物种间的距离;UniFrac矩阵算法则考虑进了物种间的进化关系,所对应的为距离矩阵的权重算法(weighted UniFrac)。对应矩阵的非权重算法(unweighted UniFrac)则是将原先算法的ASV丰度表的数值进行二进制转化再进行计算,其只考虑了物种在各个样本间否存在,而不考虑物种丰度。对Bray-Curtis,jaccard、weighted UniFrac,unweighted UniFrac进行ANOSIM分析检测两组样品间是否有显著性差异,找到组别中差异成分;使用线性分析效应对细菌群落组成的相似性即β多样性指数进行计算,并确定治疗前和治疗结束后细菌属的变化,选择线性判别分析得分大于2的微生物群作为与放射治疗相关的微生物群。P<0.05为差异有统计学意义。
2 结 果
2.1患者临床资料特征 根治性盆腔外照射治疗患者72例,其中剔除信息不全者,共收集患者67例粪便样本134个。宫颈癌临床分期:Ⅱa2~Ⅲb期29例,Ⅲc1r~Ⅳb期38例;病理类型:鳞癌64例,腺癌3例;淋巴结转移38例,高危型HPV感染57例。
2.2外照射治疗前后的肠道菌群变化
2.2.1外照射治疗前后肠道菌群丰富度与多样性的比较 样本中总共获得了2 844个ASV。其中,放射治疗前组检出2 620例(92.1%),外照射治疗后组检出2 271例(79.9%),治疗前组和治疗后组均检出2 047例(71.9%)。T0组与T1组α多样性指数即Simpson指数、Shannon-entropy指数、Pielou-evenness指数、Chao1指数、Faith-pd指数、Observed-features指数差异无统计学意义(P>0.05)。即外照射治疗前后肠道菌群丰富度差异无统计学意义(P>0.05)。见表1。
表1 治疗前后肠道菌群α-多样性指数比较
2.2.2外照射治疗前后肠道菌群结构的比较 经ANOSIM分析结果显示,β多样性Bray-Curtis指数主成分差异有统计学意义(R值=0.014,P=0.039),其主成分分析(PcoA-2D)(图1),即外照射治疗前后肠道菌群组成绝对丰度差异有统计学意义(P<0.05)。见表2。
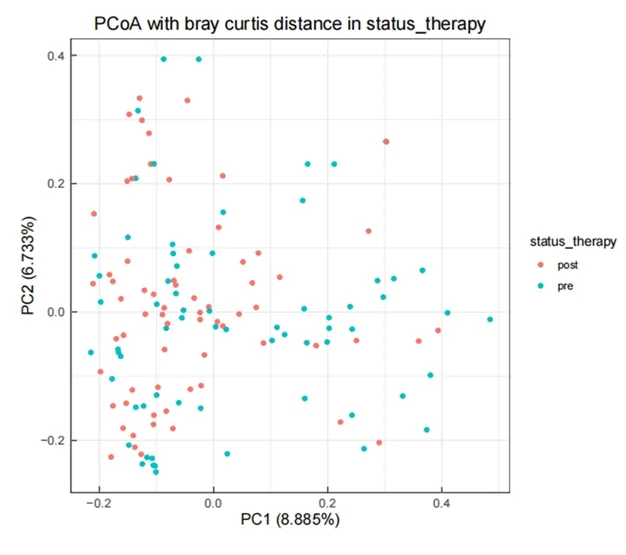
图1 放疗前后肠道菌群Bray-Curtis指数的PCoA 2D图

表2 治疗前后肠道菌群β-多样性指数比较
2.2.3放射治疗对患者的肠道菌群成分的影响 将ASV与数据库比对,进行物种分类,分别在门、纲、目、科、属、种几个分类等级对各个样品作物种profiling面积图和柱状图,在门水平做出所有物种的柱状图,从纲水平开始,将物种丰度在所有样品均低于0.5%的物种全部合并成其他物种,结果显示,在放射治疗前后肠道微生物菌群在“属”水平上物种丰度更高(图2)。放射治疗前后之间不同富集的特定细菌门、纲、目、科和属,显示了放射治疗期间肠道微生物群的组成变化(显著差异是对数线性判别分析得分>2和Kruskal-WallisP值<0.05)(图3)。其中发生最显著的菌群相对丰度改变的细菌包括梭杆菌门、变形杆菌门;变形杆菌门、γ-变形菌纲、肠杆菌目、肠杆菌科的相对丰度降低,而梭状芽胞杆菌类成员包括梭杆菌门、梭杆菌纲、梭杆菌目、梭杆菌科以及毛螺菌科的Dorea属、韦荣球菌科的Anaerosinus属、肠杆菌科的变形杆菌属的相对丰度显著升高。共筛选出7种菌群丰度差异有统计学意义,分别为A变形菌门-γ变形菌纲(p-Proteobacteria.c-Gammaproteobacteria)(P=0.009)、B肠杆菌科-变形杆菌属(f-Enterobacteriaceae.g-Proteus)(P=0.048)、C毛螺菌科-Dorea属(f-Lachnospiraceae.g-Dorea)(P=0.044)、D韦荣球菌科-Anaerosinus属(f-Veillonellaceae.g-Anaerosinus)(P=0.024)、E变形杆菌门(k-Bacteria.p-Proteobacteria)(P=0.007)、F肠杆菌目-肠杆菌科(o-Enterobacteriales.f-Enterobacteriaceae)(P=0.004)、G梭形杆菌目-梭杆菌科(o-Fusobacteriales.f-Fusobacteriaceae)(P=0.035),结果示差异有统计学意义(P<0.05)。见图4。
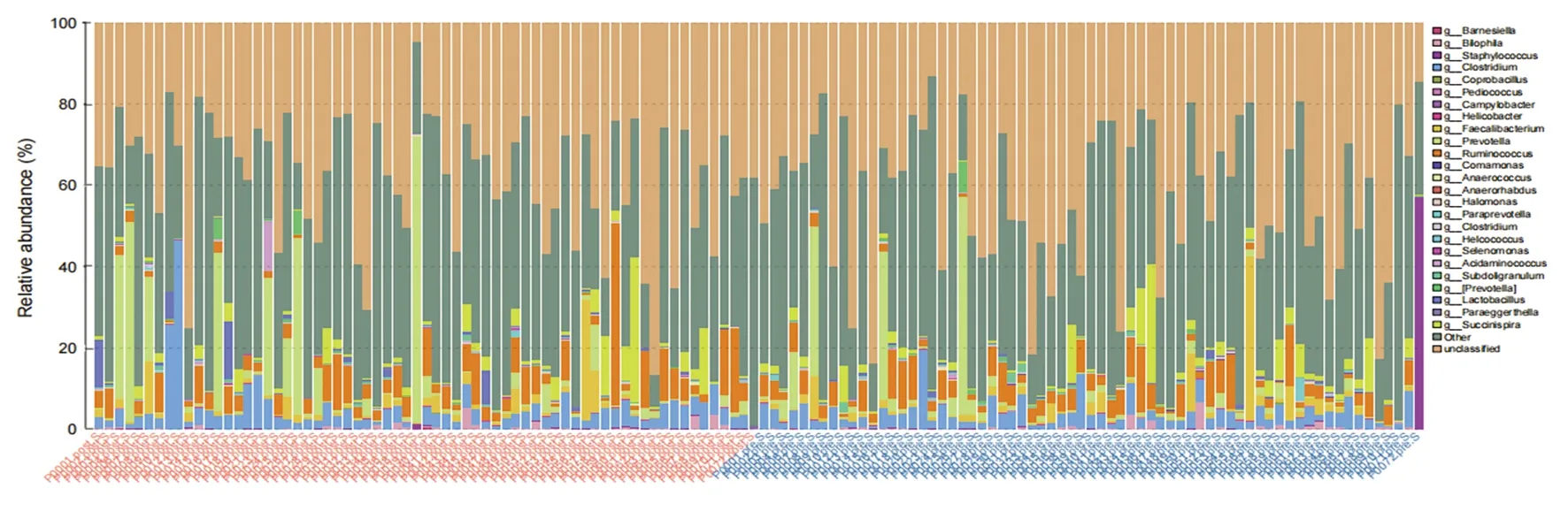
图2 在外照射治疗前后的粪便样本中“属”水平菌群分布

图3 放射治疗前后肠道菌群变化及差异

图4 放射治疗前后肠道中相对丰度存在显著差异的菌群 A.p-Proteobacteria.c-Gammaproteobacteria(P=0.009);B.f-Enterobacteriaceae.g- Proteus(P=0.048);C.f-Lachnospiraceae.g-Dorea(P=0.044);D.f-Veillonellaceae.g-Anaerosinus(P=0.024);E.k-Bacteria.p- Proteobacteria(P=0.007);F.o-Enter-obacteriales.f- Enterobacteriaceae(P=0.004);G.o-Fusobacteriales.f- Fusobacteriace-ae(P=0.035)Figure 4 The intestinal flora with significant difference in relative abundance before and after external irradiation
2.3分层分析
2.3.1放射性肠炎与肠道菌群的关系
2.3.1.1放射性肠炎与肠道菌群丰富度及多样性变化的关系 分别对E0组(n=42)、E1组(n=25)放射治疗前后进行对比分析,细菌群落丰富度由观察到的ASVs确定,α多样性分析结果显示,E0与E1组在治疗前后α多样性指数差异无统计学意义(P>0.05)。见表3。

表3 E0与E1组间在T0、T1时α多样性指数比较
2.3.1.2E0、E1组间肠道菌群结构的差异 采用Bray-curtis、Jaccard、Unweighted Unifrac和Weighted Unifrac四种距离矩阵Anosim分析方法,对E0、E1两组放射治疗前后β多样性指数进行显著性分析,结果显示,E0、E1组治疗前后各组间β多样性指数差异无统计学意义(P>0.05)。见表4。
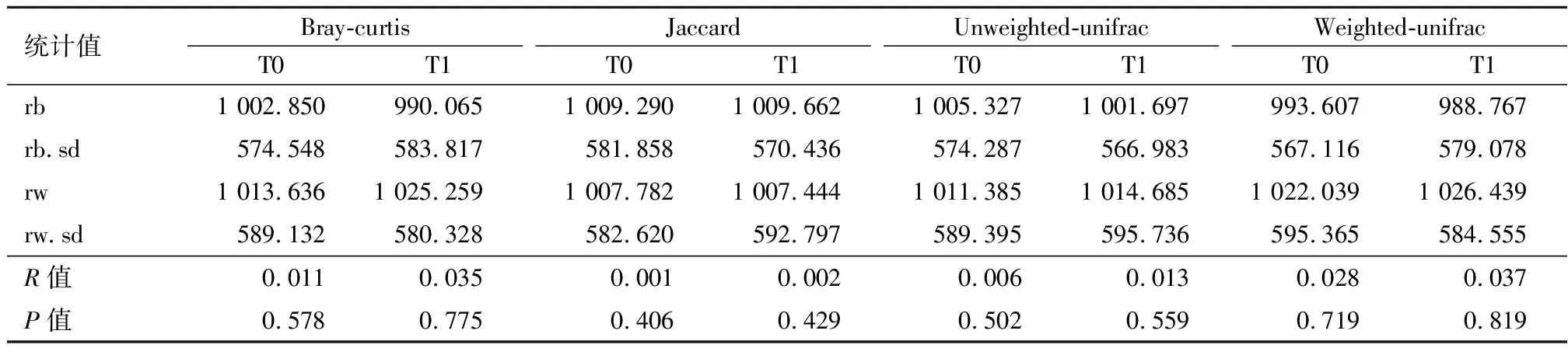
表4 E0与E1组间在T0、T1时β多样性指数比较
2.3.1.3E0、E1组肠道菌群组成及差异分析 利用LEfSe确定了患者肠道微生物群的组成变化(显著差异是对数线性判别分析得分>2和Kruskal-WallisP值<0.05),见图5。图6中显示了放射治疗期间E0和E1组间主要菌群相对丰度的变化,两组共筛选出9种菌群丰度差异有统计学意义,在放射治疗前,E1组中厚壁菌门(P=0.029)、γ变形菌纲的气单胞菌(P=0.033)、粪芽孢菌属(P=0.046)的相对丰度最高,E0组中未发现相对丰度差异有统计学意义的菌群;在放射治疗后,E0组中放线菌目微球菌科(P=0.029)、罗氏菌属(P=0.038),E1组中乳杆菌科(P=0.048)、拟杆菌门(P=0.025)、拟杆菌目S24-7(P=0.025)、布雷德菌属(P=0.028)相对丰度增高,差异有统计学意义(P<0.05),见图6。

图5 放射治疗前后E0与E1组间肠道菌群LEfSe分析A.放射治疗前;B.放射治疗后Figure 5 LEfSe analysis of in-testinal flora between E0 group and E1 group

图6 放射治疗前后E0与E1组间相对丰度存在显著差异的肠道菌群
2.3.2肿瘤消退率与肠道菌群的关系
2.3.2.1肿瘤消退率与肠道菌群丰富度及多样性变化的关系 肿瘤消退率<75%为治疗效果欠佳(R0)组(n=18),肿瘤消退率≥75%为治疗有效(R1)组(n=49),分别对R0、R1组放射治疗前后进行对比分析,结果显示,R0、R1组治疗前后α多样性指数差异无统计学意义(P>0.05)。见表5。

表5 R0与R1组治疗前后α多样性指数比较
2.3.2.2R0组及R1组组间肠道菌群结构的差异 采用距离矩阵Anosim分析方法,对放射治疗前后肠道菌群结构的差异进行β多样性指数显著性分析,结果显示,R0和R1组治疗前后β多样性指数差异无统计学意义(P>0.05)。见表6。
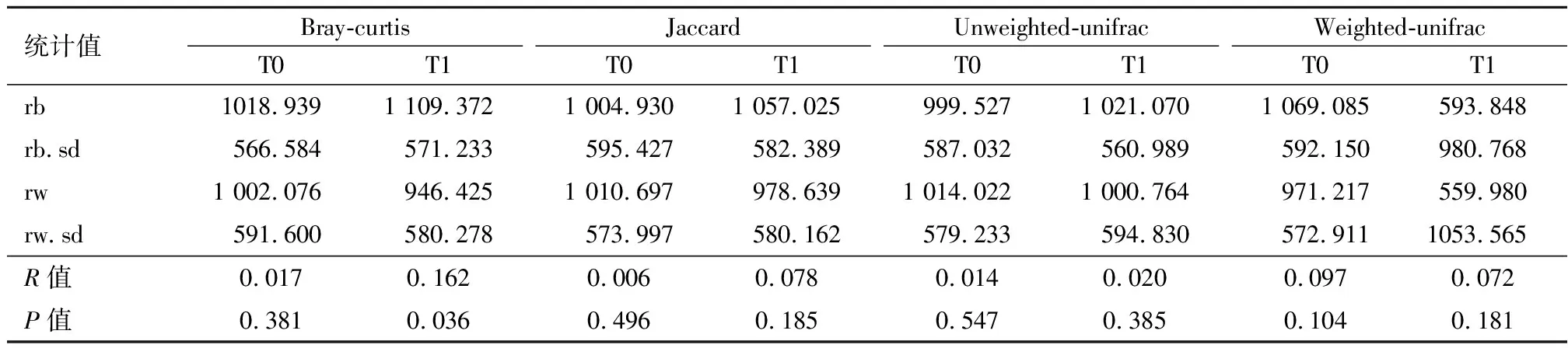
表6 R0与R1组治疗前后β多样性指数比较
2.3.2.3R0组及R1组组间肠道菌群组成及差异分析 利用LEfSe确定了患者肠道微生物群的组成变化(显著差异是对数线性判别分析得分>2和Kruskal-WallisP值<0.05),见图7,在放射治疗前,仅发现R0组中变形菌门变形菌纲(P=0.002)相对丰度较高,在放射治疗后,拟杆菌(P=0.037)、毛螺菌科—Lactonifactor(P=0.037)、巴斯德菌(P=0.048)、丹毒丝菌(P=0.040)在R1组相对丰度较高。共筛选出5种菌群丰度差异有统计学意义(P<0.05),见图8。

图7 放射治疗前后R0组与R1组肠道菌群LEfSe分析A.放射治疗前;B.放射治疗后Figure 7 LEfSe analysis of in-testinal flora between R0 group and R1 group
3 讨 论
现已知某些细菌和病毒和癌症有关,胃肠道细菌的影响并不局限于消化道内的癌症,也被证明可以影响肝细胞癌的转移,可能是通过细菌成分如脂多糖或间接地通过全身炎症及先天免疫途径转移到肝脏[7]。亦有研究报道,由于肠道共生微生物的存在,系统性Th17炎症因子或抗炎Treg因子被激活,可能改变任何器官的癌症风险,包括宫颈、卵巢和子宫等[8-9]。
放射治疗是宫颈癌治疗中的主要手段之一。同步放化疗是目前规范的宫颈癌放射治疗模式。放化疗对人肠道微生物菌群的不良影响已经获得数据的支持。一项采用16SrRna测序分析宫颈癌患者(n=8)和健康对照组(n=5)的肠道微生物区系,结果表明与宫颈癌相关的肠道微生物菌群在α多样性指数有增加的趋势,但差异无统计学意义(P>0.05);β多样性指数分析表明癌症患者与健康对照组之间的群体结构的组间变异性差异有统计学意义,宫颈癌患者粪便标本中以变形菌属最丰富,其中7个属(大肠杆菌志贺菌属、玫瑰杆菌属、假单胞菌属、梭状芽孢杆菌属、乳杆菌科UCG-004属、多尔菌属和琥珀酸杆菌属)的相对丰度差异有统计学意义(P<0.05)[10]。类似的研究表明,癌症患者和健康人群两组的胃肠道微生物菌群差异有统计学意义。癌症患者治疗前放线菌的相对丰度是健康人的30倍,而梭杆菌、变形杆菌的相对丰度分别是健康人的7.4%、1.4%[11]。也有发现在接受盆腔放射治疗后的患者与健康人群相比,其肠道微生物群的丰度、多样性普遍降低[12]。本研究前瞻性分析宫颈癌患者外照射前后肠道菌群的变化,结果显示,放射治疗前后α多样性指数差异无统计学意义(P>0.05);β多样性Bray-Curtis指数差异有统计学意义(P<0.05),说明治疗前后肠道菌群组成差异有统计学意义,发现放射治疗后变形杆菌门、γ-变形菌纲、肠杆菌目、肠杆菌科的相对丰度降低,而梭状芽胞杆菌类成员以及毛螺菌科的Dorea属、韦荣菌科的厌氧菌属、变形杆菌属的相对丰度显著升高。有研究发现厚壁菌门和梭菌经放射治疗后分别显著减少10%和增加3%,差异有统计学意义(P<0.05)[11];另一研究发现放射治疗期间肠道菌群组成发生明显变化,变形杆菌增多,梭状芽胞杆菌减少,但放射治疗后这些菌群恢复到基线水平,而类杆菌种类增加[13]。有研究报道在放射治疗后,宫颈癌患者肠道菌群中拟杆菌门的普雷沃菌明显减少,而厚壁菌门的链球菌和梭状芽胞杆菌明显增多(P<0.05)[14]。由此可见,研究结果不一,较多研究发现接受放射治疗后的肠道菌群丰度及多样性是降低的。
本研究在放射性肠炎的分层分析中的结果与上述结果有相似之处,即在治疗后及放射性肠炎组中差异有统计学意义的菌群多为条件致病菌,且菌群种类相对增多;并而首次发现发生放射性肠炎的宫颈癌患者中,其肠道菌群以乳杆菌科、拟杆菌门、拟杆菌目S24-7科、f-Erysipelotrichaceae.g-Bulleidia为主。
目前尚无对肿瘤消退情况与肠道菌群变化相关性报道。在根据肿瘤消退率的分层分析中发现,R0与R1两组中肠道微生物菌群的丰富度α多样性指数及β多样性指数差异无统计学意义。但可观察到在放射治疗期间,菌群的组成及相对丰度是有变化的。治疗前,仅发现R0组中变形菌门、变形菌纲相对丰度较高;治疗后,拟杆菌、Lactonifactor、巴斯德菌、丹毒丝菌(Erysipelotrichaceae)在R1组相对丰度较高。Erysipelotrichaceae是从属于厚壁菌门的一种革兰阳性菌,其相对丰度与肿瘤坏死因子α水平及肝脏脂肪代谢水平呈正相关,其特定分类群可能参与炎症反应,而其他分类群具有高度的免疫原性[15]。因此Erysipelotrichaceae可能与代谢紊乱及炎症具有一定相关性,本研究发现丹毒丝菌在经放射治疗后肿瘤消退率较高的患者肠道中相对丰度较高,其是否可以增加放射治疗的抗肿瘤效果还有待进一步的研究观察,且有必要研究其代谢谱以及其丰度的变化对宿主的直接影响。
综上所述,宫颈癌患者外照射前后肠道菌群结构和组成均有显著改变,此变化可能与增加放射性肠炎的发生有关,并可能对近期治疗效果产生一定影响。
