急性主动脉夹层患者死亡的危险因素及其预测价值分析
2023-11-06袁祝康
袁祝康
急性主动脉夹层(acute aortic dissection, AAD)是人体大血管内血液通过某处撕裂的动脉内膜破口进入主动脉中膜, 使原本紧密相连且富有弹性的正常的主动脉壁分离, 沿血管长轴方向延展形成真腔和假腔两个腔道, 是常常可累及主动脉邻近所灌注的组织或器官及分支血管, 从而出现多组织器官灌注不良等一系列并发症的一种严重威胁人类身体健康的心血管疾病。该病起病急, 预后差, 部分患者甚至于猝死后行法医尸体解剖后方能确诊, 使其更容易引发医疗纠纷。因此,积极探索AAD 患者住院期间因该疾病进展导致院内死亡的相关因素, 早期识别出高死亡风险患者(如>65岁、急性肢体缺血、急性心包填塞等特征)并及时干预[1],对早期识别预后不佳的该类患者、提高患者生存率,进行充分有效的医患沟通、减少急诊科或心脏大血管外科或介入科内潜在医疗纠纷具有非常重要的意义。本研究回顾性分析了214 例AAD 患者的临床特征, 探讨AAD 患者院内死亡的危险因素, 以期优化AAD 患者的管理, 降低该类危重患者在住院期间的院内死亡率。现报告如下。
1 资料与方法
1. 1 一般资料 回顾性分析广州地区多家临床医疗机构2018 年7 月~2021 年7 月收治的214 例AAD 住院治疗患者的病历资料, 根据患者住院转归分为存活组(197 例)和死亡组(17 例)。纳入标准:①AAD 均通过肺动脉CT 心血管造影或腹部大血管超声查验早期诊断, 通过DeBakey 分型将主动脉夹层分成Ⅰ型、Ⅱ型、Ⅲ型, 通过Standford 分型分成A、B 两种类型;②发病时间<14 d, 针对以往已诊断主动脉夹层而未作医治或手术后复查患者仅保存在医院初次发病状况。排除标准:①病情>3 个月;②合并闭塞性动脉炎或急性心肌梗死等外围和中心血管栓塞病症;③存有重症感染;④肿瘤中晚期或老人临终关怀患者[2]。本研究遵守一般医学伦理学规范。
1. 2 方法 搜集两组患者的临床资料, 包括性别、年龄、既往史、吸烟史、夹层种类、治疗方式(保守疗法指该次患者住院期内仅接纳用药治疗, 手术治疗方式包含开放式外科手术、介入手术等)、实验室及影像检查结果等。
1. 3 统计学方法 采用SPSS19.0 统计学软件对研究数据进行统计分析。符合正态分布的计量资料以均数±标准差(±s)表示, 采用t 检验;不符合正态分布的计量资料以中位值(四分位数间隔)M(P25, P75)表示, 采用Mann-Whitney U 检验;计数资料以率(%)表示, 采用χ2检验;将有统计学意义的因素纳入二元Logistic 回归模型, 分析AAD 患者住院期间死亡的危险因素;制作ROC 曲线分析危险因素对AAD 院内死亡的预测价值, 并估算界值点。P<0.05 表示差异具有统计学意义。
2 结果
2. 1 两组临床资料比较 214 例AAD 患者死亡率为7.9%(17/214)。死亡组的男性占比低于存活组, 手术时间长于存活组, D-二聚体、肌红蛋白水平高于存活组, 差异具有统计学意义(P<0.05)。两组年龄、高血压史占比、糖尿病史占比、吸烟史占比、饮酒史占比、DeBakey 分型、白细胞计数、血红蛋白、血小板计数、肌钙蛋白I、血肌酐水平比较差异无统计学意义(P>0.05)。见表1。
表1 两组临床资料比较[ ±s, n(%), M(P25, P75)]

表1 两组临床资料比较[ ±s, n(%), M(P25, P75)]
注:与存活组比较, aP<0.05
项目类别总体(n=214)死亡组(n=17)存活组(n=197)t/χ2/ZP年龄(岁)55.2±14.156.4±17.855.1±13.80.3640.716男性179(83.6)11(64.7)a168(85.3)4.8420.028高血压史132(61.7)7(41.2)125(63.5)3.2850.070糖尿病史12(5.6)012(6.1)1.0970.295吸烟史54(25.2)6(35.3)48(24.4)0.9910.320饮酒史13(6.1)1(5.9)12(6.1)0.0010.972 DeBakey 分型Ⅰ型71(33.2)3(17.6)68(34.5)Ⅱ型21(9.8)1(5.9)20(10.2)2.8600.239Ⅲ型122(57.0)13(76.5)109(55.3)手术时间(min)142.5(80.3, 469.5)598.5(151.3, 838.0)a142.5(80.3, 469.5)-2.8200.049白细胞计数(×109/L)11.6(8.7, 16.2)15.4(6.2, 19.2)11.6(8.7, 15.6)-1.3080.191血红蛋白(g/L)123.5(105.0, 142.0)125(93.5, 145.0)123(105.0, 141.5)-0.2720.786血小板计数(×109/L)196.5(133.8, 244.3)134.0(92.5, 370.5)197.0(137.5, 244.0)-0.8080.419肌钙蛋白I(ng/ml)0.021(0.007, 0.050)0.043(0.007, 0.110)0.022(0.007, 0.050)-0.8900.373血肌酐(μmol/L)91.0(73.0, 125.8)103.0(86.5, 128.8)89.0(72.0, 124.5)-1.0800.280 D-二聚体(μg/L)4485.0(1665.0, 15595.0) 19465.0(3247.5, 20000.0)a 4170.0(1620.0, 12775.0)-2.2000.028肌红蛋白(ng/ml)38.0(23.9, 88.8)90.0(35.9, 228.0)a36.0(23.6, 84.1)-2.2510.024
2. 2 AAD 患者死亡的危险因素二元Logistic 回归分析 将性别、手术时间、肌红蛋白、D-二聚体水平纳入二元Logistic 回归模型, 结果显示:手术时间长、D-二聚体水平高是AAD 患者死亡的危险因素(P<0.05)。见表2。

表2 AAD 患者死亡的危险因素二元Logistic 回归分析
2. 3 危险因素对AAD 患者死亡的预测价值分析ROC 曲线分析显示:手术时间预测AAD 患者死亡的AUC 为0.765[95%CI=(0.614, 0.917), P=0.005<0.05],最佳临界值为555.0 min, 灵敏度、特异度分别为0.600、0.847。D-二聚体预测ADD 患者死亡的AUC 为0.677[95%CI=(0.511, 0.843), P=0.028<0.05], 最佳临界值为8475 μg/L, 灵敏度及特异度分别为0.714、0.669。见图1,图2, 表3。
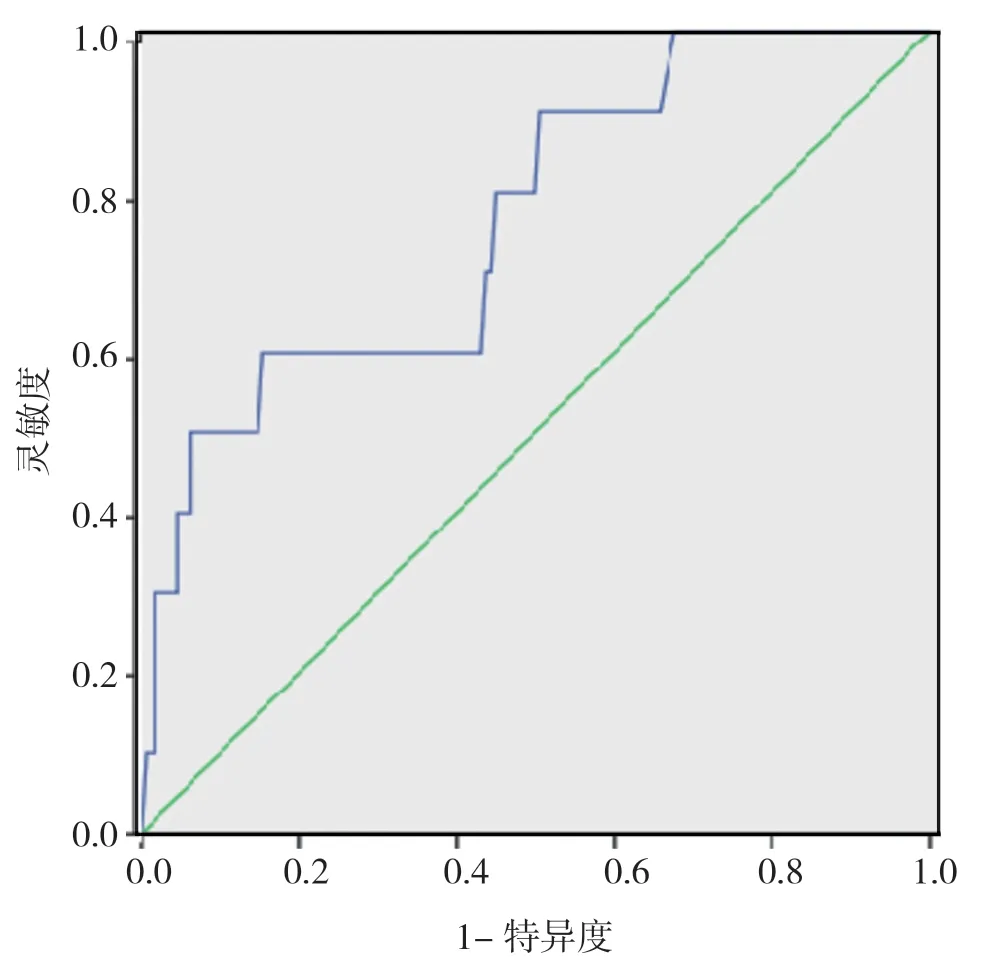
图1 手术时间对ADD 患者死亡预测的ROC 曲线图

图2 手D-二聚体对ADD 患者死亡预测的ROC 曲线图

表3 手术时间和D-二聚体对ADD 患者死亡的预测价值
3 讨论
主动脉夹层是一种少见但致死率较高的疾病, 随着外科手术水平的进步以及术后管理水平的提高, 该病的死亡率在上一个十年里已经下降到12%左右[3]。在分子水平, 主动脉夹层被认为是主动脉壁结构重塑的结果, 也是炎症导致细胞外基质降解的结果。活化的巨噬细胞浸润中膜并释放基质金属蛋白酶(MMP)及促炎症细胞因子。MMP-1、MMP-9 和MMP-12 的过度生成导致胶原蛋白和弹力纤维的加速降解[4]。不仅MMP 自身的释放增加, 而且MMP 与其组织抑制剂(TIMPs)之间的不平衡也促进了主动脉夹层中蛋白水解的优势, 最终引发了该疾病-主动脉夹层[5,6]。
本研究发现手术时间长是ADD 患者死亡的独立危险因素。众多研究也证实体外循环时间、主动脉阻断时间是AAD 患者术后死亡的危险因素[7]。而手术时长的影响因素则包括患者基础情况、病理分型、手术方式选择(全弓置换+支架象鼻置入术、主动脉腔内隔绝术、杂交手术等)、手术时机、手术参与者熟练程度等。多项研究表明, 手术时间越长, 其术后并发症如急性肾损伤、急性呼吸功能不全、顽固性低心排等器官损伤几率越高。其病理生理学机制可能是术中长时间主动脉阻断、术中停循环, 组织器官灌注不足, 组织中酸性代谢性产物增多, 缺血再灌注损伤等因素进一步加重灌注器官细胞损伤, 进而可能影响患者预后[8]。本研究中ROC 曲线分析提示手术时间的最佳临界点为555.0 min, 能达到该最佳临界点的手术类型大多为主动脉腔内隔绝术等介入手术。
AAD 患者临床表现有时不甚典型, 可能与冠心病、心肌梗死等病相似, 可能诊断上与其他心脑血管疾病相比存在困难[9-11]。目前已有大量临床研究表明显著升高的血清D-二聚体水平对AAD 有较高的诊断价值[12-14], 典型心电图(ECG)改变、肌钙蛋白I 水平和D-二聚体水平同时诊断可大概排除AAD[15-18]。但增强CT 图像结果依旧为AAD 诊断的金标准。本研究还提示高D-二聚体水平除高度提示AAD 诊断外,可在一定程度预测该类患者相对低D-二聚体水平的AAD 患者有更高的死亡率, 病情更加危重。
但到目前为止, 血液生物标志物在AAD 的评估中只起次要作用。部分AAD 患者的高敏肌钙蛋白会呈阳性, 类似于 ECG 提示心肌缺血, 高敏肌钙蛋白检测结果阳性会干扰AAD 的诊断, 误认为心肌梗死, 增加误诊风险[19]。故不应常规将高敏肌钙蛋白作为AAD 患者的评估。而几种炎症标志物, 如白细胞介素(IL)-6、IL-8、IL-10、肿瘤坏死因子-α(TNF-α)已被提议可能有助于AAD 的诊断。虽然血管的炎症可能主要地参与了主动脉夹层病理生理发展过程, 但目前也有多项较大规模的临床研究证实这些炎症标志物对AAD 患者的评估中特异性较差[20]。故尚不能将炎症标志物用于AAD 患者的危险评估。
查阅文献发现, 近年来经胸超声心动图 (transthoracic echocardiography, TTE) 的发展使其可快速对几个主动脉段进行无创评估, 特别是主动脉根部和近端升主动脉的影像评估。然而, 其检测受检测者水平和患者本身配合度影响较大, 如患者胸壁形态异常、肥胖或肺肺气肿, 以及机械通气者。使TTE 不能精确评估AAD患者。核磁共振成像(magnetic resonance imaging, MRI)被认为是AAD 最准确的诊断技术, 但在急诊科应用极少。限制因素包括时间延迟, 与植入的金属设备不兼容,或在检查期间难以监测患者。但MRI 适合长期动态随访或者在科学研究中检查已知患有主动脉疾病患者。
对于主动脉夹层患者死亡的直接因素, 目前一些尸检数据库分析研究认为非主动脉夹层破裂患者中最多见的是急性心力衰竭, 其次是急性肠系膜缺血和术前中风。而接近一半(47%)的非主动脉夹层破裂死亡病例的病理检查中发现存在远端内脏器官动脉栓塞。学者Pál 等[21]将灌注不良综合征定义为由分支血管受累引起的内脏器官局部缺血性功能障碍, 而这一部分病例甚至可以占到死亡病例的53%, 并且都由病理学检查证实。另一项关于A 型主动脉夹层患者的临床研究显示, 合并肠系膜灌注不良综合征(MPS)的患者院内死亡率为39%, 比非MPS 患者高5 倍[22], 这与死亡后尸体解剖的病理学检查结论一致。一项回顾8 年时间里对20533 例接受手术治疗的主动脉夹层患者发病率和住院死亡率的德国全国性研究也发现, 所有类型主动脉夹层患者的院内总死亡率为16.7%, 其中A 型主动脉夹层患者院内死亡率是19.5%, B 型主动脉夹层患者院内死亡率是9.3%。在B 型主动脉夹层患者中接受开放式手术患者的院内死亡率为34.3%, 而接受血管内介入治疗的患者院内死亡率为7.6%。这项研究也发现, 医院机构诊疗主动脉夹层的病例数量和患者年龄及Elixhauser 共病情况是该病院内死亡的独立危险因素。提示大型专科化及更加熟练的医疗服务及较年轻患者院内死亡率会更低[23]。该结论非常容易理解。
除了患者个人特征因素外, 还有学者对AAD 患者院内死亡的非自然因素做了分析。例如国外有研究发现, 周末入院的AAD 患者与工作日住院患者相比, 住院死亡率高出29%(分别为14.3%和11.5%)[24], 这种“周末效应”可能的因素包括人员配备水平可能在周末处理紧急情况和紧急手术时显得能力相对不足;其次,每个专业人员周末的相对工作量可能会更大, 因此, 现有医疗服务的效率可能较低;而对于像体弱的老人这样的弱势人群来说, 一些患者可能会在周末和节假日推迟就医, 并在病情进展到无法忍受时(如剧烈疼痛、休克、昏迷等)情况时才勉强就医, 使得院内死亡率也较平常工作日升高。
综上所述, 手术时间长和D-二聚体水平高是AAD患者院内死亡的危险因素, D-二聚体水平除可提示AAD 的诊断外, 对AAD 患者院内死亡风险也具有较好的预测价值。不过, 由于本研究是一项仅纳入214 例病例的单中心、回顾性病例对照研究, 具有一定的局限性, 需进一步进行多中心、大样本、前瞻性甚至结合基础医学实验的深入研究加以证实。
