党参多糖对脑缺血再灌注损伤大鼠血清S100-β及NSE水平的影响*
2023-11-02邹赢锌
刘 飞 邹赢锌 焦 勇 唐 瑛
(海军军医大学海军特色医学中心,上海 200433)
卒中危害公共健康,具有高死亡率和致残率的特点[1]。脑缺血被认为是全球范围内的主要死亡原因。该病的预后高度依赖于早期医疗干预[2]。国内外学者发现血液生物标志物的循环水平与神经组织损伤相关,不仅可用于缺血性卒中尤其是早期阶段(发病后72 h内)诊断,还可用于缺血性卒中的严重程度评估及监测梗死进展,甚至有助于早期成像结果呈阴性的有症状患者的诊断[3-4]。脑缺血后神经元受损、胶质细胞坏死及血脑屏障(blood-brain barrier,BBB)的损伤致使S100-β蛋白及神经特异性烯醇化酶(neuron specific enolase,NSE)释放进入血液,其血清中水平的变化能够反映脑损伤程度及疾病的预后[5]。
因此,本研究通过党参多糖(codonopsis pilosula polysaccharide, CPPS)预处理后建立大鼠中脑闭塞(middle cerebral artery occlusion,MCAO)模型,研究缺血再灌注损伤大鼠血清中S100-β蛋白和NSE水平的变化,探讨CPPS对脑缺血再灌注损伤的保护作用,为临床提供实验依据。
1 材料和方法
1.1 材料
1.1.1动物分组与给药:SPF级 雄性 SD大鼠 130只,体质量(280±20)g, 购自上海西普尔-必凯实验动物有限公司,生产许可证号【SCXK(沪):2018-0016】。动物饲养于海军特色医学中心动物房,许可证号【SYXK(沪)2022-0033】。饲养条件:室温12~24 ℃,采用12 h/12 h昼夜间断照明,分笼饲养,自由饮水。动物购进后在本单位动物房饲养1周后,随机分为假手术组(Sham)、模型组、依达拉奉组10 mg/(kg·bw)、CPPS低【1 g/(kg·bw)】、高【2 g/(kg·bw)】两个剂量组,每组10只。术前2个CPPS组按实验设计每天灌胃1次,连续给药14 d,给药体积为1 mL/100 g;依达拉奉组按10 mg/(kg·bw)每日尾静脉注射1次,连续给药14 d;其余两组给予等体积的双蒸水。本实验分3批次完成。所有实验均经过海军特色医学中心动物伦理委员会授权(NMC-2021041),整个实验期间按照《实验动物的护理和使用指南》进行操作。
1.1.2药品:党参多糖 (CPPS),黄褐色粉末状,纯度32.8%,购自西安天一生物科技有限公司;依达拉奉注射液(规格20 mL∶30 mg,国药集团国瑞药业有限公司)。
1.1.3试剂与仪器:MCAO栓线(北京沙东生物技术有限公司);神经元特异性烯醇化酶(NSE)、S100-β蛋白 ELASA检测试剂盒(上海研谨生物科技有限公司);伊文思蓝(evans blue, EB)(MP Bio medicals, LCC);其余试剂均为国产分析纯。752N型紫外可见分光光度计(上海精密科学仪器有限公司)。
1.2 方法
1.2.1动物模型制备及处理:各组大鼠末次给药1 h后,采用改良Longa线栓法[6],腹腔注射1%戊巴比妥钠(0.3 mL/100 g)麻醉,取仰卧位,钝性分离出右侧颈总动脉、 颈外动脉及颈内动脉。结扎颈总动脉近心端,用动脉夹暂时夹闭颈内、外动脉分叉处,将栓线通过颈总动脉小切口插入,打开动脉夹,插入深度约为18 mm,栓线入颅至大脑前动脉,以阻断大脑中动脉所有血流来源,缝合伤口。2 h后轻轻取线恢复血流。假手术组进行了相同的手术,但不插入栓线。在手术过程中始终维持大鼠体温和保持适宜环境温度。
1.2.2神经功能评分:参考经典Zea Longa[6]评分标准进行神经行为学评分。按照5分制评分原则(0分:无神经功能受损体征,活动正常;1分:不能完全伸展对侧前爪;2分:行走时向对侧转圈;3分:向对侧倾倒;4分:不能自发行走,意识丧失)对缺血再灌注24 h 后的大鼠进行神经功能缺失评分。得分在2~4分,说明造模成功。
1.2.3脑含水量测定:实验结束后每组各10只,于再灌注24 h 后,采用1%戊巴比妥钠【0.3 mL/(100 g·bw)】腹腔麻醉安乐后取脑,在冰盒上迅速分离右侧脑组织并称重(湿重)。再将右侧脑组织在干燥箱110 ℃烘干24 h至恒重(干重)。按下式公式计算:
脑组织含水量(%)=(湿重-干重)/湿重×100%
1.2.4血脑屏障通透性的检测:采用伊文思蓝染料(EB)法测定BBB的通透性。实验结束后每组各10只大鼠,于再灌注23 h 后经尾静脉注射2% 伊文思蓝【4 mL/(kg·bw)】,注射2 h后,采用1% 戊巴比妥钠麻醉后,打开大鼠胸腔,从左心室插入注射针头,于右心耳部剪一小口,向内注入0.9% 氯化钠溶液,直至右心耳流出液体变清亮,表明已将残存于血管内生物EB充分排出,然后开颅取脑,沿正中线称取脑损伤部位约100 mg脑组织,将其浸泡在3 mL甲酰胺中, 50 ℃ 水浴72 h,1 500 r/min离心10 min,取上清液。用分光光度计(λ=630 nm),测定上清液A值,计算每克脑组织中EB的含量(μg/g脑组织)。
1.2.5血清中NSE及S100-β 蛋白含量检测:实验结束后,将大鼠麻醉后腹主动脉取血,离心取上清,-80 ℃下冻存备用。按照试剂盒说明书,采用ELASA法检测血清中NSE及S100-β 蛋白。
1.2.6HE染色:给药及建模同上,每组5只大鼠。再灌注24 h后,将麻醉后大鼠用4%多聚甲醛进行心脑灌注,然后取脑组织,将脑组织放入10%多聚甲醛固定,常规脱水、石蜡包埋切片。将组织切片脱蜡,苏木精染色,伊红复染,水洗,脱水,透明,封片。光镜下观察拍照。
1.2.7尼氏小体染色:将组织切片用甲酚紫溶液56 ℃ 染色60 min,蒸馏水洗涤2次,95%乙醇分化2次,每次2 min;切片在100% 乙醇中脱水5 min,在二甲苯中清除5 min。封片,在光镜下观察Nissal染色的细胞。正常神经元细胞内含丰富的细胞质和大的细胞体,伴有大量尼氏小体。而细胞受损时胞体萎缩,细胞核浓缩,尼氏小体减少或缺失。
1.3 统计学分析
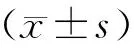
2 结果
2.1 CPPS对MCAO诱导的缺血大鼠的影响
大鼠建立脑MCAO模型后进行神经功能缺损评分。假手术组无神经功能缺失,评分为0分。与假手术组相比,模型组大鼠神经功能学评分增加(3.20±0.79,P<0.01),提示严重功能障碍(表1)。与模型组相比,依达拉奉组大鼠神经功能评分明显降低(2.20±0.79,P<0.05),具有统计学意义。CPPS高剂量组明显降低,具有统计学意义(2.20±0.79,P<0.05 ),CPPS低剂量组神经功能评分也降低但无统计学意义(2.50±0.85)。

表1 大鼠神经功能评分Table 1 Neurological function scores of rats
同样,与假手术组相比,模型组大鼠脑含水量增加(79.17%±0.35%,P<0.01)。与模型组相比,依达拉奉组大鼠脑含水量明显降低(76.95%±0.67%,P<0.01)。CPPS高剂量组脑含水量明显降低,具有统计学意义(77.22%±0.51%,P<0.01),CPPS低剂量组脑组织含水量降低但无统计学意义(79.07%±0.67%)(图1)。
注:与假手术组比较,#P<0.01;与模型组比较,*P<0.01。Note:Compared with the namely sham operation group,#P<0.01;Compared with the model group,*P<0.01.图1 大鼠脑含水量Fig.1 The water content in rat brain
2.2 CPPS对缺血再灌注大鼠BBB通透性的影响
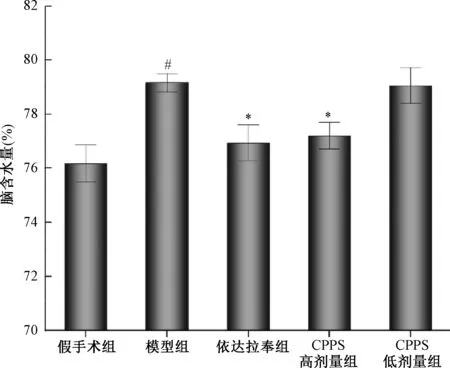
与假手术组相比,模型组大鼠脑组织EB含量增加(302.85±35.77,P<0.01)。与模型组相比,依达拉奉组大鼠脑组织EB含量明显降低(249.93±60.28,P<0.05)。CPPS高剂量组脑组织EB含量明显降低,具有统计学意义(233.58±39.50,P<0.01),CPPS低剂量组脑组织EB含量降低但无统计学意义(267.97±48.35)(图2)。
注:与假手术组比较,#P<0.01;与模型组比较,*P<0.05,**P<0.01。Note:Compared with the namely sham operation group,#P<0.01;Compared with the model group,*P<0.05,**P<0.01.图2 大鼠脑组织EB含量检测Fig.2 The determination of EB content in rat brain tissue
2.3 CPPS对MCAO大鼠神经元损伤的影响
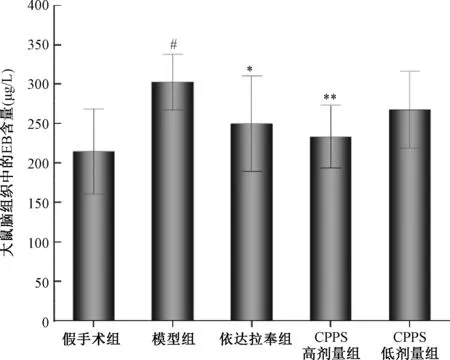
采用HE染色对MCAO诱导的缺血大鼠缺血侧神经元结构进行组织病理学分析。如图3所示,假手术组大鼠脑组织结构完整,排列规则紧密,胞质丰富,细胞核清晰。与假手术组相比,模型组大鼠脑组织疏松、细胞排列紊乱,神经元出现坏死、核固缩。依达拉奉组及2个CPPS组均有明显改善。
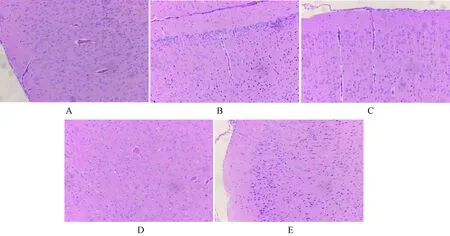
注:A.假手术组;B.模型组;C.依达拉奉组;D.CPPS低剂量组;E.CPPS高剂量组。Note:A. Sham operation group;B. Model group;C. Edaravone group;D. CPPS low-dose group;E. CPPS high-dose group.图3 大鼠缺血侧神经元HE染色结果(×200)Fig.3 The results of HE staining of neurons on the ischemic side of rats (×200)
用尼氏染色法观察神经元形态。结果如图4所示,假手术组神经细胞结构清晰,胞质中尼氏小体分布均匀,呈蓝色颗粒状;模型组脑组织水肿疏松,神经元胞质浓缩,核固缩,尼氏体染色不清;依达拉奉组及2个CPPS组有明显改善。
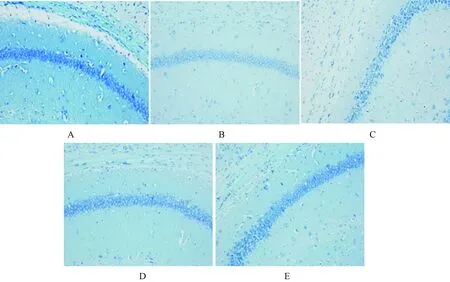
注:A.假手术组;B.模型组;C.依达拉奉组;D. CPPS低剂量组;E.CPPS高剂量组。Note:A. Sham operation group; B. Model group; C. Edaravone group; D. CPPS low-dose group ;E. CPPS high-dose group.图4 尼氏染色法观察神经元形态(×200)Fig.4 Observation of neuronal morphology by Knell’s staining (×200)
2.4 CPPS对缺血再灌注大鼠血清中NSE及S100-β水平的影响
与假手术组相比,模型组大鼠血清中S100-β蛋白含量增加(0.135±0.008,P<0.01)。与模型组相比,依达拉奉组大鼠血清中S100-β蛋白含量明显降低(0.116±0.013,P<0.01)。CPPS高剂量及低剂量组血清中S100-β蛋白含量明显降低,具有统计学意义(0.116±0.010,P<0.01)(0.112±0.012,P<0.01)(图5)。
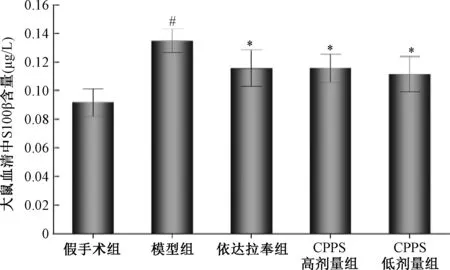
注:与假手术组比较,#P<0.01;与模型组比较,*P<0.01。Note:Compared with the namely sham operation group,#P<0.01;Compared with the model group,*P<0.01.图5 大鼠血清中S100-β 蛋白含量Fig.5 The content of S100-β protein in serum of rats
同样,与假手术组相比,模型组大鼠血清中NSE含量增加(2.62±0.37,P<0.01)。与模型组相比,依达拉奉组大鼠血清中NSE含量明显降低(2.01±0.99,P<0.01)。CPPS高剂量及低剂量组血清中NSE含量明显降低,具有统计学意义(2.03±0.22,P<0.01)(2.14±0.14,P<0.01)(图6)。
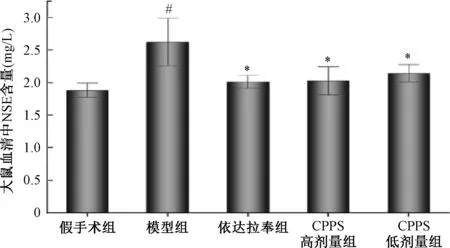
注:与假手术组比较,# P<0.01;与模型组比较,*P<0.01。Note:Compared with the namely sham operation group,# P<0.01;Compared with the model group,*P<0.01.图6 大鼠血清中NSE含量Fig.6 The NSE content in rats serum
3 讨论
卒中是全球第二大死亡原因,而且卒中的流行率正在上升[7]。缺血性卒中是最常见的卒中形式,以大脑动脉闭塞引起的脑组织损伤为特征,具有较高的发病率、死亡率、致残率和复发率[8]。
S100蛋白是一类相对分子质量较小及具有广泛的生物学特性的钙结合酸性蛋白。S100-β蛋白属于S100蛋白家族的亚型之一,主要位于中枢神经系统的星形胶质细胞、少突胶质细胞以及周围神经的雪旺细胞内,是神经胶质细胞的标记蛋白[9]。在正常情况下,S100-β蛋白不能通过血脑屏障(BBB),即对自发的神经系统活性无明显影响。但患脑外伤、缺血缺氧性脑病及脑血管病时,BBB受损,S100-β蛋白既可直接经受损的BBB,又可以经脑室内的脉络丛或蛛网膜下腔的蛛网膜颗粒进入血液,以导致血清中S100-β蛋白的含量增加。有研究证实,急性脑卒中(acute ischemic stroke,AIS)患者血清S100-β浓度与梗死体积之间存在显著相关性[10]。因此,血清S100-β可作为卒中严重程度的有效监测指标[11]。
神经元特异性烯醇化酶(NSE) 是由2-磷酸甘油转化成磷酸烯醇丙酮酸的限速酶,由α、β、γ 3种亚基以二聚体形式组成5种同工酶,其中γγ型,即NSE特异性地存在于神经元细胞和神经内分泌细胞中,脑胶质细胞和其他神经组织中不含这种酶,是神经元的标志酶[12]。烯醇化酶γ是一种主要存在于神经元和神经外胚层细胞中的酶,能将厌氧葡萄糖转化为适于氧化的代谢物。健康人血清NSE水平低,然而,在神经组织损伤如脑损伤或卒中后,NSE可迅速从细胞内释放并进入细胞间隙,进而释放入脑脊液(CSF)或通过血-脑脊液屏障(blood-cerebrospinal fluid barrier, BCB)进入外周血,血液中的NSE水平会出现强烈的升高,从而作为脑损伤的生物标志物[13]。因此,NSE是观察脑内神经元损伤的量的指标,在原发或激发的神经系统疾病患者中检测血清NSE水平有一定的价值。
由于NSE和S100-β蛋白在脑内的分布存在差异性,缺血再灌注损伤后大鼠除脑血管外,神经元、髓鞘和各种胶质细胞等都有一定程度的损害,因此,将二者的变化结合分析可以较为全面的反映I/R后脑组织的损伤情况。
对缺血性卒中具有明显治疗作用的药物成为当前研究的热点,特别是从天然来源中提取的副作用小的活性成分。多糖具有安全无毒的特性受到越来越多的关注[14]。党参多糖(CPPS)是党参主要生物活性成分之一,具有免疫调节、抗氧化及抗肿瘤[15]等作用而受到广泛关注。在前期的研究中,我们发现CPPS预处理可减小脑梗死面积,增加抗氧化酶活性,降低氧自由基含量,减少炎性因子的分泌,并能抑制Beclin-1表达,党参多糖具有保护脑缺血和再灌注损伤[16-17]。
本研究结果显示,与假手术组比较,所有I/R大鼠血清NSE和S100-β蛋白水平均有不同程度的升高,脑水肿明显,BBB通透性增大,提示大鼠全脑缺血再灌注损伤后存在NSE和S100-β蛋白水平升高加重脑组织损伤,脑水肿明显,脑组织通透性增加明显;与模型组相比较,给予党参多糖2个剂量组NSE和S100-β蛋白水平均有不同程度降低,脑水肿程度及通透性较轻,表明党参多糖在一定程度上可以抑制NSE和S100-β蛋白的释放,减轻脑损伤,从而起到对脑神经保护作用。
总之,本研究发现,党参多糖预处理可减轻脑缺血再灌注损伤后大鼠的脑水肿。
