D-半乳糖诱导青年树鼩卵巢衰老*
2023-11-02田川叶丽赵晓娟朱向情赵晶阮光萍潘兴华
田川叶丽赵晓娟朱向情赵晶阮光萍潘兴华
(中国人民解放军联勤保障部队第920医院基础医学实验室,云南省细胞治疗技术转化医学重点实验室,干细胞与免疫细胞生物医药技术国家地方联合工程实验室,昆明 650032)
卵巢作为衰老最敏感的器官之一,可随年龄增长而自然衰老,也可因疾病、感染、中毒等导致卵巢衰老,引起女性内分泌紊乱和全身组织器官结构退变以及功能衰退,导致女性不孕,并使卵巢衰老相关疾病高发[1]。卵巢衰老是一个长期而复杂的过程,其与神经、内分泌、免疫、氧化应激、遗传易感、线粒体受损等因素有关,然而,目前多因素导致卵巢衰老的分子机制并不完全清楚[2]。可见,一个合适的模式生物将有助于研究人员探索卵巢功能下降的危险因素和阐明其分子机制,并有助于预防或延缓卵巢衰老过程[3]。而树鼩的遗传、解剖、生理、神经、免疫等与人类相对接近,比现有的中小型实验动物更接近于人类,比猕猴等灵长类实验动物成本低,用于实验研究的结果对人类有较大参考价值[4-5]。此外,树鼩的体质量、体积均与大、小鼠相接近,实验操作方便,易于大规模实验研究[6]。因此,树鼩卵巢衰老模型是研究卵巢衰老的理想模型。
D-半乳糖(D-galactose,D-gal)作为一种还原糖,可通过半乳糖激酶和半乳糖1磷酸尿苷转移酶分解为葡萄糖代谢,使活性氧过度累积,破坏基因组的稳定性,引起氧化应激损伤,导致机体代谢紊乱、抗氧化应激系统失衡[7]。此外,D-gal可与蛋白质、氨基酸等游离基团发生反应,形成晚期糖基化终产物(advanced glycation end products,AGE),AGE通过与晚期糖基化终产物受体和其他受体结合,在卵巢颗粒、叶黄素和单核细胞等表面积聚,促进炎性反应,加速卵巢衰老。因此,D-gal被广泛用于抗衰老药物开发的动物模型研究。基于以上研究结果,本研究以树鼩来作为卵巢衰老的研究对象,利用D-gal诱导法,通过观测卵巢组织结构、增殖活性、细胞凋亡和衰老相关标志分子等指标,评价、建立卵巢衰老模型,可为卵巢衰老的研究提供技术参考方案。
1 材料和方法
1.1 材料
1.1.1实验动物:SPF级雌性青年树鼩(n=8)购买自中国科学院昆明动物研究所,实验动物生产许可证号【SCXK(滇)K2017-0003】,平均年龄3.5岁,体质量130~160 g,饲养于中国人民解放军联勤保障部队第920医院动物实验室,其环境清洁、卫生,达到动物饲养环境标准,实验动物使用许可证号【SYXK(军)2017-0051】,实验动物伦理审批号为:伦审2021-055(科)-01。
1.1.2主要实验试剂与器材:通用型中性组织固定液、HE染液(Servicebio)、Masson 染液(均Servicebio);Tunel 试剂盒(Vazyme);无水乙醇(天津市风船化学试剂科技有限公司);中性树胶(国药集团化学试剂有限公司);IX70-121倒置相差显微镜(Olympus);冰冻切片机(Thermo);D-gal(Sigme, G0750-50G)。
1.2 方法
1.2.1D-gal溶液配制及颈背部皮下给药:电子天平称取适量的D-gal粉末,倒入500 mL烧杯中加入无菌注射用水,用磁力搅拌器搅拌至透明,并配制成30%的D-gal溶液,于50 mL无菌离心管中备用。8只青年树鼩经1周适应性饲养、观察无异样后,随机分为对照组(n=4)与模型组(n=4),D-gal溶液按2.5 mL/g的剂量,给予模型组树鼩颈背部皮下注射,每天1次,连续给药5个月。
1.2.2HE染色:石蜡切片依次放入二甲苯Ⅰ 20 min、二甲苯Ⅱ 20 min、无水乙醇Ⅰ 5 min、无水乙醇Ⅱ 5 min、75%乙醇5 min,加双蒸水冲洗3次。苏木精染液染4 min,双蒸水冲洗3次,分化液处理5 min,加双蒸水冲洗3次,返蓝液处理5 min,加双蒸水冲洗3次。切片依次放入85%和95%乙醇脱水5 min,伊红染液处理5 min。切片依次放入无水乙醇I 5 min、无水乙醇II 5 min、无水乙醇Ⅲ 5 min、二甲苯Ⅰ 5 min、二甲苯Ⅱ 5 min透明。中性树胶封片。荧光倒置显微镜下观测、拍照。
1.2.3Ki67染色:切片依次放入环保型脱蜡液Ⅰ10 min、环保型脱蜡液Ⅱ10 min、环保型脱蜡液Ⅲ 10 min、无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、无水乙醇Ⅲ 5 min、ddH2O2冲洗。抗原修复,PBS(PH7.4)洗涤3次,每次5 min。组织周围画圈,加血清封闭30 min。加一抗(Ki67,1∶200),湿盒内4℃孵育过夜。PBS洗涤3次,每次5 min。加对应的二抗(CY3山羊抗兔,1∶200),避光室温孵育50 min。PBS洗涤3次,每次5 min,加DAPI染液,避光室温孵育10 min。PBS洗涤3次,每次5 min,加自发荧光淬灭剂B液5 min,ddH2O2冲洗10 min。加抗荧光淬灭封片剂封片。采集图像。
1.2.4Tunel染色:切片37 ℃烘箱烘烤15 min,4%多聚甲醛固定 30 min,PBS(pH 7.4)洗涤 3 次,每次5 min。组织周围画圈并加蛋白酶K工作液,37 ℃温箱孵育25 min。PBS洗涤 3 次,每次5 min。加破膜液室温孵育20 min,PBS洗涤3次,每次5 min。加1×平衡缓冲液室温孵育 10 min。加重组末端脱氧核糖核苷酸转移酶、BrightRed Labeling Mix、5×平衡缓冲液和ddH2O2的混合液,37 ℃孵育2 h。PBS洗涤 3 次,每次5 min。加 DAPI 染液室温避光孵育10 min。PBS洗涤 3 次,每次5 min。加抗荧光淬灭封片剂进行封片。荧光倒置显微镜下观测、拍照。
1.2.5免疫组织化学染色 :切片依次放入二甲苯Ⅰ 20 min、二甲苯Ⅱ 20 min、无水乙醇Ⅰ 5 min、无水乙醇Ⅱ 5 min、75%乙醇5 min后,双蒸水冲洗3次。EDTA抗原修复液处理5 min,中火8 min、停火8 min、低火7 min。PBS洗涤3次,每次5 min。组织周围滴加BSA孵育30 min,加一抗(P53/21/16)4 ℃过夜,PBS洗涤3次后,每次5 min。二抗孵育60 min。抗荧光淬灭封片剂封片。DAPI染液孵育10 min。PBS洗涤3次,每次5 min,再用抗荧光淬灭封片剂封片。荧光倒置显微镜下观察并采集图像。
1.3 统计学分析
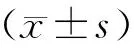
2 结果
2.1 卵巢组织结构变化
对照组树鼩卵巢组织细胞排列整齐,间质和髓质界限明显,可见原始卵泡(黑色箭头)、初级卵泡(蓝色箭头)、次级卵泡(橙、绿色箭头)、成熟卵泡(紫色箭头),并有可见少量闭锁卵泡(深蓝色箭头)。模型组树鼩卵巢组织细胞排列散乱,间质和髓质界限模糊,局部只见原始卵泡(黑色箭头)、初级卵泡(蓝色箭头)、次级卵泡(橙色箭头)且其数量显著低于对照组树鼩,还可见大量闭锁卵泡(深蓝色箭头)(图1)。
注:黑色箭头:原始卵泡;蓝色箭头:初级卵泡;橙、绿色箭头:次级卵泡;紫色箭头:成熟卵泡;深蓝色箭头:闭锁卵泡。Note:Black arrow:primitive follicles;blue arrow:primary follicles;Orange,green arrow:secondary follicles; purple arrow:mature follicles;dark blue arrow: atretic follicles.图1 卵巢组织HE染色Fig.1 HE staining of ovarian tissue
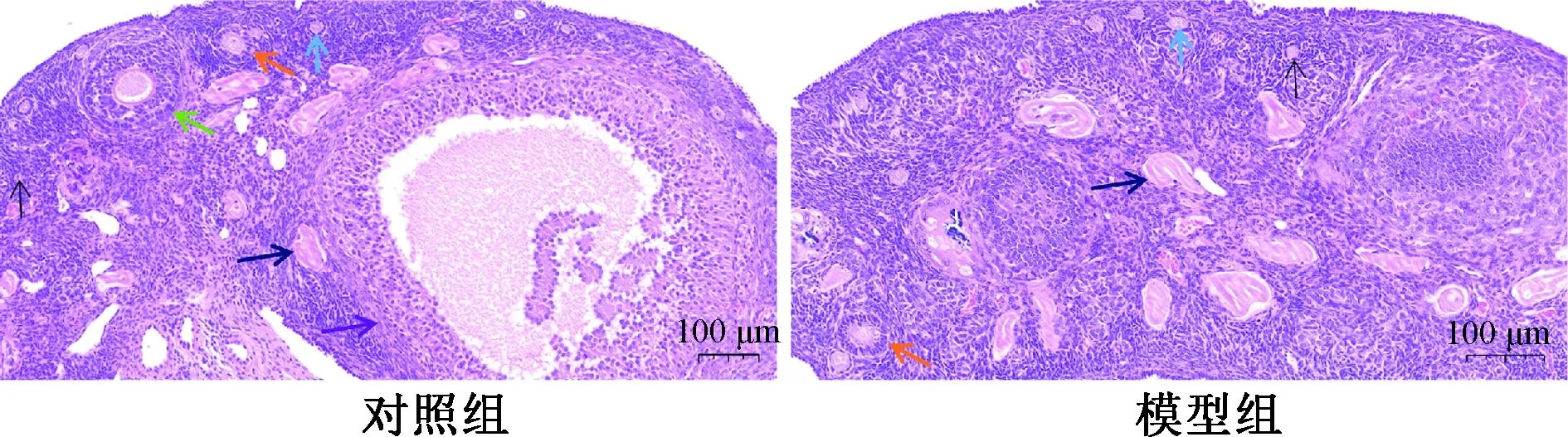
2.2 P53、P21、P16蛋白表达
P53、P21、P16标记的细胞,蓝色为细胞核。结果显示,模型组可见大量P53、P21、P16标记的棕褐色细胞,而对照组局部只见少量棕褐色细胞。统计学分析结果显示,模型组P53、P21、P16标记的阳性细胞率显著高于对照组,表明模型组卵巢组织中P53、P21、P16的蛋白表达水平均显著高于对照组(图2)。
*P<0.01,**P<0.001图2 卵巢组织免疫组织化学染色Fig.2 Immunohistochemical staining of ovarian
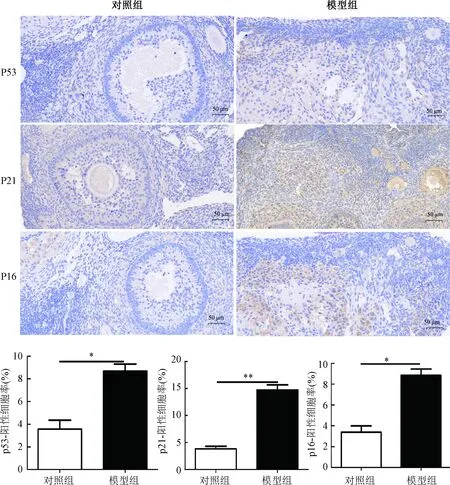
2.3 细胞分裂增殖
Ki67标记的细胞,蓝色为细胞核被。Ki67染色结果显示,对照组成熟卵泡中可见大量红色荧光,而模型组局部只见少量红色荧光,统计学分析结果表明,对照组Ki67标记的阳性细胞率显著高于模型组(图3)。
*P<0.001图3 卵巢组织Ki67染色Fig.3 Ki67 staining of ovarian
2.4 细胞凋亡
红色为凋亡的细胞,蓝色为细胞核。结果显示,对照组树鼩卵巢局部只见少量红色荧光,而经D-gal背颈部注射5个月后可见有大量红色荧光出现,表明对照组树鼩卵巢仅有少量细胞凋亡,模型组树鼩卵巢有大量细胞凋亡(图4)。
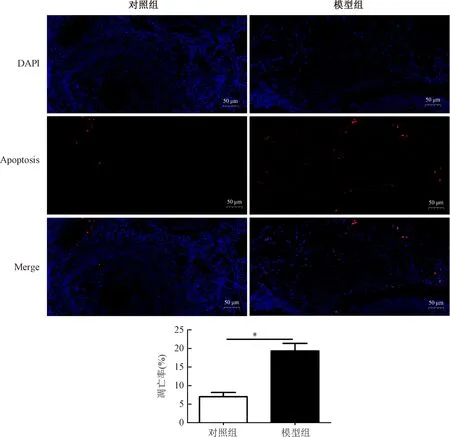
*P<0.01图4 卵巢组织Tunel染色Fig.4 Tunel staining of ovarian
3 讨论
目前,多种因素导致卵巢衰老的女性人群不断增多,而针对卵巢衰老的治疗方法多是延缓疾病发展,并不能从根本上解决卵巢衰老诱发的内分泌紊乱、多组织器官结构衰退和不孕等问题,且会伴随相关并发症的发生,如激素替代治疗会引起乳腺癌、血栓和卵巢癌等病发,究其原因部分是因为引起卵巢衰老关键的细胞和分子调控机制尚不明确。获得与人类更为接近的卵巢衰老模型是解析卵巢衰老发生发展的关键要素之一。因此,树鼩属于非人类灵长类动物,其遗传和生理生化等与人类相近,通过D-gal诱导法建立树鼩卵巢衰老模型,获得的研究结果将对女性卵巢衰老治疗具有更重要的参考价值。
卵巢衰老被认为是以卵泡数量逐渐减少为主导的,这与卵母细胞的质量下降相一致[8]。卵巢衰老的典型特征是组织结构破坏、卵母细胞数量减少且质量降低、卵泡闭锁。衰老作为一个渐进的、不可逆转的病理生理过程,表现为组织和细胞功能下降,各种与衰老相关的疾病风险显著增加[9]。本研究的HE结果显示,青年健康雌性树鼩经D-gal溶液行颈背部注射5个月后,卵巢组织细胞排列散乱,局部只见少量原始卵泡和初级卵泡,并有大量闭锁卵泡。在小鼠模型上,通过连续皮下注射D-gal约6周已被证明可以加速大脑、肾、肝衰老,降低血浆中抗苗勒氏激素(AMH),诱导卵巢衰老[10]。这和本研究的实验结果相一致,提示D-gal溶液经颈背部给药可使青年树鼩卵巢组织结构破坏、卵泡闭锁。
激活P53-P21-和P16依赖的DNA损伤反应可减弱细胞的增殖能力,加速细胞衰老。研究表明,肿瘤蛋白P53可通过调节细胞周期停滞和细胞凋亡来决定DNA损伤检查点反应的结果,故在DNA损伤反应中起核心作用,包括对细胞衰老、基因组不稳定、线粒体功能障碍和代谢途径改变等调控方面扮演重要角色[11]。P21作为细胞周期进程的关键负调控因子,它可以与细胞周期蛋白依赖性激酶和特定的细胞周期蛋白形成复合物,在特定阶段诱导细胞周期阻滞,稳定P21蛋白表达,可导致细胞周期阻滞在G1期[12]。仅P21就足以驱动细胞衰老程序,包括转录组改变、DNA损伤、线粒体功能障碍和衰老相关的分泌表型[13]。P16细胞周期调节因子是最经典的衰老生物标志物之一,因为它在胚胎发育早期被抑制,在衰老过程中逐渐被激活,在细胞衰老和干细胞动力学等导致衰老的关键细胞命运决定中起着至关重要的作用[14]。P16抑癌基因在衰老组织中积聚,是细胞衰老的生物标志物,其在体内限制干细胞的功能[15]。本实验中,与对照组相比较,模型组卵巢组织中P53、P21、P16的蛋白表达水平均显著升高,提示了青年雌性健康树鼩经D-gal溶液行背颈部给药5个月,可诱导卵巢组织细胞衰老。
Ki67是细胞周期进程和进入静止状态以来的时间的分级标记,作为一种和细胞周期相关的蛋白质,可间接反映细胞增殖活性[16],Ki67染色在临床上被广泛用作增殖指标。因此,我们利用Ki67染色来观测经D-gal干预后细胞的增殖活性,结果显示,对照组细胞增殖活性显著高于模型组。有研究在单细胞水平观测内源性调控下Ki67水平随时间的变化,发现Ki67的积聚只发生在S、G2和M期[16]。
卵母细胞凋亡导致卵巢功能不全[17],颗粒细胞凋亡会导致卵泡闭锁[18]。卵巢卵泡池的大小受细胞凋亡和自噬的调节,前者是导致生理性下降的原因,后者在青春期前的生理性卵泡池缩小中起主要作用[19]。也有研究表明,衰老的卵泡间质细胞产生的与衰老相关的分泌表型相关的细胞分泌趋化因子配体,可能通过促进颗粒细胞凋亡而在卵巢衰老过程中损害卵泡的发育和成熟[20]。而本实验结果显示,青年健康树鼩经D-gal溶液行颈背部注射给药5个月后,TUNAL染色结果显示卵巢组织细胞凋亡率明显增加,且模型组树鼩卵巢组织可见大量的闭锁卵泡。有研究发现[21],在D-半乳糖诱导小鼠衰老的转录与代谢谱研究中,D-半乳糖对衰老的影响可能与糖和脂代谢紊乱、氧化损伤、晚期糖基化终末产物的积累和细胞凋亡显著相关[21]。这些研究结果提示了D-gal可诱导卵巢衰老,而这可能是由于卵巢细胞凋亡增加所导致的。
综上所述,可见D-半乳糖按8 g/kg的剂量给予青年树鼩颈背部皮下注射给药5个月,可使卵巢组织结构散乱,衰老标志分子P53、P21、P16蛋白表达上调,使细胞分裂增殖能力减弱,细胞凋亡率增加,从而诱导卵巢衰老。
