11C-β-CFT PET/CT与TCS检测对PD及APS的鉴别诊断价值研究*
2023-10-26杨天宇
许 璐,庞 华,刘 双,翁 宇,杨天宇,左 睿
(重庆医科大学附属第一医院核医学科,重庆 400016)
帕金森病(PD)患病率随年龄的增长而增加,60岁以上人群中有1%的人罹患PD[1]。2016年,全球PD诊断率是1990年的2.4倍,其发病率的上升可能与PD诊断方法的改进、对疾病进一步的认识及人均寿命的延长等有关[2]。目前临床缺乏诊断PD的“金标准”,主要依靠临床症状及体格检查。PD患者运动症状主要表现为静止性震颤、运动迟缓、强直[1],但以上症状并无特异性,相似表现也可见于非典型帕金森综合征(APS),因此早期准确诊断PD显得尤为困难。
PD是一以α-突触核蛋白为主要病理特征的疾病,其中多巴胺能神经的缺失被认为可能是造成运动症状的原因[3-4]。运动症状是临床诊断PD的关键,早期评估多巴胺能神经元受损情况显得十分重要。11C-甲基-N-2β-甲基酯-3β-(4-氟-苯基)托烷(11C-β-CFT)正电子发射断层显像/X线计算机体层成像(PET/CT)及经颅超声(TCS)检测分别从功能和结构角度评估PD患者神经元损伤情况[5],进而辅助临床诊断并探讨其与临床基本特征的相关性。然而,上述检测方法单独应用时,诊断准确性均受到一定限制[6-8],本研究评估了2种检测的相关性及联合显像的可能性。
1 资料与方法
1.1一般资料 选取2020年5月至2021年6月本院核医学科行11C-β-CFT PET/CT检测的患者91例,其中PD 55例(PD组),APS 36例(APS组)。同时选取无相关神经系统疾病的健康者11例作为对照组。PD的最终诊断均是神经内科专家在评估患者疾病状态及辅助检查的基础上依据目前广泛使用的诊断指南[9]确定的,所有确诊患者均具有至少1年的随访记录。APS指其他中枢神经系统变性疾病,如多系统萎缩、进行性核上性麻痹等。根据黑质回声强度将研究对象(对照组11例,PD组39例,APS组29例,部分研究对象因颅骨影响,黑质显示不清而未纳入分析)分为阳性组(38例)和阴性组(41例),其中黑质回声强度Ⅰ、Ⅱ级为阴性,≥Ⅲ级时测量高回声面积,单侧高回声面积大于或等于0.20 cm2时为阳性。所有研究对象均签署知情同意书,本研究经医院医学伦理委员会批准(批准文号:2021-516)。
1.2方法 收集研究对象基本临床资料,包括性别、年龄、病程、受教育程度等。采用统一PD评定量表第三部分(UPDRS-Ⅲ)、改良Hoehn&Yahr分级(H&Y分级)及简易智力状态检查量表(MMSE)评估患者运动症状及智力状态。(1)11C-β-CFT PET/CT检测:采用Philips Gemini TF 64 PET/CT显像设备成像。检测前,患者安静休息约30 min,经肘静脉注射示踪剂11C-β-CFT(本院核医学科合成,放化纯度大于90%)555~740 MBq,安静休息40~60 min后进行脑部扫描,患者平躺于扫描床上,头颅固定在头托内,扫描范围包括整个头颅,头部采集1个床位。在电压120 keV、电流100 mA、层厚3~5 mm的采集条件下,在同一视野内用三维模式进行PET采集,采集时间15~20 min。随后以电压120 keV、电流100 mA、矩阵512×512、层厚2 mm的采集参数得到同一部位的CT图像。经过计算机衰减矫正、迭代重建后,获得横断面、矢状面、冠状面的PET、CT及PET/CT融合图像。在11C-β-CFT PET/CT检测前,停服抗PD药物12 h,停服多巴受体激动剂72 h。(2)TCS检测:采用Canon Aplio 800超声诊断仪,深度设置为14~17 cm,将探头选择、图像增益和亮度以黑质显示清晰为标准进行调整。患者取侧卧位,沿轨道听觉线的轴线对中脑的水平横截面进行扫描,将中脑调整至图像中心,应用配套软件分析处理图像。TCS检测由经验丰富的主治医师以上级别的超声科医师对两侧黑质回声评估分级,并测量黑质高回声的总面积,测量2次,取平均值。所有影像医师对患者临床资料不知情。(3)11C-β-CFT PET/CT图像分析:采用感兴趣区(ROI)方法,选取CT图像上显示纹状体最为清晰的3帧连续图像,逐层手动勾画以下各区:双侧尾状核、双侧前/后壳核、双侧小脑皮层。计算机自动给出各区的平均放射性计数。所有ROI均由同一名核医学专业主治医师独立重复勾画,取平均值。尾状核、前壳核及后壳核的11C-β-CFT摄取值均取左右两侧的平均值。纹状体11C-β-CFT分布的不对称性则用不对称指数表示。选取缺乏多巴胺转运蛋白(DAT)分布的小脑皮层作为参考区,计算公式如下:11C-β-CFT摄取值=ROI放射性计数值/小脑皮层放射性计数值—1;不对称指数=(高侧11C-β-CFT摄取值—低侧11C-β-CFT摄取值)/两侧11C-β-CFT摄取值平均值。(4)TCS图像分析:先对两侧黑质回声评估分级,再测量黑质高回声的总面积,测量2次,取平均值。黑质高回声面积指黑质回声强度大于Ⅲ级的面积。黑质回声分级(5级):Ⅰ级为黑质回声强度较脑干组织相近;Ⅱ级为黑质回声呈短线状或逗点状;Ⅲ级为黑质回声较脑干组织明显增强,但低于中脑周围环池,呈斑片状;Ⅳ级为黑质回声与中脑周围环池相似,呈团块状;Ⅴ级为黑质回声明显高于中脑周围环池,呈片状。
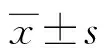
2 结 果
2.1各组一般资料比较及相关性分析 PD组、APS组、对照组一般资料(MMSE评分、H&Y分级除外)比较,差异无统计学意义(P>0.05)。见表1。阳性组、阴性组一般资料(UPDRS-Ⅲ评分除外)比较,差异无统计学意义(P>0.05)。见表2。H&Y分级与UPDRS-Ⅲ评分呈正相关(r=0.629,P<0.001),MMSE评分与受教育程度呈正相关(r=0.512,P<0.001)。

表1 PD组、APS组、对照组一般资料比较

表2 阳性组、阴性组一般资料比较
2.2PD组、APS组、对照组11C-β-CFT PET/CT检测参数比较 PD组、APS组、对照组11C-β-CFT PET/CT检测参数(尾状核不对称指数除外)比较,差异有统计学意义(P<0.05)。见表3。对照组各检测参数与PD组比较,差异有统计学意义(P<0.05)。对照组各检测参数(尾状核11C-β-CFT摄取值、尾/壳除外)与APS组比较,差异有统计学意义(P<0.05)。PD组尾状核及前壳核11C-β-CFT摄取值与APS组比较,差异有统计学意义(P<0.05)。见表4。典型纹状体11C-β-CFT PET/CT显像见图1。

注:对照组中,横断面(a)和冠状面(b,c)图像分别显示正常纹状体,并可在不同层面的PET/CT上显示熊猫眼征(b)和蝴蝶征(c)。d~f图像来自1例女性PD患者(53岁),该患者右上肢震颤12年,运动迟缓10年。横断位(d)和冠状位(e,f)图像显示尾状核和壳核存在缺失,尤其是左侧壳核后部(箭头)。
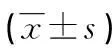
表3 PD组、APS组、对照组11C-β-CFT PET/CT检测参数比较
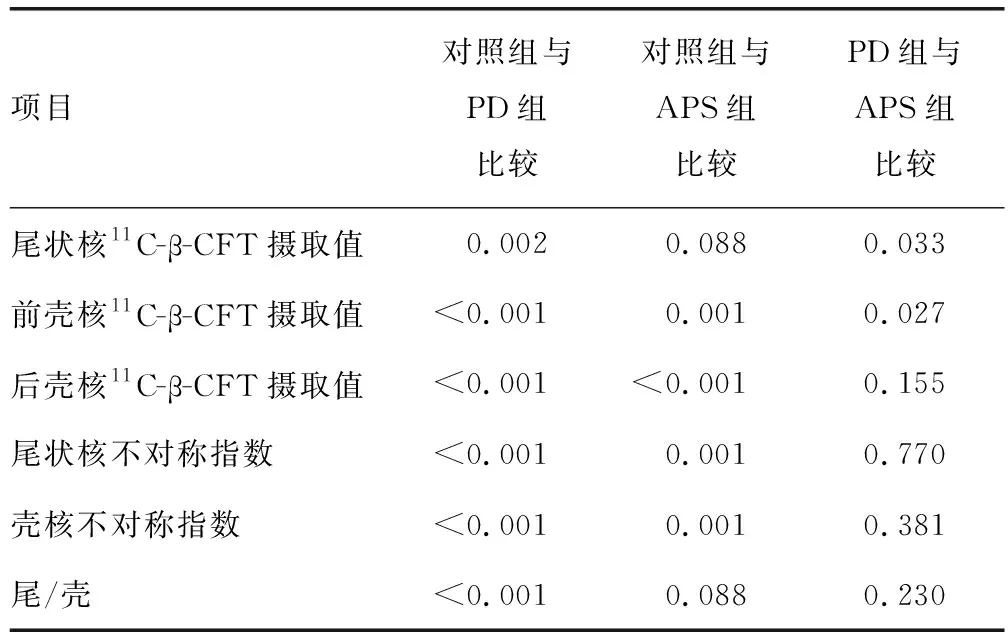
表4 PD组、APS组、对照组11C-β-CFT PET/CT检测参数两两比较统计值(P)
2.3PD组、APS组、对照组TCS检测参数比较 PD组、APS组、对照组黑质高回声面积分别为(0.12±0.19)、(0.22±0.17)、(0.23±0.23)cm2,差异无统计学意义(P>0.05)。
2.4阳性组、阴性组11C-β-CFT PET/CT检测参数比较及相关性分析 阳性组、阴性组11C-β-CFT PET/CT检测参数比较,差异无统计学意义(P>0.05)。11C-β-CFT PET/CT检测参数与黑质高回声面积无相关性(P>0.05)。见表5。

表5 阳性组、阴性组11C-β-CFT PET/CT检测参数比较[M(P25,P75)或
2.511C-β-CFT PET/CT诊断效能分析 在对照组和各疾病组中进行ROC分析时发现,后壳核11C-β-CFT摄取值PD和APS的诊断效能最佳(截断值为1.368)。见表6。将11C-β-CFT PET/CT检测的所有参数纳入logistic回归分析时发现,各参数联合诊断价值不大,诊断效能不如单一指标。在PD组和APS组中进行ROC分析时发现,前壳核11C-β-CFT摄取值鉴别PD和APS的诊断效能相对较高(AUC为0.638,截断值为0.920),但仍不能对PD和APS准确鉴别。见表7。

表6 11C-β-CFT PET/CT在各疾病组和对照组中的诊断价值
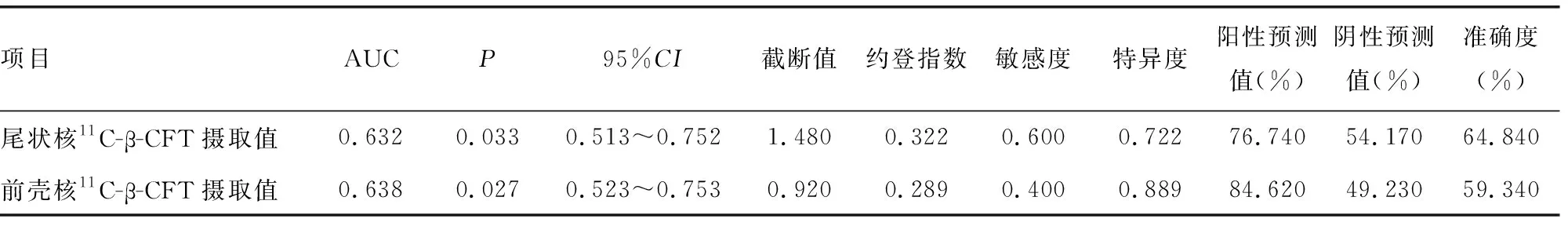
表7 11C-β-CFT PET/CT在PD组和APS组中的诊断价值
3 讨 论
在疾病早期,最先出现多巴胺能神经元受损部位一般为壳核后部,并且主要发生在症状首发侧的对侧,这是本研究关注不对称指数的原因。本研究结果显示,3组尾状核不对称指数无显著差异。这可能是因为纳入患者多处于疾病早中期,尾状核的多巴胺能神经元受损还不严重,双侧尾状核的多巴胺能神经功能未明显下降。除尾状核不对称指数外,对照组各检测参数与PD组比较,差异有统计学意义(P<0.05)。对照组各检测参数(尾状核11C-β-CFT摄取值、尾/壳除外)与APS组比较,差异有统计学意义(P<0.05)。提示这些检测参数可识神经退行性疾病患者,与以往研究[10]结论类似,最新的PD诊断指南也将其列入排除标准之一[11]。
SUN等[10]研究未能在PD与APS间发现11C-β-CFT摄取值的不同。本研究结果显示,PD和APS患者的部分感兴趣区11C-β-CFT摄取值存在显著差异,但存在差异的区域并不是最先受损的后壳核,而是在疾病进展后期才被累及的前壳核及尾状核。黑质多巴胺能神经元的丢失是神经退行性疾病的共同病理基础[12-13]。神经退行性疾病的DAT表达随病情进展逐渐降低,多巴胺能神经元受损范围也随病情进展由壳核后部逐渐向尾状核扩展[14-16]。疾病早期,壳核的受损程度比尾状核严重。但随着病情进展,疾病严重程度与尾状核多巴胺能神经元丢失程度更具有相关性,这表明壳核对多巴胺神经元的丢失较敏感,而尾状核更能反映疾病进展情况。PD和APS疾病进展速度不同,多巴胺能神经功能受损程度不同[5,17],相应地,纹状体11C-β-CFT摄取值也不同。这可能是本研究中PD和APS患者11C-β-CFT摄取值存在差异的部位为前壳核及尾状核的主要原因。
壳核在PD患者运动症状出现前就已经丢失约50%的多巴胺能神经元,由于地板效应,壳核多巴胺能神经元丢失的速度会随疾病的进展减缓[5]。不同疾病间的差异在壳核中表现不明显,而疾病早期尾状核功能保存完好,更能反映临床症状出现后的多巴胺能神经元缺失,不同疾病间神经元缺失的差异更明显。但对ROI内的11C-β-CFT摄取值进行ROC分析时发现,AUC不到0.700,诊断效能并不高,这可能和纳入患者处于疾病早中期有关,但其可以为临床上鉴别诊断PD与APS提供一个方向。在疾病后期,前壳核和尾状核损害程度相对更重,APS及PD之间相应部位的11C-β-CFT摄取值差异是否会更明显,诊断价值是否能够得到提高,这都需要进一步研究。
TCS是通过检测黑质铁沉积引起的结构改变,以不同角度显示颅内结构来辅助PD的诊断及鉴别。11C-β-CFT PET/CT则是通过评估纹状体多巴胺能神经系统功能障碍程度来反映黑质受损情况[6,16]。2种检测方法均可用于评价黑质受损情况,不同之处在于,前者反映的是黑质本身的情况,后者则是间接地评估黑质状况,本研究未在二者间观察到显著相关性。PD患者运动障碍越严重,纹状体11C-β-CFT摄取值随之相应减少[18],说明11C-β-CFT PET/CT在评估多巴胺能神经元的丢失时具有时间依赖性。而黑质强回声面积大小与PD严重程度无关[14],本研究也未发现黑质强回声与病程的相关性,说明PD的黑质回声改变会随着时间的推移保持不变。以往的报道未发现PD患者纹状体11C-β-CFT摄取值减少与黑质高回声面积之间的确切联系,其可能是黑质损伤的独立但互补的标志物[19]。
本研究以黑质强回声面积0.200 cm2为截断值[14]进行分析时发现,阳性组、阴性组11C-β-CFT PET/CT检测参数比较,差异无统计学意义(P>0.05),与MASKOVA等[18]研究结果一致。BAE等[20]研究发现,黑质结构改变与11C-β-CFT摄取值有着较强关联,与本研究结果不一致。本研究结果与更多研究观点一致,即突触前多巴胺能神经末梢功能障碍和黑质结构改变由不同的机制产生,多巴胺能神经功能障碍和铁沉积可能是相互独立的,但也可能是由于黑质回声的评估主要依靠超声医师的主观判断,而不是定量分析,其准确性相对有限,且黑质高回声面积与11C-β-CFT摄取值之间的关系尚不明确[14,18-19]。本研究中,对照组有5例健康者黑质强回声面积达到阳性组的标准,虽然其尚未出现相关临床症状,而且11C-β-CFT PET/CT检测结果也未提示存在神经退行性疾病征象,但鉴于中脑黑质强回声已被认为是神经退行性疾病的先兆征象之一[7],这5例健康者患神经退行性疾病的风险增加,因此应定期随访以提高早期诊断的可能。
综上所述,11C-β-CFT PET/CT检测可以用于诊断神经退行性疾病,且后壳核11C-β-CFT摄取值诊断效能最高,APS与PD患者的11C-β-CFT摄取值存在差异,但其鉴别诊断效能欠佳。11C-β-CFT PET/CT检测在PD的诊断及鉴别中有一定优势,对于存在运动症状的疑诊PD患者,TCS检测也可提供一些有效信息,因此综合考虑各影像检测获得有效信息是必要的,以便辅助早期准确诊断。神经退行性疾病相关研究都存在临床诊断不确定的局限性,由于疾病发生部位的特殊性,尸检才是“金标准”。本研究纳入的患者随访了至少1年,但临床资料并不能取代“金标准”。受颞骨影响,部分患者黑质显示不清,且黑质强回声面积的测量是通过视觉分析而不是定量分析,这可能造成一定偏倚。
