云南香格里拉不同海拔葡萄果皮酚类物质差异及成因分析
2023-10-25张柯楠尹海宁王家逵曹建宏惠竹梅
张柯楠,尹海宁,王家逵,曹建宏,惠竹梅,3
云南香格里拉不同海拔葡萄果皮酚类物质差异及成因分析

1西北农林科技大学葡萄酒学院,陕西杨凌 712100;2香格里拉酒业股份有限公司,云南香格里拉 674400;3陕西省葡萄与葡萄酒工程技术研究中心,陕西杨凌 712100
【目的】酚类物质是酿酒葡萄的重要次级代谢产物,对葡萄和葡萄酒的品质有重要影响。结合土壤及气候因子研究不同海拔葡萄果皮酚类物质含量的差异及成因,为高海拔酿酒葡萄种植及葡萄品质差异化管理提供理论依据。【方法】本研究以云南香格里拉产区酿酒葡萄‘梅尔诺’(Merlot)为试材,连续3年(2020、2021、2022年)分析2个海拔(2 181、2 300 m)成熟期葡萄果皮总酚、总类黄酮、总单宁、总花色苷、单体花色苷及非单体花色苷酚类物质含量差异,同时监测葡萄生长发育期间不同海拔的光照、温度、湿度等气候因子,进而分析气候因子对葡萄果皮酚类物质的影响。【结果】两个海拔葡萄园土壤主要矿质养分无显著差异,光照、紫外线强度、温湿度等气候因子存在一定差异。海拔对葡萄果皮酚类物质含量具有显著影响,较高海拔有利于葡萄果皮酚类物质的积累。在2020—2022年,海拔(2 300 m)葡萄果皮总酚、总单宁、总花色苷、大部分单体花色苷以及槲皮素物质含量显著高于海拔2 181 m,其中总单宁含量提高幅度为56.27%—174.49%;而海拔2 181 m处葡萄果皮的总类黄酮含量显著高于海拔2 300 m,提高32.25%—79.48%。OPLS-DA分析显示,两个海拔葡萄果皮酚类物质的主要差异化合物为总单宁(TTC)、总类黄酮(TFo)、二甲花翠素-3--葡萄糖苷(Mv)、二甲花翠素-3--(6--乙酰化)葡萄糖苷(Mv-Ace)、花青素-3--葡萄糖苷(Cy)以及甲基花青素-3--葡萄糖苷(Pn)。灰色关联分析显示,葡萄生长季昼夜温差对葡萄果皮总酚和总类黄酮含量影响较大;光照强度和紫外线强度对果皮总花色苷、单体花色苷和槲皮素含量影响较大;3种单体花色苷(Pt、Pn-Ace和Pn-Cou)和槲皮素含量主要受葡萄转色期(7月)光照强度的影响。【结论】不同海拔昼夜温差、光照强度和紫外线强度是引起葡萄果皮酚类物质含量显著差异的主要气候因素。高海拔下较大的昼夜温差、光照强度和紫外线强度有利于葡萄果皮总酚、槲皮素、总花色苷及其单体物质的积累。
葡萄;酚类物质;海拔;气候因子;灰色关联分析
0 引言
【研究意义】葡萄()是世界上最重要的果树之一,葡萄浆果中含有丰富的营养物质[1]。酚类物质(phenolics)作为葡萄果实的重要次级代谢产物,不仅可以保护植物免受生物和非生物胁迫,还可影响葡萄及葡萄酒的颜色和口感[2-5]。酚类物质的合成途径包括类黄酮和苯丙烷途径,其中花色苷、类黄酮、单宁等物质是主要的类黄酮途径代谢产物[6],也是决定葡萄与葡萄酒品质的重要指标。近年来全球气候持续变暖,葡萄品质易受到高温干旱气候的影响,而在温度较低的高海拔地区进行葡萄种植很可能成为应对气候变暖的一种途径[7]。因此,研究海拔及其环境因子对葡萄果实酚类物质的影响,有助于明确不同海拔葡萄酚类物质含量差异及成因,为高海拔酿酒葡萄产区葡萄园址选择、种植管理和差异化葡萄酒产品的研发提供理论依据。【前人研究进展】光照、温度、湿度、土壤、水分、地形等环境因子作为葡萄品质形成的基础,对葡萄生长发育至关重要,其中海拔作为主要影响因子之一,显著影响葡萄果皮酚类物质的积累[8-10]。不同海拔山地葡萄园在世界范围内分布较广,葡萄果皮中花色苷、单宁、儿茶素、表儿茶素等酚类物质含量也因海拔不同而存在显著差异[11-13]。海拔通过改变葡萄果实酚类物质含量进而影响葡萄和葡萄酒品质。JIN等[14]研究发现随海拔高度增加,‘赤霞珠’葡萄酒中总酚、总花色苷、总类黄酮和黄酮醇含量增加。为了应对不同海拔多样的微气候环境,葡萄一般通过调整代谢通路和代谢物如酚类物质进行适应[15-17]。通常随着海拔高度的增加,葡萄园空气温度逐渐降低,光照强度和紫外线辐射逐渐增强[18],不同的光强、光质、温度均会影响葡萄花色苷等酚类物质的积累[19-21]。同时,适宜的湿度可以促进葡萄、番茄等水果的光合作用,有利于可溶性固形物、Vc以及花色苷含量的提高。因此,人们在生产中通过微喷等农业技术提高作物微气候湿度以应对高温干旱的不利影响[22-26]。【本研究切入点】目前关于海拔对葡萄酚类物质影响的研究较多,但不同海拔酿酒葡萄品质尤其是酚类物质差异的成因研究较少,还需进一步深入研究。【拟解决的关键问题】本研究以酿酒葡萄梅尔诺(Merlot)为试材,分析不同海拔成熟期葡萄果皮总酚、总类黄酮、总单宁、总花色苷、单体花色苷组分和非单体花色苷酚类物质含量差异;同时,在葡萄生长发育期监测不同海拔葡萄园的气候因子,从气候因子角度综合探究不同海拔葡萄果皮酚类物质含量积累差异的原因,为不同海拔葡萄优质生产提供理论依据。
1 材料与方法
1.1 试验地概况
本试验于2020、2021和2022年在云南香格里拉产区德钦葡萄基地(28°10′ N,98°52′ E)进行,设置2个试验区,海拔分别为2 181 m和2 300 m(图1)。供试材料为欧亚种酿酒葡萄‘梅尔诺’(Merlot),定植于2008年,南北行向,株行距1.0 m×1.5 m,树形为单干双臂,采用短梢修剪,新梢间距为10—15 cm,叶幕高度和宽度分别为140 cm和80 cm,灌溉方式为滴灌,采用常规葡萄园管理方式,施肥、灌溉、病虫害防治采用相同标准。

图1 德钦葡萄基地采样点及等高线示意图
1.2 试验材料
在果实转色后,每隔3—5 d随机采集试验区果实样品测定可溶性物含量及含酸量,监测果实成熟曲线,当果实可溶性物含量趋于稳定不再上升(即27%左右),且种子变为棕褐色时采集葡萄样品(2020年9月16日、2021年9月20日、2022年9月22日)。于每个海拔葡萄园随机选取10株生长势一致的葡萄植株,在每株葡萄树的阳面和阴面各采集一穗葡萄,共20穗,果粒剪下混匀后于-40 ℃下保存待测,重复3次。样品用于测定葡萄果皮的总酚、总花色苷、总类黄酮、总单宁、单体花色苷及非花色苷单体酚类物质含量。
1.3 气候因子的监测
分别于2021年和2022年的5—9月监测各海拔葡萄园主要气候因子。采用温湿度记录仪(RC-4HC,中国江苏省精创电气公司)测定每个葡萄园5—9月的空气温度和空气相对湿度,温湿度记录仪探头放置在葡萄果穗附近,距离地面1.5 m,每隔30 min记录一次。在每月晴天的上午11:30—12:30采用数字照度计(Z-10,中国深圳格信达科技有限公司)、紫外辐射照度计(UV340B,中国西安欣宝科仪电子科技有限公司)和光纤光谱仪(FX2000,中国上海复享光学股份有限公司)分别测定2个海拔葡萄园的光照强度、紫外线强度和不同光质(300—1 000 nm)的相对光照强度。
1.4 测定指标与方法
1.4.1 土壤养分含量的测定 按照五点取样法取表层0—20 cm的土壤样品,采用四分法[27]取1 kg土样带回实验室待测。土壤质地采用激光粒度仪(2000E,Mastersizer,UK)测定;pH采用pH测定仪(S400,梅特勒托利多有限公司,中国)测定;参考《土壤农化分析》[27],土壤全氮含量的测定采用半微量凯式法,有机质含量的测定采用重铬酸钾容量法-外加热法,全磷含量的测定采用高氯酸-硫酸-钼锑抗法,速效磷含量的测定采用碳酸氢钠提取-钼锑抗法,全钾含量采用NaOH熔融,火焰光度法测定,速效磷含量采用NH4OAc浸提,火焰光度法测定,所有样品重复测定3次。
1.4.2 果实酚类物质含量的测定 参考TIAN等[28]的方法,每个样品设置3个生物学重复,每个生物学重复随机取葡萄50粒,立即剥取葡萄皮,将葡萄皮液氮冷冻并研磨成粉末后装于培养皿中,在真空冷冻干燥器(Goldsim Cellular Science LLC,USA)中冻干24 h,取出装于自封袋中,存放于-80 ℃冰箱。提取时,每个重复分别称取1 g干粉于50 mL离心管中(离心管要用黑胶带或锡箔纸包裹),加入20 mL盐酸甲醇溶液(体积分数60%甲醇,质量分数0.1%盐酸)使料液比为1﹕20,超声提取器于水温30 ℃、40 W功率下提取30 min,接着在4 ℃下10 000 r/min离心10 min,收集上清液于丝口瓶中。然后在沉淀物中加入20 mL盐酸甲醇,重复以上提取步骤2次,合并3次所有上清液摇匀并于-80 ℃冰箱中储存。以上操作均要避光。
总花色苷含量的测定采用pH示差法[29];总单宁含量的测定采用甲基纤维素沉淀法[30],结果以儿茶素表示;总酚含量的测定采用福林-肖卡法[31],结果以没食子酸表示;总类黄酮含量的测定采用PEINADO等[32]的方法,结果以芦丁含量表示,所有样品重复测定3次。
1.4.3 单体花色苷含量的测定 葡萄果皮单体花色苷的提取:每个样品设置3个生物学重复,每个生物学重复随机取葡萄100粒,于-80 ℃预冷并去皮,在液氮中磨成粉末后在真空冷冻干燥器(Goldsim Cellular Science LLC,USA)中冻干24 h。称取0.1 g葡萄果皮干粉,加入5 mL色谱甲醇,避光超声10 min后,置于摇床25 ℃,130 r/min提取30 min,随后8 000 r/min离心5 min取上清液。重复提取2次,合并上清液。
单体花色苷含量的测定:提取液0.22 μm有机滤头过滤,采用LC-20AT高效液相色谱仪(岛津,日本)和二极管阵列检测器(岛津,日本)进行测定。色谱条件:色谱柱为Synergi Hydro-RP 80A柱(250 mm×4.6 mm,4 μm,Phenomenex,USA)。流动相A:甲酸﹕乙腈﹕水(1﹕4﹕32,V/V)。流动相B:甲酸﹕乙腈﹕水(1﹕20﹕16,V/V)。洗脱程序:0—18 min,10%—25% B;18—20 min,25% B;20—30 min,25%—40% B;30—35 min,40%—70% B;35—40 min,70%—100% B。流速1.0 mL·min-1,柱温30 ℃,二极管阵列检测器检测波长520 nm,进样量20 µL,所有样品重复测定2次。结合Yang等[33]方法中花色苷的保留时间对样品各单体花色苷进行定性分析;参照赵裴等[34]方法,花色苷定量分析采用外标法,以纯度95%的二甲花翠素-3--葡萄糖苷为标准品(索莱宝科技有限公司,中国),准确称取标准品0.0100 g并以色谱甲醇定容得到10 mL单标溶液,使用单标溶液梯度稀释5个不同浓度(重复3次),在上述色谱条件下分析并绘制标准曲线,标准曲线的相关系数在0.999以上。结合标准曲线对样品的二甲花翠素-3--葡萄糖进行定量分析。其余单体花色苷的浓度以二甲花翠素-3--葡萄糖苷当量表示。果皮中单体花色苷含量用“mg·g-1DW”表示。
1.4.4 非花色苷单体酚类物质含量的测定 葡萄果皮非花色苷单体酚类物质的提取:每个样品设置3个生物学重复,每个生物学重复随机取葡萄100粒,于-80 ℃预冷并去皮,在液氮中磨成粉末后在真空冷冻干燥器(Goldsim Cellular Science LLC,USA)中冻干24 h。取葡萄果皮干粉2 g溶于45 mL乙酸乙酯,加入5 mL蒸馏水,在25 ℃条件下摇床振荡30 min(避光,130 r/min),12 000 r/min、4 ℃离心20 min,将上清液转移至100 mL丝口瓶中,重复上述步骤3次。合并4次上清液并转移至圆底烧瓶,在33 ℃条件下旋转蒸发至干,用色谱级甲醇重溶定容至5 mL,-20 ℃避光存放待测。
非花色苷单体酚类物质含量的测定:提取液0.22 μm有机滤头过滤,采用LC-2030CD高效液相色谱仪(岛津,日本)和二极管阵列检测器(岛津,日本)进行测定。色谱条件:色谱柱为ZORBAX SB-C18柱(250 mm×4.6 mm,5 μm,Agilent,USA)。梯度洗脱:流动相A:水﹕乙酸(1﹕99,V/V),流动相B:乙腈。洗脱程序:0—3min,3%—6% B;3—7 min,6%—15% B;7—11 min,15%—30% B;11—13 min,30% B;13—15 min,30%—3% B。流速0.20 mL·min-1,柱温30 ℃,二极管阵列检测器检测波长280 nm,进样量10 μL,所有样品重复测定2次。以儿茶素、表儿茶素、槲皮素、山奈酚、绿原酸、咖啡酸、反式阿魏酸、对香豆酸、没食子酸、原儿茶酸、香草酸和丁香酸为标准品(索莱宝科技有限公司,中国),标准品纯度均为98%,分别准确称取标准品0.0100 g并以色谱甲醇定容得到10 mL单标溶液,分别对12种单标溶液梯度稀释5个不同浓度(重复3次),在上述色谱条件下分析各标准品并绘制标准曲线,标准曲线的相关系数在0.999以上。结合各标准品的保留时间对样品进行定性。结合标准曲线采用外标法对样品进行定量分析。果皮中非花色苷单体酚类物质含量用“mg·g-1DW”表示。
1.5 数据统计与分析
采用Microsoft Excel 2016(Microsoft,USA)进行数据统计,使用SPSS 25.0(SPSS,IBM,Chicago,IL,USA)进行单因素方差分析和相关分析,采用Turkey极差法(<0.05)进行差异显著性检验,使用Origin 2022(OriginLab,USA)进行主成分分析,使用SMICA14.1(Umetrics,SE)进行正交偏最小二乘分析,利用灰色关联分析评价酚类物质相关联的气候因子[35]。
1.5.1 光合有效辐射系数(PARC)计算
计算公式:
式中,1:400—700 nm相对光照强度,2:300—1 000 nm相对光照强度。
1.5.2 灰色关联分析关联度计算
对海拔、气候和酚类物质数据进行无量纲处理:
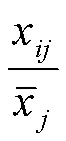
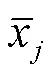
计算关联系数:
式中,min∆()、max∆()分别为所有比较数列绝对差值的最小值和最大值,∆()为i个比较数列绝对差值。本研究中min∆()为0、max∆()为0.98;ρ为分辨系数,0<ρ<1,通常取0.5。
计算关联度:
式中,γi为第i个比较数列与参考数列的等权关联度,N为样本数量。
2 结果
2.1 不同海拔葡萄园土壤养分情况
如表1所示,两个海拔葡萄园的土壤质地均为粉砂质壤土,土壤中有机质、全氮含量、全磷、全钾、速效磷和速效钾含量无显著性差异。两个海拔葡萄园土壤pH分别为7.34和7.09,海拔2 300 m处土壤pH显著低于海拔2 181 m,各海拔土壤均属于中性土壤,适于葡萄种植。参照第二次土壤普查土壤养分含量分级标准,两海拔葡萄园土壤有机质含量较贫乏(四级),全氮含量中等(三级),钾含量丰富(一级),磷含量中等(三级)。综上,两个海拔的土壤养分水平基本一致。

表1 葡萄园土壤养分
同列不同小写字母表示差异显著(<0.05)。下同
Different lowercase letters in the same column indicate significant difference (<0.05). The same as below
2.2 不同海拔葡萄生长发育期气候因子参数
由图2-A可以看出,2021年两个海拔葡萄园生长季(5—9月)及各月份最高、平均和最低空气温度在两个海拔之间无显著差异;在2022年,海拔2 181 m葡萄园6月、生长季(5—9月)最高及平均空气温度显著高于海拔2 300 m,但两个海拔最低空气温度无显著差异;海拔2 300 m连续两年生长季(5—9月)昼夜温差显著高于2 181 m,两个海拔昼夜温差在不同月份差异不同,两个海拔7、8月昼夜温差无显著差异,而在2022年6月和9月出现显著差异。
由图2-B可以看出,在2021年两个海拔生长季(5—9月)及各月份相对湿度无显著差异;在2022年,海拔2 300 m生长季(5—9月)及各月份最高相对湿度均显著高于2 181 m,海拔2 300 m平均相对湿度除6月显著高于2 181 m外,其余月份两个海拔葡萄园平均相对湿度无显著差异,而在5月和6月,海拔2 300 m最低相对湿度显著低于2 181 m,其余月份两个海拔最低空气相对湿度无显著差异。

不同小写字母表示同一气候因子不同海拔之间差异显著(<0.05)。下同
Different lowercase letters of same climatic factor indicate significant difference between different altitudes (<0.05). The same as below
图2 不同海拔葡萄园气候因子
Fig. 2 Climate factors of vineyards at different altitudes
在2021和2022年,5月和6月两个海拔葡萄园光照强度无显著差异,7月和5—9月平均光照强度存在显著差异,且以海拔2 300 m较高(图2-C)。5月,海拔2 300 m紫外线强度显著低于2 181 m,6月则两个海拔之间无显著差异,而7月时2 300 m紫外线强度显著高于2 181 m,分别是海拔2 181 m的1.73倍(2021年)和3.65倍(2022年),在9月则以海拔2 181 m紫外线较强(图2-D)。由图2-E可知,2021年和2022年两个海拔葡萄园5—9月平均有效光合辐射系数无显著差异,海拔2 181 m光合有效辐射系数在部分月份(2021年6、7月和2022年8月)显著高于2 300 m,其余月份两海拔无显著差异。连续两年两个海拔有效积温无显著差异,2022年有效积温较2021年高(图2-F)。
2.3 不同海拔葡萄果皮酚类物质含量
2020—2022年,海拔2 300 m处葡萄果皮的总酚(TPC)、总花色苷(TAC)和总单宁含量(TTC)均显著高于海拔2 181 m;相比于2020和2022年,2021年海拔2 300 m处葡萄总花色苷(TAC)和总单宁(TTC)较海拔2 181 m增加幅度大,分别增加了44.34%和174.49%。2020—2022年,海拔2 181 m处葡萄果皮的总类黄酮含量(TFo)连续3年显著高于2 300 m,提高幅度分别为32.24%、57.64%和79.48%(图3)。

图3 不同海拔葡萄果皮酚类物质含量
由图4可以看出,不同海拔葡萄果皮测定的9种单体花色苷中,以二甲花翠素-3--葡萄糖苷(Mv)的含量最高,其次是甲基花青素-3--葡萄糖苷(Pn)。海拔对葡萄果皮单体花色苷含量具有显著影响。2020—2022连续3年,海拔2 300 m葡萄果皮的总单体花色苷含量显著高于海拔2 181 m。在2020年,海拔2 300 m葡萄果皮单体花色苷除花青素-3--葡萄糖苷(Cy)和二甲花翠素-3--葡萄糖苷(Mv)含量显著低于2 181 m,其余单体花色苷含量均为海拔2 300 m显著高于2 181 m;在2021和2022年,海拔2 300 m葡萄果皮各单体花色苷含量均显著高于2 181 m,其中二甲花翠素-3--(6--乙酰化)葡萄糖苷(Mv-Ace)含量较海拔2 181 m增幅大,两年分别增加了198.65%和42.22%。连续3年,海拔2 300 m葡萄果皮甲基化和酰基化花色苷含量较高,相较于海拔2 181 m,分别增加了25.62%—117.00%和31.10%— 159.16%,说明海拔对葡萄果皮的甲基化花色苷和酰基化花色苷含量影响较大。

Dp:花翠素-3--葡萄糖苷Delphinidin-3--gliucoside,Cy:花青素-3--葡萄糖苷Cyanidin-3--glucoside,Pt:甲基花翠素-3--葡萄糖苷Petunidin-3--glucoside,Pn:甲基花青素-3--葡萄糖苷Peonidin- 3-- glucoside,Mv:二甲花翠素-3--葡萄糖苷Malvidin-3--glucoside,Pn-Ace:甲基花青素-3--(6--乙酰化)Peonidin-3--(6--acetate)- glucoside,Mv-Ace:二甲花翠素-3--(6--乙酰化)葡萄糖苷Malvidin- 3--(6--acetate)-glucoside,Pn-Cou:甲基花青素-3--(6--香豆酰化)葡萄糖苷Peonidin-3--(6--coumarate)-glucoside,Mv-Cou:二甲花翠素-3--(6--香豆酰化)葡萄糖苷Malvidin-3--(6--coumarate)- glucoside
*表示不同海拔之间单体花色苷含量差异显著(<0.05)且含量较高
* meant significant difference (<0.05) and higher content of individual anthocyanin between different altitudes in same year
图4 不同海拔葡萄果皮单体花色苷物质含量
Fig. 4 The individual anthocyanin content in grape skins of different altitudes
由表2可以看出,不同海拔葡萄果皮共检测出12种非花色苷单体酚类物质,包括2种黄烷醇类、2种黄酮醇类、4种羟基肉桂酸类和4种羟基苯甲酸类,其中槲皮素的含量较高,其次是山奈酚。在2021和2022年,海拔2 300 m葡萄果皮槲皮素含量显著高于2 181 m。在黄烷醇类物质中,较高海拔葡萄果皮表儿茶素含量高于海拔2 181 m,其余黄烷醇类物质在2022年两个海拔之间差异显著。非类黄酮物质包括羟基肉桂酸类和羟基苯甲酸类,2021年,两个海拔葡萄果皮中羟基肉桂酸类和羟基苯甲酸类物质含量无显著差异;而在2022年,海拔2 300 m葡萄果皮的绿原酸、反式阿魏酸、对香豆酸、没食子酸和香草酸含量显著高于海拔2 181 m。
2.4 不同海拔葡萄果皮酚类物质的OPLS-DA分析
为进一步探究海拔对葡萄果皮酚类物质含量的影响,建立OPLS-DA模型进行正交偏最小二乘回归分析。如图5所示,采用2020、2021和2022年葡萄果皮的总酚、总类黄酮、总单宁、总花色苷及单体花色苷数据构建模型,同时对模型进行200次置换检验。一般而言,置换检验后intercept2<0说明模型无过度拟合现象,2值>0.7说明模型有较好的解释能力,2值>0.5说明模型有较好的预测能力。本试验构建的模型intercept2值为-0.98,2值为0.74,2值为0.53,说明模型有效,且筛选差异化合物能力较好。通过模型筛选VIP值>1的酚类化合物发现,海拔2 181 m和海拔2 300 m葡萄果皮的主要差异化合物是总类黄酮(TFo)、总单宁(TTC)、二甲花翠素-3--葡萄糖苷(Mv)及其乙酰化(Mv-Ace)、花青素-3--葡萄糖苷(Cy)及其甲基化(Pn)。
2.5 葡萄果皮酚类物质与气候因子的关联分析
采用2020、2021和2022年数据对海拔及9种单体花色苷物质进行Pearson相关分析,采用2021和2022年数据对海拔及12种非花色苷单体酚类物质进行Pearson相关分析。相关分析显示,葡萄果皮单体花色苷(Pt、Pn-Ace、Pn-Cou)和槲皮素(Qu)与海拔显著正相关,可以进一步分析其与气候因子的关系。对2021、2022年葡萄生长季(5—9月)气候因子、TPC、TAC、TFo、TTC、Pt、Pn-Ace、Pn-Cou和Qu数据均值化处理后构建灰色关联分析模型。由图6可知,葡萄果皮的TPC和TFo含量与昼夜温差的关联度最大,其次分别是紫外线强度和最高空气相对湿度。TTC与最低空气相对湿度关联度最大,其次是光照强度。TAC、Pt、Pn-Ace、Pn-Cou和Qu含量均与光照强度的关联度最大,但它们的次级关联指标不同,依次是TAC、Pt、Qu与紫外线强度,Pn-Ace、Pn-Cou与昼夜温差。综上,葡萄果皮总酚和总类黄酮物质含量主要受葡萄生长季(5—9月)昼夜温差的影响,总单宁含量受最低相对湿度的影响,槲皮素含量、花色苷总量及其部分组分含量主要受生长季(5—9月)光照强度的影响。
表2 不同海拔葡萄果皮非花色苷单体酚类物质含量
Table 2 The non-individual anthocyanin content in grape skins of different altitudes (mg·g-1DW)

图5 不同海拔葡萄果皮酚类物质OPLS-DA得分及检验图
Fig. 5 OPLS-DA score and test plots of phenolic compounds in grape skins at different altitudes

Qu:槲皮素 Quercetin;AL:海拔 Altitude;HAT:最高空气温度 Highest air temperature;MAT:平均空气温度 Mean air temperature;LAT:最低空气温度 Lowest air temperature;HRH:最高相对湿度 Highest relative humidity;MRH:平均相对湿度 Mean relative humidity;LRH:最低相对湿度 Lowest relative humidity;DIF:昼夜温差 Day-night temperature difference;LI:光照强度 Light intensity;UVI:紫外线强度 UV intensity;PARC:光合有效辐射系数 Photosynthetic active radiation coefficient;GDD:有效积温 Growing degree days;SDIF:9月昼夜温差 September day-night temperature difference;JLRH:7月最低相对湿度 July lowest relative humidity;JLI:7月光照强度 July light intensity。*表示酚类物质与海拔显著相关(P<0.05)*represent phenolics are significantly correlated with altitude (P<0.05)
为进一步分析葡萄生长发育过程中影响葡萄酚类物质积累的主要气候因子,在原有模型中增加引入各月光照、温度、湿度类气候因子形成新的灰色关联模型。结果显示(图6绿色部分),葡萄果皮TFo与9月昼夜温差的关联度最大,TTC与7月最低空气湿度关联度最大。Pt、Pn-Ace、Pn-Cou和Qu与7月光照强度关联度最大。两个灰色关联模型比较分析发现,葡萄果皮TPC和TAC受生长季(5—9月)气候因子的影响较大,Pt、Pn-Ace、Pn-Cou和Qu含量主要受葡萄转色期(7月)光照强度的影响,TFo含量主要受葡萄成熟期(9月)昼夜温差的影响,最低相对湿度尤其是转色期(7月)最低相对湿度对果皮TTC影响较大。
3 讨论
3.1 海拔影响葡萄果皮酚类物质
海拔对葡萄的生长发育有重要影响,目前有关海拔影响葡萄品质的研究较多。不同海拔葡萄果实的还原糖、可滴定酸以及葡萄果皮中的单体花色苷、单宁、黄酮醇、二苯乙烯等代谢产物存在显著差异[8-10]。对葡萄果皮酚类物质的研究发现,高海拔有利于增强葡萄抗氧化活性[14],提高葡萄果皮花色苷[8]、黄酮醇[10]等物质含量。本研究中不同海拔葡萄果皮酚类物质含量差异显著,而较高海拔有利于葡萄果皮总酚、总单宁、槲皮素类黄酮醇、总花色苷及多种单体花色苷含量的积累,与Mateus等[36]对不同海拔酿酒葡萄的研究结果一致。花色苷、单宁等酚类物质是类黄酮途径主要的代谢产物,较高海拔地区葡萄果皮类黄酮合成途径中F3′H支路的代谢较为活跃[17]。本研究中部分羟基肉桂酸类物质如对香豆酸、反式阿魏酸在较高海拔含量较高,对香豆酸是类黄酮物质合成的前体物质,说明较高海拔可能促进了葡萄果皮酚类前体物质的合成,这也是葡萄果实代谢物和代谢通路多样化适应不同海拔生态环境的结果[15]。不同海拔土壤类型、土壤肥力均会影响葡萄果实的品质,例如土壤中氮、磷、钾含量配比会影响‘梅尔诺’葡萄的花色苷、总类黄酮等物质含量[37]。本研究中两个海拔的土壤养分水平相近,土壤对两个海拔‘梅尔诺’葡萄酚类物质含量的差异影响较小,因此,本研究主要分析不同海拔气候因子与果实酚类物质的关系。
3.2 气候因子影响葡萄果皮酚类物质
酚类物质作为植物的保护剂,可以保护植物免受环境生物和非生物胁迫[4],其种类和含量受到气候如温度、光照、湿度等多种因素的影响。在本研究中,不同海拔的气候条件尤其是光照强度和紫外线强度是影响‘梅尔诺’葡萄果皮酚类物质积累的主要因素,这也与‘赤霞珠’[38]、‘黑比诺’[39]、雷司令[40]的研究结果一致。目前有关气候因子调控葡萄酚类物质合成代谢的研究较多,但是大部分研究是在人工调控的微气候环境中进行,往往借助气候箱、日光温室或通过调整葡萄树形、叶幕等方式[41-42]。本研究在大田自然环境中发现,在葡萄生长季和转色期(7月),较高海拔(2 300 m)为葡萄果皮总花色苷、单体花色苷(Pt、Pn-Ace和Pn-Cou)和槲皮素类黄酮醇(Qu)物质积累提供了较强的光照和紫外线,这在田间自然条件下验证了较强的光照和紫外线促进了葡萄果皮花色苷物质和槲皮素类黄酮醇物质含量的合成。转录组分析发现,遮光处理下葡萄果皮花色苷含量以及相关基因、表达量显著降低[43];紫外线通过影响类黄酮代谢途径中一些酶的活性如PAL、CHS[44],促进葡萄果皮花色苷的合成[45]。高海拔较强的光照和紫外线可能通过影响葡萄类黄酮代谢途径中相关酶的活性或者相关基因的表达来影响花色苷等酚类物质含量,具体机制有待进一步深入研究。
温度是影响葡萄酚类物质合成的另一重要气候因子。本研究发现,葡萄果皮总酚、总类黄酮和单体花色苷(Pn-Ace、Pn-Cou)物质含量与昼夜温差的关联度较大(图6),较高海拔伴随较大的昼夜温差有利于葡萄果皮酚类物质的积累。昼夜温差较大,夜间空气温度较低,葡萄叶片呼吸作用强度减弱,葡萄果实糖含量得到积累,而糖作为花色苷物质合成的前体物质,在一定程度上可以促进类黄酮尤其是花色苷的合成[46]。MORI等[47]研究发现,夜间温度显著影响葡萄果皮单体花色苷的含量,较高的夜间温度不利于非甲基化花色苷的积累,这可能与其化学结构不够稳定有关。在高海拔地区,较大的昼夜温差,较低的夜间温度(11.5—12.36 ℃)一方面促进了花色苷前体物质糖的合成,另一方面有利于类黄酮合成途径代谢产物尤其是非甲基化花色苷的积累。同时,高海拔地区平均空气温度在20.86—21.96 ℃,最热月平均空气温度不超过23.15 ℃,葡萄果皮花色苷积累的最佳温度约20℃,这与YAN等[48]对‘梅尔诺’葡萄研究的结果一致。空气相对湿度与葡萄叶片的光合速率变化呈抛物线关系,较低或较高的空气相对湿度均会影响葡萄叶片的气孔导度、蒸腾速率并降低叶片光合速率,进而影响葡萄果实次级代谢产物的合成[26]。本研究发现葡萄果皮的总类黄酮、总单宁含量分别受到最高相对湿度和最低相对湿度的影响。该产区位于澜沧江流域,属于干热河谷,蒸发量大[49],海拔2 181 m葡萄果皮较低的总单宁含量和海拔2 300 m较低的总类黄酮含量可能分别与低湿(14.05%—14.30%)和高湿(87.69%—93.61%)环境下葡萄叶片光合作用受阻有关。
4 结论
不同海拔(2 181 m和2 300 m)的‘梅尔诺’葡萄果皮酚类物质含量存在显著差异,较高海拔的葡萄果皮酚类物质含量较高。不同海拔的气候条件,尤其是昼夜温差和光照强度是引起酚类物质含量差异的主要因子。较高海拔较大的昼夜温差、较强的光照和紫外线促进了葡萄果皮总酚、槲皮素类黄酮醇和总花色苷及其单体物质的积累。在云南香格里拉干旱河谷产区,建议葡萄种植选择光照较强和昼夜温差较大的高海拔区域,同时对于湿度较低的海拔区域可以考虑采用微喷等农业技术进行增湿,以提高葡萄果皮总单宁物质含量。
[1] VO G T, LIU Z Y, CHOU O, ZHONG B M, BARROW C J, DUNSHEA F R, SULERIA H A R. Screening of phenolic compounds in Australian grown grapes and their potential antioxidant activities. Food Bioscience, 2022, 47: 101644.
[2] RIENTH M, CROVADORE J, GHAFFARI S, LEFORT F. Oregano essential oil vapour preventsinfection in grapevine () and primes plant immunity mechanisms. PLoS One, 2019, 14(9): e0222854.
[3] JU Y L, YANG L, YUE X F, LI Y K, HE R, DENG S L, YANG X, FANG Y L. Anthocyanin profiles and color properties of red wines made fromandgrapes. Food Science and Human Wellness, 2021, 10(3): 335-344.
[4] 王燕, 李德美, 孙智文, 王宗义, 赵炳岩, 王莹莹. 赤霞珠干红葡萄酒酚类物质及其与苦涩感的关联性分析. 食品与发酵工业, 2022, 48(7): 91-96.
WANG Y, LI D M, SUN Z W, WANG Z Y, ZHAO B Y, WANG Y Y. Phenolics compounds in Cabernet Samvignon wine and their correlation with astringency. Food and Fermentation Industries, 2022, 48(7): 91-96. (in Chinese)
[5] 江雨, 孟江飞, 刘崇怀, 姜建福, 樊秀彩, 严静, 张振文. 中国野生葡萄果实基本品质、酚类物质含量及其抗氧化活性分析. 食品科学, 2017, 38(7): 142-148.
JIANG Y, MENG J F, LIU C H, JIANG J F, FAN X C, YAN J, ZHANG Z W. Quality characteristics, phenolics content and antioxidant activity of Chinese wild grapes. Food Science, 2017, 38(7): 142-148. (in Chinese)
[6] FLAMINI R, MATTIVI F, ROSSO M, ARAPITSAS P, BAVARESCO L. Advanced knowledge of three important classes of grape phenolics: Anthocyanins, stilbenes and flavonols. International Journal of Molecular Sciences, 2013, 14(10): 19651-19669.
[7] RIENTH M, VIGNERON N, DARRIET P, SWEETMAN C, BURBIDGE C, BONGHI C, WALKER R P, FAMIANI F, CASTELLARIN S D. Grape berry secondary metabolites and their modulation by abiotic factors in a climate change scenario-A review. Frontiers in Plant Science, 2021, 12: 643258.
[8] 赵亚蒙, 尹春晓, 梁攀, 乐小凤, 张振文. 不同海拔对刺葡萄果实风味物质的影响. 果树学报, 2018, 35(10): 1197-1207.
ZHAO Y M, YIN C X, LIANG P, LE X F, ZHANG Z W. Effects of altitude on berry flavor compounds in spine grapes. Journal of Fruit Science, 2018, 35(10): 1197-1207. (in Chinese)
[9] 蒋宝, 蒲飞, 孙占育, 王录军. 海拔对酿酒葡萄果实和相应葡萄酒中多酚物质影响的研究概述. 食品与发酵工业, 2016, 42(8): 262-267.
JIANG B, PU F, SUN Z Y, WANG L J. Research progress on influence of cultivation altitude on phenolics of grape berry and wine. Food and Fermentation Industries, 2016, 42(8): 262-267. (in Chinese)
[10] DE OLIVEIRA J B, EGIPTO R, LAUREANO O, DE CASTRO R D, PEREIRA G, RICARDO-DA-SILVA J. Climate effects on physicochemical composition of Syrah grapes at low and high altitude sites from tropical grown regions of Brazil. Food Research International, 2019, 121: 870-879.
[11] URVIETA R, JONES G, BUSCEMA F, BOTTINI R, FONTANA A. Terroir and vintage discrimination of Malbec wines based on phenolic composition across multiple sites in,. Scientific Reports, 2021, 11: 2863.
[12] MUÑOZ F, URVIETA R, BUSCEMA F, RASSE M, FONTANA A, BERLI F. Phenolic characterization of Cabernet Sauvignon wines from different geographical indications of,: Effects of plant material and environment. Frontiers in Sustainable Food Systems, 2021, 5: 700642.
[13] 何涛, 杜鸿燕, 马义, 邓维萍, 朱书生, 杜飞. 香格里拉海拔高度对‘赤霞珠’葡萄果实花色苷的影响. 中外葡萄与葡萄酒, 2021(1): 8-13.
HE T, DU H Y, MA Y, DENG W P, ZHU S S, DU F. Effect of altitude on anthocyanin of ‘Cabernet Sauvignon’ grape in Shangri-La region. Sino-Overseas Grapevine & Wine, 2021(1): 8-13. (in Chinese)
[14] JIN X D, WU X, LIU X. Phenolic characteristics and antioxidant activity of merlot and Cabernet Sauvignon wines increase with vineyard altitude in a high-altitude region. South African Journal of Enology & Viticulture, 2017, 38(2): 132-143.
[15] RAMOS M C, MARTÍNEZ DE TODA F. Macabeo () grape response to climate variability in areas located at different elevations in the Rioja Designation of Origin. Journal of the Science of Food and Agriculture, 2022, 102(13): 5670-5679.
[16] 毛如志, 张国涛, 王家逵, 杜飞, 邓维萍, 邵建辉, 赵新节, 朱书生, 何霞红. 西拉葡萄浆果代谢物对低海拔和高海拔气象因子的响应. 现代农业科技, 2015(20): 240-246.
MAO R Z, ZHANG G T, WANG J K, DU F, DENG W P, SHAO J H, ZHAO X J, ZHU S S, HE X H. Shiraz/syrah grape metabolites response to low/high altitudes. XianDai NongYe KeJi, 2015(20): 240-246. (in Chinese)
[17] XING R R, HE F, XIAO H L, DUAN C Q, PAN Q H. Accumulation pattern of flavonoids in Cabernet Sauvignon grapes grown in a low-latitude and high-altitude region. South African Journal of Enology & Viticulture, 2016, 36(1): 32-43.
[18] KÖRNER C. The use of ‘altitude’ in ecological research. Trends in Ecology & Evolution, 2007, 22(11): 569-574.
[19] 冀晓昊, 王海波, 张克坤, 王孝娣, 史祥宾, 王宝亮, 郑晓翠, 王志强, 刘凤之. 不同颜色果袋对葡萄花青苷合成的调控. 中国农业科学, 2016, 49(22): 4460-4468. doi: 10.3864/j.issn.0578-1752.2016. 22.018.
JI X H, WANG H B, ZHANG K K, WANG X D, SHI X B, WANG B L, ZHENG X C, WANG Z Q, LIU F Z. The grape anthocyanin biosynthesis regulation by different color fruit bags. Scientia Agricultura Sinica, 2016, 49(22): 4460-4468. doi: 10.3864/j.issn. 0578-1752.2016.22.018. (in Chinese)
[20] GAIOTTI F, PASTORE C, FILIPPETTI I, LOVAT L, BELFIORE N, TOMASI D. Low night temperature at veraison enhances the accumulation of anthocyanins in Corvina grapes (L.). Scientific Reports, 2018, 8: 8719.
[21] SUN L, LI S C, TANG X P, FAN X C, ZHANG Y, JIANG J F, LIU J H, LIU C H. Transcriptome analysis reveal the putative genes involved in light-induced anthocyanin accumulation in grape ‘Red Globe’ (L.). Gene, 2020, 728: 144284.
[22] 张衡, 刘红梅, 杨雪, 宫厚杰. 不同微喷高度对葡萄棚架下微气候因子及品质的影响. 节水灌溉, 2022(5): 97-100.
ZHANG H, LIU H M, YANG X, GONG H J. Effects of different micro-spray heights on the microclimate factors and quality under the grape trellis. Water Saving Irrigation, 2022(5): 97-100. (in Chinese)
[23] 杨世琼, 杨再强, 王琳, 李军, 张曼义, 李凯伟. 高温高湿交互对设施番茄叶片光合特性的影响. 生态学杂志, 2018, 37(1): 57-63.
YANG S Q, YANG Z Q, WANG L, LI J, ZHANG M Y, LI K W. Effect of high humidity and high temperature interaction on photosynthetic characteristics of greenhouse tomato crops. Chinese Journal of Ecology, 2018, 37(1): 57-63. (in Chinese)
[24] 刘笑宏, 孙永江, 孙红, 翟衡. 不同叶幕类型对‘摩尔多瓦’葡萄果穗微域环境及果实品质的影响. 中国农业科学, 2016, 49(21): 4246-4254. doi: 10.3864/j.issn.0578-1752.2016.21.019.
LIU X H, SUN Y J, SUN H, ZHAI H. Effect of canopy types on the cluster micro-environment and fruit quality of the ‘Moldova’ grapes. Scientia Agricultura Sinica, 2016, 49(21): 4246-4254. doi: 10.3864/ j.issn.0578-1752.2016.21.019. (in Chinese)
[25] XIE S, LEI Y J, WANG Y J, WANG X Q, REN R H, ZHANG Z W. Influence of continental climates on the volatile profile of Cabernet Sauvignon grapes from five Chinese viticulture regions.Plant Growth Regulation, 2019, 87(1): 83-92.
[26] 张江辉, 刘洪波, 白云岗, 杨旭东, 丁平. 果园微气候因子改善葡萄净光合速率与蒸腾速率研究. 北方园艺, 2020(1): 27-33.
ZHANG J H, LIU H B, BAI Y G, YANG X D, DING P. Studies on orchard microclimate factors to improve grape net photosynthetic rate and transpiration rate. Northern Horticulture, 2020(1): 27-33. (in Chinese)
[27] 鲍士旦. 土壤农化分析. 3版. 北京: 中国农业出版社, 2000.
BAO S D. Soil and Agricultural Chemistry Analysis. 3rd ed. Beijing: China Agriculture Press, 2000. (in Chinese)
[28] TIAN M B, YUAN L, ZHENG M Y, XI Z M. Differences in anthocyanin accumulation profiles between teinturier and non- teinturier cultivars during ripening. Foods, 2021, 10(5): 1073.
[29] MENG J F, FANG Y L, QIN M Y, ZHUANG X F, ZHANG Z W. Varietal differences among the phenolic profiles and antioxidant properties of four cultivars of spine grape (Foex) in Chongyi County (China). Food Chemistry, 2012, 134(4): 2049-2056.
[30] MERCURIO MEAGAN D, DAMBERGS ROBERT G, HERDERICH MARKUS J, SMITH PAUL A. High throughput analysis of red wine and grape phenolics-adaptation and validation of methyl cellulose precipitable tannin assay and modified Somers color assay to a rapid 96 well plate format. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4651-4657.
[31] RAPISARDA P, TOMAINO A, LO CASCIO R, BONINA F, DE PASQUALE A, SAIJA A. Antioxidant effectiveness as influenced by phenolic content of fresh orange juices. Journal of Agricultural and Food Chemistry, 1999, 47(11): 4718-4723.
[32] PEINADO J, LOPEZ DE LERMA N, MORENO J, PEINADO R A. Antioxidant activity of different phenolics fractions isolated in must from Pedro Ximenez grapes at different stages of the off-vine drying process. Food Chemistry, 2009, 114(3): 1050-1055.
[33] YANG P, YUAN C L, WANG H, HAN F L, LIU Y J, WANG L, LIU Y. Stability of anthocyanins and their degradation products from Cabernet Sauvignon red wine under gastrointestinal pH and temperature conditions. Molecules, 2018, 23(2): 354.
[34] 赵裴, 成甜甜, 王开贤, 韩富亮. 干化处理对‘马瑟兰’葡萄有机酸、花色苷和单宁组分的影响. 食品与发酵工业, 2021, 47(18): 194-200.
ZHAO P, CHENG T T, WANG K X, HAN F L. Effects of postharvest dehydration on the organic acids, anthocyanins and tannin fractions of ‘Marselan’ grapes. Food and Fermentation Industries, 2021, 47(18): 194-200. (in Chinese)
[35] 李桂荣, 程珊珊, 张少伟, 扈惠灵, 连艳会, 周瑞金, 朱自果. 葡萄抗寒相关生理生化指标灰色关联分析. 东北林业大学学报, 2018, 46(10): 40-47, 53.
LI G R, CHENG S S, ZHANG S W, HU H L, LIAN Y H, ZHOU R J, ZHU Z G. Grey correlation analysis of physi-biochemical indexes related to cold tolerance in different grapes. Journal of Northeast Forestry University, 2018, 46(10): 40-47, 53. (in Chinese)
[36] MATEUS N, PROENCA S, RIBEIRO P, MACHADO J M, DE FREITAS V. Grape and wine polyphenolic composition of redvarieties concerning vineyard altitude. CyTA-Journal of Food, 2001, 3(2): 102-110.
[37] 王小龙, 张正文, 钟晓敏, 王福成, 史祥宾, 张艺灿, 王宝亮, 冀晓昊, 王海波. 不同组织和土壤矿质营养与美乐葡萄果实品质的多元分析. 果树学报, 2021, 38(12): 2108-2118.
WANG X L, ZHANG Z W, ZHONG X M, WANG F C, SHI X B, ZHANG Y C, WANG B L, JI X H, WANG H B. Multivariate analysis of fruit quality and mineral nutritions in different tissues and soils of Merlot grape. Journal of Fruit Science, 2021, 38(12): 2108-2118. (in Chinese)
[38] BLANCQUAERT E H, OBERHOLSTER A, RICARDO-DA-SILVA J M, DELOIRE A J. Grape flavonoid evolution and composition under altered light and temperature conditions in cabernet sauvignon (L.). Frontiers in Plant Science, 2019, 10: 1062.
[39] SONG J Q, SMART R, WANG H, DAMBERGS B, SPARROW A, QIAN M C. Effect of grape bunch sunlight exposure and UV radiation on phenolics and volatile composition ofL. cv. Pinot Noir wine. Food Chemistry, 2015, 173: 424-431.
[40] BRANDT M, SCHEIDWEILER M, RAUHUT D, PATZ C D, WILL F, ZORN H, STOLL M. The influence of temperature and solar radiation on phenols in berry skin and maturity parameters ofL. cv. Riesling. Journal volume & issue, 2019, 53(2): 261-276.
[41] EDWARDS E J, UNWIN D, KILMISTER R, TREEBY M. Multi- seasonal effects of warming and elevated CO2on the physiology, growth and production of mature, field grown, Shiraz grapevines. OENO ONE, 2017, 51(2): 127-132.
[42] GOUOT J C, SMITH J P, HOLZAPFEL B P, WALKER A R, BARRIL C. Grape berry flavonoids: A review of their biochemical responses to high and extreme high temperatures. Journal of Experimental Botany, 2019, 70(2): 397-423.
[43] DOWNEY M O, HARVEY J S, ROBINSON S P. The effect of bunch shading on berry development and flavonoid accumulation in Shiraz grapes. Australian Journal of Grape and Wine Research, 2008, 10(1): 55-73.
[44] PONTIN M A, PICCOLI P N, FRANCISCO R, BOTTINI R, MARTÍNEZ-ZAPATER J M, LIJAVETZKY D. Transcriptome changes in grapevine (L.) cv. Malbec leaves induced by ultraviolet-B radiation. BMC Plant Biology, 2010, 10(1): 224.
[45] KATAOKA I, SUGIYAMA A, BEPPU K. Role of ultraviolet radiation in accumulation of anthocyanin in berries of ‘gros Colman’ grapes (L.). Journal of the Japanese Society for Horticultural Science, 2003, 72(1): 1-6.
[46] SINGH R K, MARTINS V, SOARES B, CASTRO I, FALCO V. Chitosan application in vineyards (L. cv. Tinto Cão) induces accumulation of anthocyanins and other phenolics in berries, mediated by modifications in the transcription of secondary metabolism genes. International Journal of Molecular Sciences, 2020, 21(1): 306.
[47] MORI K, SUGAYA S, GEMMA H. Decreased anthocyanin biosynthesis in grape berries grown under elevated night temperature condition. Scientia Horticulturae, 2005, 105(3): 319-330.
[48] YAN Y F, SONG C Z, FALGINELLA L, CASTELLARIN S D. Day temperature has a stronger effect than night temperature on anthocyanin and flavonol accumulation in ‘Merlot’ (L.) grapes during ripening. Frontiers in Plant Science, 2020, 11: 1095.
[49] 孙晨娜, 杨大新, 宋清海, 陈爱国, 闻国静, 张树斌, 张晶, 段兴武, 金艳强. 2011-2020年云南元江干热河谷生态站气象监测数据集. 中国科学数据, 2022, 7(1): 199-210.
SUN C N, YANG D X, SONG Q H, CHEN A G, WEN G J, ZHANG S B, ZHANG J, DUAN X W, JIN Y Q. A dataset of meteorological observations at Yuanjiang Savanna Ecosystem Research Station, Yunnan Province (2011-2020). China Scientific Data, 2022, 7(1): 199-210. (in Chinese)
Differences and Genesis of Grape Phenolic Compounds Among Different Altitudes in Yunnan Shangri-la

1College of Enology, Northwest A&F University, Yangling 712100, Shaanxi;2Shangri-la Winery Co, LTD, Shangri-la 674400, Yunnan;3Shaanxi Grape and Wine Engineering Center, Yangling 712100, Shaanxi
【Objective】Phenolic compounds are important secondary metabolites of wine grape, which have an important influence on the quality of grape and wine. In this study, the differences and genesis of phenolic substances in grape skins among different altitudes were studied combined with soil and climate factors, so as to provide a theoretical basis for the planting management of wine grapes at high altitudes region. 【Method】In the present research, Merlot wine grape was used as the test material. For three consecutive years (2020, 2021 and 2022), the differences of total phenols, flavonoids, tannins, total anthocyanins, the content of individual and non-individual anthocyanin components in grape skins at two altitudes (2 181, 2 300 m) at maturity stage were analyzed. Meanwhile, climate factors such as light, temperature and humidity at different altitudes were monitored during grape development, and the influences of climatic factors on phenolic substances of grape skins were analyzed. 【Result】There were no significant differences in the main mineral nutrients of the soils of the two altitude vineyards, and some differences in climatic factors, such as light, UV intensity, temperature and humidity. Altitude had a significant effect on the content of phenolic substances in grape skins. In the years of 2020-2022, the higher altitude was conducive to the accumulation of phenolic substances in grape skins. the content of total phenols, total tannin, total anthocyanins, most of the individual anthocyanins and the quercetin in berry skins were higher at the altitude of 2 300 m; compared with that at 2 181 m, the content of total tannin in grape skins at 2 300 m increased by 56.27%-174.49%. The flavonoid content at 2 181 m altitude were significantly higher than that at 2 300 m, with an increase of 32.25% to 79.48%. OPLS-DA analysis showed that, the main different compounds of phenolic compounds between the two altitudes were total tannin (TTC), total flavonoids (TFo), malvidin-3-glucoside (Mv), malvidin-3-acetly-glucoside (Mv-Ace), cyanidin-3- glucoside (Cy), and peonidin-3-glucoside (Pn). Grey correlation analysis showed that day-night temperature difference in grape growing season had a great effect on the content of total phenols and total flavonoids in grape skins. The content of total anthocyanins, individual anthocyanins and quercetin in skins were significantly affected by light and ultraviolet intensity. The content of three anthocyanins (Pt, Pn-Ace and Pn-Cou) and quercetin were mainly affected by the light intensity during grape veraison (July).【Conclusion】The climatic conditions of different altitudes, especially day-night temperature difference, light and ultraviolet intensity were the main factors causing the differences of phenolic content. The larger day-night temperature difference, stronger light and ultraviolet intensity at higher altitude were conducive to the accumulation of phenolic substances in grape skins.
grape; phenolic; altitude; climate factors; grey correlation analysis
10.3864/j.issn.0578-1752.2023.19.014
2023-03-15;
2023-06-05
国家自然科学基金(31772258)、国家现代农业产业技术体系建设专项(CARS-29-zp-6)、迪庆州雪域人才项目
张柯楠,E-mail:kenanzhang@nwafu.edu.cn。通信作者惠竹梅,E-mail:xizhumei@nwafu.edu.cn
(责任编辑 赵伶俐)
