陆地棉GhCPR5的克隆及其在抗病中的功能分析
2023-10-25许福春赵静若张振楠胡改元龙璐
许福春,赵静若,张振楠,胡改元,龙璐
陆地棉的克隆及其在抗病中的功能分析
许福春1,2,赵静若2,张振楠2,胡改元2,龙璐
1长治医学院,山西长治 046000;2河南大学生命科学学院/棉花生物育种与综合利用全国重点实验室,河南开封 475000
【目的】通过克隆陆地棉,分析其蛋白结构、表达模式和生物学功能,探究其在棉花响应黄萎病菌与灰霉病菌侵染中的功能和作用机制,为棉花抗病机制研究和育种提供理论基础和候选基因。【方法】根据棉花响应黄萎病菌侵染的转录组数据筛选到,并从陆地棉TM-1中克隆获得的全长编码序列。利用生物信息学技术分析GhCPR5的保守结构域、蛋白结构特征和同源基因的系统进化关系;利用实时荧光定量PCR(qPCR)分析在棉花根、茎、叶、胚珠、纤维、花瓣中的表达模式和黄萎病菌诱导的表达模式;构建病毒诱导的沉默载体TRV:,利用农杆菌介导的瞬时转化方法创建抑制表达植株,并借助RT-PCR和qPCR技术检测的干涉效率。对TRV:和TRV:植株进行黄萎病菌和灰霉病菌接种,观察比较TRV:和TRV:植株对病原菌的抗性差异;利用qPCR检测TRV:和TRV:植株中防御相关基因的表达量,分析GhCPR5的作用机制。【结果】从陆地棉TM-1中克隆获得,其CDS全长1 683 bp,编码560个氨基酸,蛋白质相对分子量为62.883 kDa,等电点为9.01。多重序列比对和进化树分析显示,GhCPR5与榴莲、可可等物种CPR5同源性较高。此外,GhCPR5与不同物种CPR5的C端蛋白结构高度保守,含有4—5个跨膜结构域。在棉花幼苗真叶中的表达量最高,茎中表达量最低,且其表达受黄萎病菌诱导。在正常条件下,抑制表达植株TRV:和对照植株TRV:在发育上无明显差异。但是,接种黄萎病菌后,TRV:植株对黄萎病菌表现敏感,发病率和病情指数显著高于TRV:植株。黄萎病菌和灰霉病菌的离体叶片接种和台盼蓝染色结果显示,TRV:叶片上的病斑面积显著高于TRV:叶片,说明下调表达降低了棉花对黄萎病菌和灰霉病菌的抗性。此外,抑制植株体内表达量显著上升,而、和的表达量显著下降。【结论】GhCPR5正调控棉花抗病性,下调表达可显著降低棉花对黄萎病菌和灰霉病菌的抗性。
棉花;抗病蛋白;黄萎病菌;灰霉病菌;基因表达
0 引言
【研究意义】棉花作为我国主要的经济作物之一,是天然纤维和植物油的重要原料,在国民经济发展中占据重要地位。然而,由黄萎病菌、枯萎病菌、灰霉病菌等植物病原菌引发的各种植物病害严重影响了棉花产量与品质。其中,由大丽轮枝菌()引起的黄萎病被认为是棉花的“癌症”,主要通过维管组织向植株各部位扩散,是制约棉花产业发展的主要病害[1-2]。通常情况下,黄萎病菌以菌核体的形式在土壤中休眠,并在适宜环境下,从寄主根部伤口或幼根侵入,传播迅速、为害广泛。在我国,每年有一半以上的棉田遭受此病害[3-4]。尽管如此,目前还没有控制黄萎病菌的有效方法和策略。此外,由灰葡萄孢菌()引起的棉铃灰霉病分布广泛,该病菌会造成棉花烂铃或棉铃干腐,严重影响了纤维品质。因此,发掘抗病功能基因、解析抗病机制、培育棉花抗病新品种对棉花产业发展具有重要意义。【前人研究进展】研究表明,木质素、棉酚、类黄酮等次生代谢物在棉花对黄萎病菌的抗性反应中发挥了重要作用。Xu等[5]发现黄萎病菌接种处理后,抗病品种海岛棉体内的木质素合成路径基因表达显著高于感病的陆地棉品种,且木质素含量增加,说明木质素参与棉花抗黄萎病菌。棉花主要次生代谢产物棉酚可抑制病原菌生长,抑制棉酚合成关键基因的表达可降低棉花对黄萎病菌的抗性[6]。漆酶也参与棉花抗病过程,在棉花中过表达漆酶基因和可增强棉花对黄萎病菌的抗性[7-8]。此外,调控木质素、类黄酮等次生物质合成的转录因子、、也参与调控棉花对黄萎病的抗性[9-11]。番茄是目前报道的唯一一个抗黄萎病的R基因,将转化到棉花中并不能增强棉花对黄萎病菌V991的抗性,但提高了棉花对含有的黄萎病菌株V4的抗性[12]。激素信号路径作为植物免疫调控网络的重要组分,其中茉莉酸(jasmonic acid,JA)、水杨酸(salicylic acid,SA)、乙烯(ethylene,ETH)在棉花与黄萎病互作中发挥了重要作用[13-14]。黄萎病菌的侵染会改变棉花体内的激素水平和相关基因的表达,在棉花中抑制JA合成或信号转导相关基因、的表达可降低棉花对黄萎病菌的抗性[15-16]。参与逆境胁迫响应的有丝分裂原活化蛋白激酶MAPK信号路径在棉花抗病反应中也发挥了重要作用,在棉花中过表达降低了棉花对黄萎病菌的抗性[17]。此外,灰霉病主要危害农作物果实,如棉铃、黄瓜、番茄、草莓等,我国目前对灰霉病的防治主要以化学防治为主。因此,发掘新的抗病基因,培育抗病品种对于农作物产业发展具有重要意义。组成型表达的病程相关基因(constitutive expression of pathogenesis-related genes 5)作为一个重要防御相关基因,其功能在拟南芥、玉米、水稻等多种植物中被广泛研究。拟南芥AtCPR5编码一个核膜蛋白,被认为是核孔复合体的组成部分。在不同植物中,CPR5跨膜结构较为保守,C端包含4—5个跨膜结构域[18-19]。大量研究表明,是一个多功能基因,广泛参与植物抗病反应、细胞增殖、细胞死亡、细胞衰老、细胞壁形成、茉莉酸信号途径、水杨酸信号路径、乙烯信号路径、脱落酸途径等过程[20-26]。最近,Wang等[27]根据拟南芥CPR5蛋白序列对海岛棉、陆地棉、树棉、草棉等不同基因组类型棉花中的进行全基因组鉴定,发现在棉花中沉默草棉后,沉默植株叶和叶柄上的表皮毛密度显著低于对照植株,但并未研究在棉花抗病反应中的功能。【本研究切入点】病害是影响棉花产量和品质的重要因素之一,CPR5作为一个重要免疫蛋白,在植物抗病防御反应中发挥着重要作用,在拟南芥、水稻、玉米等物种中已被广泛研究。但是,棉花中关于的研究较少,在棉花抗病过程中发挥的功能尚不清楚。通过棉花响应黄萎病菌的转录组数据筛选到一个,其在棉花抗病方面的功能有待发掘。【拟解决的关键问题】本研究通过分析陆地棉序列特征和黄萎病菌诱导表达模式,利用病毒诱导的基因沉默技术(virus induced gene silencing,VIGS)下调棉花体内的表达,明确其在棉花抵御黄萎病菌和灰霉病菌中的作用,为棉花抗病机制研究和分子育种提供理论依据和候选基因。
1 材料与方法
1.1 材料和培养
所用棉花材料为陆地棉TM-1。挑选籽粒饱满的种子,用无菌水浸泡5 h,然后将浸泡过的种子用湿润的纱布包裹,放置于28 ℃生化培养箱中进行催芽。将胚根长度萌发较为一致的种子种于营养土中,并覆盖一层薄膜保湿,放于光照培养箱中培养,2 d后去除薄膜和种壳。培养条件为温度25 ℃,湿度70%,光照/黑暗=16 h/ 8 h。
1.2 棉花总RNA提取、cDNA合成和PCR扩增
使用多糖多酚植物总RNA提取试剂盒DP441(天根生化科技,北京)提取棉花不同组织的总RNA。用HiScript® Ⅲ RT SuperMix for qPCR(+gDNA wiper)试剂盒(诺唯赞,南京)合成cDNA。将稀释50倍的cDNA作为模板,进行RT-PCR和实时荧光定量PCR扩增试验,内参基因为陆地棉(登录号:DQ116441)。RT-PCR扩增结果用1.2%琼脂糖凝胶电泳进行检测。qRT-PCR用ChamQTM SYBR® qPCR Master Mix定量试剂盒(诺唯赞,南京)完成,每个反应至少3个技术重复,用2-ΔCt方法计算目的基因的表达量。所用引物见表1。

表1 研究所用引物
1.3 GhCPR5的克隆和生物信息学分析
从CottonFGD(https://cottonfgd.org/)网站下载的全长序列,将此序列作为参考序列进行引物设计和PCR扩增,然后将扩增片段与TA克隆载体PGEM-T-easy连接,通过测序获得的转录序列。使用在线网站Compute pI/Mw tool(http://web.expasy.org/compute_pi/)分析GhCPR5蛋白的等电点和分子量;从NCBI(http://www.ncbi.nlm. nih.gov/)网站下载GhCPR5的同源蛋白序列,利用DNAMAN软件对GhCPR5和其同源蛋白进行序列比对;利用MEGA6邻近法构建GhCPR5和同源蛋白的系统进化树[28];使用TMHMM在线网站(http:// www.cbs.dtu.dk/services/TMHMM/)分析GhCPR5和同源蛋白的跨膜结构域;利用SMART在线网站(http://smart.embl-heidelberg.de/)分析CPR5蛋白的保守结构域。
1.4 GhCPR5表达模式分析
按照RNA提取试剂盒说明书提取陆地棉TM-1植株根、茎、真叶、子叶、胚珠、纤维和花瓣7个组织的RNA,并反转录成cDNA备用。以这些组织的cDNA为模板进行qRT-PCR扩增,分析在棉花不同组织中的表达水平。利用伤根法对生长至四叶一心的棉株进行黄萎病菌接种处理,水处理作为对照组。对处理1、4、12和24 h的根进行RNA提取和cDNA合成,方法参考1.2。以合成的cDNA为模板进行qRT-PCR扩增,以分析在黄萎病菌处理不同时间下的表达量。每个反应至少3个技术重复,用2-ΔCt方法计算的相对表达量。
1.5 GhCPR5干涉载体构建
采用酶切连接方法构建干涉载体,具体步骤如下:将的特异序列作为干涉区段,正向引物加上Ⅰ酶切位点,反向引物加上HⅠ酶切位点[6],然后以全长序列为模板进行PCR扩增。扩增产物和VIGS干涉载体TRV2同时用Ⅰ和HⅠ进行酶切,酶切3 h后纯化回收,然后用T4连接酶进行连接反应。利用热激法将连接产物转化到大肠杆菌DH5α中,并对单克隆进行PCR检测和测序分析,然后将测序正确的质粒转化到农杆菌GV3101中,备用。
1.6 GhCPR5沉默植株创建和干涉效率检测
将-80 ℃保存的、、TRV:和TRV:农杆菌菌株进行活化培养。利用离心机收集过夜培养的菌液,菌体用重悬液重悬,并将菌液OD600值调整至0.9。重悬液组分为10 mmol·L-1氯化镁、10 mmol·L-12-(N-吗啉)乙磺酸和200 µmol·L-1乙酰丁香酮。重悬菌液室温静置3 h后,将、TRV:和TRV:菌液分别与辅助菌液进行等体积混匀,利用注射器将混匀后的菌液分别注射到生长一周的TM-1棉花子叶中,然后在黑暗条件下培养16 h后放于正常光周期培养箱中继续培养,培养温度为23 ℃。待阳性对照植株TRV:出现白化表型后,提取对照植株TRV:(注射菌液的植株)和基因沉默植株TRV:的RNA,并反转录成cDNA,利用RT-PCR和qRT-PCR技术检测的干涉效率。每个反应至少3个技术重复,用2-ΔΔCt方法计算表达量。
1.7 黄萎病菌培养与棉株接菌处理
将300 μL黄萎病菌孢子液V991接种到PDA固体培养基上,置于25 ℃生化培养箱中黑暗培养5 d,利用无菌水冲洗出培养的黄萎病菌孢子,并将其浓度调整至2×106个/mL备用。棉花黄萎病菌整株接种采用伤根法进行接种[29],具体操作如下:将TRV:和TRV:植株从湿润的营养土中取出,利用剪刀剪去主根和侧根根尖,在浓度为2×106个/mL的孢子液中浸泡30 s,然后种回营养土中,置于光照培养箱中继续培养,观察统计植株黄萎病发病情况。每个处理设置3个生物学重复,每个重复至少接种15棵棉花植株,然后计算植株的发病率和发病指数[17]。此外,对TRV:和TRV:发病植株进行真菌恢复培养试验[30]。
对TRV:和TRV:植株进行离体叶片接种时,将黄萎病菌孢子浓度调整为2×107个/mL。具体操作如下:将相同叶龄、大小比较一致的棉花叶片放在托盘中,托盘底部放置两张湿润的滤纸。利用针头在叶片相同部位的叶脉处扎出伤口,将10 µL孢子液滴在伤口处,然后用保鲜膜覆盖叶片,25 ℃培养箱中培养。每天观察叶片的发病情况,并拍照记录。每个处理设置3个生物学重复,每个重复至少接种10片棉花真叶。
1.8 灰霉病菌培养与棉株接菌处理
将保存的灰霉病菌接种到PDA固体培养基上,25 ℃生化培养箱中进行活化培养。培养4 d后,用打孔器获取大小一致的菌体,备用。将相同叶龄、大小比较一致的来自TRV:和TRV:植株的棉花叶片放在托盘中,底部放置两张湿润的滤纸。在叶片主脉中间扎出伤口,将菌体置于伤口处,然后覆盖一层保鲜膜,置于25 ℃培养箱中培养[31]。每天观察记录叶片的发病情况,叶片病斑面积用Image J软件进行统计。每个处理设置3个生物学重复,每个重复至少接种10片棉花真叶。
1.9 棉花叶片台盼蓝染色
用台盼蓝乳酸染色液对接菌后的棉花叶片进行染色,台盼蓝乳酸染色液组分为:10 mL 85%乳酸、10 mL水饱和酚、10 mL甘油、10 mL蒸馏水和15 mg台盼蓝染料。将来自TRV:和TRV:植株的棉花叶片分别置于玻璃瓶中,加入30 mL台盼蓝乳酸染色液,真空处理20 min。随后100 ℃孵育8 min,37 ℃孵育4 h,25 ℃染色8 h。染色结束后用蒸馏水洗去多余染液,用2.5 g·mL-1的水合氯醛溶液进行脱色,对脱色的叶片进行拍照记录。
2 结果
2.1 GhCPR5的克隆与序列分析
前期研究中,通过比较转录组分析在陆地棉TM-1中筛选到一个在转录水平响应黄萎病菌侵染的候选基因,将其命名为。随后,从陆地棉TM-1基因组数据库中下载的编码序列(CDS),结果显示,在A基因组()和D基因组()的CDS全长1 683 bp,编码560个氨基酸,和编码的蛋白质氨基酸序列相似性为96.61%。以陆地棉TM-1叶的cDNA为模板进行PCR扩增和测序分析,结果显示,GhCPR5和Gh_D03G0427的氨基酸序列相似性为99.82%,只在C末端存在一个氨基酸差异,且GhCPR5和拟南芥AtCPR5(AT5G64930)在C端序列相似性较高(图1-A)。此外,GhCPR5蛋白质相对分子量为62.883 kDa,等电点为9.01。将陆地棉GhCPR5氨基酸序列和拟南芥、玉米、水稻、大豆、可可、榴莲、木槿、茶树、木薯等其他物种的CPR5序列进行比对和进化树分析,发现GhCPR5蛋白序列与锦葵科的可可和锦葵目的榴莲CPR5序列同源性较高(图1-B)。跨膜结构域预测分析显示,GhCPR5在C端含有5个跨膜结构域(图1-C),源自大豆、木薯、茶树的CPR5分别包含4个跨膜结构域,而拟南芥、玉米、水稻、高粱、木槿、榴莲、可可和黄麻植物的CPR5分别包括5个跨膜结构域,说明CPR5蛋白C端的跨膜结构域在植物界高度保守。
2.2 GhCPR5组织表达和黄萎病菌诱导表达模式分析
通过分析棉花幼苗真叶、子叶、茎和根,开花期的纤维、花瓣和胚珠中的表达量,发现在幼苗真叶中的表达量最高、在茎中的表达量最低,而在其他组织中的表达量约为内参基因的0.02%—0.15%,说明相对的表达量较低(图2-A)。此外,为探究的转录是否响应黄萎病菌的侵染,对四叶期的棉花幼苗进行黄萎病菌V991接种处理,进一步分析在黄萎病菌诱导下的基因表达情况。结果显示,在棉花接种黄萎病菌1和4 h时,表达量显著高于对照组。但是,在12和24 h时,表达量降低,且和对照组的表达量无显著差异(图2-B)。
2.3 GhCPR5抑制表达植株创建和基因干涉效率分析
为探究在棉花抵御病原菌侵染中的作用,构建了病毒诱导的沉默载体TRV:,并通过农杆菌介导的瞬时转化方法获得沉默植株。结果显示,阳性对照TRV:植株真叶出现明显的白化表型,说明在棉花中利用VIGS技术可对目标基因实现快速、高效沉默(图3-A)。此外,与对照植株TRV:相比,抑制表达植株TRV:在发育上无显著差异(图3-B),且TRV:植株体内的表达量显著低于TRV:植株(图3-C)。结果表明,在正常生长条件下,降低棉花体内表达不影响棉株生长发育。
2.4 抑制GhCPR5表达降低了棉花对黄萎病菌的抗性
对TRV:和TRV:植株进行整株黄萎病菌V991接种,结果表明,TRV:植株叶片发黄、萎蔫的程度显著高于TRV:(图4-A)。且与TRV:植株相比,TRV:植株茎秆维管组织的褐化程度较高(图4-B),与TRV:植株发病较重的症状相符。真菌恢复培养试验结果显示,TRV:植株的茎段经培养后生长的菌落较少,而TRV:植株茎段上生长的菌落较多(图4-C)。发病率统计结果显示,接种后第5天,TRV:植株发病率约为25.56%,而TRV:抑制表达植株发病率达到50%以上,显著高于对照植株;接种后第7天,TRV:发病率达到50%,TRV:抑制表达植株发表率约为90.83%,统计分析显示仍显著高于对照植株;接种后第9天,TRV:和TRV:发病率均达到90%以上,两者之间无显著差异(图4-D)。病情指数统计结果表明,在黄萎病菌接种后的第5、7和9天,TRV:植株病情指数均显著高于TRV:植株(图4-E)。
此外,对TRV:和TRV:植株的离体叶片进行黄萎病菌接种,结果显示,TRV:植株叶片上的病斑面积显著高于TRV:植株叶片上的病斑面积(图5-A—B)。台盼蓝染色结果显示,TRV:叶片上的坏死细胞量明显高于对照植株叶片(图5-C)。以上结果表明,在棉花中下调表达,降低了棉花对黄萎病菌的抗性。
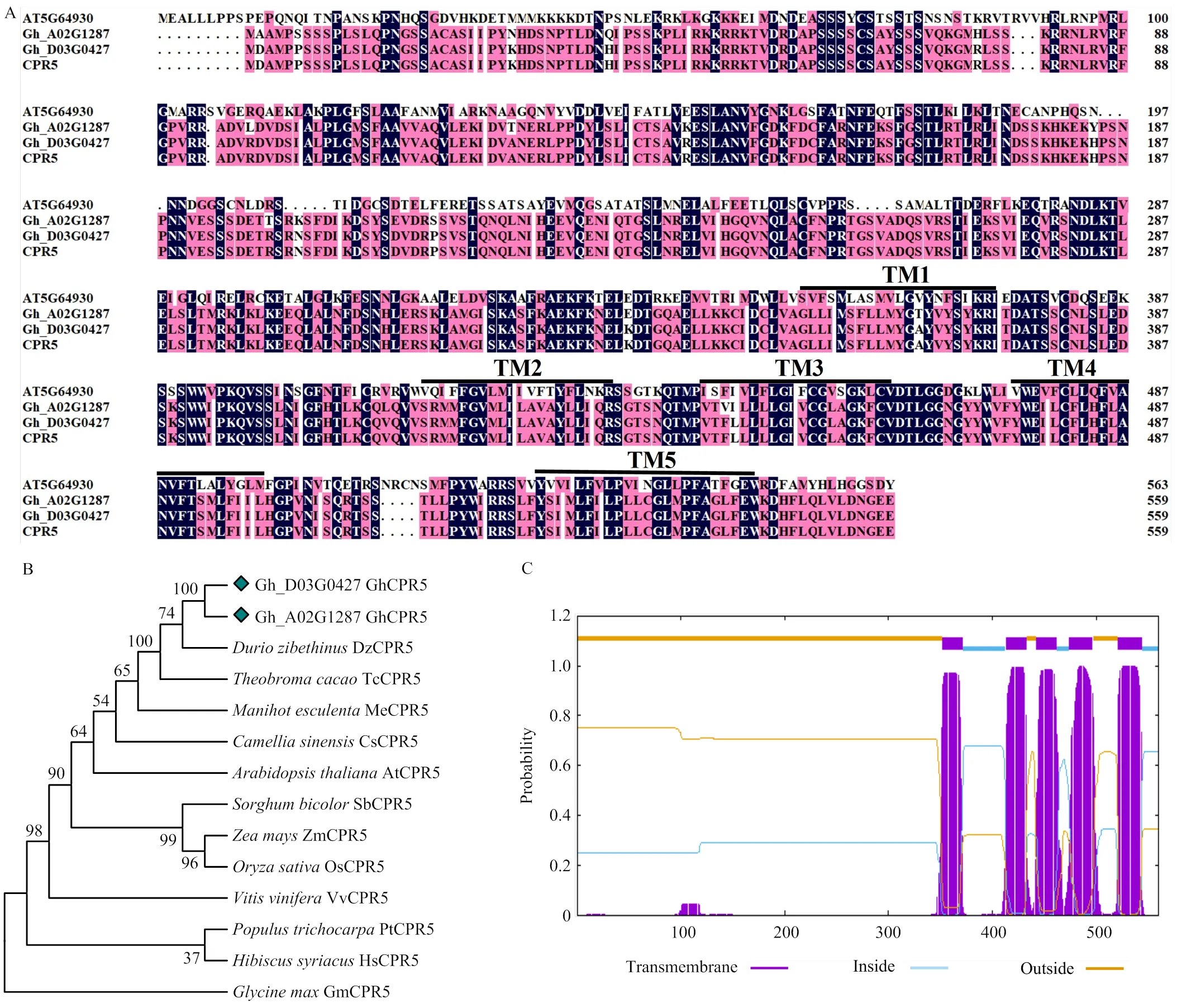
A:GhCPR5与拟南芥CPR5氨基酸序列比对。AT5G64930:拟南芥CPR5;Gh_A02G1287/Gh_D03G0427:陆地棉基因组库中A、D基因组上的GhCPR5序列;CPR5:GhCPR5的扩增序列。B:GhCPR5与其他物种CPR5的系统进化树。Dz:榴莲,XP_022739926,Tc:可可,XP_007048101,Me:木薯,XP_021633464,Cs:茶树,XP_028102180,At:拟南芥,AT5G64930,Sb:高粱,XP_002454622,Zm:玉米,NP_001146273,Os:水稻,XP_015643035,Vv:葡萄,XP_002280314,Pt:毛果杨,XP_006380467,Hs:木槿,XP_039044948,Gm:大豆,XP_006581733。C:GhCPR5蛋白跨膜结构域(TMs)预测
2.5 抑制棉花体内GhCPR5表达降低了棉花对灰霉病菌的抗性
为检测下调表达是否影响棉花对灰霉病菌的抗性,对TRV:和TRV:植株的离体叶片进行灰霉病菌接种试验。结果显示,TRV:叶片上的病斑面积显著高于TRV:对照植株叶片的病斑面积(图5-D—E)。此外,台盼蓝染色结果显示,TRV:植株叶片上坏死细胞面积和灰霉病菌的菌丝量显著高于对照植株叶片(图5-F)。此结果表明,在棉花中下调表达,降低了棉花对灰霉病菌的抗性。
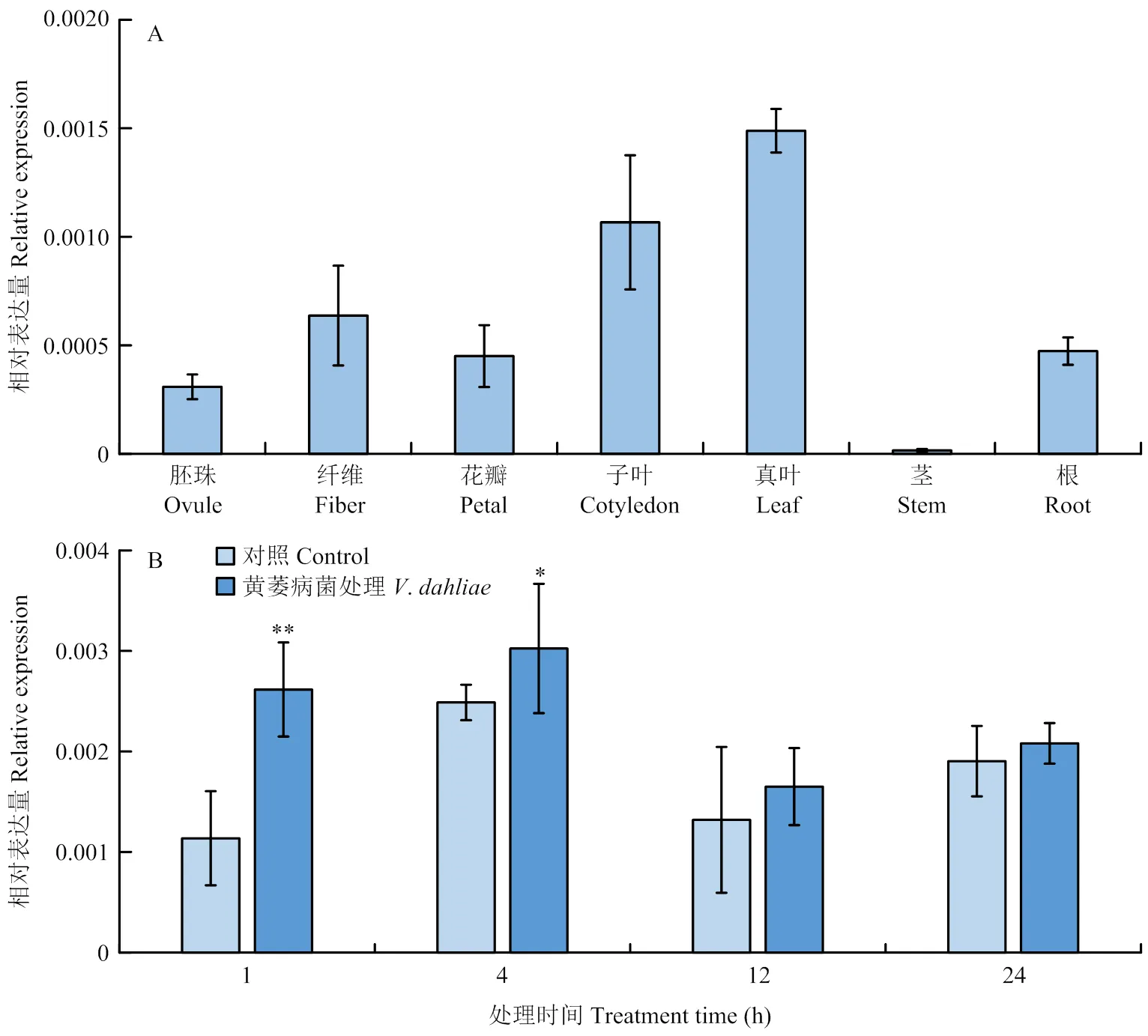
A:GhCPR5在不同棉花组织中的表达模式分析;B:GhCPR5在黄萎病菌诱导下的基因表达分析。*和**:在P<0.05和P<0.01时差异达到显著和极显著。下同
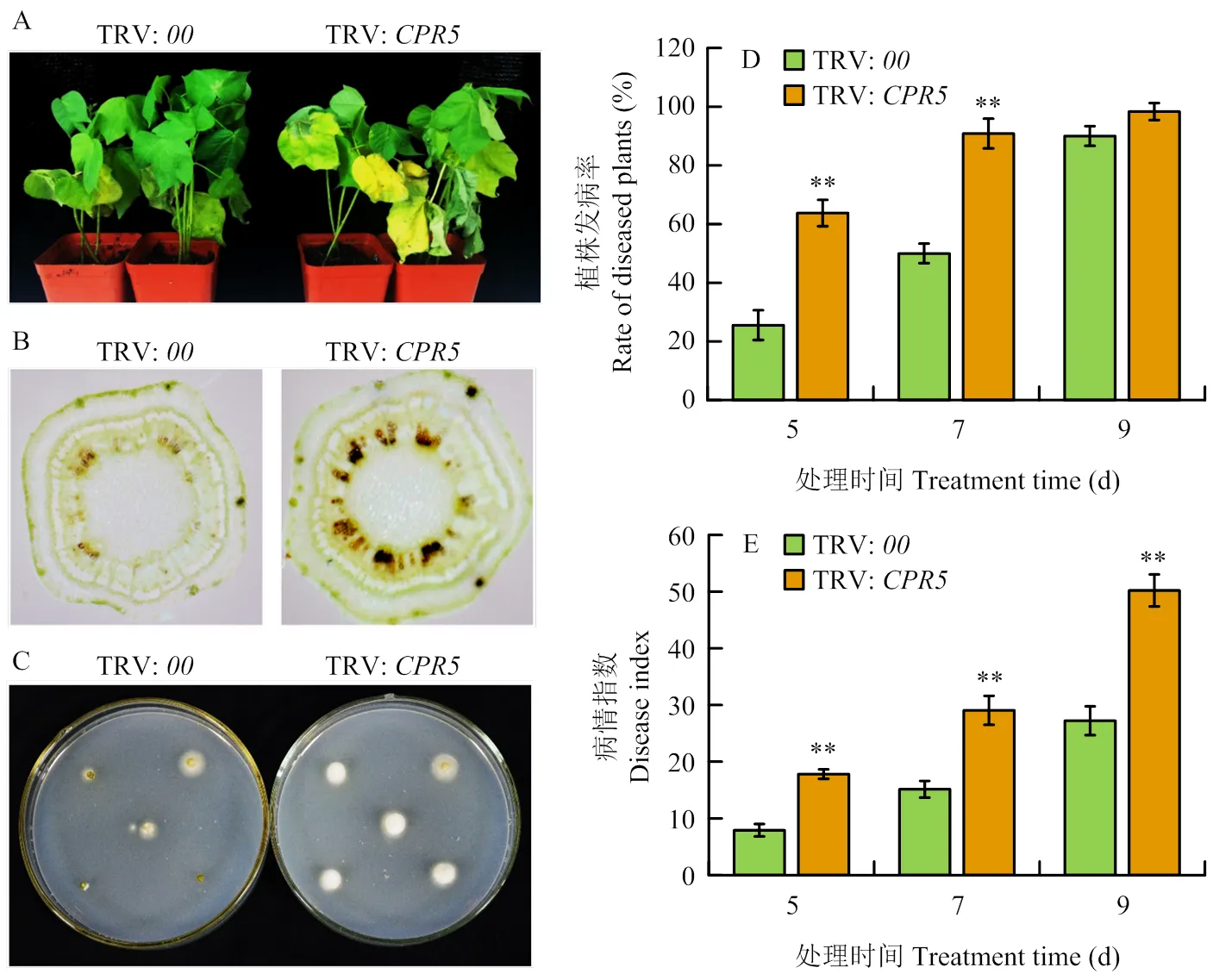
A:TRV:00和TRV:CPR5植株在接种黄萎病菌9 d后的整株发病情况;B:TRV:00和TRV:CPR5接种黄萎病菌9 d后茎秆横切面观察;C:TRV:00和TRV:CPR5植株接种黄萎病菌9 d后茎秆真菌恢复培养;D:TRV:00和TRV:CPR5植株接种黄萎病菌后发病率统计分析;E:TRV:00和TRV:CPR5植株接种黄萎病菌不同天数的病情指数

A:TRV:00和TRV:CPR5植株叶片接种黄萎病菌3 d的病斑情况;B:黄萎病菌侵染TRV:00和TRV:CPR5叶片的病斑面积统计;C:TRV:00和TRV:CPR5叶片接种黄萎病菌后,叶片表面菌丝和坏死细胞的台盼蓝染色;D:TRV:00和TRV:CPR5植株叶片接种灰霉病菌4 d的表型观察;E:灰霉病菌侵染TRV:00和TRV:CPR5叶片的病斑面积统计;F:TRV:00和TRV:CPR5叶片接种灰霉病菌后,叶片表面菌丝和坏死细胞的台盼蓝染色
2.6 GhCPR5抑制表达植株防御相关基因表达分析
为进一步探究在响应病原菌过程中可能参与的抗病信号路径,检测TRV:和TRV:植株在黄萎病菌侵染4 h时体内JA信号路径、SA信号路径和一些防御相关基因的表达水平。结果显示,与对照植株相比,沉默植株体内JA信号路径相关基因的表达量显著高于对照植株,而抗病相关基因、和在TRV:植株中的表达量显著低于TRV:植株(图6)。此外,和SA信号通路中病程相关蛋白基因的表达量无显著变化。此结果说明,棉株在受到病原菌侵染时,可能通过表达GhCPR5蛋白进一步激活JA信号路径和诱导抗病相关蛋白的表达来提高棉花抗病性。

图6 qRT-PCR分析防御相关基因在TRV:00和TRV:CPR5植株中的表达量
3 讨论
3.1 GhCPR5与同源蛋白的结构保守性
生物信息学可分析蛋白结构、基因表达、基因启动子元件等,为研究基因功能提供线索和参考依据。本研究通过分析GhCPR5及其同源蛋白的氨基酸序列,预测到GhCPR5蛋白C端有5个跨膜结构域,大豆、玉米和高粱等物种CPR5蛋白在C端也有4—5个跨膜结构。有文献报道AtGhCPR5在C端有4—5个跨膜结构域[32],水稻有5个跨膜结构域[33]。系统进化树分析显示,棉花GhCPR5和可可、榴莲、拟南芥等物种CPR5氨基酸序列同源性较高。此外,序列比对和蛋白结构分析结果表明植物界CPR5蛋白C端序列结构高度保守,这种保守性可能与其生物学功能相关。
3.2 GhCPR5与同源蛋白的功能差异性
拟南芥突变体植株表现为矮小、表皮毛异常、叶片早衰并有类病斑、水杨酸高积累、对致病菌抗性增强等性状[20, 25, 32]。近期研究表明,突变体对丁香假单胞菌Pst hrcC菌株的感病性显著高于对照植株,在植物模式触发的免疫(pattern- triggered immunity,PTI)反应中起正调控作用,同时也说明CPR5在PTI和效应子引起的免疫反应调控中发挥着不同的功能[34]。我们的研究发现表达受黄萎病菌诱导,且在棉花中下调降低了棉花对病原菌的抗性,说明GhCPR5正调控棉花对病原菌的抗性。但是,下调表达不影响棉株生长和发育,棉花叶片也没有出现类病斑。此结果表明,GhCPR5和AtCPR5功能在病原菌防御方面类似,都参与植物免疫过程;同时也表明不同植物间CPR5蛋白结构虽然保守,但具体生物学功能存在一定差异。
3.3 GhCPR5与JA信号的关系
JA及其衍生物是植物重要的信号分子,在植物应对生物与非生物胁迫中发挥重要作用,并被广泛研究[35]。植物受到病原菌入侵时会激活JA合成途径,合成的JA作为信号分子进一步激活下游防御信号路径,诱导、、等防御相关基因表达,以提高植物对病原菌的抗性[36]。茉莉酸甲酯处理还会诱导植物萜类物质合成、苯丙氨酸代谢、JA合成、JA信号路径等有利于增强植物抗性相关基因的表达[37]。棉花与黄萎病互作机制研究结果表明,JA合成以及信号传导路径在棉花抵御黄萎病菌侵染中发挥着重要作用。如,He等[38]发现在棉花中过表达JA信号路径关键抑制因子会降低棉花对黄萎病菌的抗性,过表达激活JA合成路径的转录因子可增强棉花对黄萎病菌的抗性。Wang等[16]发现,在棉花中抑制长链非编码RNA基因的表达,导致JA合成关键基因表达显著下调,植株体内JA含量降低,对黄萎病菌抗性减弱。在本研究中,沉默植株体内JA信号路径表达量显著高于对照植株,而防御相关基因、、表达量显著下调,说明病原菌侵染激发了TRV:植株体内的JA信号路径。但表达被抑制,导致植物防御相关基因不能正常表达,对病原菌防御能力降低,推测GhCPR5可能作用于JA信号路径的下游。
4 结论
从陆地棉TM-1中克隆到,其全长1 683 bp,编码560个氨基酸,且GhCPR5蛋白在结构上较为保守,具有5个跨膜结构域。在棉花幼苗真叶中表达量最高,茎中表达量最低,并受黄萎病菌诱导表达。在棉花中下调表达可降低棉花对黄萎病菌和灰霉病菌的抗性。
[1] SHABAN M, MIAO Y H, ULLAH A, KHAN A Q, MENGHWAR H, KHAN A H, AHMED M M, TABASSUM M A, ZHU L F. Physiological and molecular mechanism of defense in cotton against. Plant Physiology and Biochemistry, 2018, 125: 193-204.
[2] ZHANG J, HU H L, WANG X N, YANG Y H, ZHANG C J, ZHU H Q, SHI L, TANG C M, ZHAO M W. Dynamic infection ofin upland cotton. Plant Biology, 2020, 22(1): 90-105.
[3] LUO X M, XIE C J, DONG J Y, YANG X Y, SUI A P. Interactions betweenand its host: vegetative growth, pathogenicity, plant immunity. Applied Microbiology and Biotechnology, 2014, 98(16): 6921-6932.
[4] ZHANG X Y, CHENG W H, FENG Z D, ZHU Q H, SUN Y Q, LI Y J, SUN J. Transcriptomic analysis of gene expression ofupon treatment of the cotton root exudates. BMC Genomics, 2020, 21(1): 155.
[5] XU L, ZHU L F, TU L L, LIU L L, YUAN D J, JIN L, LONG L, ZHANG X L. Lignin metabolism has a central role in the resistance of cotton to the wilt fungusas revealed by RNA-Seq-dependent transcriptional analysis and histochemistry. Journal of Experimental Botany, 2011, 62(15): 5607-5621.
[6] GAO W, LONG L, ZHU L F, XU L, GAO W H, SUN L Q, LIU L L, ZHANG X L. Proteomic and virus-induced gene silencing (VIGS) analyses reveal that gossypol, brassinosteroids, and jasmonic acid contribute to the resistance of cotton to. Molecular & Cellular Proteomics, 2013, 12(12): 3690-3703.
[7] HU Q, MIN L, YANG X Y, JIN S X, ZHANG L, LI Y Y, MA Y Z, QI X W, LI D Q, LIU H B, LINDSEY K, ZHU L F, ZHANG X L. Laccasemodulates broad spectrum biotic stress tolerance via manipulating phenylpropanoid pathway and jasmonic acid synthesis. Plant Physiology, 2018, 176(2): 1808-1823.
[8] ZHANG Y, WU L Z, WANG X F, CHEN B, ZHAO J, CUI J, LI Z K, YANG J, WU L Q, WU J H, ZHANG G Y, MA Z Y. The cotton laccase geneenhanceswilt resistance via an increase in defence induced lignification and lignin components in the cell walls of plants. Molecular Plant Pathology, 2019, 20(3): 309-322.
[9] MA Q, WANG N H, MA L, LU J H, WANG H T, WANG C C, YU S X, WEI H L. The cotton bel1-like transcription factor GhBLH7-D06 negatively regulates the defense response against. International Journal of Molecular Sciences, 2020, 21(19): 7126.
[10] XIAO S H, HU Q, SHEN J L, LIU S M, YANG Z G, CHEN K, KLOSTERMAN S J, JAVORNIK B, ZHANG X L, ZHU L F. GhMYB4 downregulates lignin biosynthesis and enhances cotton resistance to. Plant Cell Reports, 2021, 40(4): 735-751.
[11] HU Q, XIAO S H, WANG X R, AO C W, ZHANG X L, ZHU L F.enhances cotton resistance tovia an increase in defense induced lignification and S monolignol content. Plant Science, 2021, 305: 110833.
[12] SONG Y, LIU L L, WANG Y D, VALKENBURG D J, ZHANG X L, ZHU L F, THOMMA B P H J. Transfer of tomato immune receptorconfers Ave1 dependentresistance in tobacco and cotton. Plant Biotechnology Journal, 2018, 16(2): 638-648.
[13] SONG R R, LI J P, XIE C J, JIAN W, YANG X Y. An overview of the molecular genetics of plant resistance to thewilt pathogen. International Journal of Molecular Sciences, 2020, 21(3): 1120.
[14] SHABAN M, KHAN A H, NOOR E, MALIK W, ALI H M W, SHEHZAD M, AKRAM U, QAYYUM A. A 13-lipoxygenase, GhLOX2, positively regulates cotton tolerance againstthrough JA-mediated pathway. Gene, 2021, 796/797: 145797.
[15] LIU S C, SUN R B, ZHANG X J, FENG Z L, WEI F, ZHAO L H, ZHANG Y L, ZHU L F, FENG H J, ZHU H Q. Genome wide analysis of OPR family genes in cotton identified a role for GhOPR9 inresistance. Genes, 2020, 11(10): 1134.
[16] WANG G N, WANG X F, ZHANG Y, YANG J, LI Z K, WU L Z, WU J H, WU N, LIU L X, LIU Z W, ZHANG M, WU L Q, ZHANG G Y, MA Z Y. Dynamic characteristics and functional analysis provide new insights into long non-coding RNA responsive toinfection in. BMC Plant Biology, 2021, 21(1): 68.
[17] LONG L, XU F C, ZHAO J R, LI B, XU L, GAO W.overexpression increases cotton sensitivity toby regulating salicylic acid signaling. Plant Science, 2020, 292: 110374.
[18] YOSHIDA S, ITO M, NISHIDA I, WATANABE A. Identification of a novel genethat has a repressive role in the induction of leaf senescence and pathogen-defence responses in. The Plant Journal, 2002, 29(4): 427-437.
[19] VAN D J. CPR5 modulates plant immunity via RNA processing. The Plant Cell, 2022, 34(5): 1437-1438.
[20] BOWLING S A, CLARKE J D, LIU Y, KLESSIG D F, DONG X. Themutant ofexpresses both NPR1-dependent and NPR1-independent resistance. The Plant Cell, 1997, 9(9): 1573-1584.
[21] BOCH J, VERBSKY M L, ROBERTSON T L, LARKIN J C, KUNKEL B N. Analysis of resistance gene-mediated defense responses inplants carrying a mutation in CPR5. Molecular Plant-Microbe Interactions, 1998, 11(12): 1196-1206.
[22] JING H C, ANDERSON L, STURRE M J G, HILLE J, DIJKWEL P P.is a senescence-regulatory gene with pleiotropic functions as predicted by the evolutionary theory of senescence. Journal of Experimental Botany, 2007, 58(14): 3885-3894.
[23] GAO G L, ZHANG S C, WANG C F, YANG X, WANG Y Q, SU X J, DU J J, YANG C W.independently regulates seed germination and postgermination arrest of development through LOX pathway and ABA signaling. PLoS One, 2011, 6(4): e19406.
[24] MENG Z, RUBERTI C, GONG Z Z, BRANDIZZI F. CPR5 modulates salicylic acid and the unfolded protein response to manage tradeoffs between plant growth and stress responses. The Plant Journal, 2017, 89(3): 486-501.
[25] PENG S, GUO D B, GUO Y, ZHAO H Y, MEI J, HAN Y K, GUAN R, WANG T H, SONG T, SUN K K, LIU Y H, MAO T, CHANG H, XUE J S, CAI Y F, CHEN D, WANG S. Constitutive expresser of pathogenesis-related genes 5 is an RNA-binding protein controlling plant immunity via an RNA processing complex. The Plant Cell, 2022, 34(5): 1724-1744.
[26] CHEN J C, SUI X Y, MA B R, LI Y T, LI N, QIAO L F, YU Y C, DONG C H.CPR5 plays a role in regulating nucleocytoplasmic transport of mRNAs in ethylene signaling pathway. Plant Cell Reports, 2022, 41(4): 1075-1085.
[27] WANG H, UMER M J, LIU F, CAI X Y, ZHENG J, XU Y C, HOU Y Q, ZHOU Z L. Genome-wide identification and characterization ofgenes inreveals their potential role in trichome development. Frontiers in Genetics, 2022, 13: 921096.
[28] TAMURA K, STECHER G, PETERSON D, FILIPSKI A, KUMAR S. MEGA6: Molecular evolutionary genetics analysis version 6.0. Molecular Biology and Evolution, 2013, 30(12): 2725-2729.
[29] LONG L, LIU J, GAO Y, XU F C, ZHAO J R, LI B, GAO W. Flavonoid accumulation in spontaneous cotton mutant results in red coloration and enhanced disease resistance. Plant Physiology and Biochemistry, 2019, 143: 40-49.
[30] FRADIN E F, ZHANG Z, JUAREZ AYALA J C, CASTROVERDE C D M, NAZAR R N, ROBB J, LIU C M, THOMMA B P H J. Genetic dissection ofwilt resistance mediated by tomato Ve1. Plant Physiology, 2009, 150(1): 320-332.
[31] GAO W, LONG L, XU L, LINDSEY K, ZHANG X L, ZHU L F. Suppression of the homeobox geneenhances resistance toandin cotton. Journal of Integrative Plant Biology, 2016, 58(5): 503-513.
[32] KIRIK V, BOUYER D, SCHÖBINGER U, BECHTOLD N, HERZOG M, BONNEVILLE J M, HÜLSKAMP M. CPR5 is involved in cell proliferation and cell death control and encodes a novel transmembrane protein. Current Biology, 2001, 11(23): 1891-1895.
[33] 刘锋, 舒曦, 郑艳华, 黎梓君, 阳成伟, 王亚琴. 水稻CPR5基因参与氧化胁迫响应. 热带亚热带植物学报, 2013, 21(4): 305-314.
LIU F, SHU X, ZHENG Y H, LI Z J, YANG C W, WANG Y Q. Involvement of rice CPR5 in response to oxidative stress. Journal of Tropical and Subtropical Botany, 2013, 21(4): 305-314. (in Chinese)
[34] MA M M, LI M, ZHOU R F, YU J B, WU Y, ZHANG X L, WANG J L, ZHOU J M, LIANG X X. CPR5 positively regulates pattern- triggered immunity via a mediator protein. Journal of Integrative Plant Biology, 2023, 65(7): 1613-1619.
[35] WANG Y, MOSTAFA S, ZENG W, JIN B. Function and mechanism of jasmonic acid in plant responses to abiotic and biotic stresses. International Journal of Molecular Sciences, 2021, 22(16): 8568.
[36] AMEYE M, AUDENAERT K, DE ZUTTER N, STEPPE K, VAN MEULEBROEK L, VANHAECKE L, DE VLEESSCHAUWER D, HAESAERT G, SMAGGHE G. Priming of wheat with the green leaf volatile Z-3-hexenyl acetate enhances defense againstbut boosts deoxynivalenol production. Plant Physiology, 2015, 167(4): 1671-1684.
[37] LIU D, ZHAO Q, CUI X, CHEN R, LI X, QIU B, GE F. A transcriptome analysis uncoversresistance toinduced by methyl jasmonate. Genes Genomics, 2019, 41(12): 1383-1396.
[38] HE X, ZHU L F, WASSAN G M, WANG Y J, MIAO Y H, SHABAN M, HU H Y, SUN H, ZHANG X L. GhJAZ2 attenuates cotton resistance to biotic stresses via the inhibition of the transcriptional activity of GhbHLH171. Molecular Plant Pathology, 2018, 19(4): 896-908.
Cloning and functional characterization of
XU FuChun1,2, ZHAO JingRuo2, ZHANG ZhenNan2, HU GaiYuan2, LONG Lu
1Changzhi Medical College, Changzhi 046000, Shanxi;2School of life sciences, Henan University/National Key Laboratory of Cotton Bio-breeding and Integrated Utilization, Kaifeng 475000, Henan
【Objective】This study on the function and mechanism of GhCPR5 in response to() and() in cotton analysed nucleotide sequence, protein structure, expression pattern, and biological function to provide a theoretical basis and genetic resources for cotton disease resistance and breeding mechanism research. 【Method】GhCPR5was identified from the unpublished transcriptome data of cotton responses toinfection. The full-length coding sequence of GhCPR5 was amplified from upland cotton TM-1. The conserved domain, protein structure, and phylogenetic relationship of GhCPR5 and homologous genes were analysed using bioinformatics techniques. Real-time fluorescence quantitative PCR (qPCR) was used to analyse the GhCPR5 expression patterns in cotton roots, stems, leaves, ovules, fibres, and petals, and the induced expression of GhCPR5 byinfection. The silencing fragments of GhCPR5 were amplified and inserted into the VIGS vector to generate the gene silencing construct TRV:. GhCPR5-silencing plants were created via-mediated transformation methods. RT-PCR and qPCR were used to analyse the silencing efficiency of GhCPR5 in TRV:plants. TRV:and TRV:plants were inoculated withand, respectively, to analyse the difference in resistance in TRV:and TRV:plants in response topathogens. To analyse defence signal pathways involving GhCPR5, the expression levels of defence-related genes in TRV:and TRV:plants were detected by qPCR. 【Result】The GhCPR5 cloned fromTM-1 is 1 683 bp long and encodes a 560 amino acidprotein. The relative molecular weight and isoelectric point of GhCPR5 are 62.883 kDa and 9.01, respectively. Multiple-sequence alignment and phylogenetic analysis showed that GhCPR5 is highly homologous with the CPR5 ofand. Furthermore, the C-terminals of GhCPR5 and CPR5 of other species are highly conserved and contain 4-5 transmembrane domains. The GhCPR5 expression level was induced byinfection and is highest in leaves and lowest in stems. Under normal conditions, no significant developmental differences were observed between theGhCPR5-silencing plants, TRV:, and the TRV:control plants.After inoculation with, the rate of disease and the disease index of TRV:plants were significantly higher than those of the control plants. Analysis of detached leaves inoculated withandand lactophenol-trypan blue staining showed that the lesions on the leavesof TRV:plants were much bigger than those of TRV:plants, indicating that silencing GhCPR5 made cotton less resistant toand. In addition, theexpression levels in TRV:plants were significantly higher than in TRV:plants, whereas the,, andexpression levels were markedly lower in TRV:plants. 【Conclusion】GhCPR5 positively regulates cotton disease resistance; the downregulated expression of GhCPR5 significantly reduced cotton resistance toand.
cotton; disease resistance protein;;; gene expression
10.3864/j.issn.0578-1752.2023.19.004
2023-05-05;
2023-06-12
山西省基础研究计划(202203021222310)、长治医学院博士科研启动基金(BS202206)、河南省科学技术研究项目(222300420402)
许福春,E-mail:henanxufuchun@163.com。赵静若,E-mail:707398769@qq.com。许福春和赵静若为同等贡献作者。通信作者龙璐,E-mail:lulong1826@163.com
(责任编辑 李莉)
