海岛棉CAD和CAD-Like基因家族的鉴定、表达及其对大丽轮枝菌的响应
2023-10-25张钰佳崔凯文段力升曹爱萍谢全亮沈海涛王斐李鸿彬
张钰佳,崔凯文,段力升,曹爱萍,2,谢全亮,2,沈海涛,2,王斐,2,李鸿彬,2
海岛棉CAD和CAD-Like基因家族的鉴定、表达及其对大丽轮枝菌的响应
张钰佳1,崔凯文1,段力升1,曹爱萍1,2,谢全亮1,2,沈海涛1,2,王斐,李鸿彬
1石河子大学生命科学学院,新疆石河子 832003;2绿洲城镇与山盆系统生态兵团重点实验室,新疆石河子 832003
【目的】肉桂醇脱氢酶(CAD)是木质素合成途径中的关键酶,在增强植物机械强度、抵御病原菌入侵等方面发挥重要作用。鉴定海岛棉GbCAD、GbCAD-LIKE(GbCADL)基因家族成员,并对其表达特征及其在黄萎病抗性中的作用进行分析,为棉花抗黄萎病机制的解析及抗病育种提供参考。【方法】利用生物信息学方法对海岛棉GbCAD、GbCADL基因家族成员进行鉴定,并对其染色体定位、系统发育关系、基因结构、启动子顺式元件的预测进行系统分析。通过获得公开释放的转录组数据和实时荧光定量聚合酶链式反应(qRT-PCR)分析GbCAD基因及GbCADL基因的表达特征。利用病毒诱导的基因沉默(VIGS)技术对GbCAD基因及GbCADL基因进行功能分析。【结果】从海岛棉中鉴定到25个GbCAD基因(分布在10条染色体)和34个GbCADL基因(分布在17条染色体)。GbCAD基因分为3个亚组,GbCADL基因分为4个亚组,同一个组内基因含有相似的外显子-内含子结构和保守结构域。GbCAD基因和GbCADL基因具有不同的转录表达特征,其启动子中含有多种激素和胁迫响应元件。转录组数据和qRT-PCR显示,、、、、的表达受大丽轮枝菌诱导,尤其是、、、的表达在大丽轮枝菌处理后显著增加。利用VIGS技术,将显著受大丽轮枝菌诱导表达的、、、分别在棉花中沉默,分析VIGS株系对大丽轮枝菌抗性的变化。结果显示,与对照植株相比,VIGS株系对大丽轮枝菌的抗性显著降低。二氨基联苯胺(DAB)染色结果显示,在未受到黄萎病侵染时,VIGS植株和对照植株的染色程度无显著差异;在大丽轮枝菌处理6 h后,与对照植株相比,沉默株系、、、均表现出较深的着色,表明在沉默株系中有较高的活性氧累积。茎的切片结果显示,大丽轮枝菌处理后,TRV:、TRV:、TRV:、TRV:沉默株系的茎维管组织表现出明显的深褐色,表明其对大丽轮枝菌的抗性显著降低。【结论】抑制、、、的表达可以显著降低棉花对大丽轮枝菌的抗性。
海岛棉;肉桂醇脱氢酶;基因家族;表达特征;基因沉默;大丽轮枝菌
0 引言
【研究意义】大丽轮枝菌()引起的黄萎病是一种具有破坏性的土传维管束病害,对植物具有广泛的侵害性,通常会引起植物发育不良、枯萎、维管束褐变等,最终导致植物生长发育受到严重影响甚至死亡[1]。棉花是重要的经济作物和天然纤维作物,在种植过程中容易受黄萎病的危害,该真菌病害严重影响棉花的生长、品质以及产量。中国棉田中的黄萎病主要由大丽轮枝菌侵染所致[2]。研究棉花中响应大丽轮枝菌的关键基因及其功能,对于抗病机制解析及抗病棉花材料培育具有重要意义。【前人研究进展】木质素(lignin)是一种植物体内重要的大分子有机物质,主要存在于次生加厚的细胞壁中[3],能增强植物体机械强度及细胞壁的硬度,进而增强植物抵御生物和非生物胁迫[4]。当植物受到病原菌侵害时,会启动一系列信号通路诱导植物防御相关基因的表达和一些化合物的产生,如萜类和苯丙烷[5],苯丙烷途径进一步可合成木质素单体,进而增强植物的抗病性[6-7]。木质素主要由香豆醇、松柏醇、芥子醇3种木质醇单体聚合而成,根据这3种不同单体最终形成3种类型的木质素,分别是对-羟基苯基丙烷木质素(H-木质素)、愈创木基木质素(G-木质素)、紫丁香基木质素(S-木质素)[8]。木质素可通过增强植物机械强度、增厚细胞壁形成物理屏障以抑制病原体入侵[9-12]。木质素对黄萎病的抗性与活性氧(reactive oxygen species,ROS)信号介导的植物防御反应密切相关[13-14]。肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)是一类NADPH依赖性酶,是调控木质素单体生物合成的关键酶,对于木质素的合成发挥着重要作用[7]。当植物受到外界环境的刺激或诱导时,植物各组织会产生复杂的生理生化反应,形成特定的机制,木质化过程或木质素大量沉积也是对逆境胁迫的一种响应机制[15]。研究发现,香瓜抗病材料PMR-45在接种白粉病菌24 h后,被侵入的表皮细胞发生木质化[16]。亚麻CAD基因在不同组织器官对镰刀菌侵染具有不同程度的响应[17]。通过对3个玉米品种接种串珠镰刀菌(),发现木质素含量与品种抗茎腐病的能力呈显著正相关[18]。大丽轮枝菌诱导的木质化赋予植物对黄萎病的抗性[19]。棉花转录组学研究发现,大丽轮枝菌诱导了木质素生物合成基因的上调[20]。木质素合成基因能够通过调节木质化和酚含量参与对黄萎病的抗性;木质素合成受到转录因子GhMYB4的调控,进而参与对大丽轮枝菌的响应[21-22]。拟南芥有9个CAD基因和8个CADL基因,一些已被证明与木质素生物合成有关[23-24]。和在花、茎的木质素合成中发挥作用[25];甜瓜和的表达受干旱的诱导,并可以促进木质素的生物合成[26];抑制拟南芥和小麦CAD基因的表达,显著降低植物对病原菌的抗性[27-28]。【本研究切入点】海岛棉具有较好的黄萎病抗性,目前,关于海岛棉GbCAD基因和GbCADL基因参与棉花大丽轮枝菌响应的研究及调控机制鲜见报道。【拟解决的关键问题】本研究基于海岛棉全基因组信息,通过生物信息学方法对GbCAD基因和GbCADL基因家族成员进行鉴定,分析GbCAD基因和GbCADL基因在海岛棉不同组织和大丽轮枝菌侵染下的表达特征,利用病毒诱导的基因沉默(virus-induced gene silencing,VIGS)技术抑制GbCAD基因和GbCADL基因的表达,分析其在海岛棉响应大丽轮枝菌处理下的功能,为棉花抗病遗传改良提供有效的候选基因,为棉花抗黄萎病机制解析及抗病育种提供参考。
1 材料与方法
1.1 试验材料
试验材料为海岛棉品种新海21号,其种子由石河子大学生命科学学院103实验室提供。
1.2 数据库下载与分析工具
从Cottongen(https://www.cottongen.org/)下载海岛棉基因组数据,通过本地BLAST构建本地数据库。从TAIR(https://www.arabidopsis.org/index.jsp)下载拟南芥同源CAD、CADL蛋白质序列,以拟南芥同源CAD、CADL蛋白序列为命中序列,使用BLASTP命令(e-value:1e-30)调取海岛棉的CAD、CADL蛋白序列。取相似度大于50%的蛋白序列,提交Pfam(https://pfam.xfam.org/)进行在线预测,有CAD、CADL保守结构域的确定为CAD基因和CADL基因家族成员。
1.3 CAD基因和CADL基因的系统进化分析
利用DNAMAN软件对海岛棉和拟南芥的CAD、CADL蛋白质序列进行比对。利用MEGA7.0软件采用邻接法构建系统进化树,Bootstrap重复次数设置为1 000,将生成的无根树提交ITOL(http://itol.embl.de/)形成环形进化树。
1.4 GbCAD基因和GbCADL基因的染色体定位分析
利用本地BLAST从海岛棉基因组数据库中获取GbCAD基因和GbCADL基因的染色体定位信息,运用TBtools软件作图。
1.5 GbCAD基因和GbCADL基因的结构分析
从海岛棉基因组数据库中(https://cottonfgd.org/)下载海岛棉GbCAD基因和GbCADL基因的信息,基于MEGA7.0软件构建进化树。利用MEME(http:// meme-suite.org/tools/meme)进行motif预测,设置查找10个motif,利用TBtools软件进行可视化。
1.6 启动子顺式元件组成分析
使用TBtools中的Gff3 Sequence Extractor 提取GbCAD基因和GbCADL基因起始密码子前2 000 bp的启动子区序列,并提交在线分析软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/ plantcare/)分析启动子的顺式作用元件组成,通过TBtools中的Simple BioSequence Viewer软件进行可视化。
1.7 海岛棉GbCAD基因和GbCADL基因的表达特征
利用海岛棉转录组测序数据分析GbCAD基因和GbCADL基因在海岛棉根、茎、叶、花瓣、花药、柱头、胚珠和纤维(0 d的胚珠及开花后10、15、18、21和28 d的纤维)的表达特征。
1.8 总RNA的提取和cDNA的制备
选取海岛棉品种新海21号,分别在大丽轮枝菌浸染处理前(0 h)和处理后6、24、48和72 h取棉花的叶片和根,采用多酚多糖植物总RNA提取试剂盒(天根,北京)提取RNA,再利用反转录试剂盒(宝生物,大连)将提取的RNA反转录为cDNA,用于后续qRT-PCR试验分析。
1.9 GbCAD基因和GbCADL基因响应大丽轮枝菌处理的表达分析
基于海岛棉转录组测序数据结果,选择显著优势表达的、、、、和,使用Primer Premier 5.0设计特异引物,检测其在响应大丽轮枝菌浸染不同时期的表达特征。按照荧光定量试剂盒(全式金,北京)说明书设置qRT-PCR反应体系和反应程序。以作为内参基因,每个反应设置3个重复,采用2-ΔΔCt计算基因的相对表达值。
1.10 GbCAD10A/D、GbCADL4A/D、GbCADL6A/D和GbCADL7A/D VIGS沉默载体的构建
根据、、和的序列,选取特异目的片段,以海岛棉cDNA为模板进行PCR扩增,将纯化后产物与TRV沉默载体连接,并转化DH5α大肠杆菌感受态细胞中。将测序正确的载体转化农杆菌感受态LBA4404中,将TRV:、TRV:、TRV:和TRV:分别转化海岛棉。
1.11 大丽轮枝菌浸染处理棉花
将TRV:、TRV:、TRV:、TRV:、TRV:、PDS和辅助菌液在含有卡那霉素、链霉素和利福平的LB液体培养基中,置于摇床过夜培养(28 ℃,16 h),使用离心机收集菌体(4 000 r/min,10 min),再用重悬液(MES、乙酰丁香酮、MgCl2)进行重悬,测OD值为1.1左右时,将各个载体重悬液和辅助载体重悬液按照1﹕1进行混合,室温黑暗培养3 h以上。选取子叶完全展开的棉花幼苗进行注射,注射之后黑暗处理24 h,随后置于23 ℃的温室(16 h光照,8 h黑暗)继续培养。三叶期对试验组和对照组分别进行大丽轮枝菌浸染处理,试验重复3次。
1.12 DAB染色
配制二氨基联苯胺(DAB)染色液,按照A液﹕B液=19﹕1混匀备用。分别取棉花接种大丽轮枝菌0、6和12 h后的叶片,用无菌水冲洗干净后,将叶片置于离心管中,加入适量的染色液于室温避光染色9 h,随后用95%的酒精脱色。每天更换无水乙醇,2—3 d后,用无菌水洗脱后拍照记录。
1.13 沉默植株表型观察
在海岛棉三叶期进行大丽轮枝菌浸染15 d后,观察沉默植株与空载植株的表型。用灭菌后的锋利刀片对沉默植株和空载对照植株的茎部进行纵剖,然后使用光学显微镜观察其感病程度,从而比较不同植株维管束被黄萎病侵害后的差异。
1.14 抗病性分析
采用灌根法接种大丽轮枝菌,其发病情况调查使用5级分级标准[29]。0级:叶片无病斑;1级:1—2片叶片出现萎蔫;2级:3—5片叶片出现萎蔫;3级:大部分叶片出现萎蔫;4级:植株萎凋枯死或即将萎凋枯死[30]。病情指数指标可作为植株抗病能力的评定标准,病情指数=∑(发病级数×株数)/(最高发病级数×总株数)×100%[31]。
2 结果
2.1 海岛棉GbCAD基因和GbCADL基因的全基因组鉴定
在海岛棉基因组中共筛选得到25个GbCAD基因和34个GbCADL基因,分别分布在10条染色体和17条染色体(或scaffold)(图1)。根据每个基因在染色体的位置及序列的同源性,将海岛棉GbCAD基因命名为—,将海岛棉GbCADL基因命名为—。
2.2 海岛棉GbCAD基因和GbCADL基因的系统进化分析
为了进一步分析海岛棉GbCAD基因、GbCADL基因的系统进化关系,将拟南芥AtCAD基因、AtCADL基因与海岛棉GbCAD基因、GbCADL基因整合,进行系统进化分析(图2)。CAD基因可分为A、B和C 3个亚组,包含9个AtCAD基因和25个GbCAD基因。CADL基因可分为D、E、F和G 4个亚组,包含8个AtCADL基因和34个GbCADL基因。
2.3 海岛棉GbCAD基因和GbCADL基因结构与保守基序分析
CAD基因和CADL基因聚类为2个不同的类群(图3-A);基因结构分析发现,GbCAD基因的外显子数目为3—6个,内含子数目为2—5个。GbCADL基因的外显子数目和内含子数目相较于GbCAD基因较多,外显子数目为7—10个,内含子数目为6—9个(图3-B),表明CAD基因和CADL基因家族成员的基因结构具有多样性。保守基序分析发现,GbCAD基因均含有motif1、motif4和motif10 3个保守基序,GbCADL基因均含有motif1、motif5、motif6和motif9 4个保守基序。不同组CAD基因和CADL基因之间的基序类型存在一定差异,但在同一聚类组中的成员表现出相似的基序组成模式(图3-C)。
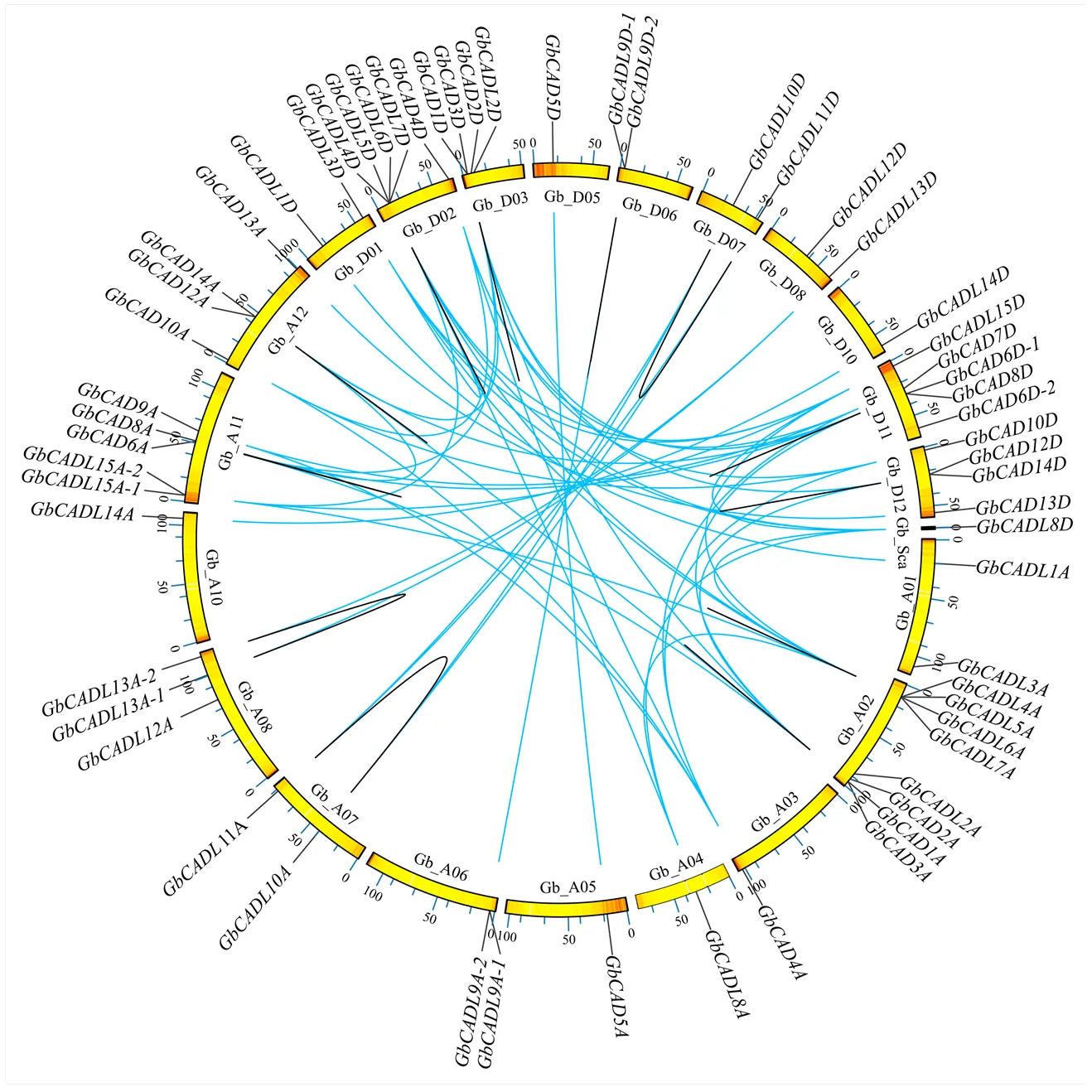
图1 海岛棉GbCAD基因和GbCADL基因的染色体定位
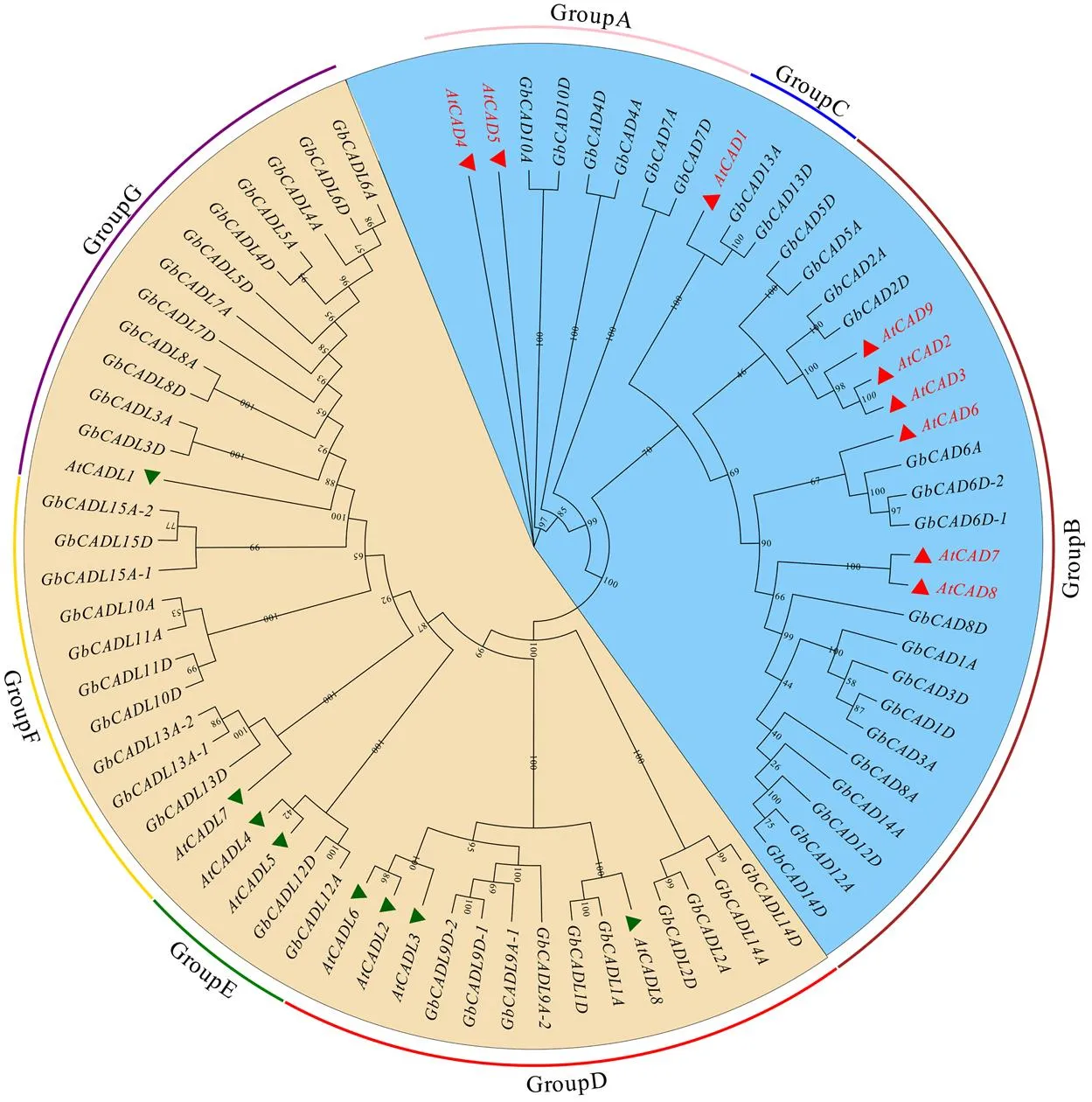
图2 海岛棉和拟南芥CAD及CADL基因的系统进化分析

A:系统发育树;B:基因结构分析;C:保守结构域分析
2.4 启动子顺式作用元件组成分析
启动子顺式作用元件组成结果显示,海岛棉GbCAD基因和GbCADL基因中含有多种激素相关的响应元件和胁迫响应元件(图4),如脱落酸响应元件、生长素响应元件、赤霉素响应元件、茉莉酸甲酯响应元件和水杨酸响应元件等。还发现了一些与胁迫相关的顺式作用元件,如干旱响应元件、低温响应元件、防御应激元件以及厌氧响应元件等。结果表明,GbCAD基因和GbCADL基因的启动子区域包含不同顺式作用元件,可能在调节植物逆境胁迫响应和激素的响应等过程中发挥着潜在的重要作用。
2.5 海岛棉GbCAD基因和GbCADL基因的表达分析
基于转录组分析GbCAD基因和GbCADL基因在海岛棉的根、茎、叶、花瓣、花药、柱头、胚珠和纤维的表达特征,结果显示,、、、、、在根、茎、叶、胚珠和纤维组织中优势表达;和在花瓣、花药和柱头中优势表达,和在花瓣、花药、柱头和纤维中显著累积,在纤维表现出独特的特异性高表达(图5);表明这些基因在组织器官发育中发挥着重要的作用。大丽轮枝菌胁迫不同时间的转录组分析显示,、、、、和的表达显著累积(图6);进一步对这些基因在大丽轮枝菌处理不同时间的表达进行qRT-PCR验证,结果显示,、、、的表达均显著受到大丽轮枝菌处理的诱导(图7),表明这些GbCAD基因和GbCADL基因在棉花响应大丽轮枝菌过程中的重要作用。

图4 海岛棉GbCAD基因和GbCADL基因启动子的顺式作用元件组成分析
2.6 抑制GbCAD基因和GbCADL基因的表达降低海岛棉对大丽轮枝菌的抗性
利用VIGS技术对显著响应大丽轮枝菌处理诱导表达的、、和进行抑制表达,分析这些基因表达的变化与大丽轮枝菌抗性之间的联系。棉花的沉默,导致棉花后期新出现的真叶表现白化(图8-A),表明抑制基因表达的遗传转化成功有效。取阳性植株与对照植株接种大丽轮枝菌0、6和12 h后的棉花叶片进行DAB染色,空载体对照植株和转化植株在未受到黄萎病侵染时,染色结果无差异;在接菌后6 h,与对照植株相比,VIGS转化株系TRV: G、TRV:、TRV:、TRV:表现出显著加深的棕褐色(图8-B),表明这些基因的沉默表达导致了细胞内活性氧的累积;
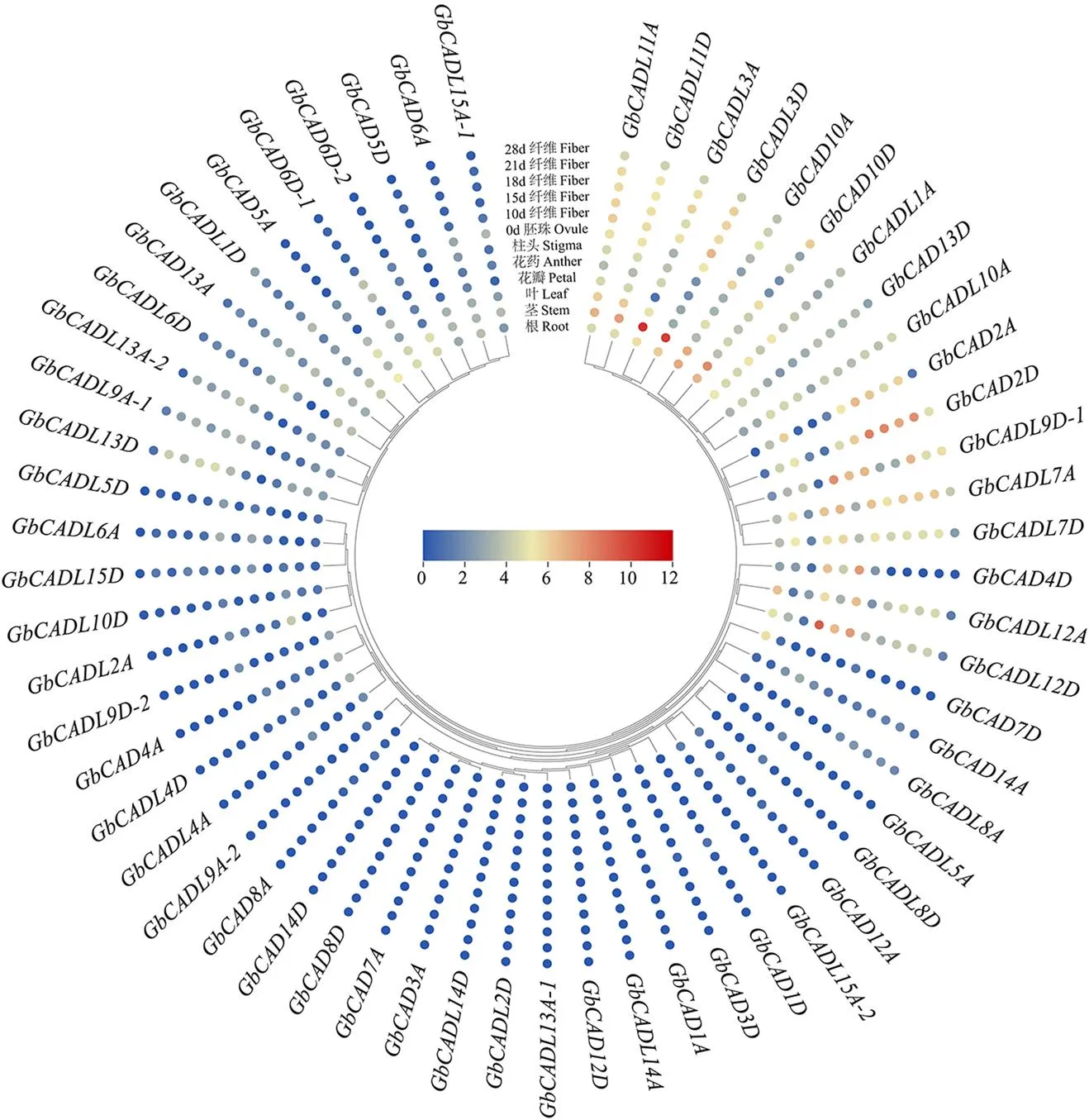
图5 海岛棉GbCAD基因和GbCADL基因的组织表达特征分析
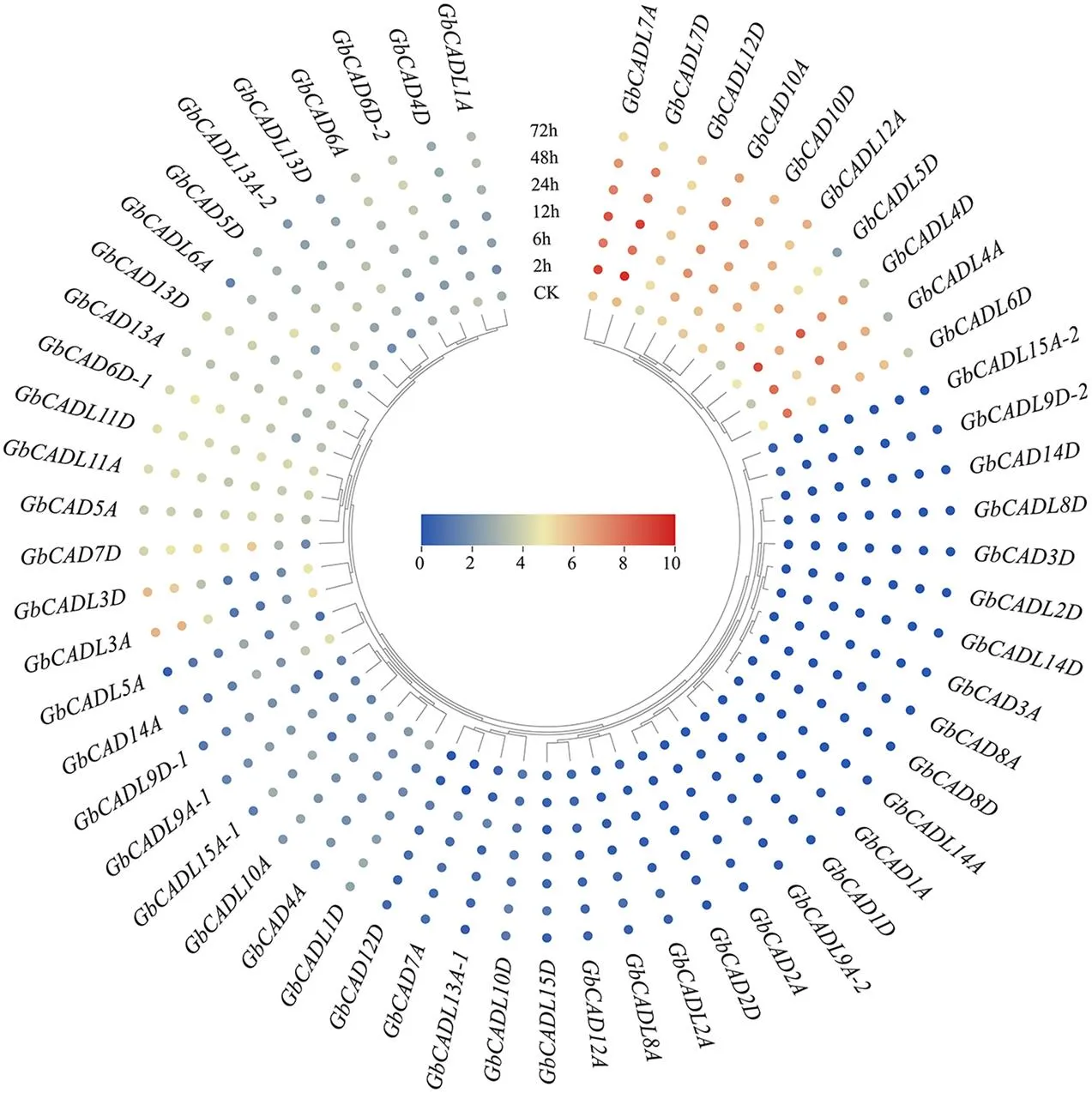
图6 GbCAD基因和GbCADL基因响应大丽轮枝菌处理的表达分析
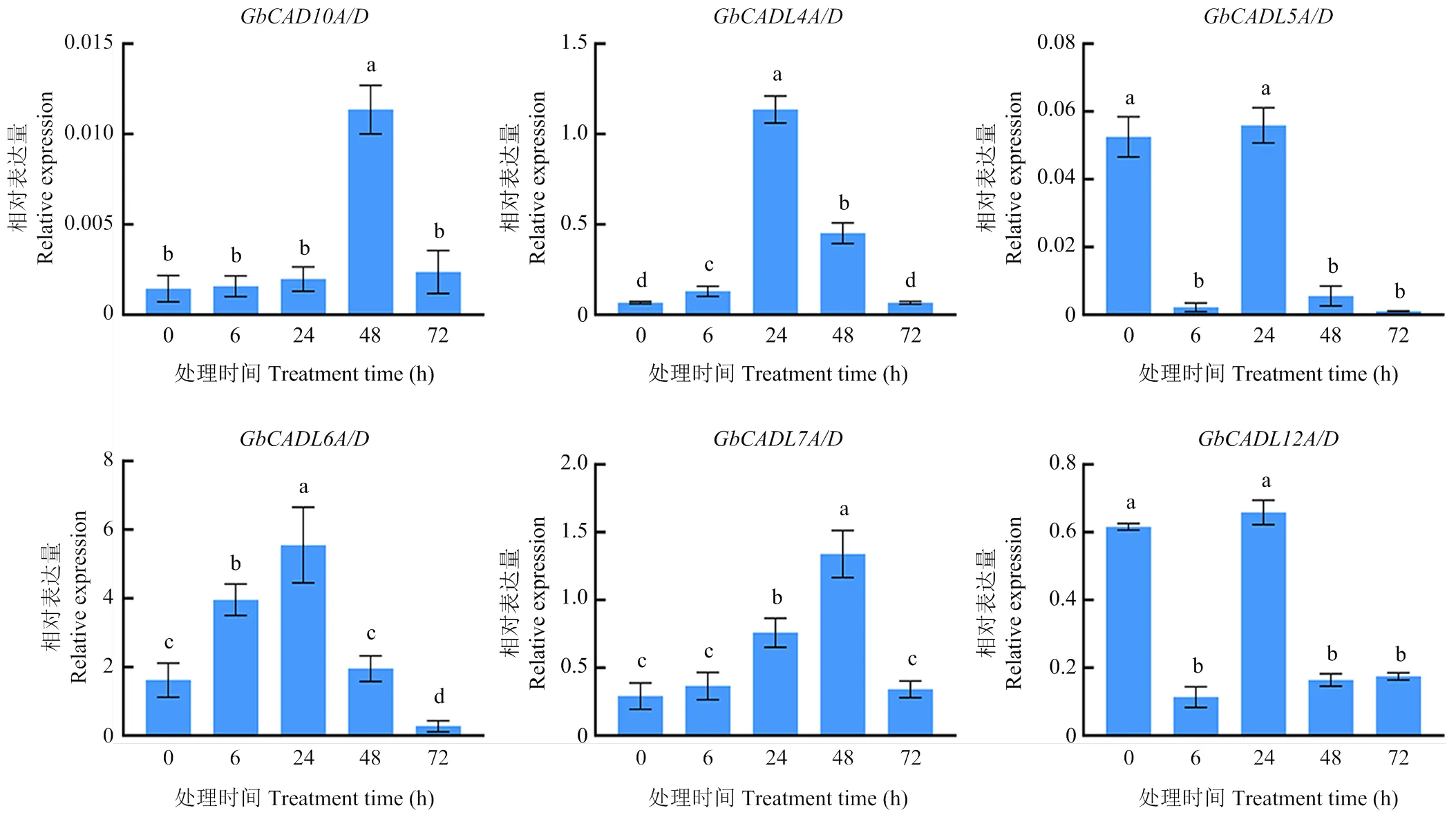
GbUBQ7为内参基因,不同字母间表示样本的显著差异(p<0.05)。下同
与对照植株相比,VIGS转化株系在受到大丽轮枝菌浸染后叶片枯萎,表现出对大丽轮枝菌敏感性的增加(图8-C)。对海岛棉茎纵切面的观察结果显示,在大丽轮枝菌处理后,与对照相比,VIGS转化株系TRV:G、TRV:、TRV:、TRV:表现出茎维管组织显著的深褐色和更高的病情指数(图8-D和图8-E)。结果表明,抑制、、和的表达降低了棉花对大丽轮枝菌的抗性,暗示它们在棉花响应大丽轮枝菌过程中的重要作用。
3 讨论
3.1 GbCAD基因和GbCADL基因家族的鉴定与表达分析
肉桂醇脱氢酶(CAD)是木质素合成途径中最早研究的酶类,是木质素单体合成过程中的最后一步关键酶[32],在木质素种类和功能多样性中发挥重要作用[33]。目前,在许多物种中鉴定到CAD基因,如拟南芥有9个CAD基因和8个CADL基因[34],水稻有12个CAD基因[35],高粱有14个CAD基因[36],杨树有15个CAD基因[37],陆地棉有19个CAD基因和27个CADL基因[38]。
本研究在海岛棉基因组中鉴定得到25个GbCAD基因和34个GbCADL基因,分布在不同的染色体上(图1);拟南芥和海岛棉CAD基因和CADL基因分别可分为3个亚组和4个亚组(图2),、、聚类于A组,、与木质素的合成过程密切相关[39];在紫丁香假单胞菌()侵染拟南芥的过程中,该基因受到诱导表达[28],在和缺失的双突变体中木质素的含量显著降低[25],表明它们不仅与拟南芥木质素合成相关,还与植物木质素防御途径相关[23]。棉花/在根、茎中具优势表达,且受到大丽轮枝菌的诱导表达(图5和图6),表明/可能通过调控木质素的合成进而参与棉花对大丽轮枝菌的响应过程。同组的CAD基因和CADL基因具有相似的基因结构和保守结构域(图3),表明它们可能具有功能的相似性。
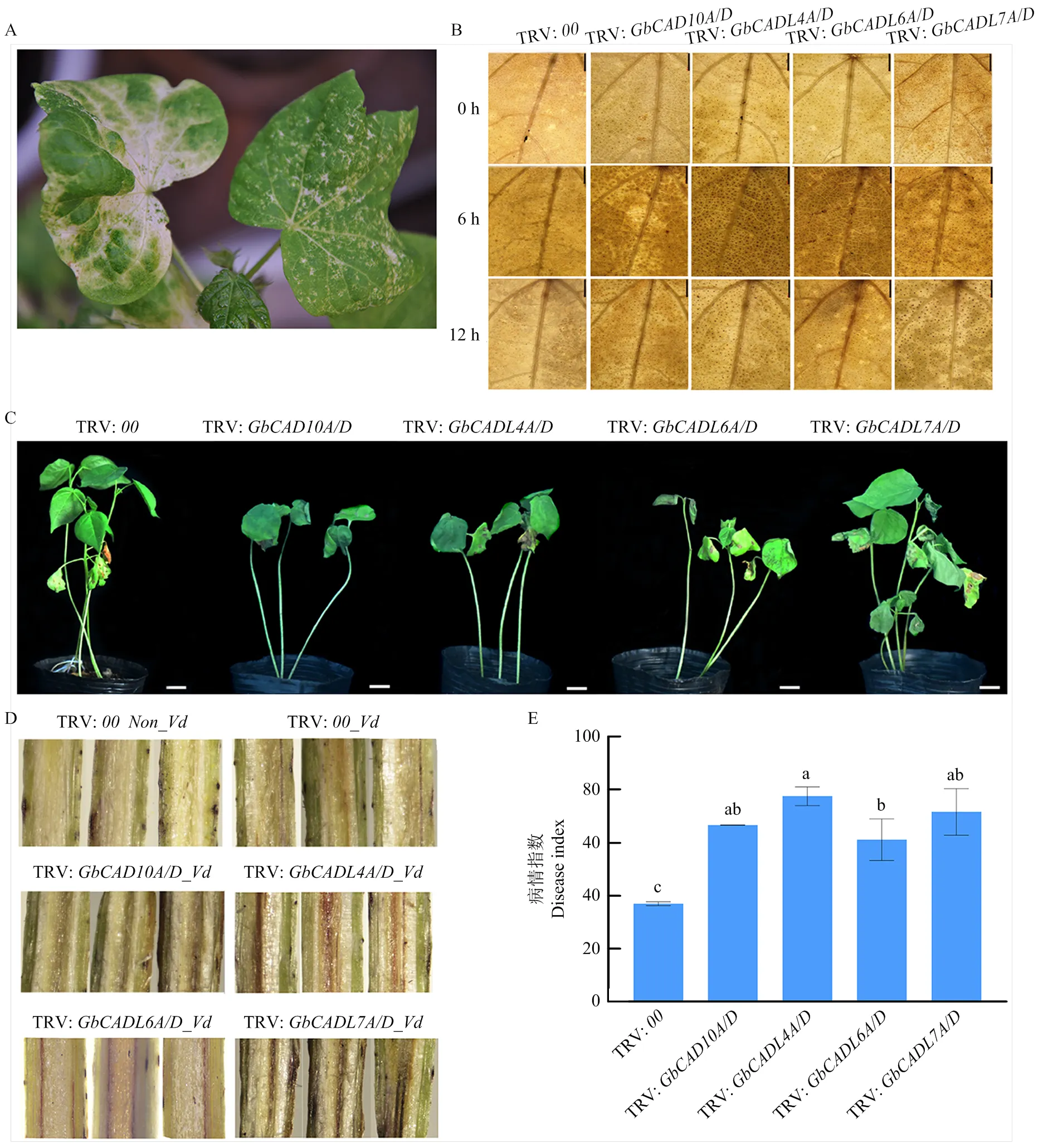
A:阳性对照植株叶片表型;B:大丽轮枝菌处理后的叶片DAB染色分析;C:大丽轮枝菌浸染后的棉花植株表型分析;D:大丽轮枝菌浸染后的棉花茎纵剖图;E:大丽轮枝菌浸染后的棉花病情指数统计
3.2 GbCAD基因和GbCADL基因功能发挥与植物的抗病响应密切相关
在对患易碎叶病的枣椰树的研究中发现,易碎叶病诱导了枣椰树和在根中的表达,与木质素合成相关的在感病植株的叶片和根中的表达也显著增强[40]。拟南芥木质素合成的主要基因和是防御细菌性叶斑病的主要成分,的表达也受细菌性叶斑病处理的诱导[41]。沉默小麦植株后,植株叶片组织更易感小麦白粉病菌[42]。这表明CAD基因在植物抗病过程中起着重要作用。接种细菌性叶斑病的双突变体与野生型相比,水杨酸(SA)通路基因的表达水平在接种病菌时被显著诱导,且双突变体中的SA含量减少,表明SA可能是参与抗病的信号分子[41]。外源SA处理诱导感病香蕉品种和耐病香蕉品种根组织中苯丙烷类途径与木质素产生,提高对TR4的抗病性[43],表明CAD基因可能通过水杨酸激素信号途径调控其对病原菌的抗性。本研究中GbCAD基因和GbCADL基因的启动子序列中含有多个激素和胁迫响应元件(图4),可能在植物逆境胁迫响应过程中发挥重要作用;、、和的表达显著受到大丽轮枝菌处理的诱导(图6和图7),暗示这些基因在棉花对大丽轮枝菌响应过程中的重要功能。
在拟南芥中过量表达导致植物对寄生疫霉菌和辣椒疫霉菌的抗性减弱,的沉默抑制了疫霉菌的侵染[44]。本研究中,分别抑制、、和表达的棉花株系表现出对大丽轮枝菌抗性显著降低的现象,茎维管组织表现出深褐色(图8),表明它们在棉花响应大丽轮枝菌过程中的重要作用。
4 结论
海岛棉GbCAD基因和GbCADL基因具有不同的组织表达特征和受到大丽轮枝菌的诱导表达,抑制、、和的表达显著降低海岛棉对大丽轮枝菌的抗性。
[1] SONG R R, LI J P, XIE C J, YANG X Y, JIAN W, YANG X Y. An overview of the molecular genetics of plant resistance to thewilt pathogen. International Journal of Molecular Sciences, 2020, 21(3): 1120.
[2] 马峙英, 李兴红, 孙济中, 刘金兰. 棉花黄萎病菌致病力分化与寄主抗病性遗传研究进展. 棉花学报, 1996, 8(4): 172-176.
MA Z Y, LI X H, SUN J Z, LIU J L. Review on the differentiation ofandand the resistance inheritance in cotton. Acta Gossypii Sinica, 1996, 8(4): 172-176. (in Chinese)
[3] NOVAES E, KIRST M, CHIANG V, WINTER-SEDEROFF H, SEDEROFF R. Lignin and biomass: a negative correlation for wood formation and lignin content in trees. Plant Physiology, 2010, 154(2): 555-561.
[4] RENCORET J, GUTIÉRREZ A, NIETO L, JIMÉNEZ-BARBERO J, FAULDS C B, KIM H, RALPH J, MARTÍNEZ Á T, DEL RÍO J C. Lignin composition and structure in young versus adultplants. Plant Physiology, 2011, 155(2): 667-682.
[5] M C FADDEN H G, CHAPPLE R, FEYTER R D, DENNIS E. Expression of pathogenesis-related genes in cotton stems in response to infection by. Physiological and Molecular Plant Pathology, 2001, 58(3): 119-131.
[6] MOTTIAR Y, VANHOLME R, BOERJAN W, RALPH J, MANSFIELD S D. Designer lignins: harnessing the plasticity of lignification. Current Opinion in Biotechnology, 2016, 37: 190-200.
[7] DONG N Q, LIN H X. Contribution of phenylpropanoid metabolism to plant development and plant-environment interactions. Journal of Integrative Plant Biology, 2021, 63(1): 180-209.
[8] 耿飒, 徐存拴, 李玉昌. 木质素的生物合成及其调控研究进展. 西北植物学报, 2003, 23(1): 171-181.
GENG S, XU C S, LI Y C. Advance in biosynthesis of lignin and its regulation. Acta Botanica Boreali-occidentalia Sinica, 2003, 23(1): 171-181. (in Chinese)
[9] XIE M, ZHANG J, TSCHAPLINSKI T J, TUSKAN G A, CHEN J G, MUCHERO W. Regulation of lignin biosynthesis and its role in growth-defense tradeoffs. Frontiers in Plant Science, 2018, 9: 1427.
[10] CESARINO I. Structural features and regulation of lignin deposited upon biotic and abiotic stresses. Current Opinion in Biotechnology, 2019, 56: 209-214.
[11] EYNCK C, SÉGUIN-SWARTZ G, CLARKE W E, PARKIN A P. Monolignol biosynthesis is associated with resistance toin. Molecular Plant Pathology, 2012, 13(8): 887-899.
[12] CHEZEM W R, MEMON A, LI F S, WENG J K, CLAY N K. SG2-Type R2R3-MYB transcription factor MYB15 controls defense- induced lignification and basal immunity in. The Plant Cell, 2017, 29(8): 1907-1926.
[13] LI C, HE Q L, ZHANG F, YU J W, LI C, ZHAO T L, ZHANG Y, XIE Q W, SU B R, MEI L, ZHU S J, CHEN J H. Melatonin enhances cotton immunity towilt via manipulating lignin and gossypol biosynthesis. The Plant Journal, 2019, 100(4): 784-800.
[14] TANG Y, ZHANG Z N, LEI Y, HU G, LIU J F, HAO M Y, CHEN A M, PENG Q Z, WU J H. Cottonmodulate sa biosynthesis and local lignin deposition participating in plant resistance against. Frontiers in Plant Science, 2019, 10: 526.
[15] 金贺. 大豆胞囊线虫胁迫下微紫青霉处理对GmC4H和GmCAD的影响及抗性机制研究[D]. 沈阳: 沈阳农业大学, 2022.
JIN H. Effects ofon GmC4H and GmCAD under soybean cyst nematode stress and their resistance mechanism[D]. Shenyang: Shenyang Agricultural University, 2022. (in Chinese)
[16] COHEN Y, EYAL H, HANANIA J. Ultrastructure, autofluorescence, callose deposition and lignification in susceptible and resistant muskmelon leaves infected with the powdery mildew fungus. Physiological and Molecular Plant Pathology, 1990, 36(3): 191-204.
[17] PREISNER M, WOJTASIK W, KOSTYN K, BOBA A, CZUJ T, SZOPA J, KULMA A. The cinnamyl alcohol dehydrogenase family in flax: Differentiation during plant growth and under stress conditions. Journal of Plant Physiology, 2018, 221: 132-143.
[18] BORGES M F, RESENDE M L V, PINHO R G V. Time of inoculation and inoculum concentration in relation to the expression of corn stalk resistance to. Fitopatologia Brasileira, 2001, 26(4): 715-720.
[19] GAYOSO C, POMAR F, NOVO-UZAL E, MERINO F, DE ILÁRDUYA O M. The Ve-mediated resistance response of the tomato toinvolves H2O2, peroxidase and lignins and drives PAL gene expression. BMC Plant Biology, 2010, 10(1): 232.
[20] XU L, ZHU L F, TU L L, LIU L L, YUAN D J, JIN L, LONG L, ZHANG X L. Lignin metabolism has a central role in the resistance of cotton to the wilt fungusas revealed by RNA-Seq-dependent transcriptional analysis and histochemistry. Journal of Experimental Botany, 2011, 62(15): 5607-5621.
[21] XIAO S H, HU Q, SHEN J L, LIU S M, YANG Z G, CHEN K, KLOSTERMAN S J, JAVORNIK B, ZHANG X L, ZHU L F. GhMYB4 downregulates lignin biosynthesis and enhances cotton resistance to. Plant Cell Reports, 2021, 40(4): 735-751.
[22] XIONG X P, SUN S C, ZHU Q H, ZHANG X Y, LI Y J, LIU F, XUE F, SUN J. The cotton lignin biosynthetic generegulates lignification and phenolic content and contributes towilt resistance. Molecular Plant-Microbe Interactions, 2021, 34 (3): 240-254.
[23] KIM S J, KIM K W, CHO M H, FRANCESCHI V R, DAVIN L B, LEWIS N G. Expression of cinnamyl alcohol dehydrogenases and their putative homologues duringgrowth and development: Lessons for database annotations? Phytochemistry, 2007, 68 (14): 1957-1974.
[24] SABALLOS A, EJETA G, SANCHEZ E, KANG C, VERMERRIS W. A genomewide analysis of the cinnamyl alcohol dehydrogenase family in[(L.) Moench] identifies SbCAD2 as the brown midrib6 gene. Genetics, 2009, 181(2): 783-795.
[25] SIBOUT R, EUDES A, MOUILLE G, POLLTE B, LAPIERRE C, JOUANIN L, SÉGUIN A. Cinnamyl alcohol dehydrogenase-C and -D are the primary genes involved in lignin biosynthesis in the floral stem of. The Plant Cell, 2005, 17(7): 2059-2076.
[26] LIU W, JIANG Y, WANG C H, ZHAO L L, JIN Y Z, XING Q J, LI M, LV T H, QI H Y. Lignin synthesized byandL.) seedlings contributes to drought tolerance. Plant Molecular Biology, 2020, 103(6): 689-704.
[27] RONG W, LUO M Y, SHAN T L, WEI X N, DU L P, XU H J, ZHANG Z Y. A wheat cinnamyl alcohol dehydrogenase TaCAD12 contributes to host resistance to the sharp eyespot disease. Frontiers in Plant Science, 2016, 7: 1723.
[28] TRONCHET M, BALAGUÉ C, KROJ T, JOUANIN L, roby d. Cinnamyl alcohol dehydrogenases-C and D, key enzymes in lignin biosynthesis, play an essential role in disease resistance in. Molecular Plant Pathology, 2010, 11(1): 83-92.
[29] LIU L, WANG D, ZHANG C, LIU H Y, GUO H M, CHENG H M, LIU E L, SU X F. The heat shock factor GhHSFA4a positively regulates cotton resistance to. Frontiers in Plant Science, 2022, 13: 1050216.
[30] 陈敏, 林元秘, 朱文姣, 杨清. 茄子miR171b在抵抗黄萎病菌侵染中的功能. 农业生物技术学报, 2022, 30(7): 1268-1278.
CHEN M, LIN Y M, ZHU W J, YANG Q. Function of eggplant () miR171b in resistance toinfection. Journal of Agricultural Biotechnology, 2022, 30(7): 1268-1278. (in Chinese)
[31] LIU S P, ZHU Y P, XIE C, JUE D W, HONG Y B, CHEN M, HUBDAR A K, YANG Q. Transgenic potato plants expressing StoVe1 exhibit enhanced resistance to. Plant Molecular Biology Reporter, 2012, 30(4): 1032-1039.
[32] SUN Y, WU Y E, ZHAO Y, HAN X J, LOU H X, CHENG A X. Molecular cloning and biochemical characterization of two cinnamyl alcohol dehydrogenases from a liverwort. Plant Physiology and Biochemistry, 2013, 70: 133-141.
[33] 王卓, 徐碧玉, 贾彩红, 李健平, 刘菊华, 张建斌, 苗红霞, 金志强. 香蕉肉桂醇脱氢酶基因的克隆及表达分析. 西北植物学报, 2015, 35(7): 1305-1310.
WANG Z, XU B Y, JIA C H, LI J P, LIU J H, ZHANG J B, MIAO H X, JIN Z Q. Molecular cloning and expression of cinnamyl alcohol dehydrogenase gene from banana. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(7): 1305-1310. (in Chinese)
[34] KIM S J, KIM M R, BEDGAR D L, MOINUDDIN S G, CARDENAS C L, DAVIN L B, KANG C, LEWIS N G. Functional reclassification of the putative cinnamyl alcohol dehydrogenase multigene family in. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(6): 1455-1460.
[35] TOBIAS C M, CHOW E K. Structure of the cinnamyl-alcohol dehydrogenase gene family in rice and promoter activity of a member associated with lignification. Planta, 2005, 220(5): 678-688.
[36] SABALLOS A, EJETA G, SANCHEZ E, KANG C, VERMERRIS W. A genomewide analysis of the cinnamyl alcohol dehydrogenase family in[(L.) Moench] identifies SbCAD2 as the brown midrib6 gene. Genetics, 2009, 181(2): 783-795.
[37] BARAKAT A, BAGNIEWSKA-ZADWORNA A, CHOI A, PLAKKAT U, DILORETO D S, YELLANKI P, CARLSON J. The cinnamyl alcohol dehydrogenase gene family in: phylogeny, organization, and expression. BMC Plant Biology, 2009, 9: 26.
[38] LI H P, ZHANG S L, ZHAO Y L, ZHAO X L, XIE W F, GAO Y T, WANG Y G, LI K, GUO J G, ZHU Q H, ZHANG X B, JIA K P, MIAO Y C. Identification and characterization of cinnamyl alcohol dehydrogenase encoding genes involved in lignin biosynthesis and resistance toin upland cotton (L.). Frontiers in Plant Science, 2022, 13: 840397.
[39] MORANT M, HEHN A, WERCK-REICHHART D. Conservation and diversity of gene families explored using the CODEHOP strategy in higher plants. BMC Plant Biology, 2002, 2: 7.
[40] SAIDI M N, BOUAZIZ D, HAMMAMI I, NAMSI A, DRIRA N, GARGOURI-BOUZID R. Alterations in lignin content and phenylpropanoids pathway in date palm (L.) tissues affected by brittle leaf disease. Plant Science, 2013, 211: 8-16.
[41] TRONCHET M, BALAGUÉC, KROJ T, JOUANIN L, ROBY D. Cinnamyl alcohol dehydrogenases-C and D, key enzymes in lignin biosynthesis, play an essential role in disease resistance in. Molecular plant pathology, 2010, 11(1): 83-92.
[42] BHUIYAN N H, SELVARAJ G, WEI Y D, KING J. Gene expression profiling and silencing reveal that monolignol biosynthesis plays a critical role in penetration defence in wheat against powdery mildew invasion. Journal of Experimental Botany, 2009, 60(2): 509-521.
[43] 段雅婕, 杨宝明, 郭志祥, 尹可锁, 胡会刚, 曾莉, 白亭亭. 外源水杨酸诱导香蕉苯丙烷类代谢提高对枯萎病抗性. 热带作物学报, 2022, 43(9): 1870-1879.
DUAN Y J, YANG B M, GUO Z X, YIN K S, HU H G, ZENG L, BAI T T. Exogenous salicylic acid induced phenylpropane metabolism in banana to improve the resistance againstwilt. Chinese Journal of Tropical Crops, 2022, 43(9): 1870-1879. (in Chinese)
[44] 李婷婷. 疫霉菌Avr3a家族效应蛋白保守靶标CAD7的鉴定与功能研究[D]. 杨凌: 西北农林科技大学, 2017.
LI T T. Identification and functional analysis of conserved target CAD7 byAvr3a family effectors[D]. Yangling: Northwest Agricultural and Forestry University, 2017. (in Chinese)
Identification and expression of CAD and CAD-Like gene families fromand Their response to
ZHANG YuJia1, CUI KaiWen1, DUAN LiSheng1, CAO AiPing1,2, XIE QuanLiang1,2, SHEN HaiTao1,2, WANG Fei, LI HongBin
1College of Life Sciences, Shihezi University, Shihezi 832003, Xinjiang;2Key Laboratory of Oasis Town and Mountain-Basin System Ecology of Xinjiang Production and Construction Corps, Shihezi 832003, Xinjiang
【Objective】Cinnamyl alcohol dehydrogenas(CAD) is a key enzyme in lignin synthesis pathway, which plays an important role in enhancing plant mechanical strength and resisting pathogen invasion. The aim of this study is to identifyCAD and CAD-Like (CADL) gene family members inand to analyze their expression characteristics and their role inwilt resistance, which provides reference for the mechanism elucidation and disease resistance breeding of cotton againstwilt. 【Method】The CAD andCADLgene family members ingenome were identified by bioinformatics method, and their chromosomal location, phylogenetic relationship, gene structure and promoter-element prediction were systematically analyzed. The expression characteristics of GbCAD and GbCADL were analyzed by obtaining publicly released transcriptome data and real-time fluorescence quantitative polymerase chain reaction (qRT-PCR). Functional analysis of GbCADandGbCADL genes was performed by viral-induced gene silencing (VIGS) technique. 【Result】A total of 25 GbCAD and 34 GbCADL genes were identified fromand distributed on 10 and 17 different chromosomes, respectively. GbCAD and GbCADL genes are divided into 3 and 4 subgroups, respectively. The genes in the same group contain similar exon-intron structures and conserved domains. GbCAD and GbCADL genes have different transcriptional expression characteristics, and the promoters of GbCAD and GbCADL genes contain various hormone response elements and stress response elements. Transcriptome data and qRT-PCR showed that the expressions of,,,, andwere induced byespecially the,,, andindicated significant increased expressions undertreatment. The genes of,,, andwere respectively silenced in cotton by virus-induced gene silencing (VIGS) technology, to analyze the changes of VIGS plant lines againsttreatment. The results showed that, compared with the control plants, the VIGS plant lines indicated significant decreased resistance toThe results of diaminobenzidine (DAB) histochemical stain displayed that, both control and VIGS plants showed similar normal phenotype withoutaddition; after 6 h treatment of, the VIGS plant lines silencing,,,expressions demonstrated a deeper brown coloring, indicating a higher reactive oxygen species (ROS) accumulation in the VIGS plant lines. The results of stem sectioning showed that, the stem vascular tissues of VIGS plant lines TRV:,TRV:,TRV:,and TRV:showed obvious dark brown enrichment aftertreatment, indicating the significant decreased resistance to【Conclusion】 Suppressing the expressions of,,,could significantly reduce the cotton resistance to.
; cinnamyl alcohol dehydrogenase; gene family; expression characteristics; gene silencing;
2022-12-31;
2023-04-06
国家自然科学基金(31960413)、兵团科技计划(2016AC017)
张钰佳,E-mail:1427740428@qq.com。通信作者王斐,E-mail:feiw@shzu.edu.cn。通信作者李鸿彬,E-mail:lihb@shzu.edu.cn
10.3864/j.issn.0578-1752.2023.19.005
(责任编辑 李莉)
