棉花纤维优势表达基因GhSLD1启动子的克隆和功能分析
2023-10-25刘芳徐梦贝王巧玲孟倩李桂名张宏菊田惠丹徐凡罗明
刘芳,徐梦贝,王巧玲,孟倩,李桂名,张宏菊,田惠丹,徐凡,罗明
棉花纤维优势表达基因启动子的克隆和功能分析
刘芳,徐梦贝,王巧玲,孟倩,李桂名,张宏菊,田惠丹,徐凡,罗明
西南大学生物技术中心/农业农村部生物技术与作物品质改良重点开放实验室,重庆 400716
【目的】棉花纤维是棉花的主要经济产品,是由胚珠外珠被表皮细胞经极性伸长和次生壁加厚而成的单细胞。棉花纤维细胞是最长的植物细胞之一,是研究植物细胞生长发育的理想材料。鉴定纤维细胞特异或优势表达启动子可为纤维发育的基础研究提供控制目标基因表达的调控序列,为改良纤维性状的分子育种提供依据。【方法】克隆纤维细胞优势表达基因的启动子,通过启动子序列分析网站PlantCARE分析克隆序列中包含的重要顺式调控元件。根据部分重要顺式调控元件的分布,对克隆启动子片段进行5′-端删除,共获得4个启动子片段,并构建了相应的植物表达载体。利用构建的植物表达载体进行烟草和棉花的遗传转化,通过转基因烟草和棉花的分子鉴定明确转基因植株。并检测转基因植株不同组织器官、纤维细胞不同发育时期的GUS活性。【结果】克隆获得最长启动子片段为2 900 bp,除了包含多个启动子必备转录调控元件外,还包含多个脱落酸响应元件、厌氧诱导元件、茉莉酸甲酯响应元件、油菜素内酯响应元件、种子特异调控元件、胁迫响应元件和MYB转录因子结合位点。通过5′-端删除获得长度分别为2 900()、2 178()、1 657()和1 232 bp()4个启动子片段,经分子鉴定,获得4个片段的转基因烟草,在转基因烟草中,、和不表达,而广泛表达,表达强度与CaMV 35S启动子相似。和差异序列中包含4个脱落酸响应元件、2个油菜素内酯响应元件和3个MYB结合位点,这些顺式调控元件可能与、和在转基因烟草中不表达有一定关系。经分子鉴定,获得转基因棉花。在转基因棉花纤维中优势表达,在转基因花粉中有较低的表达,在其他组织器官中几乎不表达。在纤维细胞的生长发育过程中,在纤维细胞早期生长阶段(5 DPA)表达较低,在纤维细胞伸长期(10—15 DPA)表达水平相对较高,在纤维细胞次生壁合成期(20—30 DPA)表达水平有所降低。【结论】启动子是一个广泛表达启动子,启动子是一个纤维细胞优势表达启动子,在纤维细胞伸长期表达量相对较高。可应用于棉花纤维发育相关基因的功能研究和改良纤维性状的分子育种。
棉花;启动子;功能分析;;鞘脂delta8-去饱和酶
0 引言
【研究意义】棉花是世界上最重要的天然纤维作物,中国是棉花生产和消费大国,棉花生产在中国国民经济中占有重要的地位。传统的育种方法曾在棉花品种改良上取得较大的成功,但近年来,改良棉花产量和品质的育种进入平台期。利用现有的遗传资源和传统育种手段难以再大幅度提高棉花产量。基因工程方法具有后代易于稳定,育种周期短等优点,可以打破物种间的遗传障碍,实现优良目的基因的定向转移,是改良棉花产量和纤维品质的有效途径。但基因工程在作物改良中的作用发挥取决于3个方面的进展程度:目标基因的功能、调控目标性状形成的分子机理和控制目标基因在特定部位和特定时间表达的特异启动子。在棉花纤维品质和产量的基因工程改良中,常常需要在纤维细胞中超量或抑制一些基因的表达,来达到提高产量或改良品质的目的。在棉花纤维发育的分子机理研究中,也需要纤维细胞特异表达启动子来上调或下调目标基因的表达,进而分析其在纤维细胞中的功能。最大限度地减少目标基因对其他组织和器官的不良影响。因此,棉花纤维特异或优势表达启动子的克隆和功能分析,对棉花纤维发育相关基因功能研究和棉花纤维改良的基因工程具有重要的理论意义和应用价值。【前人研究进展】启动子是一段能被RNA聚合酶识别并结合的,位于结构基因5′上游的DNA序列,能活化RNA聚合酶并指导相应类型的RNA聚合酶与模板的正确结合,决定转录的方向和效率,控制基因表达(转录)的起始时间、空间和表达的强度。最早在棉花中克隆和功能分析的启动子是的启动子,的2.5 kb启动子序列能够指导报告基因在5—28 DPA(day post anthesis)的纤维中表达,在15—22 DPA表达量最高,而在其他组织中不表达[1-2]。说明启动子是纤维发育早期特异表达的启动子。随后,于晓红等[3]从亚洲棉中克隆了纤维特异表达基因的5′端约1.5 kb的上游序列,通过转基因烟草证明该启动子能够驱动报告基因在烟草的根、茎、叶、表皮毛及维管组织中表达,说明该启动子不具备纤维细胞特异表达特性。吴霭民等[4]进一步验证了614 bp启动子的功能,发现只在烟草叶片的表皮毛中检测到报告基因表达,推测614 bp的启动子序列已足够驱动基因在棉花纤维中特异表达。Rinehart等[5]克隆了纤维发育中后期特异表达基因的启动子并进行了5′删除试验。瞬时表达结果表明,的5′端2.3 kb片段已经具备启动子活性,其表达活性约为组成型强启动子CaMV 35S启动子的1/3,是早期特异表达的启动子的3倍。3个脂转移蛋白基因(、和)在纤维伸长期特异表达。通过转基因烟草分析其启动子活性,结果显示,报告基因仅在烟草表皮毛中表达。启动子的启动活性较弱,仅为CaMV 35S启动子的1/1000左右。启动子的活性强于启动子[6-10]。棉花纤维素合成酶4亚基基因()在纤维次生壁沉积起始期和沉积期表达。该基因2.6 kb启动子能够指导报告基因在纤维细胞次生壁合成期表达[11-12]。棉花肌动蛋白基因()0.8 kb启动子序列能够指导报告基因在纤维中高量表达[13]。2个的启动子(1 679 bp)和(1 285 bp)能驱动在纤维细胞中高量表达[14]。启动子(1 000 bp)仅在转基因棉花苞叶和花药中表达[15]。(seed coat and fiber protease)启动子(1 006 bp)指导报告基因在纤维细胞中特异表达,是一个纤维细胞发育早期的特异启动子[16]。启动子在棉花纤维发育过程中优势表达,且表达活性较高,该启动子活性受赤霉素诱导和脱落酸抑制[17]。是一个纤维伸长期优势表达基因,其启动子(961 bp)指导在0—20 DPA纤维以及柱头、雄蕊、萼片、胚根、子叶和根中表达[18]。这些研究结果为解析目标基因的功能和调控机制提供了重要数据,也为改良纤维产量和品质的分子设计提供更多可选择的调控序列。但迄今为止,可选择的纤维细胞特异或优势表达的启动子还十分有限。【本研究切入点】棉花纤维细胞中特异/优势表达启动子的研究虽然取得了一定进展,但由于棉花遗传转化比较困难,多数在纤维细胞中特异/优势表达基因的启动子还没有通过转基因棉花进行功能鉴定。部分启动子通过转基因拟南芥或烟草进行了功能鉴定,但仅是间接地揭示了目标启动子的功能。同时,由于纤维细胞的生长发育包含纤维细胞起始、伸长和次生壁沉积等不同发育过程,不同时空和不同表达效率的启动子还十分缺乏。鞘脂(sphingolipid)在棉花纤维细胞生长发育中具有重要作用,但不同的鞘脂分子在棉花不同组织、器官和细胞中的积累差异较大[19-21]。与此相对应,参与鞘脂分子修饰的鞘脂合成酶基因的表达也具有明显的组织器官特异性。鞘脂delta8-去饱和酶(GhSLD1)介导LCB(long chain base)链C-8的去饱和反应,在棉花纤维细胞中优势表达。【拟解决的关键问题】本研究通过克隆启动子序列和构建不同长度启动子(5′-删除)植物表达载体,利用转基因烟草和棉花,分析启动子的功能,证明具有纤维细胞表达特异性,为棉花纤维发育基础研究和现代育种分子设计提供新的纤维特异表达启动子。
1 材料与方法
1.1 试验材料
棉花遗传转化受体材料为棉花品种冀棉14(J14),由河北农业大学马峙英教授所赠,西南大学生物技术中心保存。烟草遗传转化受体为cv.xanthi,由西南大学生物技术中心保存。
1.2 克隆GhSLD1的启动子序列
位于陆地棉D亚基因组(),利用的cDNA序列,搜索已公布的棉花D-亚基因组序列(http://www.phytozome.net)。获得的5′-上游调控序列,进而在ATG上游约3.0 kb处设计特异引物-up(5′-ATTCTCCACC ACATGCAAACC-3′)和在近ATG位点处设计特异引物-down(5′-GGCTTGATCATGTCTAG ACTC-3′),以冀棉14基因组DNA为模板进行扩增。扩增产物回收,与克隆载体pMD19(TaKaRa,中国大连)连接,经转化、验证和测序,获得扩增片段长度为2 900 bp,并命名为。采用PlantCare数据库(http://bioinformatics.psb.ugent.be/webtools/ plantcare/html/)分析启动子顺式调控元件。为了进行启动子5′-端删除试验,根据启动子顺式调控元件分析结果,分别设计特异引物(-up:5′- cctaaagcaaccacatgcttc-3′,-up:5′-catcacgtgacatccttctct-3′,-up:5′-ttaggtgatgaatggcacgac-3′)。以为模板进行扩增,分别获得2178 bp、1 657 bp和1 232 bp。
1.3 植物表达载体构建
用dⅢ和Ⅰ内切酶从pMD19--—载体上酶切不同长度的启动子片段,与经dⅢ和Ⅰ双酶切的pBI121载体片段连接,从而使启动子片段置换了pBI121载体中的CaMV35S启动子。通过酶切验证,构建植物表达载体pBI121--—::GUS。
1.4 棉花的遗传转化
参照LUO等[22]棉花遗传转化方法进行棉花遗传转化。取50颗剥去外壳的冀棉14种子,放入一个三角瓶中,先用75%乙醇灭菌1 min,再用3%过氧化氢灭菌10 min,灭菌期间用手不断摇晃三角瓶;用无菌水冲洗8—10次,直至将泡沫洗净;在三角瓶中加入约50 mL无菌水,置于摇床,早晚各换一次无菌水;1 d之后就可以选择长出根的种子,并将其插入种子萌发培养基上,于26 ℃暗培养1—2 d,选择适宜的下胚轴进行遗传转化。将棉花下胚轴切成小段,放入制备好的农杆菌菌液,于26 ℃ 90 r/min浸染40—60 min;侵染后的下胚轴段转移到棉花共培养基上,于26 ℃暗培养2 d之后,将其转移到下胚段筛选培养基中,15 d后转移到继代培养基直到大量长出愈伤组织;将其转移到棉花胚性愈伤诱导培养基中;当大量出现胚性愈伤时,可进行胚性愈伤悬浮培养,于26 ℃ 120 r/min摇床培养15 d左右;将体胚铺于体胚伸长培养基上,体胚转入体胚伸长培养基;待体胚伸长到1—2 cm后,转入生根培养基上(继代培养基、胚性愈伤诱导培养基、生根培养基每隔15 d继代一次)。抗性幼苗在培养基中长大后,栽种于温室培养钵。
1.5 烟草的遗传转化
采用农杆菌介导法进行烟草的遗传转化。取烟草种子用1%次氯酸钠灭菌,再用无菌水冲洗5—8次,三角瓶中加入约50 mL无菌水,置于摇床培养2 d后种子至露白,然后转移至萌发培养基,约1个月可取叶片进行遗传转化。在无菌条件下将叶片除去主叶脉,切成0.5 cm2大小的叶片,转移到准备好的菌液中,于26 ℃ 90 r/min摇床浸染30—50 min,将浸染后的叶片转移到烟草共培养基上,于26 ℃暗培养2 d后,将其转移到烟草筛选培养基中,10 d后转移到继代培养基直到大量长出不定芽,将其切取转移到生根培养基中。幼苗长大后栽种于温室培养钵。
1.6 植物gDNA的提取
依据北京艾德来生物科技公司的新型植物基因组DNA(gDNA)快速提取试剂盒操作说明书提取植物基因组DNA,并进行琼脂糖凝胶电泳检测。
1.7 棉花RNA的提取
选取新鲜棉花材料(根、茎、叶、花、开花后0 d的胚珠和纤维至开花后6 d的胚珠和纤维、开花后6 d的纤维至开花后20 d的纤维、开花后6 d的胚珠至开花后20 d的胚珠),利用北京艾德来(Aidlab,中国)生物科技公司的EASYspin植物RNA快速提取试剂盒(货号:RN09)提取各个样品的总RNA,具体操作按说明书进行。
1.8 基因表达分析
将上述RNA合成cDNA(TakaRa),-20 ℃保存。运用实时荧光定量PCR扩增分析的表达水平。反应体系包括10 μL扩增混合缓冲液(试剂盒提供)、5′-端和3′-端引物各1 μL(5 μmol·L-1)、1 μL cDNA,去离子水补至20 μL。反应程序为94 ℃ 3 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s,40个循环。用棉花作内参基因,引物为(5′-ATGCCCAAGGACATCCAGTTG-3′)和(5′-CCTACCACTACCATCATGGCT-3′)。的引物为-1(5′-GATACAGAGTGG TTGGATAGG-3′)和-2(5′-GATCCTAGCAA AGCACATGAC-3′)。
1.9 转基因烟草和棉花的分子鉴定
提取转基因烟草和棉花抗性苗基因组DNA,以特异引物-up、-up、-up和-up分别和结合5′-端的3′引物-down(5′-ATCGAAACGCAGCACGATACG-3′)扩增抗性烟草或棉花基因组DNA,电泳检测。
1.10 转基因棉花中GUS活性的检测
随机选取5株PCR阳性转基因棉花植株进行全面的β-葡萄糖苷酸酶(GUS)活性检测。样品中加适量植物组织GUS染液,37 ℃避光处理1 h,每隔一定时间更换一次75%酒精进行脱色。脱色完全后,在体视镜下拍照记录。
2 结果
2.1 GhSLD1的表达分析
为了分析鞘脂在棉花纤维细胞生长发育中的功能,从陆地棉中克隆了拟南芥鞘脂delta8-去饱和酶(SLD)基因的同源基因。首先检测了该基因在棉花不同组织器官和纤维胚珠不同发育时期的表达特性(图1)。结果显示,主要在纤维细胞中表达,在胚珠早期发育阶段(6—12 DPA)有较低的表达,在根、茎、叶、花以及开花当天胚珠和14—20 DPA胚珠中几乎检测不到表达信号。在不同发育时期的纤维细胞中,该基因的表达峰值出现8 DPA和10 DPA,随后,表达水平快速降低。在14—20 DPA纤维细胞中维持较低的表达水平。说明是一个纤维细胞优势表达基因,在纤维细胞不同发育时期,该基因的表达水平有明显差异,在纤维细胞快速伸长期的表达水平最高。

图1 GhSLD1在棉花不同器官和不同发育时期纤维胚珠中的表达特征
2.2 GhSLD1启动子的克隆和序列分析
基因的启动子是调控基因表达的主要元件,棉花纤维细胞特异或优势表达调控序列是棉花纤维发育研究和现代分子设计育种的重要序列。是一个在纤维细胞快速伸长期优势表达的基因,为了深入研究的表达特性和调控机制以及获得纤维细胞特异或优势表达的调控序列,首先克隆的启动子并对克隆序列进行了分析。以(3)的5′-上游序列为参考,设计特异引物,从陆地棉(冀棉14)基因组中克隆获得约3 000 bp的片段(图2),通过克隆测序显示扩增片段长2 900 bp。将该序列导入PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/ html/)进行顺式调控元件分析(表1),结果显示,序列中除具有一般启动子所具有的大量TATA框和CAAT框,以及较多的光反应元件外,还具有许多特异性响应元件,如脱落酸响应元件(CACGTG/ ACGTG)、厌氧响应元件(AAACCA)、油菜素内酯响应元件(CANNTG)、茉莉酸响应元件(CGTCA)、MYB结合位点(AACCTAA/TAACCA/CAACCA/ TAACTG),防御与胁迫响应元件(ATTCTCTAAC)等(表1)。说明的表达受到多种因子的调控。

M:DNA marker;GhSLD1-P1:GhSLD1的启动子P1

表1 GhSLD1-P1启动子序列中的顺式调控元件
2.3 启动子功能分析及植物表达载体的构建
为了寻找启动子的核心区段,根据重要调控元件的分布,进行5′-删除试验。共获得4个片段,长度分别为2 900()、2 178()、1 657()和1 232 bp(),分别构建启动子植物表达载体(图3)。由于许多研究者认为棉花纤维细胞的生长发育及其调控机制与植物表皮毛相似[23-26],为了探究启动子各区段的功能,将构建的表达载体先进行烟草的遗传转化。

LB:T-DNA区段左边界;RB:T-DNA区段右边界;NPTII:卡那霉素抗性基因;GUS:b-葡萄糖酸苷酶基因(报告基因);Ter:终止子;CaMV 35S:花椰菜花叶病毒(CaMV)35S启动子
2.4 启动子转基因烟草的鉴定
利用构建的植物表达载体进行烟草的遗传转化。待抗性再生苗移栽成活后,提取再生苗基因组DNA,利用特异引物-up、-up、-up和-up分别和结合5′-端的3′引物GUS-down扩增烟草基因组DNA(图4)。结果表明,各个植物表达载体的转基因烟草都扩增出特异条带,该扩增带与各自载体质粒的扩增带大小一致,而以非转基因烟草基因组DNA为模板的阴性对照和以水为模板的空白对照没有任何特异扩增产物。表明包含不同启动子长度的T-DNA区段整合到烟草基因组DNA中,获得转基因烟草植株。
2.5 启动子转基因烟草GUS活性分析
为了明确不同长度的启动子在烟草中的表达模式,对不同启动子转基因烟草的根、茎、叶、花等不同部位进行GUS组织化学染色(图5)。结果表明,在、和转基因烟草的各部位均未检测到GUS活性。在转基因烟草各部位均检测到GUS活性,包括叶片和茎的表皮毛中也具有较强的GUS信号。说明1 232 bp的启动子序列具有启动子的必要元件,可以控制基因的表达,但不具有表达特异性。-2 900— -1 232 bp序列中可能具有调控特异性表达的元件。由于也没有GUS染色信号,进一步分析了-1 657—-1 232 bp间的序列特征,该序列包含4个脱落酸响应元件(G-box,ACGTG),同时与2个油菜素内酯响应元件(E-box,CANNTG)重叠;包含3个MYB结合位点(AACCTAA、CAACCA和TAACCA),这些顺式调控元件可能与、和在转基因烟草中没有明显GUS信号有一定关系。特别是全长启动子中共有4个脱落酸响应元件(表1),都集中在这段序列中,而中没有脱落酸响应元件,推测该元件与表达特性有密切关系。

A:GhSLD1-P1转基因烟草;B:GhSLD1-P2转基因烟草;C:GhSLD1-P3转基因烟草;D:GhSLD1-P4转基因烟草。M:DNA Marker;+:阳性对照,以对应片段的启动子表达载体质粒为扩增模板;-:阴性对照,以野生型烟草gDNA为扩增模板;H2O:空白对照,以水为PCR扩增模板;1—4:对应片段的启动子转基因烟草植株

CaMV 35S:组成型强启动子CaMV35S转基因烟草;GhSLD1-P1— GhSLD1-P4:分别为GhSLD1-P1、GhSLD1-P2、GhSLD1-P3和GhSLD1-P4转基因烟草。A:柱头,B:雄蕊,C:叶片,D:叶柄横切,E:茎横切,F:茎纵切,G:花瓣,H:开花当天的子房,I:根
2.6 转基因棉花的鉴定
结合前面的转基因烟草GUS活性的结果,将对进行进一步探索。利用不同长度启动子控制的植物表达载体和根癌农杆菌介导的棉花遗传转化,获得的卡那(kan)抗性再生苗。进一步提取再生苗基因组DNA,以此为模板进行PCR扩增验证,扩增引物分别结合于的5′序列和5′-端序列(图6)。结果表明,转基因棉花植株中能够扩增出一条与阳性对照一致的带,而阴性对照和空白对照均无任何扩增带。说明植物表达载体的T-DNA区段整合到了棉花基因组中。
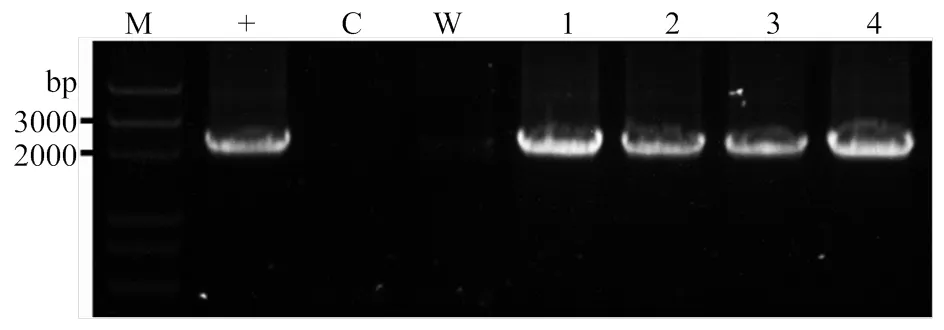
M:DNA Marker;+:阳性对照(以GhSLD1-P2植物表达载体质粒为模板);C:阴性对照(以野生型基因组DNA为模板);W:空白对照(以水为模板);1—4:转基因棉花株系1—4
2.7 转基因棉花中GUS活性分析
为了分析转基因棉花中GUS活性,对不同组织器官和纤维细胞发育不同时期进行组织化学分析,并以组成型强启动子CaMV 35S控制的转基因棉花为阳性对照,以非转基因棉花为阴性对照(图7—图9)。结果显示,在转基因棉花植株的根、茎、叶中均未检测到GUS信号,在开花当天(0 DPA)也未检测到GUS信号,仅在花粉中有较弱GUS信号(图7和图8)。为了明确启动子在不同发育时期的纤维细胞中的表达特性,检测5、10、15、20、25和30 DPA纤维细胞中GUS信号(图9)。结果显示,纤维细胞中有较强的GUS信号,相对而言,5 DPA中的信号较弱,10和15 DPA中的GUS信号最强,随后GUS信号有所降低。说明主要在纤维细胞中表达,其次在花粉中有较低水平表达,是一个纤维细胞优势表达启动子,而且在纤维细胞伸长期表达水平最高。
3 讨论
3.1 GhSLD1-P2启动子在棉花纤维基础研究和分子育种中有重要应用
启动子是基因组中控制基因表达的主要序列。分析目标基因启动子的功能不仅有助于解析目标基因的表达特性和表达调控机制,而且能够获得具有特殊时空表达特性的启动子。在基因功能研究和改良作物性状的分子设计中具有重要作用。传统基因工程中常使用组成型强启动子CaMV 35S,但过度的表达水平和不适的表达时空常常带来副作用,即使改良了目标性状,也严重干扰了其他生产性状。因此,启动子的功能鉴定是作物分子生物学的重要方面。

Non-T:阴性对照,非转基因棉花;8DP2-GUS:pBI121-GhSLD1-P2::GUS载体转基因棉花;35S-GUS:阳性对照,pBI121-CaMV35S::GUS载体转基因棉花。下同

图8 转基因棉花花器官中的GUS活性检测

5—30 DPA:开花后5—30 d的胚珠和纤维细胞 5-30 DPA: The ovules and fiber cells at 5-30 day post anthesis
棉花纤维是棉花的主要经济产品,是由胚珠外珠被表皮细胞经极性伸长和次生壁加厚而成的单细胞纤维。纤维细胞的生长发育包含起始、伸长、次生壁沉积和脱水成熟4个阶段,具有一个植物细胞生长和衰老的全过程。纤维细胞中的基因表达和物质代谢具有相对独立的体系。因此,研究纤维发育相关基因的功能和调控机制迫切需要纤维细胞特异或优势表达启动子,以控制目标基因在纤维细胞中表达而不影响或少影响棉花植株的生长发育;同时,也使转基因材料更具有可用性。如利用种皮特异启动子控制生长素合成酶基因iaaM能够促进纤维细胞起始[27]。利用CaMV 35S控制棉花类固醇5α-还原酶基因()难以获得正常生长的转基因棉花,而利用FBP7控制能够获得生长正常的转基因棉花,且能够促进纤维细胞的起始和伸长[22]。本研究中,启动子在转基因棉花纤维细胞中优势表达,且在纤维细胞伸长期(10—15 DPA)的表达水平相对较高;同时,与CaMV 35S相比,该启动子的总体表达水平较低。这些表达特性更有利于在纤维细胞中适时适量地调控目标基因的表达变化。
3.2 GhSLD1启动子中脱落酸响应元件可能对表达具有重要影响
由于许多研究者认为纤维细胞的生长发育及其调控机制与植物表皮毛相似[28-29]。因此,多个棉花纤维细胞特异或优势表达基因启动子的功能分析都在转基因烟草和拟南芥中进行。(棉花可逆糖基化多肽基因)启动子能在转基因烟草根中表达[30],(棉花葡糖醛基因)可在转基因烟草种皮、花粉、表皮毛和根冠中表达[31],启动子能够指导在转基因烟草表皮毛中优势表达[18]。(棉花纤维素合成酶基因)启动子在烟草表皮毛和叶脉以及下胚轴和茎的维管组织中表达[11]。启动子在转基因烟草和拟南芥的表皮毛中特异表达[32]。这些研究说明模式植物烟草和拟南芥分析棉花基因启动子的功能具有一定的可行性。本研究中,4个不同长度的的启动子载体都进行了烟草的遗传转化并获得转基因植株。其中3个较长的启动子在转基因烟草中不表达,而最短的启动子()在转基因烟草的各个检测样品中均表达,而且表达强度与CaMV 35S相似。说明具备启动子表达的基本元件,但不含有组织器官特异表达元件。在-2 900—-1 232 bp序列中可能存在控制在纤维细胞特异或优势表达的元件。由于(1 657 bp)无表达,而(1 232 bp)能够表达,说明-1 657—-1 232 bp的425 bp序列可能具有重要的作用。为此分析了这段序列中的顺式调控元件,发现这段序列中包含4个脱落酸响应元件,其中2个元件与油菜素内酯响应元件重叠,以及3个MYB结合位点。有趣的是:全长启动子序列(2 900 bp)中也只有4个脱落酸响应元件,说明这个启动子的脱落酸响应元件就集中在这段序列中。3个有这段序列的启动子在转基因烟草中无表达,缺失这段序列的启动子在转基因烟草中有表达,推测这段序列可能与该启动子的表达特性有密切关系。下一步可能针对这段序列进行深入研究。(2 178 bp)在转基因棉花的非纤维部分与烟草相似,也无表达信号;但在纤维细胞中有明显的表达信号。由此推测:抑制启动子在非纤维的组织器官中表达的元件可能存在于-2 178—-1 232 bp。下一步研究将对这段启动子序列进行更加密集的5′-端删除,可望找到控制基因在纤维细胞中优势表达的核心序列。
4 结论
(1 232 bp)启动子在转基因烟草中是一个广泛表达启动子,(2 900 bp)、(2 178 bp)和(1 657 bp)在转基因烟草中不表达。和之间的差异序列(425 bp)可能对表达特异性有重要影响。是一个棉花纤维细胞优势表达启动子,在纤维细胞伸长期(10—15 DPA)表达水平相对较高,总体表达强度低于组成型强启动子CaMV 35S。该启动子可应用于棉花纤维发育相关基因的功能研究和改良纤维性状的分子育种。
[1] JOHN M E, CROW L J. Gene expression in cotton (L.) fiber: cloning of the mRNAs. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(13): 5769-5773.
[2] JOHN M E, KELLER G. Metabolic pathway engineering in cotton: Biosynthesis of polyhydroxybutyrate in fiber cells. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(23): 12768-12773.
[3] 于晓红, 朱勇清, 林芝萍, 陈晓亚, 许智宏. 亚洲棉GAE6-3A上游序列的分离及其在烟草中的表达. 植物生理学报, 2000, 26(2): 143-147, 180.
YU X H, ZHU Y Q, LIN Z P, CHEN X Y, XU Z H. Isolation of GAE6-3A upstream fragment fromand its expression in tobacco. Acta Photophysiologica Sinica, 2000, 26(2): 143-147, 180. (in Chinese)
[4] 吴蔼民, 刘进元. 棉花半乳糖苷酶基因启动子的分离及其在转基因烟草中的表达. 中国科学C辑: 生命科学, 2005, 35(5): 389-397.
WU A M, LIU J Y. Isolation of cotton galactosidase gene promoter and its expression in transgenic tobacco. Science in China Ser.C Life Sciences, 2005, 35(5): 389-397. (in Chinese)
[5] RINEHART J A, PETERSEN M W, JOHN M E. Tissue-specific and developmental regulation of cotton gene FbL2A (demonstration of promoter activity in transgenic plants). Plant Physiology, 1996, 112(3): 1331-1341.
[6] DELANEY S K, ORFORD S J, MARTIN-HARRIS M, TIMMIS J N. The fiber specificity of the cottongene promoter is regulated by an AT-Rich promoter region and the AT-Hook transcription factor GhAT1. Plant and Cell Physiology, 2007, 48(10): 1426-1437.
[7] MA D P, TAN H, SI Y, CREECH R G, JENKINS J N. Differential expression of a lipid transfer protein gene in cotton fiber. Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism, 1995, 1257(1): 81-84.
[8] MA D P, LIU H C, TAN H, CREECH R G, JENKINS J N, CHANG Y F. Cloning and characterization of a cotton lipid transfer protein gene specifically expressed in fiber cells. Biochimica et Biophysica Acta(BBA)-Lipids and Lipid Metabolism, 1997, 1344(2): 111-114.
[9] LIU H C, CREECH R G, JENKINS J N, MA D P. Cloning and promoter analysis of the cotton lipid transfer protein gene Ltp3(1). Biochimica Et Biophysica Acta(BBA)-Lipids and Lipid Metabolism, 2000, 1487(1): 106-111.
[10] HSU C Y, CREECH R G, JENKINS J N, MA D P. Analysis of promoter activity of cotton lipid transfer protein gene LTP6 in transgenic tobacco plants. Plant Science, 1999, 143(1): 63-70.
[11] WU A M, HU J S, LIU J Y. Functional analysis of a cotton cellulose synthase A4 gene promoter in transgenic tobacco plants. Plant Cell Reports, 2009, 28(10): 1539-1548.
[12] KIM H J, MURAI N, FANG D D, TRIPLETT B A. Functional analysis ofcellulose synthase catalytic subunit 4 promoter in transgenicand cotton tissues. Plant Science, 2011, 180(2): 323-332.
[13] LI X B, FAN X P, WANG X L, CAI L, YANG W C. The cotton ACTIN1 gene is functionally expressed in fibers and participates in fiber elongation. The Plant Cell, 2005, 17(3): 859-875.
[14] DENG F L, TU L L, TAN J F, LI Y, NIE Y C, ZHANG X L. GbPDF1 is involved in cotton fiber initiation via the core cis-element HDZIP2ATATHB2. Plant Physiology, 2011, 158(2): 890-904.
[15] HO M H, SAHA S, JENKINS J N, MA D P. Characterization and promoter analysis of a cotton RING-type ubiquitin ligase (E3) gene. Molecular Biotechnology, 2010, 46(2): 140-148.
[16] HOU L, LIU H, LI J B, YANG X, XIAO Y H, LUO M, SONG S Q, YANG G W, PEI Y. SCFP, a novel fiber-specific promoter in cotton. Chinese Science Bulletin, 2008, 53(17): 2639-2645.
[17] LI Y, TU L L, YE Z Z, WANG M J, GAO W H, ZHANG X L. A cotton fiber-preferential promoter, PGbEXPA2, is regulated by GA and ABA in. Plant Cell Reports, 2015, 34(9): 1539-1549.
[18] 胡海燕, 刘迪秋, 李允静, 李阳, 涂礼莉. 一个棉花纤维伸长期优势表达启动子pGhFLA1的克隆与鉴定. 作物学报, 2017, 43(6): 849-854.
HU H Y, LIU D Q, LI Y J, LI Y, TU L L. identification of promoter GhFLA1 preferentially expressed during cotton fiber elongation. Acta Agronomica Sinica, 2017, 43(6): 849-854. (in Chinese)
[19] WANG L, LIU C, LIU Y J, LUO M. Fumonisin B1-induced changes in cotton fiber elongation revealed by sphingolipidomics and proteomics. Biomolecules, 2020, 10(9): 1258.
[20] WANG Q L, MENG Q, XU F, CHEN Q, MA C X, HUANG L, LI G M, LUO M. Comparative metabolomics analysis reveals sterols and sphingolipids play a role in cotton fiber cell initiation. International Journal of Molecular Sciences, 2021, 22(21): 11438.
[21] CHEN Q, XU F, WANG L, SUO X D, WANG Q L, MENG Q, HUANG L, MA C X, LI G M, LUO M. Sphingolipid profile during cotton fiber growth revealed that a phytoceramide containing hydroxylated and saturated VLCFA is important for fiber cell elongation. Biomolecules, 2021, 11(9): 1352.
[22] LUO M, XIAO Y, LI X, LU X, DENG W, LI D, HOU L, HU M, LI Y, PEI Y. GhDET2, a steroid 5α-reductase, plays an important role in cotton fiber cell initiation and elongation. The Plant Journal, 2007, 51(3): 419-430.
[23] WANG M J, TU L L, LIN M, LIN Z X, WANG P C, YANG Q Y, YE Z X, SHEN C, LI J Y, ZHANG L, ZHOU X L, NIE X H, LI Z H, GUO K, MA Y Z, HUANG C, JIN S X, ZHU L F, YANG X Y, MIN L, YUAN D J, ZHANG Q H, LINDSEY K, ZHANG X. Asymmetric subgenome selection and cis-regulatory divergence during cotton domestication. Nature Genetics, 2017, 49(4): 579-587.
[24] ZHANG J X, WANG F R, ZHANG C Y, ZHANG J H, CHEN Y, LIU G D, ZHAO Y X, HAO F S, ZHANG J. A novel VIGS method by agroinoculation of cotton seeds and application for elucidating functions of GhBI-1 in salt-stress response. Plant Cell Reports, 2018, 37(8): 1091-1100.
[25] ZHANG J, HUANG G Q, ZOU D, YAN J Q, LI Y, HU S, LI X B. The cotton () NAC transcription factor (FSN1) as a positive regulator participates in controlling secondary cell wall biosynthesis and modification of fibers. The New Phytologist, 2018, 217(2): 625-640.
[26] JIANG Y J, GUO W Z, ZHU H Y, RUAN Y L, ZHANG T Z. Overexpression of GhSusA1 increases plant biomass and improves cotton fiber yield and quality. Plant Biotechnology Journal, 2012, 10(3): 301-312.
[27] ZHANG M, ZHENG X L, SONG S Q, ZENG Q W, HOU L, LI D M, ZHAO J, WEI Y, LI X B, LUO M, XIAO Y H, LUO X Y, ZHANG J F, XIANG C B, PEI Y. Spatiotemporal manipulation of auxin biosynthesis in cotton ovule epidermal cells enhances fiber yield and quality. Natture Biotechnology, 2011, 29(5): 453-458.
[28] GUAN X Y, YU N, SHANGGUAN X X, WANG S, LU S, WANG L J, CHEN X Y.trichome research sheds light on cotton fiber development mechanisms. Chinese Science Bulletin, 2007, 52(13): 1734-1741.
[29] WANG Z, YANG Z R, LI F G. Updates on molecular mechanisms in the development of branched trichome inand nonbranched in cotton. Plant Biotechnology Journal, 2019, 17(9): 1706-1722.
[30] WU A M, LING C, LIU J Y. Isolation of a cotton reversibly glycosylated polypeptide (GhRGP1) promoter and its expression activity in transgenic tobacco. Journal of Plant Physiology, 2006, 163(4): 426-435.
[31] WU A M, LV S Y, LIU J Y. Functional analysis of a cotton glucuronosyltransferase promoter in transgenic tobaccos. Cell Research, 2007, 17(2): 174-183.
[32] SHANGGUAN X X, XU B, YU Z X, WANG L J, CHEN X Y. Promoter of a cotton fibre MYB gene functional in trichomes ofand glandular trichomes of tobacco. Journal of Experimental Botany, 2008, 59(13): 3533-3542.
Cloning and functional characterization of the promoter ofgene That predominantlyexpressed in cotton fiber
LIU Fang, XU Mengbei, WANG Qiaoling, MENG Qian, LI Guiming, ZHANG Hongju, TIAN Huidan, XU Fan, LUO Ming
Biotechnology Research Center, Southwest University/Key Laboratory of Biotechnology and Crop Quality Improvement, Ministry of Agriculture and Rural Affairs, Chongqing 400716
【Objective】Cotton fiber is the main economic product of cotton. It is the epidermal cells of the ovule outer integument through polar elongation and secondary wall thickening. As one of the longest plant cells, the cotton fiber cells are regarded as an ideal material in the study of plant cell growth and development. Identification of promoters specifically or preferentially expressed in fiber cells is of great significance for basic research on fiber development and molecular breeding for improving fiber traits. 【Method】In this study, we cloned the promoter ofgene, which is predominantly expressed in fiber cells. Through the PlantCARE website for promoter sequence analysis, we identified the important-regulatory elements contained in the cloned sequence. According to the distribution of some important-regulatory elements, the cloned promoter fragments were deleted at 5′- end. A total of 4 promoter fragments were obtained and the corresponding plant expression vector was constructed. The constructed plant expression vectors were used for genetic transformation of tobacco and cotton. The transgenic plants were identified through molecular identification of transgenic tobacco and cotton. GUS activity in different tissues, organs and fiber cells of transgenic plants at different development stages was also investigated. 【Result】The longest promoter cloned was 2 900 bp in length. In addition to a lot of transcription regulatory elements in the promoter, the sequence also contained multiple abscisic acid response elements, the elements essential for the anaerobic induction, methyl jasmonate response elements, brassinolide response elements, the elements involved in seed-specific regulation, the elements involved in defense and stress responsiveness, and MYB transcription factor binding sites. Four promoter fragments with a length of 2 900 bp (), 2 178 bp (), 1 657 bp () and 1 232 bp () were obtained by the 5′-terminal deletion, respectively. The transgenic tobacco plants were generated after confirmed by molecular identification.,anddid not express in transgenic tobacco, whileis widely expressed, and the expression level ofwas similar to that of CaMV 35S promoter. The different sequence betweenandcontained four abscisic acid response elements, two brassinolide response elements, and three MYB binding sites. These-regulatory elements may be associated with the non-expression of,, andpromoters in transgenic tobacco. The transgenic cotton plants ofwere obtained after confirmed by molecular identification.predominantly expressed in transgenic cotton fibers, and its expression level was higher at the elongation stage (10-15 DPA) of fiber cells while lower in the early developmental stage (5 DPA) of fiber cells and the stage of secondary cell wall deposition (20-30 DPA). 【Conclusion】Thepromoter was a widely expressed promoter, and thepromoter was a fiber predominant expression promoter, which was highly expressed during the elongation of fibers. It could be applied to the study on the gene function involved in cotton fiber development and molecular breeding for improving fiber traits.
cotton; promoter; functional characterization;; sphingolipid delta8-desaturase
2022-11-07;
2022-12-13
国家自然科学基金(31971984,31571722)
刘芳,Tel:15330430736;E-mail:lf530805@163.com。通信作者罗明,Tel:13996007163;E-mail:luo0424@126.com
10.3864/j.issn.0578-1752.2023.19.002
(责任编辑 李莉)
