超高效液相色谱-四极杆-飞行时间质谱法测定牛奶中51种激素
2023-10-25段鹤君孙佳林杨润晖牛宇敏
段鹤君,张 晶,孙佳林,杨润晖,邵 兵,牛宇敏*
(1.北京市疾病预防控制中心 食物中毒诊断溯源技术北京市重点实验室,北京 100013;2.首都医科大学公共卫生学院,北京 100069;3.中国农业大学 兽医学院,北京 100193)
作为重要的动物源性食品,牛奶的安全性受到社会广泛关注[1]。其中激素类药物在牛奶中的残留是社会关注的热点。一方面,激素类药物可用于治疗奶牛的生殖疾病,另一方面,激素能提高饲料转化率,促进动物生长。因此,激素被奶农非法使用,以促进奶牛性成熟,并增加原奶产量[2]。此外,部分激素被违法添加至牛奶中,使运动员产生兴奋从而提高机能状态[3]。研究表明,过量摄入激素会造成人类生殖系统功能异常,甚至引发前列腺癌和乳腺癌等癌症[4-6]。世界许多国家和组织对牛奶中激素类药物制定了最大残留限量,以保护消费者安全。欧盟理事会指令96/22/EC 和2003/74/EC 禁止某些具有激素作用的物质用于畜牧业[7-8]。中华人民共和国农业部第250 号公告明令禁止己烯雌酚等激素类药物用于食品动物[9]。世界反兴奋剂机构将勃地酮、美睾酮等雄激素和氢化可的松、泼尼松等糖皮质激素列入禁用清单[10]。
激素类药物包括糖皮质激素、孕激素、雄激素和雌激素等,化合物种类众多。目前激素类药物的检测方法包括放射免疫分析法和酶联免疫吸附法[11]、气相色谱法(GC)[12]、液相色谱法(LC)[13]以及液相色谱-串联质谱法(LC-MS/MS)[14-15]等。相比之下,液相色谱-高分辨质谱联用技术具有更高的质量精度和更强的检测通量,在激素类药物高通量筛查和检测方面具有显著优势[16-17]。在样品制备方面,《GB/T 21981-2008 动物源食品中激素多残留检测方法 液相色谱-质谱/质谱法》[18]规定了动物性食品中50 种激素的检测需使用ENVI-Carb 和氨基柱两种固相萃取柱,不适用于激素类药物的快速筛查。QuEChERS 方法由于操作简单、检测成本低且溶剂使用较少,已被用于肉类样品中激素类药物的多残留检测[19-20],但在牛奶样品中的应用研究较少。因此,本研究拟采用QuEChERS 方法实现牛奶基质中激素的多残留检测。
本研究选择常用的四大类兽用激素类药物(包括雄激素、雌激素、肾上腺皮质激素、孕激素)共51种化合物为研究对象,通过超高效液相色谱-四极杆-飞行时间质谱仪(UPLC-Q-TOF MS)获得化合物的母离子、二级碎片离子精确质量数、保留时间,构建激素类药物的定性筛查数据库;通过优化QuEChERS 前处理条件,建立了牛奶中51 种激素的筛查和定量方法,并应用于北京本地市售牛奶样品的测定。
1 实验部分
1.1 仪器、试剂与材料
超高效液相色谱-四极杆-飞行时间质谱仪(Waters ACQUITYTMUPLC 液相色谱-Sciex5600 飞行时间质谱仪,分别购自美国Waters 公司和Sciex 公司);Milli-Q 超纯水仪(美国Millipore 公司);Vortex-Genin 2涡旋振荡器(美国Scientific Industries公司);离心机(美国Beckman Coulter公司)。
51种标准物质(名称见表1)的纯度大于95%,均购自德国Dr.Ehrenstorfer公司。所有标准物质均在-18 ℃低温储存。
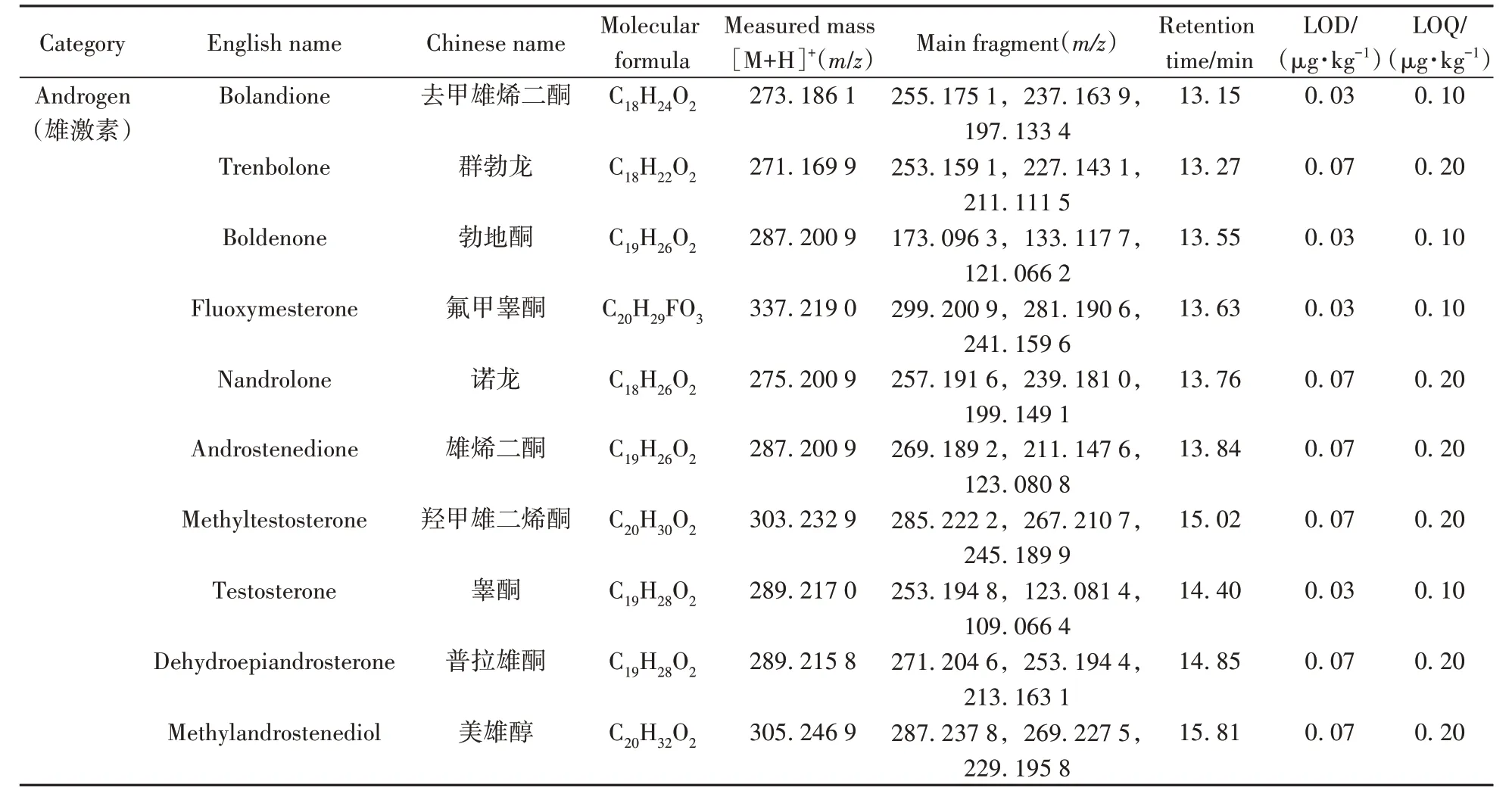
表1 51种激素的名称、分子式、测量质量数、主要碎片、保留时间、检出限及定量下限Table 1 Chemical names,molecular formulas,measured mass,main fragments,retention times,limits of detection and limits of quantitation of 51 hormones
氧化锆包覆硅胶(Z-Sep)填料、反相硅胶键合相吸附剂(C18)填料购自美国Supelco 公司,N-丙基乙二胺(PSA)、增强型脂质去除净化管(EMR-Lipid dSPE)购自美国Agilent公司。
1.2 标准溶液配制
分别准确称取标准品各0.010 0 g,用甲醇溶解,转移至10 mL 容量瓶中并用甲醇定容至刻度,配制成质量浓度为1 000 mg/L 的标准储备液。分别准确吸取100 µL 标准储备液至10 mL 容量瓶,用甲醇定容至刻度,配制成质量浓度为10 mg/L的混合标准中间液。
基质匹配标准系列溶液:用空白基质提取液将10 mg/L混合标准工作液逐级稀释,配制成质量浓度为0.1~500 µg/L的基质匹配标准系列溶液,临用前现配。
1.3 样品前处理
准确称取2.0 g(精确至0.01 g)牛奶样品,加入5 mL乙腈涡旋混匀,超声提取30 min,于9 500 r/min 4 ℃下离心10 min,转移上清液至装有75 mg Z-Sep 填料的离心管中;净化管涡旋混匀2 min 后,于9 500 r/min 4 ℃下离心10 min,吸取上清液,在微弱的氮气流下吹干。加入50%甲醇水定容至1 mL,12 000 r/min离心5 min,取上清液待测定。
1.4 仪器条件
1.4.1 色谱条件色谱柱:Waters Acquity BEH C18柱(100 mm×2.1 mm,1.7 µm);柱温:40 ℃;样品室温度:15 ℃;进样量:5 µL;流速:0.3 mL/min;流动相:0.1%甲酸水(A)-甲醇(B);梯度洗脱程序:0~18 min,3%~100% B;18~20 min,100% B;20~21 min,100%~3% B;21~25 min,3% B。
1.4.2 质谱条件离子源:电喷雾离子源(ESI+);喷雾电压:5 500 V;离子源温度:500 ℃;气帘气压力:241 kPa;辅助气压力:379 kPa;雾化气压力:379 kPa;去簇电压:60 V;扫描方式:全扫描一级质谱扫描(TOF MS),质量采集范围100~1 000 Da;信息依赖触发的二级质谱扫描(IDA),质量采集范围50~1 000 Da,碰撞电压(CE):35 V,碰撞电压差(CES):15 V;分辨率 > 45 000。质谱校正溶液:大气压化学电离源(APCI)正离子校正液;校正周期:每5针样品穿插1针校正溶液以校正质谱质量数。
1.5 定性检测
1.5.1 高分辨质谱库建立在LibraryView 中输入51 种激素的分类、中英文名称及化学式,得到每个化合物的理论质量数。进样50 µg/L 的混合标准工作溶液,在TOF MS 模式下得到每种激素的保留时间和母离子精确质量数测定值;在IDA 模式下,得到每种激素的碎片离子谱图,将二级谱图导入高分辨质谱谱库,与相应的保留时间、精确质量数测定值、中英文名称等信息关联,完成谱库构建。
1.5.2 定性筛查分析通过PeakView 软件对目标化合物的保留时间、母离子及碎片离子的精确质量数与谱库的匹配情况以及同位素分布等参数进行定性筛查分析。如检出的色谱峰保留时间与谱库中的保留时间偏差小于2.5%、母离子精确质量数与理论质量数的偏差小于5 ppm,且同位素偏差在10 ppm以内,则初步判定试样中含有该激素。进一步在IDA 模式下比对其二级碎片离子,如果有2 个及以上丰度较高的碎片离子与谱库中相应的碎片离子质量数偏差在10 ppm 以内,且相对丰度与浓度接近的标准工作液中对应碎片离子的相对丰度一致,可判定试样中含有该激素。
2 结果与讨论
2.1 检测条件的优化
配制质量浓度为50 µg/L的51种激素混合标准溶液,采用UPLC-Q-TOF MS 在全扫描模式下获得各激素的一级质谱图,并优化出最佳的碎裂电压、干燥气温度及流速、雾化气压力、鞘气温度和流速、毛细管电压。在ESI+条件下,所有化合物均有响应。进一步比较了不同流动相(甲醇、乙腈)以及添加剂(0.1%甲酸)的影响。如图1 所示,当流动相为甲醇-0.1%甲酸水时,会促进目标物的电离,显著提高目标化合物的响应,所以最终选择甲醇和0.1%甲酸水作为流动相。

图1 不同流动相条件下51种激素的一级全扫描总离子流图(50 µg/L)Fig.1 Total ion chromatograms of 51 hormones(50 µg/L) under different mobile phase conditions
2.2 前处理条件的优化
牛奶样品含有丰富的脂肪和蛋白质,乙腈通常被用作提取溶剂,以去除牛奶中大部分蛋白质。本研究采用乙腈作为提取溶剂,51 种目标化合物的回收率为61.3%~119%。然而乙腈提取液中含有大量的脂肪等干扰物,一方面影响分析结果的准确性,同时还会缩短色谱柱的使用寿命。为进一步去除脂肪,以加标回收率和基质效应为评价指标,对比了5种除脂方法:冷冻除脂、EMR 填料除脂、C18填料除脂、PSA填料除脂、Z-Sep填料除脂。基质效应为目标物在空白基质中的峰面积与溶剂中峰面积的百分比。当基质效应为70%~130%时,表示无基质效应;高于130%时,表明存在基质增强效应;低于70%时,表示存在基质抑制效应[21-22]。
不同填料净化后目标化合物在不同回收率范围的化合物个数如图2A所示,经PSA填料除脂后仅有4 种化合物的回收率为80%~120%,经EMR 填料净化除脂后有9 种化合物的回收率为80%~120%。冷冻除脂、C18填料和Z-Sep 填料3 种除脂方法,回收率在80%~120%范围的激素分别为44、46 和47 种。不同填料净化后目标化合物在不同基质效应范围内的化合物个数如图2B 所示,冷冻除脂后有41 种化合物无基质效应,C18填料净化后有47 种化合物无基质效应,Z-Sep 填料净化后有48 种化合物无基质效应。进一步比较了牛奶加标样品经Z-Sep 填料和C18填料净化后UPLC-Q-TOF MS 识别的绝对峰个数,如图2C 所示,经Z-Sep 填料净化后UPLC-Q-TOF MS 获得的识别峰个数为2 285 个,比经C18填料净化后获得的识别峰个数(3 715个)减少约38%。因此本研究选择Z-Sep填料进行净化。

图2 不同除脂方式净化后目标化合物在不同回收率范围(A)与不同基质效应范围(B)的个数,牛奶加标样品经C18填料和Z-Sep填料净化后获得的识别峰个数(C)Fig.2 The number of target compounds purified by different degreasing methods in different recovery ranges(A) and different matrix effect ranges(B),and the number of recognition peaks obtained from the spiked milk purified with C18 and Z-Sep sorbents(C)
2.3 方法学考察
2.3.1 线性范围、检出限与定量下限在优化的实验条件下,样品按“1.3”方法进行前处理后加入混合标准工作液,经UPLC-Q-TOF MS 测定,绘制工作曲线,外标法定量。以信噪比(S/N)≥ 3 对应的添加水平作为方法检出限(LOD),S/N≥ 10对应的添加水平作为定量下限(LOQ)。结果表明,51种激素在0.10~500 µg/L 范围内呈线性关系,相关系数(r2)均大于0.99。目标物的名称、分子式、测量质量数、主要碎片、保留时间、LOD 和LOQ 如表1 所示。51 种激素的LOD 为0.03~1.67 µg/kg,LOQ 为0.10~5.00 µg/kg。
2.3.2 回收率与相对标准偏差选用空白牛奶样品,分别添加5、10、50 µg/kg 的目标物,每个加标水平做6 个平行,结果见表2。除十一酸睾酮、苯丙酸诺龙、康复龙、皮质甾酮的回收率为44.6%~59.6%外,其余47种目标化合物的回收率为61.3%~120%,相对标准偏差(RSD)均在20%以内。本方法的准确度和精密度满足测定要求。
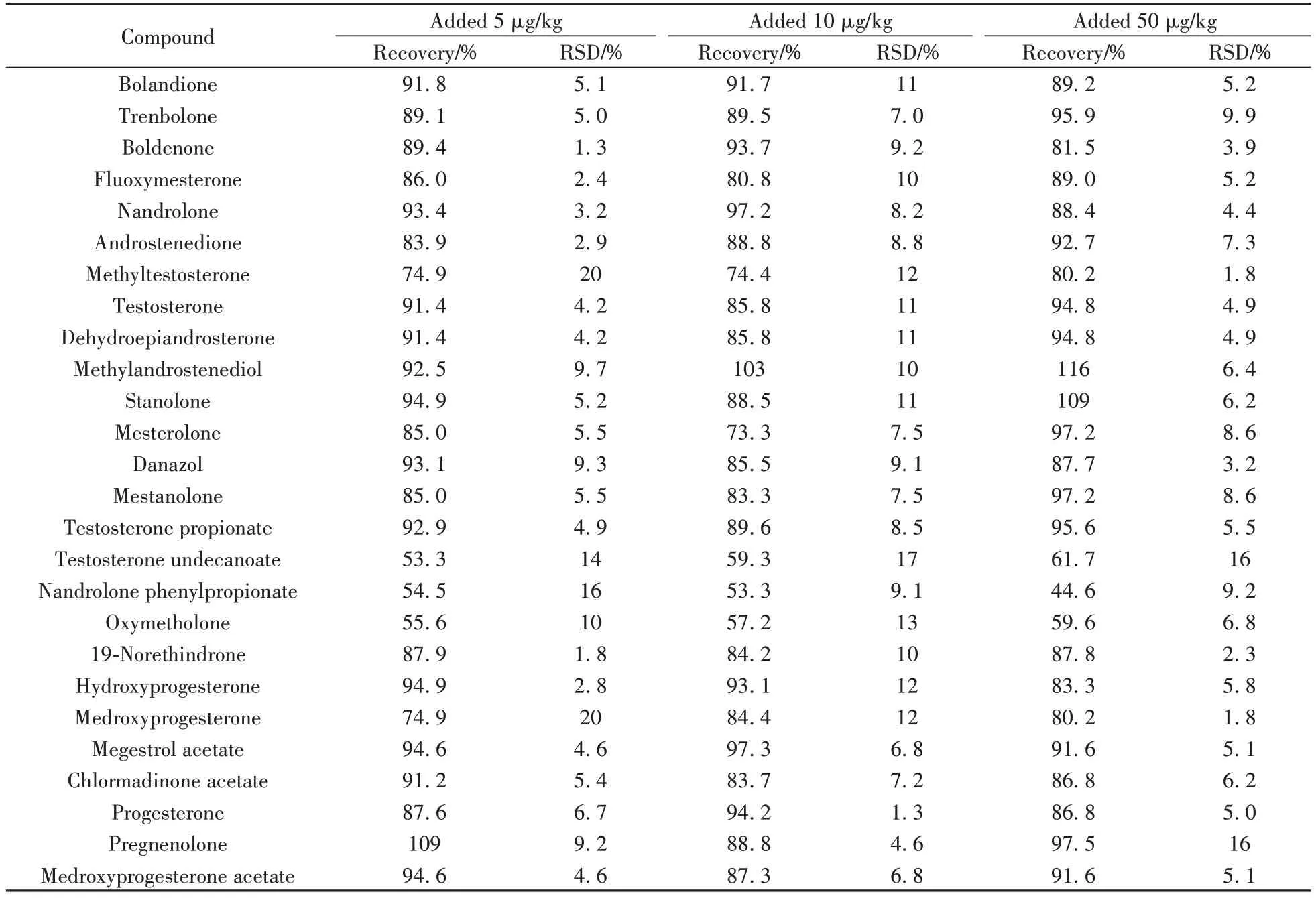
表2 51种激素的回收率及相对标准偏差(n = 6)Table 2 Recoveries and relative standard deviations of 51 hormones(n=6)
2.4 实际样品分析
应用本方法检测北京本地超市售卖的20 份牛奶样品,其中19 份样品检出孕酮,检出量为0.80~4.51 µg/kg,1 份样品检出痕量的氢化可的松,检出量为0.62 µg/kg,其他激素化合物均未检出。图3为1 份阳性样品的提取离子流图、一级质谱同位素丰度比图谱与二级质谱镜像图。《GB 31650-2019 食品中兽药最大残留限量》[23]规定氢化可的松仅作外用,未指定残留限量。段永生等[24]对市售10 种牛奶及进口乳清粉进行测定,发现所有样品均含有孕酮,含量为1.7~2.6 µg/kg。吴肖肖等[25]在10份牛奶样品检测到1份样品含有氢化可的松,含量为0.35 µg/kg。本文实际样品中的激素种类和含量范围与上述文献的测定结果基本一致。

图3 阳性样品的提取离子流图(A、B)、一级质谱同位素丰度比图谱(C、D)与二级质谱镜像图(E、F)Fig.3 Extracted ion chromatograms(A,B),isotope ratio mass spectra(C,D) and secondary mass spectra mirror images(E,F) of positive samples
3 结 论
本文利用QuEChERS 结合UPLC-Q-TOF MS 分析技术,建立了牛奶中51 种激素的同时定量检测方法。本方法利用Z-Sep 填料进行样品净化,有效降低了测定过程中脂肪的干扰,具有较好的回收率和灵敏度,满足激素检测的技术要求,可应用于大批量样品的快速、准确测定。
