绵羊肺炎支原体不同分离株的致病性比较
2023-10-24魏立翔高之煜曹鑫艳张彦兵孙延鸣
魏立翔,袁 婷,高之煜,曹鑫艳,张彦兵,2*,孙延鸣*
(1.石河子大学动物科技学院,新疆石河子 832003;2.新疆泰昆集团股份有限公司,新疆昌吉 831203)
绵羊肺炎支原体(Mycoplasmaovipneumoniae,Mo)是引起小反刍动物呼吸道疾病的重要病原体,可导致绵羊和山羊的传染性肺炎[1]。Mo对不同年龄品种的羊都有致病性,患畜会出现渐进性消瘦和间质增生性肺炎等症状[2-3]。此外,Mo感染羊体后,可继发溶血性曼氏杆菌、D型流感病毒等感染,最终导致患畜死亡,其中羔羊感染率和病死率最高,给我国养羊业造成巨大经济损失[4-5]。控制Mo感染主要通过抗菌治疗, Mo没有细胞壁结构,对靶向细胞壁的抗微生物药物,如β-内酰胺类、糖肽类具有天然耐药性,而土霉素、大环内酯类等药物只能够减轻患畜的临床症状,不能根除Mo感染[6]。因此,需要研发针对Mo感染的高效疫苗和治疗药物,然而开发药物和疫苗必须完成临床免疫评估及药物疗效试验,所以建立该病的人工发病模型是迫切需要解决的问题。
建立Mo人工感染模型需要毒力合适的Mo菌株。Besser T E等人使用不同毒力的Mo对盘羊进行攻毒,感染较弱毒力Mo的盘羊肺脏出现轻微的病理损伤,无显著的呼吸道疾病症状[7],感染强毒力Mo的盘羊肺脏出现显著的病理变化,甚至发生死亡[8]。Mo菌株之间存在高度表型和基因型异质性,菌株的致病性也有强弱差异[1]。Mo致病性的强弱表现为对羊呼吸道上皮细胞黏附力高低[9],黏附是支原体感染的关键步骤,通过突变失去黏附能力的支原体不再具有致病性[10]。间接免疫荧光技术(indirect immunofluorescence assay,IFA)的原理是将处理好的样品与特异性一抗结合,然后用被荧光标记后的二抗和一抗反应,在荧光显微镜下观察荧光,来检测样品抗原。该技术因为与临床症状相关性好,常用于病原体致病机制的研究[11]。SPF鸡胚常被用于细菌和病毒毒力检测,袁婷将不同毒力的Mo菌株接种鸡胚后,鸡胚致死率不相同[12]。
因此,本试验将6株Mo与山羊气管上皮细胞(goat tracheal epithelial cell,GTEC)共孵育,通过IFA检测黏附力强弱,进一步将Mo接种鸡胚,检测和观察鸡胚致死率和病理变化,综合筛选出致病性强的菌株,为Mo人工感染模型建立和疫苗的研发提供基础资料。
1 材料与方法
1.1 材料
1.1.1 菌株和细胞 Mo分离株XJ15、XJ13、XJ22、1412、XJN均由本实验室保存;标准株Y98、Mo高免兔血清,山羊气管上皮细胞,由兰州兽医研究所储岳峰研究员惠赠;SPF鸡胚,购自新疆恒朝生物技术有限公司。
1.1.2 主要试剂 FITC标记的山羊抗兔IgG,购自Abcam公司;马血清,胎牛血清,胰酶,RPMI1640培养基,购自Gibco公司;细菌基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司。
1.1.3 主要仪器 Micro21低温高速离心机,ABI-2720 PCR扩增仪,赛默飞世尔科技(中国)有限公司产品;Alpha紫外凝胶成像仪,美国ProteinSimple公司产品;Leica DMI6000B倒置荧光显微镜,德国莱卡公司产品;PowerPac基础型核酸电泳仪,美国Bio-Rad公司产品;恒温培养箱,Thermo Fisher生物科技有限公司产品。
1.2 方法
1.2.1 Mo和GTEC培养 将实验室冻存的Mo菌株按1∶10比例接种入含200 ml/L马血清的Thiaucourt's培养基中,37℃恒温培养箱培养3~7 d,待培养基颜色变黄,传代3次同时测定CCU,4 ℃保存。GTEC用含10%胎牛血清的RPMI1640培养基培养,当细胞铺满细胞瓶时,使用胰酶消化、洗涤,按1.5×105~3.5×105接种于24孔细胞培养板,37 ℃、5% CO2培养24 h。
1.2.2 Mo黏附细胞 Mo菌液以12 000 r/min离心15 min,收集沉淀并用PBS洗涤2次,用含4%胎牛血清的RPMI1640培养基重悬沉淀并调整菌液浓度为108CCU/mL,备用。24孔板内生长状态良好的GTEC用PBS洗1次,接种重悬的Mo菌液,37 ℃、5% CO2黏附2 h。37 ℃预热PBS洗涤未黏附的Mo,4%多聚甲醛室温固定30 min。
1.2.3 间接免疫荧光检测 多聚甲醛固定后的24孔板用4℃PBS洗涤3次,每次5 min;10%脱脂奶粉(250 μL/孔)37 ℃封闭30 min;PBS洗涤3次,每次5 min;加入Mo高免兔血清,37 ℃、5% CO2孵育1.5 h ;PBS洗涤3次,每次5 min;加入FITC标记的山羊抗兔IgG,37 ℃、5% CO2避光孵育1 h;弃二抗,4 ℃PBS洗涤3次,每次5 min。其中一抗、二抗工作浓度参考文献[13]进行稀释。用倒置荧光显微镜观察黏附情况。
1.2.4 Mo和鸡胚培养 Mo菌株培养方法与1.2.1一致,培养好的Mo菌液用0.85%生理盐水离心洗涤,并调整菌液浓度为109CCU/mL,备用。将SPF鸡胚气室向上置于37 ℃孵化箱,培养7日,每日定时翻蛋,照蛋检测鸡胚生长情况,筛去死胚,生长状态良好的鸡胚用做接种。
1.2.5 Mo鸡胚接种 将6株Mo通过卵黄囊注射方式接种于鸡胚,0.2 mL/只(109CCU/mL),其中Mo的接种剂量和浓度参考文献[12]进行调整,每株Mo接种10只鸡胚,并设空白对照组和生理盐水注射组,接种后鸡胚继续培养至21日龄,每日照蛋检查鸡胚生长情况,并剖检死亡鸡胚观察病理变化,取死亡鸡胚尿囊液,记录感染组鸡胚死亡率。
1.2.6 尿囊液Mo检测 无菌取死亡鸡胚尿囊液,与0.85%生理盐水等体积混合,2 000 r/min离心10 min,取上清按细菌基因组DNA提取试剂盒说明提取DNA,进行PCR检测。根据Mo16S rRNA基因设计引物,上游引物:5′-TGGCAAAAGTCACTAGCACAG-3′,下游引物:5′-ACCTAACATCTCACGACACGA-3′,产物大小258 bp。反应体系为20 μL:2×ESTaqmix 10 μL,DNA 2 μL,上、下游引物各0.5 μL,ddH2O 7 μL;反应程序为:95 ℃预变性5 min;95 ℃ 40 s,55 ℃ 30 s,72 ℃ 20 s,30个循环;72 ℃ 10 min。PCR产物以15 g/L琼脂糖凝胶电泳检测。
1.2.7 数据分析 采用SPSS26.0软件对数据进行Fisher's精确检验,以P<0.05 表示差异显著; 鸡胚死亡率=死亡鸡胚数/各感染组鸡胚数,使用GraphPad Prism 8.0绘制图表。
2 结果
2.1 不同Mo对GTEC的黏附
不同Mo黏附GTEC结果见图1,阴性对照和空白对照无荧光,其余Mo黏附GTEC有明显的荧光,说明6株Mo均能黏附GTEC,其中XJ15的黏附力高于其他Mo分离株。
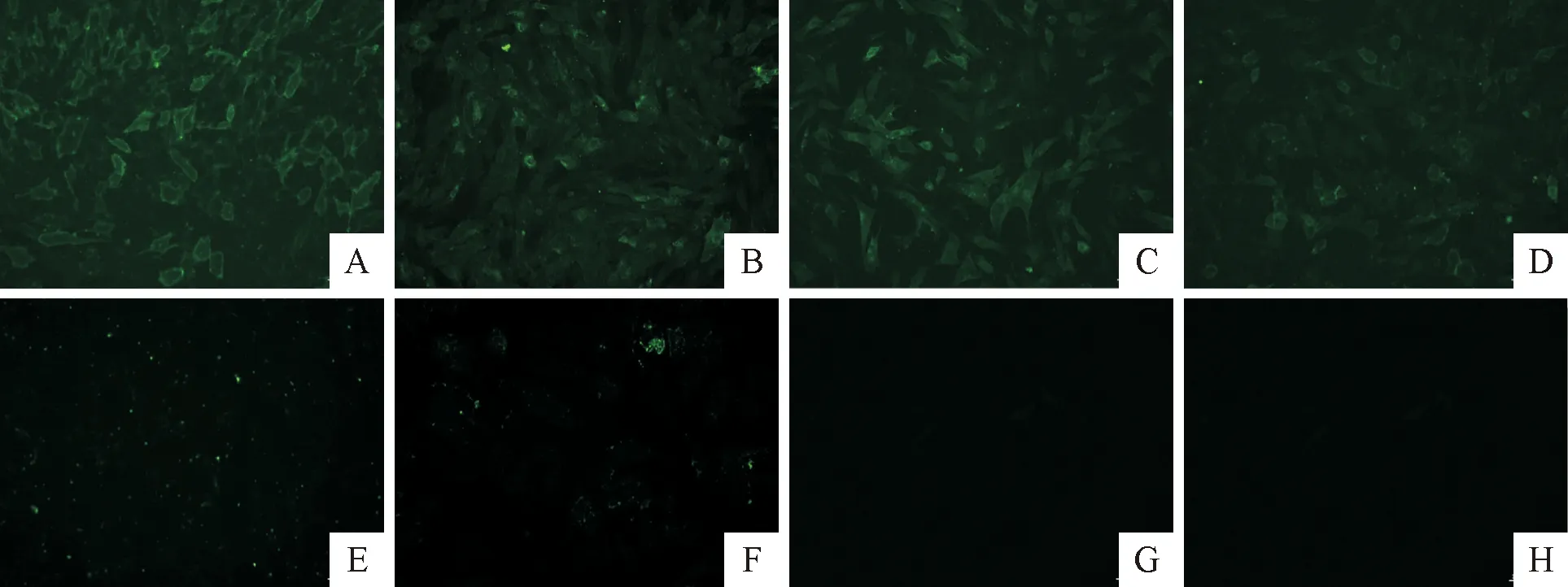
A.XJ15;B.XJ13;C.XJ22;D.Y98;E.1412;F.XJN;G.阴性对照;H.空白对照A.XJ15;B.XJ13;C.XJ22;D.Y98;E.1412;F.XJN;G.Negative control;H.Blank control图1 不同Mo对GTEC的黏附作用Fig.1 The adhesion of different Mo to GTEC
2.2 不同Mo对鸡胚的感染
死亡鸡胚剖检结果表明,生理盐水和空白对照鸡胚胚体粉嫩,无明显变化。Mo感染组鸡胚胚体呈血红色,有典型的充血和出血现象。其中XJ15、XJ13、XJ22组胚体充血情况严重,1412、XJN组胚体各处有出血点,充血情况较轻。
2.3 不同Mo感染组鸡胚卵黄囊液和死亡率以及死亡数比较
取各感染组卵黄囊液进行PCR检测,结果均为阳性。各组死亡率不同,其中死亡率高的是XJ15组, 1412和XJN组死亡率较低。各感染组鸡胚死亡数差异显著(P<0.05),其中XJ15组鸡胚死亡数与XJ22组差异不显著,但显著高于其他Mo感染组死亡鸡胚数(表1)。

表1 鸡胚感染试验结果Table 1 Results of chicken embryo infection test
2.4 不同Mo感染组生存曲线
各个Mo感染组鸡胚生存曲线结果表明,Mo感染鸡胚后,鸡胚死亡发生在1周内,鸡胚感染Mo 8天后不再出现死亡,6组Mo感染组中, XJ15株感染组存活率最低,1412、XJN株感染组存活率最高。
2.5 尿囊液Mo检测
将死亡鸡胚尿囊液短暂离心取上清,用细菌基因组DNA提取试剂盒提取Mo DNA,进行PCR检测。结果表明,尿囊液样品均为阳性,在258 bp处出现特异性条带,与预期大小一致(图2、3)。

M.DNA标准DL 2 000;1.阴性对照;2.阳性对照;3~11.XJ15组尿囊液样品;12~17.XJ22组尿囊液样品M.DNA marker DL 2 000;1.Negative control;2.Positive control;3-11.Allantoic fluid samples of XJ15 group;12-17.Allantoic fluid samples of XJ22 group图2 鸡胚尿囊液PCR结果Fig.2 PCR result of allantoic fluid

M.DNA标准DL 2 000;1.阴性对照;2.阳性对照;3~5.XJ13组尿囊液样品;6~9.Y98组尿囊液样品;10~13.1412、XJN组尿囊液样品M.DNA Marker DL 2 000;1.Negative control;2.Positive control;3-5.Allantoic fluid samples of XJ13 group;6-9.Allantoic fluid samples of Y98 group;10-13.Allantoic fluid samples of 1412,XJN group图3 鸡胚尿囊液PCR结果Fig.3 PCR result of allantoic fluid
3 讨论
支原体是最小、能够自我复制的细菌细胞,其通过黏附到上皮细胞纤毛而定植呼吸道上皮,引起宿主病理损伤[14]。同样的,Mo常定植于暴露在污染空气的绵羊呼吸道上皮细胞中,是引起绵羊原发性非典型肺炎的主要病原体[15-16]。Mo黏附并定植羊气管上皮细胞后,可通过细胞外凋亡信号调节激酶介导的线粒体途径引起宿主细胞的凋亡和氧化损伤[17]。与Mo黏附性相关的表面荚膜多糖,也被证明能够引起羊体Toll样受体(Toll-like receptors,TLRs)介导的细胞炎症反应[18]。因此,Mo黏附能力可能是其致病性的主要因素。
蔡亚婷[19]利用IFA技术,证明了人工感染山羊支原体山羊肺炎亚种(Mycoplasmacapricolumsubsp.capripneumoniae,Mccp)后获得的山羊血清能阻断Mccp黏附GTEC。李明霞等[20]为研究不同毒力牛支原体对宿主细胞的黏附差异,建立了相应的IFA。Mo不仅感染山羊,还可以感染绵羊,本试验通过IFA,以6株Mo和GETC为对象,筛选黏附力强的Mo,结果表明6株支原体均能黏附GETC,但黏附力有强弱差异,其中XJ15株黏附力最好。车巧林利用IFA技术,发现不同毒力猪肺炎支原体(Mycoplasmahyopneumoniae,Mhp)均能黏附宿主细胞,这一结果和本研究一致[21]。Mo作为致病性病原体,不易感染小鼠和雏鸡[22],直接使用试验羊进行Mo毒力筛选,不仅财力耗费高,实验时间长 ,而且Mo感染效果可能不明显[23]。鸡胚是支原体常见的人工感染对象,范媛用6株不同牛支原体分离株感染鸡胚,筛选了毒力较强的牛支原体[24]。隋兆峰等通过对SPF鸡胚人工感染鸡毒支原体,比较了不同鸡毒支原体的致病力强弱[25]。袁婷将3株Mo接种鸡胚,从接种方式、接种剂量、接种浓度进行了筛选,成功构建了Mo人工感染SPF鸡胚模型[12]。本研究采用Mo人工感染SPF鸡胚来对6株Mo进行致病力筛选,对各个Mo感染组的卵黄囊液进行PCR检测,结果均为阳性,这说明成功将Mo接种到SPF鸡胚的卵黄囊中,人工感染完成。有研究表明,鸡胚的尿囊膜可储存代谢产物,孵化过程中排出的代谢产物积聚在尿囊液中[26]。对死亡鸡胚的尿囊液进行Mo PCR检测,均有特异性条带,这表明Mo在鸡胚中发生了增殖。鸡胚的死亡发生在接种Mo后一周内,随着鸡胚日龄增加,死亡数减少,可能是因为鸡胚的胚体逐渐发育完整,对Mo的抵抗力增加。吴翠兰用不同牛支原体分离株感染鸡胚,发现感染后死亡鸡胚胚体有充血和出血,且不同分离株之间鸡胚致死率不同[27]。本研究鸡胚致死率最高的是XJ15株,致死率最低的是1412和XJN株,国际标准株Y98致死率为40%,可能是因为Mo经过了实验室的多次传代,毒力发生了减弱,这也是Rohana P D等[4]未能重复诱导持续的Mo发病的原因。接种Mo的死亡鸡胚胚体表面有出血和充血现象,这一结果与前人的结果一致。虽然Mo对宿主细胞的黏附力和感染组鸡胚致死率的高低,在一定程度上反应Mo本身毒力的大小,但决定Mo致病力的因素还有待进一步研究。本研究通过IFA和实验室人工感染鸡胚实验,初步筛选出一株毒力较强的Mo分离株,为后期疾病预防疫苗和治疗药物的研发奠定了基础。
