鸡胚营养组合物对衰老大鼠基因损伤修复的影响
2020-09-10祁昱白丽民马佳潘岳刘兵贾莉
祁昱 白丽民 马佳 潘岳 刘兵 贾莉


摘要:目的:观察鸡胚营养组合物对衰老大鼠基因损伤修复的影响,探讨其延缓衰老的可能机制。方法:采用D半乳糖建立衰老SD大鼠动物模型,每日1次颈背部皮下注射 D半乳糖500mg/(kg·d),连续造模90天,对照组颈背部皮下注射等剂量的生理盐水注射液。从第1天起,鸡胚营养组合物组、鸡胚组、营养组合物组、蛋清组,分别以相应剂量对大鼠进行灌胃,每天1次,直至第90天,拉颈处死大鼠。取各组大鼠肝脏、骨髓和脑组织,采用RTPCR法檢测各组织修复基因的表达情况。结果:与衰老模型组相比,鸡胚营养组合物组衰老大鼠肝脏和骨髓组织中错配修复基因MSH2表达量升高(P<005);鸡胚营养组合物组衰老大鼠肝脏组织中同源重组修复基因Xrcc1、Xrcc2、骨髓中同源重组修复基因Rad51以及脑组织中同源重组修复基因Rad51、Xrcc1表达量升高(P<005)。结论:鸡胚营养组合物能够修复衰老大鼠肝脏、骨髓和脑组织基因的损伤,此可能为其延缓衰老的作用机制之一。
关键词:衰老;鸡胚;营养组合物;修复基因
研究表明,氨基酸、核苷酸、维生素等营养物质有助于基因的复制以及损伤基因的自主修复[12]。鸡胚蛋含有大量生物活性物质[3]。因此,本研究采用D半乳糖建立衰老动物模型,探讨鸡胚营养组合物对衰老大鼠基因损伤修复系统的影响,为鸡胚营养组合物对延缓衰老的临床治疗提供科学依据。
1材料与方法
11材料
实验动物:SD大鼠60只,由大连医科大学实验动物中心提供(SYXK 20130006)。营养组合物:由大连金斧公司提供,由赖氨酸、色氨酸、精氨酸、甘氨酸、牛磺酸、核苷酸、维生素C、维生素D、维生素B12、叶酸、钙、铁、锌、硒等52种物质组成,按原方比率配方,经水煎、超声、浓缩,配制成口服液,分装备用。
主要试剂及仪器:D半乳糖(美国Sigma公司)、PCR仪(BIORAD)、凝胶成像分析仪(美国UVP公司AUTO MULTICHEMI)。
12大鼠衰老模型的建立
50只SD大鼠每日颈背部皮下注射D半乳糖500mg/kg,连续注射90天。正常对照组10只SD大鼠每日颈背部皮下注射等剂量的生理盐水。每日称重,并调整造模用药的剂量。
13实验分组及流程
60只SD大鼠随机分为6个组:①正常对照组,10只大鼠,每日1次颈背部皮下注射500mg/(kg·d)的生理盐水,②衰老模型组,10只大鼠,每日1次注射D半乳糖500mg/(kg·d),连续造模90d;③鸡胚营养组合物组,10只大鼠,建模的同时以鸡胚(用量同鸡胚组)和营养组合物混合物进行灌胃;④鸡胚组,10只大鼠,建模的同时选取第3天胚龄的鸡蛋,每个鸡蛋取3mL鸡胚液,以1mL鸡胚液对大鼠进行灌胃;⑤营养组合物组,10只大鼠,建模的同时,1~15天以0381 6g/d 对大鼠进行灌胃,16~30天以0763 2g/d 对大鼠进行灌胃,30~90天以1144 8g/d对大鼠进行灌胃;⑥蛋清组,10只大鼠,建模的同时选取未受精的鸡蛋,每个鸡蛋取3mL蛋清,以1mL蛋清液对大鼠进行灌胃(由于鸡胚组、营养组合物组皆含有氨基酸类,因此特设蛋清组)。直至第90天,颈椎脱臼处死大鼠,每组留取大鼠肝脏组织,骨髓以及脑组织进行RTPCR检测。
14RTPCR
141Trizol法提取总RNA取大鼠肝脏、骨髓和脑组织各100mg,加入1mL Trizol,室温静置5min;加入02mL氯仿,4℃,12 000g离心15min;加入等体积异丙醇,混匀,;弃上清,加入1mL预冷的75%乙醇, 充分洗涤沉淀, 4℃,7 500g离心5min;加入10μL DEPC水;紫外分光光度计测定A260和A280,以检测RNA含量和纯度。
142RTPCR分析反转录体系20μL,包含样品RNA 1μL,按照TaKaRa的反转录试剂盒提供的说明书进行操作。反转录反应条件为:65℃ 1min,30℃ 5min,65℃ 15min,98℃ 5min,5℃ 5min。PCR反应体系50μL,包含反转录液10μL。PCR反应条件:94℃预变性1min;97℃变性20s,64℃退火20s, 72℃ 20s延伸,循环30次;72℃延伸5min,4℃恒定。取5μL PCR扩增产物经1%琼脂糖凝胶电泳,紫外灯下凝胶成像。引物见附表。
15统计学分析
数据以均数±标准差表示,采用SPSS 170统计学软件进行分析,P<005为有统计学意义。
2结果与分析
21鸡胚营养组合物对衰老大鼠错配修复基因的影响
图1A显示,在肝脏组织中,与正常对照组大鼠错配修复基因MSH2(075±008)相比,衰老模型组MSH2表达量(036±002)下降(P<005);与衰老模型组相比,鸡胚组和营养组合物组MSH2表达量均升高 (P<005),但其表达量均低于鸡胚营养组合物组(057±005),蛋清组大鼠MSH2表达量无明显变化(P>005);而错配修复基因PMS2、MLH1、MSH3在肝脏组织中无明显变化(P>005)。图1B显示,在骨髓组织中,与正常对照组大鼠MSH2(046±007)相比,衰老模型组MSH2表达量(020±004)下降(P<005);与衰老模型组相比,鸡胚组和营养组合物组大鼠MSH2表达量升高(P<005),但其表达量仍低于鸡胚营养组合物组(043±006),蛋清组大鼠MSH2表达量无明显变化(P>005);而错配修复基因PMS2、MLH1、MSH3在骨髓组织中无明显变化(P>005)。图1C显示,在脑组织中,各组错配修复基因无明显变化(P>005)。
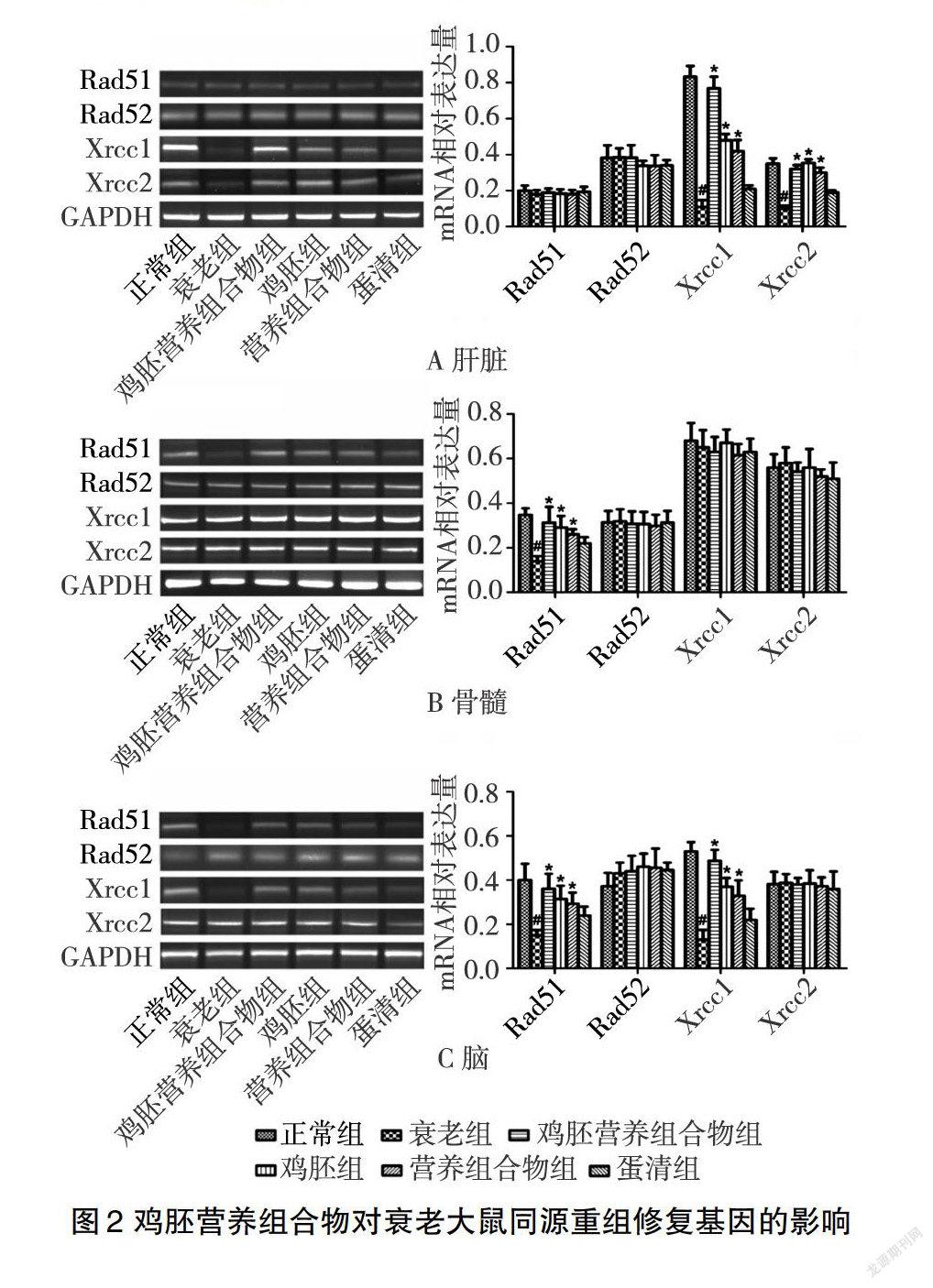
22鸡胚营养组合物对衰老大鼠同源重组修复基因的影响
图2A显示,在肝脏组织中,与正常对照组中大鼠同源重组修复基因Xrcc1(082±006)和Xrcc2(038±003)相比,衰老模型组中Xrcc1(017±004)、Xrcc2(015±002)表达量均降低(P<005);与衰老模型组相比,鸡胚和营养组合物处理衰老大鼠后,Xrcc1、Xrcc2表达量均升高(P<005),但鸡胚营养组合物组中Xrcc1(077±007)、Xrcc2(036±002)表达量最高,而蛋清组大鼠Xrcc1、Xrcc2表达量无明显变化(P>005);而重组修复基因Rad51、Rad52在肝脏组织中无明显变化(P>005)。
图2B显示,在骨髓中,与正常对照组中大鼠同源重组修复基因Rad51(035±003)相比,衰老模型组Rad51(014±002)表达量下调(P<005);与衰老模型组相比,蛋清组Rad51表达量无明显变化(P>005),鸡胚营养组合物组、鸡胚组、营养组合物组中大鼠Rad51表达量均上调(P<005),但鸡胚营养组合物组大鼠Rad51(031±007)表达量最高;而重组修复基因Rad52、Xrcc1、Xrcc2在骨髓中均无明显变化(P>005)。
图2C显示,在脑组织中,与正常对照组中大鼠同源重组修复基因Rad51(040±007)和Xrcc1(056±006)的相比,衰老模型组Rad51(015±002)、Xrcc1(015±005)表达量均降低(P<005);鸡胚和营养组合物处理衰老大鼠后,Rad51、Xrcc1表达量均增高(P<005),但鸡胚营养组合物组中Rad51(036±007)、Xrcc1(047±007)表达量最高;与衰老模型组相比,蛋清组大鼠Rad51、Xrcc1表达量均无明显变化(P>005);而重组修复基因Rad52、Xrcc2在脑组织中无明显变化(P>005)。
3讨论
探讨鸡胚营养组合物调节修复损伤DNA的能力对于延缓衰老,预防老年性疾病方面具有重要的临床应用[45]。
有文献证实,错配修复基因MSH2缺失会造成微卫星不稳定,从而加速衰老[67]。本研究显示,鸡胚营养组合物可以有效恢复衰老大鼠肝脏和骨髓组织中MSH2的表达量,这表明鸡胚营养组合物能够修复机体因衰老造成的错配修复基因缺失。本研究显示,鸡胚营养组合物可以有效恢复衰老大鼠肝脏、骨髓和脑组织中Rad51的表达水平,表明鸡胚营养组合物可以在一定程度上延缓细胞衰老。进一步研究显示,同源重组修复基因Xrcc1的部分丢失会导致小鼠脑损伤增加,小鼠缺血性中风恢复能力降低[8]。我们的研究结果同样证实了鸡胚营养组合物促进衰老大鼠肝脏及脑中Xrcc1的表达,进而对衰老大鼠同源重组修复基因的损伤具有恢复作用。
综上所述,鸡胚营养组合物可以有效提高衰老大鼠DNA损伤修复能力,为其应用于临床延缓衰老的治疗提供了科学依据。◇
参考文献
[1]Ou HL, Schumacher B DNA damage responses and p53 in the aging process [J] Blood,2018,131(5): 488495
[2]苗小艳,贾莉,杨佩满营养组合物对再生障碍性贫血小鼠肝干细胞的影响[J]中国老年学杂志,2015,35(13):35363538
[3]李曦 鸡胚蛋对免疫力低下小鼠的免疫调节功能研究[D]江南大学,2012
[4]Bonnet A E, Marchalant Y Potential Therapeutical Contributions of the Endocannabinoid System towards Aging and Alzheimers Disease [J] Aging and Disease,2015, 6(5): 400405
[5]Chatterjee N,Walker GC Mechanisms of DNA damage, repair, and mutagenesis[J] Environ Mol Mutagen,2017,58(5): 235263
[6]Li Z,et al DNA mismatch repair and the DNA damage response[J] DNA Repair (Amst),2016(38):94101
[7]李勇,金梅花,全吉淑,等錯配修复蛋白MSH2和MSH6在衰老SD大鼠组织中的表达及其意义[J]延边大学医学学报,2010,33(4):249250
[8]Ghosh S, Canugovi C, Yoon JS, ,et al Partial loss of the DNA repair scaffolding protein, Xrcc1, results in increased brain damage and reduced recovery from ischemic stroke in mice[J] Neurobiol Aging,2015, 36(7): 23192330
