白藜芦醇对Gc-1 spg细胞氧化应激损伤的作用研究*
2023-10-21石拴霞阎一鑫宋诚王纪田何毅刚王玲
石拴霞, 阎一鑫, 宋诚, 王纪田, 何毅刚, 王玲
(1.甘肃中医药大学第一临床医学院, 甘肃 兰州 730000; 2.中国人民解放军联勤保障部队第九四〇医院 生殖医学中心, 甘肃 兰州 730050; 3.中国人民解放军联勤保障部队第九四〇医院 甘肃省干细胞与基因药物重点实验室, 甘肃 兰州 730050)
有研究表明,男性不育可能是未来亚健康的先兆[1]。精原细胞是精子的前体细胞,能自我增殖和分化,具有独特的减数分裂能力,能将遗传物质减半,产生单形精子,将遗传物质传递给下一代[2],在男性生育中发挥重要作用。氧化应激(oxidative stress, OS)是过量活性氧(reactive oxygen species, ROS)堆积的结果,也是导致男性不育和生殖细胞损伤的主要病理机制[3]。线粒体作为精子活动力的主要能量产生者,易受到过量ROS 攻击,造成细胞功能障碍及凋亡,影响精子活力,导致不育[4]。白藜芦醇(Resveratrol, RES)是一种天然非黄酮类多酚化合物,广泛分布于葡萄、花生、虎杖、桑葚等药用植物中,具有抗凋亡、抗癌、抗炎、抗氧化、抗衰老、调节血脂等作用[5]。目前,已有RES 用于多种抗氧化损伤的研究报道,但在男性生殖细胞中的研究较少。因此,本研究采用过氧化氢H2O2诱导的Gc-1 spg 细胞构建氧化损伤模型,观察RES 对Gc-1 spg 细胞OS 损伤的作用。
1 材料与方法
1.1 细胞和试剂
小鼠精原细胞Gc-1 spg 细胞株、DMEM 购自上海语纯生物科技有限公司,0.25%胰酶、10%胎牛血清、1%青链霉素购自塞维尔生物科技公司,白藜芦醇购自陕西嘉果肽生物工程有限公司,3%过氧化氢H2O2购自上海信裕生物科技有限公司,CCK-8细胞活性检测试剂盒、线粒体膜电位检测试剂盒(JC-1)、Hoechst 细胞核凋亡染色试剂盒、RIPA 裂解液购自碧云天生物技术有限公司,Mito Tracker®Green FM 线粒体绿色荧光探针试剂盒购自美国Cell Signaling Technology 公司,超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde,MDA)、乳酸脱氢酶(lactate dehydrogenase, LDH)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)测定试剂盒购自南京建成生物工程研究所,BCA 蛋白浓度测定试剂盒购自北京索莱宝生物科技有限公司,兔抗Bcl-2、兔抗Bax、兔抗Caspase-3 多克隆抗体均购自博士德生物工程有限公司,β-tubulin购自武汉塞维尔生物有限公司。
1.2 方法
1.2.2 H2O2构建Gc-1 spg细胞OS损伤模型 取对数生长期的Gc-1 spg 细胞,0.25%胰酶消化2 min,培养基终止消化后反复吹打,制成细胞悬液,使细胞数达5×103个/L,将细胞均匀接种于96 孔板,每孔100 µL,待细胞贴壁后加入含H2O2(0、50、100、200、400、600、800 和1 000 µmol/L)的新鲜培养基,每组5 个复孔,置于37 ℃ 5%二氧化碳培养箱继续培养4、6、8 和10 h 后弃旧培养基,所有组均加入含10%CCK-8 的完全培养基100 µL,继续孵育30~60 min,酶标仪检测450 nm 波长处细胞活力。细胞活力(%)=(实验组-空白组)/(对照组-空白组)×100%,空白组只加CCK-8 的完全培养基,0 µmol/L 为对照组,实验组为不同浓度的H2O2。
1.2.3 不同浓度RES 组Gc-1 spg 细胞活力检测按1.2.2 中的方法接种细胞,待细胞贴壁后加入含RES(0、5、10、15、20 和30 µmol/L)的新鲜培养基,每组5 个复孔,置于37 ℃ 5%二氧化碳培养箱继续培养24 h 后弃去旧培养基,各组均加入含有10%CCK-8 的完全培养基100 µL,继续孵育30~60 min,酶标仪检测450 nm 波长处细胞活力。细胞活力(%)=(实验组-空白组)/(对照组-空白组)×100%,空白组只加CCK-8 的完全培养基,0 µmol/L 为对照组,实验组为不同浓度的RES。
1.2.4 H2O2+不同浓度RES组Gc-1 spg细胞活力检测按1.2.2 中的方法接种细胞,待细胞贴壁后加入含RES(0、5、10 和15 µmol/L)的新鲜培养基预处理24 h,每组5 个复孔,24 h 后弃旧培养基,除空白组外其余各组均加入含800 µmol/L H2O2的新鲜培养基继续培养6 h,所有组均加入含有10% CCK-8 的完全培养基100 µL,继续孵育30~60 min,酶标仪检测450 nm 波长处细胞活力。细胞活力(%)=(实验组-空白组)/(对照组-空白组)×100%,空白组只加CCK-8 的完全培养基,0 µmol/L 为对照组,实验组为H2O2+不同浓度的RES。
1.2.5 细胞氧化应激指标测定 取对数生长期的Gc-1 spg 细胞,制成细胞悬液,使细胞数达2×105,将细胞均匀接种于6 孔板,每孔2 mL,待细胞贴壁后加入含RES(0、5、10 和15 µmol/L)的新鲜培养基预处理24 h 后弃去旧培养液,除空白组外其余各组均加入含800 µmol/L H2O2的新鲜培养基继续培养6 h后弃旧培养基,磷酸盐缓冲液(phosphate buffer saline, PBS)洗涤3 次,细胞刮收集细胞不少于106/mL,1 000 r/min 离心10 min,弃上清液,加入1 mL预冷的PBS 匀浆器匀浆,采用试剂盒测定SOD、MDA、LDH、GSH-Px 水平。
1.2.6 细胞线粒体膜电位测定 根据样本按照JC-1 试剂盒配制染色工作液和缓冲液,配好的缓冲液放于-20 ℃冰箱冷冻备用;前期实验处理同1.2.5,后弃旧培养基,PBS 洗涤3次,加入配好的JC-1 染色工作液和完全培养基各1 mL,充分混匀,细胞培养箱孵育30 min,结束后弃去培养液,JC-1 染色缓冲液(1×)洗涤1 次,加入2 mL PBS,荧光显微镜下观察并拍照。Image J 软件进行荧光定量并计算红/绿荧光比值。
1.2.7 细胞线粒体测定 根据样本按照Mito Tracker®Green FM 试剂盒配制染色工作液,配好后放入37 ℃温箱预温备用;前期实验处理同1.2.5,后弃旧培养基,PBS 洗涤3次,加入配好的Mito Tracker®Green FM 染色工作液1 mL,细胞培养箱孵育30 min,结束后弃去工作液,加入预温的完全培养基1 mL,荧光显微镜下观察并拍照。Image J 软件进行荧光定量并分析。
1.2.8 细胞核凋亡率检测 前期实验处理同1.2.5,后弃旧培养基,PBS 洗涤3次,加入Hoechst 33342染色液1 mL,细胞培养箱孵育30 min,结束后弃去染色液,PBS 洗涤2 次,荧光显微镜下观察并拍照,手动计数,计算细胞核凋亡率。凋亡率=(凋亡细胞数/总细胞数)×100%。
1.2.9 Western blotting 检测凋亡蛋白表达 前期实验处理同1.2.5,后弃旧培养基,冰冷PBS 洗2 次,吸水纸吸干残余PBS,加入配好的蛋白裂解液冰上裂解40 min,4 ℃ 12 000 r/min 离心10 min,提取上清液,按照BCA 试剂盒检测蛋白浓度,计算上样量,按照样本总体积加4 × 蛋白上样缓冲液(样本总体积/4),100 ℃沸水煮样15 min,-80 ℃冰箱备用。按照目标蛋白分子量制胶,加样(按之前算好的上样量),经过SDS-PAGE 电泳,免疫印迹转膜,牛奶封闭、洗膜、一抗孵育,洗膜、二抗孵育,洗膜、化学发光成像。Image J 软件分析凋亡蛋白Bax、Caspase-3、Bcl-2 条带灰度值计算蛋白相对表达量,β-tubulin 为内参蛋白。
螺纹紧固件是将汽车的部件连接起来的装置,是汽车维修技术人员接触最多的零件,现代汽车中使用了数百种紧固件。常见的紧固件如图1所示,拧紧螺栓时在螺栓上引起的力如图2所示,作用在被紧固件上的力为夹紧力。常用螺纹标准是米(公)制螺纹,少部分从美国、英国来的进口车可能用寸制螺纹(UNC,UNF),此外车上部分传感器和螺塞还使用圆柱管螺纹和圆锥管螺纹。
1.3 统计学方法
数据分析采用SPSS 21 和GraphPad Prism 8 统计软件。计量资料以均数±标准差(±s)表示,比较采用单因素方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 H2O2对Gc-1 spg细胞活力的影响
0、50、100 、200、400、600、800 和1 000 µmol/L H2O2处理Gc-1 spg 细胞4、6、8 和10 h 后的细胞活力比较,采用重复测量设计的方差分析,结果:①不同时间点的细胞活力有差异(F=100.066,P=0.000);②不同浓度H2O2组的细胞活力有差异(F=539.136,P=0.000);③不同时间点不同浓度H2O2组细胞活力的变化趋势有差异(F=8.853,P=0.000)。与0 µmol/L H2O2组比较,4、6、8 和10 h 时,100、200、400、600、800 和1 000 µmol/L H2O2组细胞活力降低(P<0.05);8 和10 h 时,800 和1 000 µmol/L H2O2组细胞活力明显降低,细胞损伤较重(P<0.05);6 h 时,800 µmol/L H2O2组细胞活力为(51.51±5.46)%,细胞活力明显下降,既达到了损伤状态,又存在一定细胞活力,符合细胞实验研究条件(见图1 和表1)。因此,本研究采用800 µmol/L H2O2处理Gc-1 spg 细胞6 h 构建Gc-1 spg 细胞OS 损伤模型,设为H2O2组。
表1 不同浓度H2O2组细胞活力的比较 (%, ±s)

表1 不同浓度H2O2组细胞活力的比较 (%, ±s)
注 : †与0 µmol/L H2O2组比较,P <0.05。
组别0 µmol/L H2O2组50 µmol/L H2O2组100 µmol/L H2O2组200 µmol/L H2O2组400 µmol/L H2O2组600 µmol/L H2O2组800 µmol/L H2O2组1 000 µmol/L H2O2组4 h 101.14±1.06 100.41±1.25 96.12±1.04†94.89±0.43†86.98±2.34†74.46±3.98†72.31±2.74†62.66±2.29†6 h 100.49±1.88 99.54±1.69 95.94±1.91†88.99±4.80†84.91±3.15†71.83±3.24†51.51±5.46†47.54±4.77†8 h 99.82±3.02 98.49±3.26 93.11±4.90†87.59±2.77†75.69±2.90†66.81±1.10†43.26±7.81†35.04±1.63†10 h 95.59±3.60 91.39±2.55 88.97±0.92†86.19±1.87†73.91±3.46†62.04±3.47†33.56±3.80†32.75±2.85†
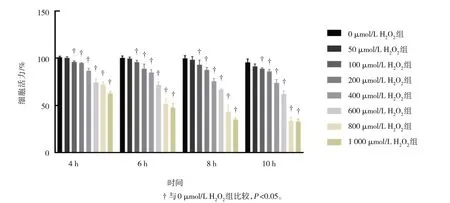
图1 不同时间点不同浓度H2O2对Gc-1 spg细胞活力的影响 (±s)
2.2 RES对Gc-1 spg细胞活力的影响
0、5、10 、15、20、30 µmol/L RES 处理Gc-1 spg 细胞24 h 后的细胞活力比较,差异无统计学意义(P>0.05)。与0 µmol/L RES 组比较,20、30 µmol/L RES 对Gc-1 spg 细胞活力影响较大(见图2 和表2)。因此,本研究采用低于20 µmol/L的RES进行后续实验。
表2 不同浓度RES组细胞活力的比较 (%,±s)
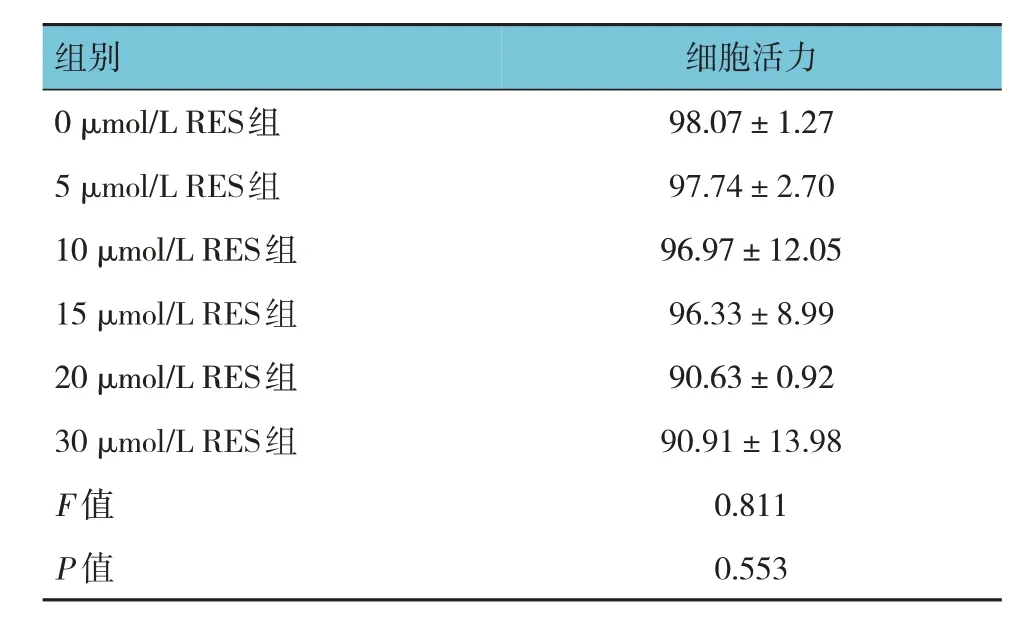
表2 不同浓度RES组细胞活力的比较 (%,±s)
组别0 µmol/L RES组5 µmol/L RES组10 µmol/L RES组15 µmol/L RES组20 µmol/L RES组30 µmol/L RES组F 值P 值细胞活力98.07±1.27 97.74±2.70 96.97±12.05 96.33±8.99 90.63±0.92 90.91±13.98 0.811 0.553
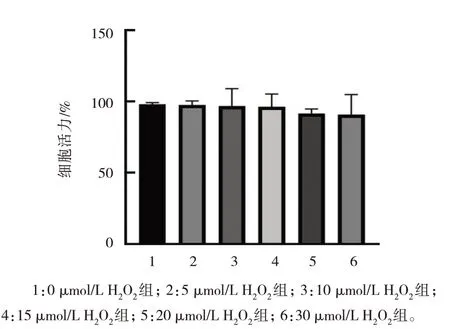
图2 不同浓度RES对Gc-1 spg细胞活力的影响 (±s)
2.3 RES对H2O2处理的Gc-1 spg细胞的保护作用
空白组、H2O2组、H2O2+不同浓度RES 组的细胞活力比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,与空白组比较,各H2O2组细胞活力降低(P<0.05),H2O2处理Gc-1 spg 细胞6 h后细胞活力显著下降;与H2O2组比较,H2O2+5 µmol/L RES 组、H2O2+10 µmol/L RES 组、H2O2+15 µmol/L RES 组细胞活力升高(P<0.05),RES 预处理24 h 后能逆转H2O2引起的细胞活力下降,且与RES 浓度有关。见图3 和表3。
表3 各组细胞活力比较 (%, ±s)

表3 各组细胞活力比较 (%, ±s)
注 : ①与空白组比较,P<0.05; ②与H2O2组比较,P<0.05。
组别空白组H2O2组H2O2+5 µmol/L RES组H2O2+10 µmol/L RES组H2O2+15 µmol/L RES组F 值P 值细胞活力96.71±3.90 56.93±2.40①77.62±4.06②81.90±5.56②84.03±8.98②28.004 0.000

图3 RES对H2O2处理的Gc-1 spg细胞活力的影响(±s)
2.4 RES 对H2O2处理的Gc-1 spg 细胞氧化应激指标的影响
空白组、H2O2组、H2O2+不同浓度RES 组的SOD、MDA、GSH-Px、LDH 水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较,与空白组比较,各H2O2组的GSH-Px 和SOD 水平降低(P<0.05),LDH 和MDA 水平升高(P<0.05),H2O2处理Gc-1 spg 细胞6 h 后能明显降低细胞的GSH-Px 和SOD 水平,并增加细胞的LDH 和MDA 水平,说明OS损伤模型复制成功;与H2O2组比较,H2O2+5 µmol/L RES 组、H2O2+10 µmol/L RES 组、H2O2+15 µmol/L RES组GSH-Px 和SOD 水平降低(P<0.05),LDH 和MDA水平升高(P<0.05),RES 预处理能明显逆转H2O2引起的Gc-1 spg 细胞GSH-Px 和SOD 下降和LDH 和MDA 升高,呈浓度依赖性。见图4 和表4。
表4 各组氧化应激指标比较 (±s)

表4 各组氧化应激指标比较 (±s)
注 : ①与空白组比较,P <0.05; ②与H2O2组比较,P <0.05。
?
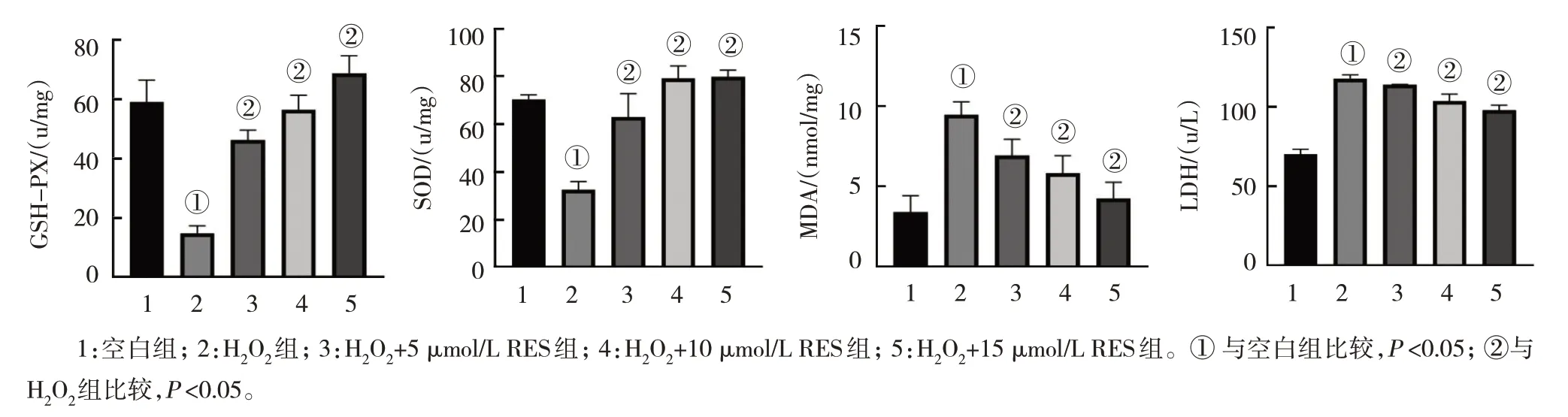
图4 RES对H2O2处理的Gc-1 spg细胞氧化应激指标的影响 (±s)
2.5 RES 对H2O2处理的Gc-1 spg 细胞线粒体膜电位的影响
空白组、H2O2组、H2O2+不同浓度RES 组的JC-1红/绿荧光比值比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,与空白组比较,H2O2组细胞的JC-1 不能聚集在线粒体基质中,表现为JC-1 单体(绿色荧光)、红/绿荧光比值降低,提示线粒体膜电位明显降低(P<0.05),标志着Gc-1 spg 细胞发生早期凋亡;与H2O2组比较,H2O2+5 µmol/L RES 组、H2O2+10 µmol/L RES 组、H2O2+15 µmol/L RES组JC-1 红/绿荧光比值升高(P<0.05),RES 预处理后能够显著提高细胞线粒体膜电位,说明RES 对OS损伤导致的Gc-1 spg 细胞线粒体膜电位具有明显保护作用,呈浓度依赖性。见图5 和表5。
表5 各组JC-1红/绿荧光比值比较 (±s)

表5 各组JC-1红/绿荧光比值比较 (±s)
注 : ①与空白组比较,P <0.05; ②与H2O2组比较,P <0.05。
组别空白组H2O2组H2O2 + 5 µmol/L RES组H2O2 +10 µmol/L RES组H2O2 +15 µmol/L RES组F 值P 值红/绿荧光比值2.48±0.22 0.85±0.05①1.15±0.06②1.64±0.20②1.88±0.10②54.550 0.000
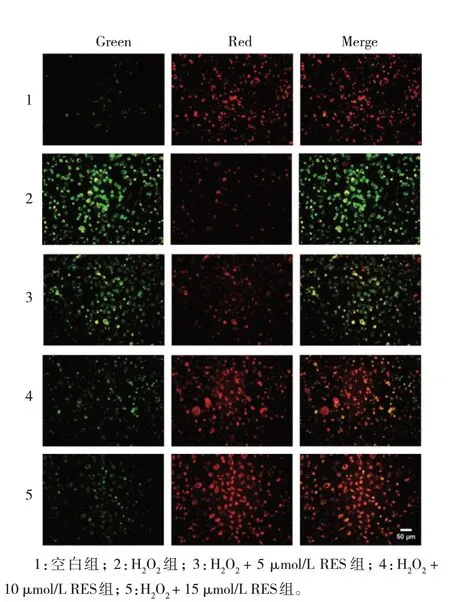
图5 RES对H2O2处理的Gc-1 spg细胞线粒体膜电位的影响 (线粒体膜电位JC-1 染色×10)
2.6 RES 对H2O2处理的Gc-1 spg 细胞线粒体的影响
空白组、H2O2组、H2O2+不同浓度RES 组的线粒体荧光强度比较,经方差分析,差异有统计学意义(P<0.05);与空白组比较,H2O2组细胞线粒体数明显减少(P<0.05),这表明细胞内线粒体产生的ATP可能减少;与H2O2组比较,H2O2+ 5 µmol/L RES 组、H2O2+10 µmol/L RES 组、H2O2+15 µmol/L RES 组细胞荧光强度升高(P<0.05),RES 预处理显著增加了细胞线粒体数,说明RES 能够降低OS 损伤导致的Gc-1 spg 细胞线粒体损伤程度,呈浓度依赖性。见图6 和表6。
表6 各组线粒体荧光强度的比较 (±s)

表6 各组线粒体荧光强度的比较 (±s)
注 : ①与Control组比较,P <0.05; ②与H2O2组比较,P <0.05。
组别空白组H2O2组H2O2 + 5 µmol/L RES组H2O2 + 10 µmol/L RES组H2O2 + 15 µmol/L RES组F 值P 值荧光强度103.95±1.53 84.64±2.96①105.90±1.34②124.70±3.69②145.82±3.40②211.077 0.000
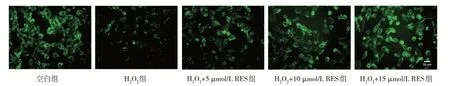
图6 RES对H2O2处理的Gc-1 spg细胞线粒体的影响 (Mito Tracker® Green FM 试剂盒配制染色×20)
2.7 RES对H2O2处理的Gc-1 spg细胞凋亡的影响
空白组、H2O2组、H2O2+不同浓度RES 组的细胞凋亡率比较,经方差分析,差异有统计学意义(P<0.05);与空白组比较,H2O2组大量细胞核皱缩、碎裂,染色程度明显增强(见图7),表明细胞凋亡严重;与H2O2组比较,H2O2+ 5 µmol/L RES 组、H2O2+10 µmol/L RES 组、H2O2+15 µmol/L RES 组细胞凋亡率降低(P<0.05),随着RES 浓度增加,细胞凋亡率降低,说明RES 能够降低OS 损伤导致的Gc-1 spg 细胞凋亡率。见表7。
表7 各组细胞凋亡率比较 (%,±s)
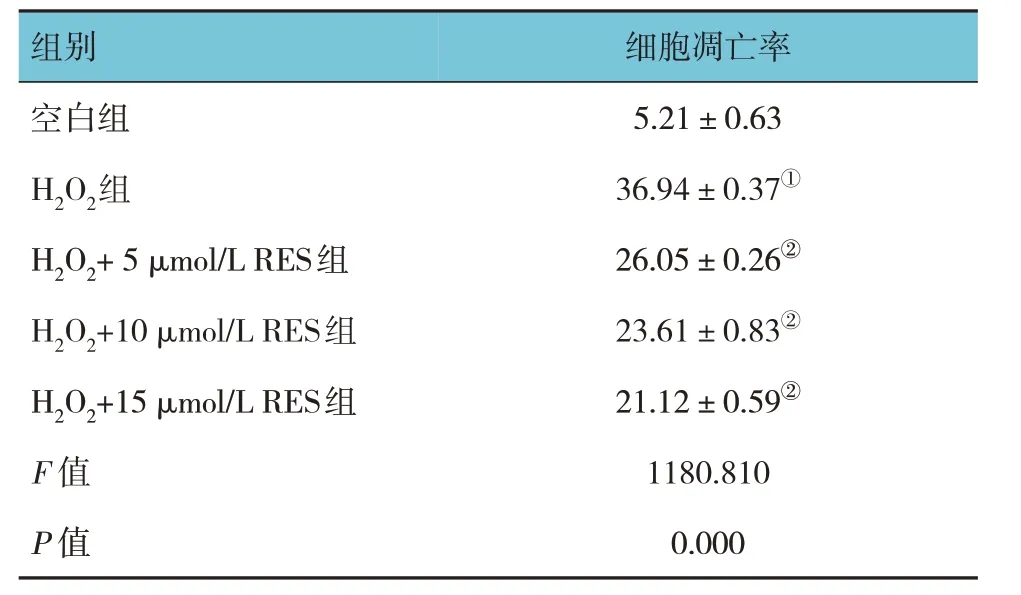
表7 各组细胞凋亡率比较 (%,±s)
注 : ①与空白组比较,P <0.05; ②与H2O2组比较,P <0.05。
组别空白组H2O2组H2O2+ 5 µmol/L RES组H2O2+10 µmol/L RES组H2O2+15 µmol/L RES组F 值P 值细胞凋亡率5.21±0.63 36.94±0.37①26.05±0.26②23.61±0.83②21.12±0.59②1180.810 0.000

图7 RES对H2O2处理的Gc-1 spg细胞凋亡的影响 (Hoechst 33342染色×10)
2.8 RES 对H2O2处理的Gc-1 spg 细胞凋亡蛋白的影响
空白组、H2O2组、H2O2+不同浓度RES 组的凋亡蛋白Bax、Caspase-3、Bcl-2 相对表达量比较,经方差分析,差异有统计学意义(P<0.05);与空白组比较,H2O2组凋亡蛋白Bax 和Caspase-3 相对表达量均增加(P<0.05),Bcl-2 相对表达量减少(P<0.05);与H2O2组比较,H2O2+ 5 µmol/L RES 组、H2O2+10 µmol/L RES 组、H2O2+15 µmol/L RES 组Bax 和Caspase-3 相对表达量降低(P<0.05),Bcl-2 相对表达量增加(P<0.05),说明RES 在Gc-1 spg 细胞OS 损伤中有明显的抗凋亡作用,且呈浓度依赖性。见图8 和表8。
表8 各组凋亡蛋白Bax、Caspase-3、Bcl-2相对表达量比较 (±s)

表8 各组凋亡蛋白Bax、Caspase-3、Bcl-2相对表达量比较 (±s)
注 : ①与空白组比较,P <0.05; ②与H2O2组比较,P <0.05。
组别空白组H2O2组H2O2+5 µmol/L RES组H2O2+10 µmol/L RES组H2O2+15 µmol/L RES组F值P值Bax 1.02±0.02 2.12±0.11①1.36±0.04②1.30±0.06②1.25±0.01②133.796 0.000 Caspase-3 1.01±0.01 2.57±0.03①2.14±0.02②1.90±0.01②1.70±0.00②5427.006 0.000 Bcl-2 1.10±0.00 0.25±0.02①0.30±0.03 0.81±0.08②1.34±0.01②372.422 0.000
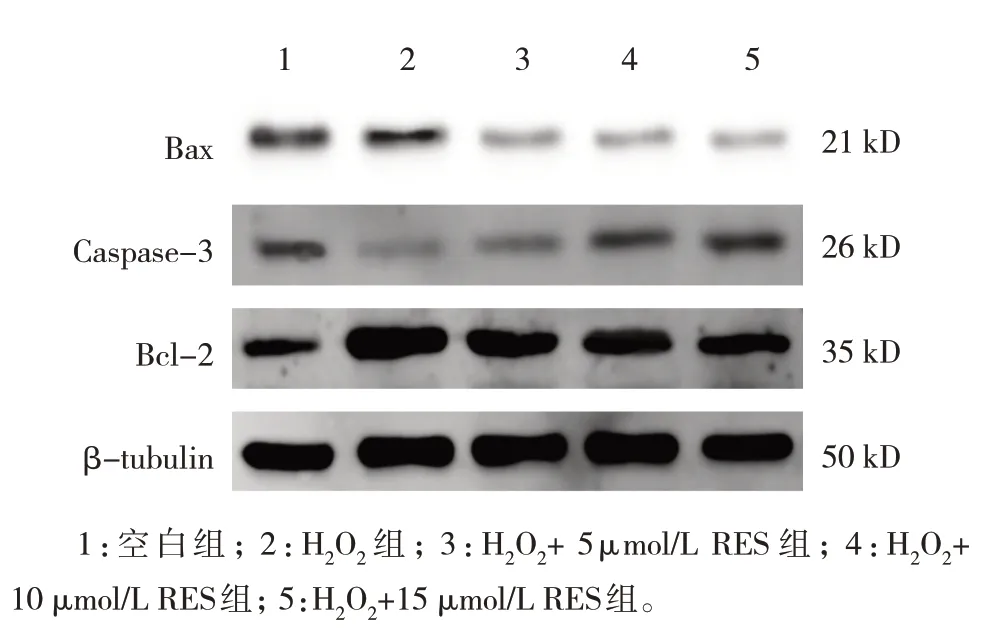
图8 RES对H2O2处理的Gc-1 spg细胞凋亡蛋白的影响
3 讨论
精子发生过程需要一个相对稳定的氧化环境来维持生殖细胞发育和分化,这是精子能够正常受精的前提[6]。位于生精上皮基底层的精原细胞是精子的前体细胞,容易受到OS 损伤,过量ROS 及抗氧化防御水平降低会导致生殖细胞OS 损伤和凋亡[7],进而引发不育。H2O2可引起细胞OS 损伤的情况不同。董晓蕾等[8]用600 µmol/L H2O2处理Gc-1 spg 细胞24 h复制OS 损伤细胞模型,李美和等[9]用300 µmol/L H2O2处理人胎盘滋养层细胞3 h 复制OS 损伤细胞模型。本研究用800 µmol/L H2O2处理Gc-1 spg 细胞6 h复制细胞OS 模型,能较好地体现RES 的保护作用,这与既往研究存在差异,可能和作用时间不同有关。SOD 和GSH-Px 是细胞内重要的抗氧化酶,能够反映机体氧化还原平衡状态。LDH 是一种糖酵解酶,当细胞膜发生损伤时,LDH 从细胞内漏出;MDA 是细胞脂质过氧化反应的产物,可加重细胞膜损伤,两者均反应细胞膜系统的损伤程度。精子在附睾成熟过程中,暴露于大量氧化应激源,这些氧化应激源被附睾上皮积极分泌的一系列附睾抗氧化分子抵消,包括过氧化物酶、GSH-Px 和硫氧还蛋白,以及精子膜上特别是顶体、顶体后区域和鞭毛上的SOD 等,其共同促进ROS 产生和减少或清除之间的平衡,以允许正常受精[10]。因此,在精子发生过程中,维持抗氧化酶活性在男性正常受精和妊娠中至关重要。
降低生殖细胞OS 反应可有效增强生殖细胞活力。RES 是植物多酚类化合物中抗氧化能力最强的物质之一,具有清除氧自由基、抑制脂质过氧化、调节相关酶活性及基因表达等作用[11],但不同细胞对其的耐受存在差异。有研究表明,10 µmol/L 以上浓度RES 会对人永生化表皮细胞活性产生影响[12],50 µmol/L 浓度RES 对H2O2导致的精子细胞OS 损伤保护作用最佳[13]。本研究结果显示,当RES 浓度大于20 µmol/L 时对Gc-1 spg 细胞活力产生影响,故本研究采用低于20 µmol/L 以下浓度作为保护浓度。Gc-1 spg 细胞经不同浓度H2O2处理4、6、8、10 h 后均能不同程度地降低细胞活力,而5、10、15 µmol/L 浓度RES 预处理24 h 均能够抵抗H2O2导致的Gc-1 spg细胞OS 损伤,且呈浓度依赖性,这和既往研究结果一致[12]。此外,H2O2处理能够显著降低Gc-1 spg 细胞内SOD 和GSH-Px 活性并增加MDA 和LDH 水平,而RES 预处理能够不同程度地逆转上述反应,并呈浓度依赖性,表明RES 具有抗Gc-1 spg 细胞OS 损伤的能力,提示RES 可能在精子形成的任何一个过程中提高细胞抗氧化酶活性并发挥抗氧化作用,从而预防和治疗男性不育。
线粒体是精子细胞内重要的供能细胞器,通过氧化磷酸化产生超过90%的能量,在维持细胞正常的生理活动中起重要作用。OS 会损伤线粒体导致线粒体功能异常进而影响精子细胞结构和功能[14],导致男性不育,但精子也需要线粒体产生足够量的ROS 进行获能,并在精子发生和附睾成熟期间对精子染色质和鞭毛蛋白进行修饰[15]。因此,防止精子细胞线粒体损伤和恢复受损线粒体是治疗男性不育的关键。线粒体膜电位能较好地反映线粒体功能,其下降是精子细胞凋亡的早期信号。研究表明,H2O2诱导视网膜色素上皮细胞和TM3 睾丸间质细胞OS 和线粒体损伤,而RES 具有显著的保护作用[16-17]。本研究结果显示,与对照组比较,H2O2组Gc-1 spg 细胞线粒体膜电位显著下降,红/绿荧光比值显著降低,提示H2O2诱导Gc-1 spg 细胞发生早期凋亡,线粒体损伤严重,细胞能量水平显著降低。RES 预处理能明显提高Gc-1 spg 细胞线粒体膜电位,改善线粒体损伤并可能提高细胞内能量水平,这种保护作用与RES 浓度有关。线粒体染色也进一步证实了这一结果,这更能说明RES 在H2O2诱导的Gc-1 spg 细胞线粒体损伤中的保护作用。
Hoechst 33342 是一种能穿透细胞膜的染料,能够进入细胞核DNA,正常情况下呈蓝色,当细胞发生凋亡时,膜通透性增强,染色体DNA 发生改变,染料大量进入,细胞核呈现亮蓝色。本研究结果显示,H2O2处理的Gc-1 spg 细胞出现大量的细胞核凋亡,而RES 低、中、高浓度组中细胞核凋亡率随药物浓度的增大逐渐减小,表明RES 能够改善H2O2诱导的细胞核凋亡。Bax 和Bcl-2 是调节线粒体功能及线粒体膜对细胞色素C 通透性的重要分子,前者能够形成同源二聚体并定位于线粒体膜,增加线粒体膜对细胞色素C 的通透性,进入胞质的细胞色素C 能够激活Caspase-3 并诱导细胞凋亡,后者能够与Bax形成异源二聚体并抑制Bax 的促凋亡作用[18]。研究表明,50 µmol/L 浓度RES 可增强卵泡颗粒细胞的抗氧化及抗凋亡能力,改善卵泡颗粒细胞功能并提高妊娠率[19]。本研究表明,H2O2处理能显著增加细胞Bax、Caspase-3 表达并抑制Bcl-2 表达水平,而RES预处理后细胞中Bcl-2 的表达显著增高,Bax、Caspase-3 的表达显著降低,且该效果与RES 浓度存在密切关联,进一步表明RES 能够抑制H2O2诱导的Gc-1 spg 细胞凋亡。
综上所述,H2O2处理能降低Gc-1 spg 细胞活力,并诱导细胞OS 损伤及凋亡,降低细胞的抗氧化能力和线粒体膜电位,损伤线粒体增加细胞凋亡率,这将会影响精子发生过程,损伤精子细胞并降低精子活力,进而导致男性不育。一定浓度的RES 能够保护H2O2诱导的Gc-1 spg 细胞OS 损伤,提高生殖细胞活力,有望成为抗生殖损伤新药。后续将进一步研究RES 在H2O2诱导的Gc-1 spg 细胞OS 损伤保护作用中的分子机制,为临床治疗生殖细胞OS 及线粒体损伤相关疾病提供理论依据。
