鳞翅目昆虫性别决定机制研究进展
2023-10-16刘万学吕志创郭建洋杨念婉
万 倩, 刘万学, 吕志创, 郭建洋, 黄 聪, 严 盈, 杨念婉,3*
(1. 中国农业科学院植物保护研究所,植物病虫害综合治理全国重点实验室,北京 100193;2. 德国吉森大学昆虫生物技术研究所,植物保护昆虫生物技术系,吉森 35394;3. 中国农业科学院西部农业研究中心,昌吉 831100)
自然界中,生物的性别决定机制复杂多样,大体可分为遗传性别决定(genotypic sex determination, GSD)和环境性别决定(environmental sex determination, ESD)两大类[1]。昆虫作为动物界中最大的一个类群,其性别决定机制一直是研究热点。对不同昆虫性别决定通路和关键基因功能的探究,既能揭示昆虫物种分化的关系,也能为基于基因编辑技术的昆虫不育技术(sterile insect technique, SIT)提供理论和实践基础[2]。昆虫的性别决定机制复杂多样,性别决定关键基因对个体雌雄性别分化的调控表现为级联反应。主要的表达模式为早期胚胎中性别决定初始信号调控关键靶基因进行雌雄差异性表达,关键靶基因表达产物在其他因子的帮助下作用于级联反应底层的双性基因doublesex(dsx),使dsx产生雌雄特异性剪接产物,从而调控下游雌雄性别偏向基因的表达,最终实现昆虫的性别分化;而缺乏性别决定初始信号的则为默认的表达模式,最后个体呈现出与之相反的性别分化[3]。
鳞翅目Lepidoptera是昆虫纲Insecta中仅次于鞘翅目Coleoptera的第二大目,包括蛾类和蝶类。鳞翅目昆虫大多为植食性,许多成虫能传粉,在生态系统中发挥着重要作用;一些物种还在人类社会生产中发挥着经济价值,如家蚕Bombyxmori和柞蚕Antheraeapernyi的应用推动了丝绸业的发展。也有不少鳞翅目昆虫为农业重大害虫,如草地贪夜蛾Spodopterafrugiperda、苹果蠹蛾Cydiapomonella、棉铃虫Helicoverpaarmigera、草地螟Loxostegesticticalis等。鳞翅目昆虫繁殖方式以两性生殖为主,不同于哺乳动物以及其他昆虫的XY/XX性染色体系统,鳞翅目大多为ZW/ZZ系统,雌性为染色体异配型即ZW型,雄性为ZZ型[4]。因此,鳞翅目昆虫所特有的W染色体使其性别决定机制不同于其他昆虫。在ZW/ZZ系统中,位于W染色体的性别决定初始信号沉默Z染色体上的雄性化关键基因Masc,然后位于常染色体上的dsx基因被雌性特异性剪接,实现雌虫分化;而雄虫中无W染色体,Masc基因正常表达并调控dsx基因的雄性特异性剪接,促进雄性偏向基因的表达,完成雄性发育。本文对鳞翅目昆虫性别决定机制的研究以及性别决定机制在鳞翅目昆虫种群遗传调控中的应用进行综述,以期为鳞翅目重要经济昆虫的性别筛选和防治有性繁殖的重大害虫的种群遗传防控技术提供理论基础。
1 鳞翅目昆虫性染色体研究进展
鳞翅目昆虫性染色体系统多为ZW/ZZ型,雌性为ZW型,雄性为ZZ型(表1)[5-23]。少部分缺失W染色体,雌性表现为Z0型,雄性ZZ型,归为Z0/ZZ系统,如蓑蛾科Psychidae的Proutiabetulina、Taleporiatubulosa和Diplodomalaichartingella的雌虫均缺失W染色体[16]。还有部分鳞翅目昆虫表现出截然不同的性染色体系统,如小蔗杆草螟Diatraeasaccharalis雌虫减数分裂产生了三价体WZ1Z2,雄虫则表现为Z1Z1Z2Z2[18]。在小粉蝶属Leptidea中还发现了W1-3Z1-3/Z1-3Z1-3、W1-3Z1-4/Z1-4Z1-4和W1-3Z1-6/Z1-6Z1-6等性染色体系统的存在[5-6]。
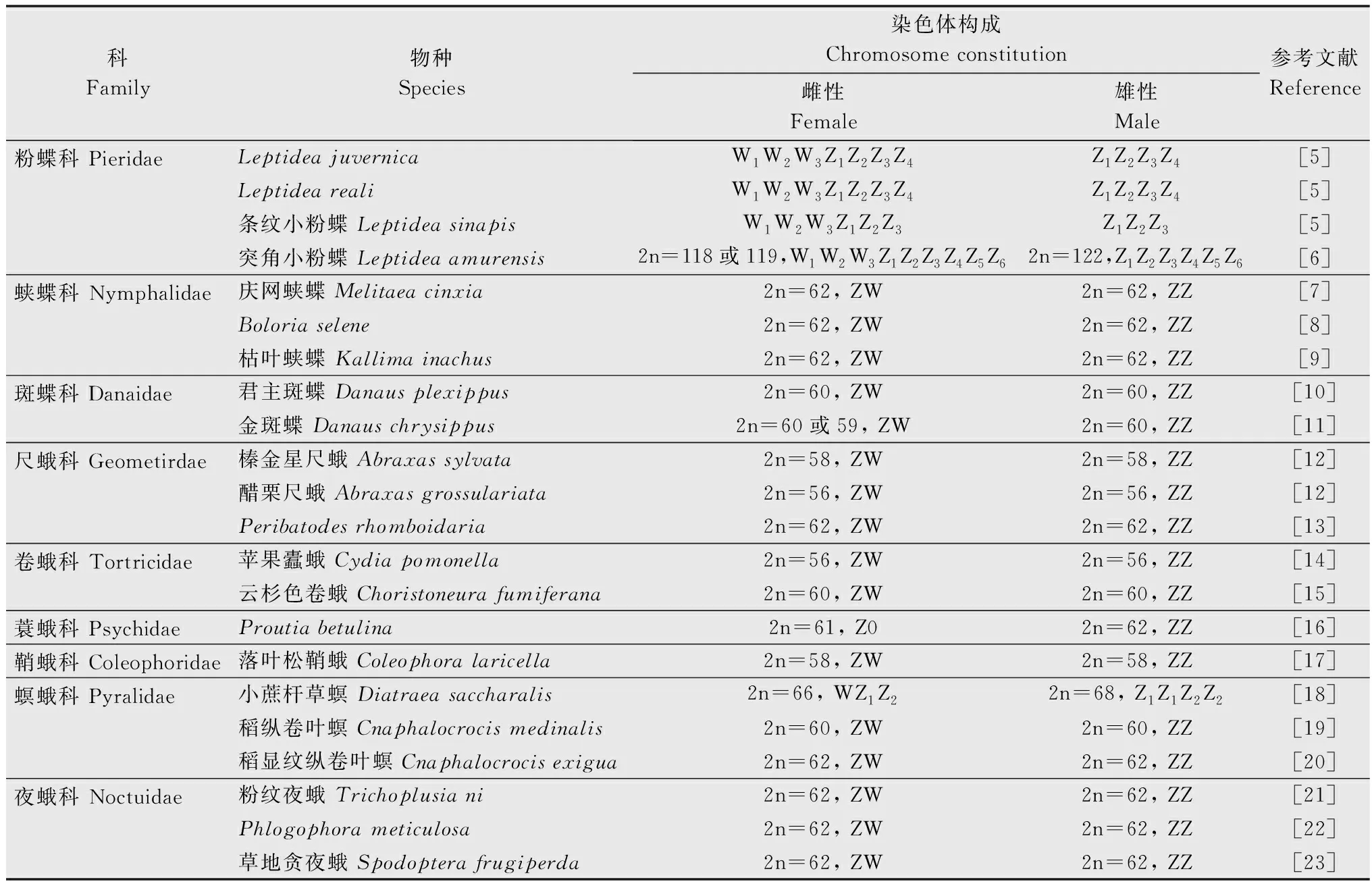
表1 鳞翅目昆虫性染色体研究进展Table 1 Research progress on sex chromosomes in lepidopteran insects
一般认为鳞翅目ZW/ZZ系统是从古老的Z0/ZZ系统中演化而来。对鳞翅目和毛翅目进行系统发育分析发现,雌性异配型性别染色体系统至少存在1.8亿年,而W染色体约0.9亿~1亿年前才出现,存在于更为高级的物种中,且正在快速进化,Z染色体则较为保守[4,24-26]。最初对W染色体上基因的研究发现,W染色体存在很多雌性特异的重复序列,未发现能编码蛋白质的基因。如利用W染色体来源的细菌人工染色体(W chromosome-derived bacterial artificial chromosome,W-BAC)作为探针进行基因组原位杂交(genomic in situ hybridization,GISH),或利用高通量测序技术等对家蚕、地中海粉螟Ephestiakuehniella、苹果蠹蛾W染色体进行研究,发现W染色体上存在大量的功能性转座元件(transposable elements, TEs)和其他重复序列[14,27-28]。近年来,随着对鳞翅目染色体研究的深入,陆续在一些鳞翅目昆虫W染色体上发现了能编码蛋白的基因,如Deng等[29]在棉铃虫中发现了第一个鳞翅目昆虫W染色体上特异性编码蛋白的基因GUW1。在水稻常发害虫稻纵卷叶螟Cnaphalocrocismedinalis的W染色体上则发现了755个编码蛋白的基因,但只有5%是能鉴定的蛋白[19]。
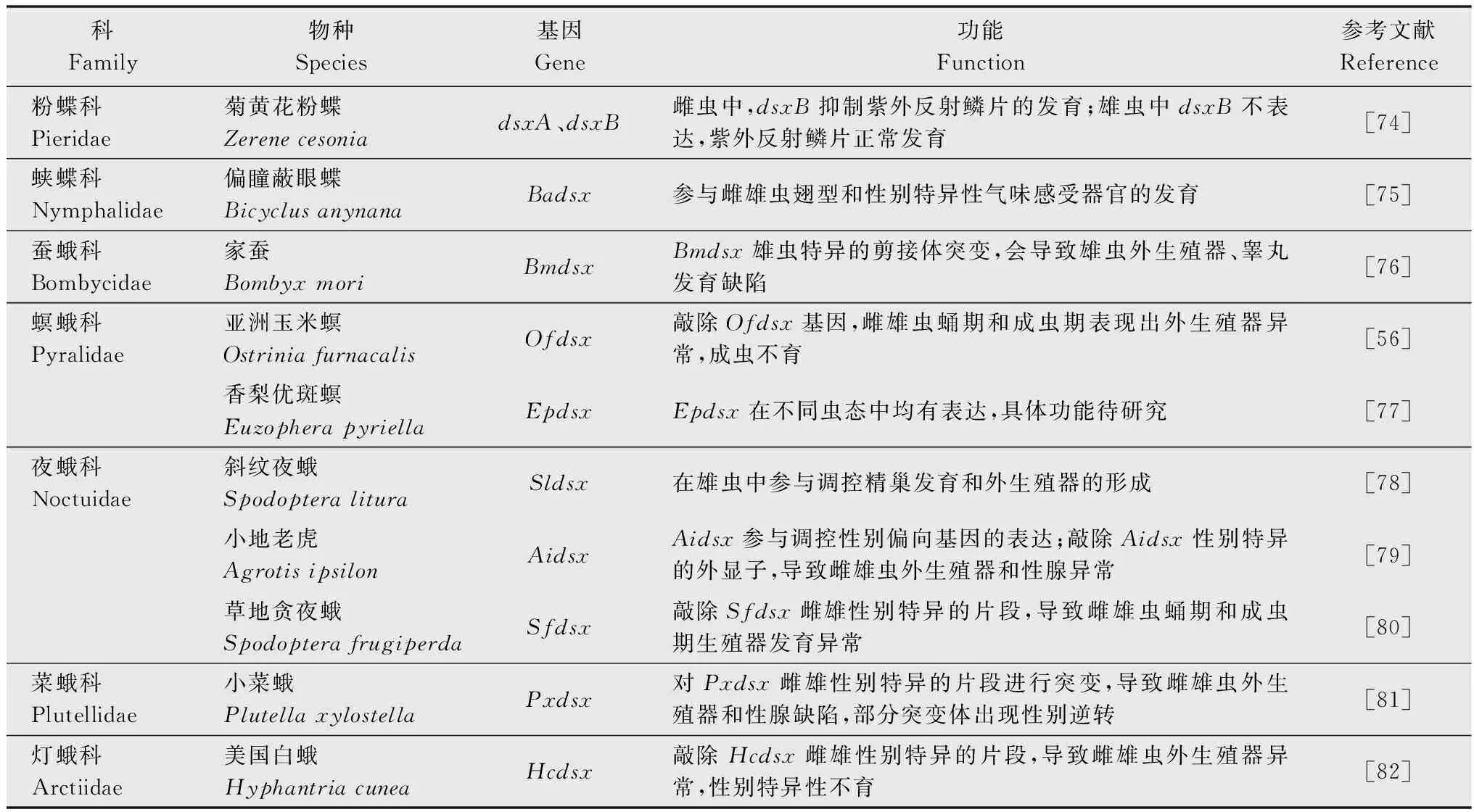
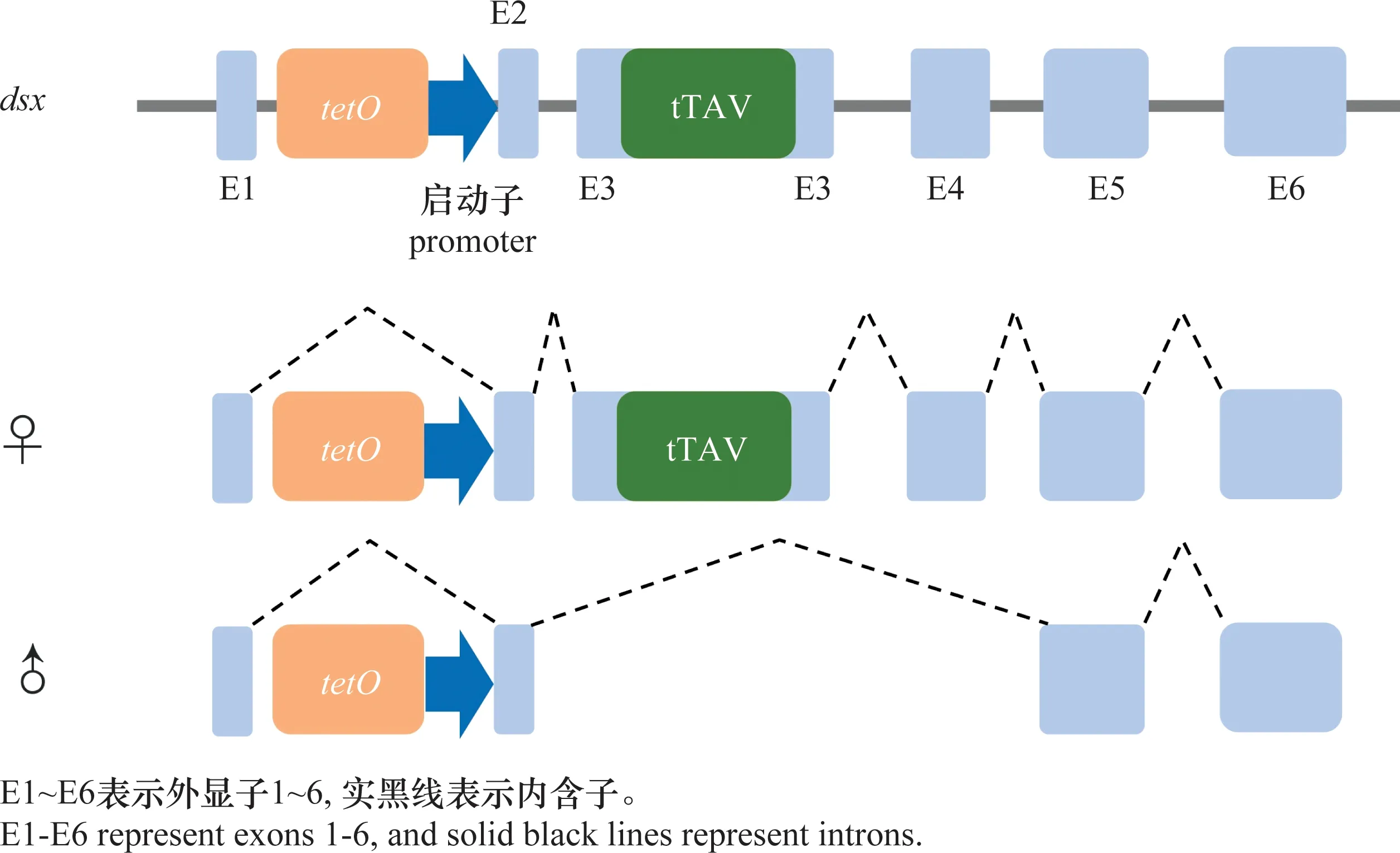
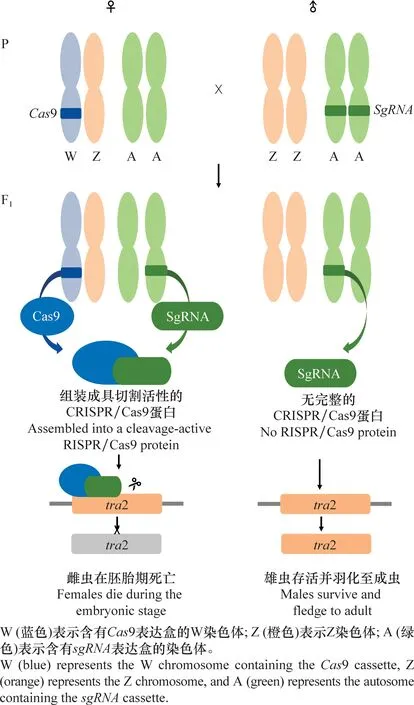
不同于W染色体,鳞翅目昆虫Z染色体上富含能编码蛋白质的基因,如家蚕的Z染色体上有编码肌动蛋白的基因[30]。同时,Z染色体上还有与雄性分化有关的基因,如条纹小粉蝶LeptideasinapisZ染色体上富集了大量雄性偏向表达的基因[31]。在烟草天蛾Manducasexta和君主斑蝶Danausplexippus的Z染色体中也发现了大量的精子蛋白基因[32]。在具有XY/XX性别决定系统的生物中,两性的X染色体数量不同,但X染色体连锁基因在2种性别中却有着相等或近乎相等的表达量,这种能平衡性染色体连锁基因的遗传效应叫做剂量补偿效应(dosage compensation)[33-34]。对鳞翅目昆虫性染色体剂量补偿的研究发现,Z染色体的剂量补偿机制在鳞翅目中普遍存在[35]。利用RNA-seq技术对苹果蠹蛾Z染色体的剂量补偿模式进行分析发现,Z染色体连锁基因在两性中的表达水平相当,且低于二倍体常染色体基因的表达水平,即Z≈ZZ 昆虫性别决定表现为级联反应。在鳞翅目昆虫ZW/ZZ性别决定系统中,位于W染色体的性别决定初始信号沉默Z染色体上的雄性化关键基因Masc,促使dsx基因形成雌性特异性剪接体,进而调控一系列雌性偏向基因的表达,实现雌虫分化;而雄虫为ZZ型,缺失W染色体上的性别决定初始信号,因此Masc基因正常表达并产生Masc蛋白,调控dsx基因形成雄性特异性剪接体,进而促进雄性分化[41-47](图1)。 在鳞翅目ZW/ZZ系统中,W染色体常与雌性的性别分化有关。利用GISH、比较基因组杂交(comparative genomic hybridization, CGH)和荧光原位杂交(fluorescence in situ hybridization, FISH)这3种方法对苹果蠹蛾3种辐射突变异常的W染色体进行详细的细胞遗传学分析,并与野生型雌虫进行比较,发现其W染色体上存在雌性决定因子的独特序列[48]。目前,鳞翅目昆虫中已鉴定出的性别决定初始信号仅有家蚕中和小菜蛾Plutellaxylostella中的Fem。在雌虫早期胚胎中,位于W染色体的Fem转录生成小沉默RNA(small silencing RNA, ssRNA),沉默雄性化基因Masc,实现雌性的性别分化。ssRNA是一类长度约20~30 nt的小RNA,能与Argonaute蛋白结合后使靶基因的表达降低,主要分为microRNA (miRNA)、small interfering RNA (siRNA) 和 Piwi-interacting RNA (piRNA)三类[49]。Fem是piRNA的前体,最终产生一个长29 nt且3′端被2′-O-甲基化修饰的piRNA。然后该FempiRNA与靶标基因Masc第9外显子上的特异性序列相互作用,沉默Masc,实现家蚕雌性的发育[43]。在小菜蛾中,Pxyfem能产生多个ssRNA,并在雌虫胚胎期对PxyMasc转录本外显子5进行剪切,以沉默PxyMasc基因的表达[50]。在与家蚕亲缘关系较近的三角斑白蚕蛾Trilochavarians中也发现了Fem的直系同源基因,但进一步研究发现FempiRNA并不参与三角斑白蚕蛾的性别决定级联反应;在与家蚕亲缘关系较远的蔗茎禾草螟Chilosacchariphagus中,则没有找到Fem的同源基因[51-52]。棉铃虫W染色体上的蛋白质编码基因GUW1可能是其主要的性别决定初始信号,能抑制雌虫中HaMasc的表达,调控雌性分化,然而该猜想还需要试验进行验证[29,53]。虽然鳞翅目昆虫的W染色体常与性别有关,但W染色体并不总是对性别决定起主导作用。如利用樗蚕蛾Samiacynthia的2个亚种S.cynthiapryeri(WZ/ZZ)和S.cynthiawalkeri(neo-Wneo-Z/neo-Zneo-Z)进行正反交试验,发现F2代中存在无W染色体和 neo-W染色体的雌虫以及携带W染色体或neo-W染色体的雄虫,进一步研究发现W染色体和neo-W染色体的存在与否对卵的孵化率并没有影响,表明W染色体对樗蚕蛾这2个亚种的性别决定和生殖能力不起作用[54]。随后通过人工合成的多倍体试验,发现樗蚕蛾的性别是由Z染色体数量与常染色体数量的比值所决定[55]。 Masc基因能调控下游基因dsx形成雄性特异性剪接体,实现雄性性别分化。Masc基因最初在家蚕Z染色体上发现,由10个外显子组成,编码一种锌指蛋白Masc,在雌虫中被FempiRNA沉默,促使Bmdsx形成雌性特异剪接体。同时还发现Masc蛋白在胚胎期会抑制雄虫Z染色体上基因的表达,具剂量补偿的作用[43]。目前,在地中海粉螟、棉铃虫、亚洲玉米螟Ostriniafurnacalis、小地老虎Agrotisipsilon、三角斑白蚕蛾、小菜蛾、斜纹夜蛾Spodopteralitura、美国白蛾Hyphantriacunea等鳞翅目昆虫中均发现了Masc蛋白,敲除Masc后,雄虫的外生殖器、精巢等出现异常,生长发育和生殖能力受到了负面影响;在部分物种的雄虫突变体中,甚至出现了胚胎或早期幼虫致死的现象(表2),表明Masc基因在雄虫正常生长发育中起着重要作用[43,51,53,56-61]。 表2 鳞翅目昆虫Masc基因研究进展Table 2 Research progresses in Masc gene in lepidopteran insects Masc蛋白由588~658个氨基酸组成,具4个典型的结构,2个串联的CCCH型锌指结构域(CCCH-type zinc finger domains, ZFs),1个核定位信号和1个高度保守的含11个氨基酸的区域[58,62-63]。目前已发现的Masc蛋白几乎都有2个串联的ZFs,但有研究表明ZFs对于鳞翅目昆虫雄性化和剂量补偿不是必须的。利用CRISPR/Cas9技术敲除家蚕Masc基因的ZFs后,发现突变后的雄性胚胎正常生长,无任何表型缺陷[62]。在对地中海粉螟的研究中发现,EkMasc和EkMascB两个基因只在雄性早期胚胎中表达,编码类似的Masc蛋白,调控Ekdsx形成雄性特异剪接体,但在这两个Masc蛋白中未发现ZFs[57]。虽然目前对ZFs的功能并不清楚,但Masc蛋白C端(210~288个氨基酸)富含脯氨酸的区域、第301和304位高度保守的2个半胱氨酸残基Cys,都是调控雄性化和剂量补偿的关键区域[57,62,64]。 不同昆虫的性别决定初始信号不同,但性别决定级联反应下游的基因dsx在双翅目、膜翅目、鞘翅目、直翅目、鳞翅目等昆虫中均有发现且保守性较高[65]。dsx基因受上游基因的调控,形成雌雄性别特异的剪接体,进一步调控下游性别偏向基因的表达,最终实现雌雄性别分化,是性别决定与性别分化的中间枢纽。dsx编码的DSX蛋白,N端一般都有一个DNA结合结构域(OD1),中间有一个蛋白寡聚结构域(OD2)以及C末端有一个性别特异的氨基酸序列[66-67]。 研究发现,黑腹果蝇雌虫中,dsx在上游基因tra/tra2的调控下形成雌性特异剪接体,促进雌性相关基因的表达,最终完成雌性的性别分化[68]。在家蚕中鉴定出了一个与黑腹果蝇dsx同源的基因Bmdsx,其受到Z染色体上Masc基因的调控。Bmdsx有6个外显子,雄性早期胚胎中,Bmdsx转录成不含外显子3和4的雄性特异BmdsxMmRNA,编码蛋白BmDSXM,激活雄虫中信息素结合蛋白(pheromone-binding protein, PBP)基因高表达,促进雄性生殖器的发育;而雌性特异BmdsxFmRNA则包含外显子3和(或)4,编码BmDSXF蛋白,正向调控雌虫中表达的卵黄蛋白原(vitellogenin,Vg)基因和雌性特异六聚体储存蛋白1(storage protein 1, Sp1)基因[69-73]。对其他鳞翅目昆虫的dsx进行研究,发现dsx都在上游基因的调控下形成性别特异的剪接体,从而促进性别偏向基因的表达,实现性别分化(表3)[56,74-82]。 表3 鳞翅目昆虫dsx基因研究进展Table 3 Research progresses in dsx gene in lepidopteran insects 目前在不少鳞翅目昆虫中都发现了dsx的可变剪接,雄虫大多只有一种剪接体,而雌虫中却有多种形式的剪接体。先后在家蚕中发现了BmdsxF1、BmdsxF2和BmdsxF3等3种雌性特异剪接体,产生的3种蛋白均能调控Vg、Sp1等在雌虫中上调表达[69,83-84]。在小地老虎和小菜蛾中,dsx分别有6种和3种雌性特异的剪接体[76,78]。但对美国白蛾的研究发现,雄蛹中至少包含了3种dsx的剪接体,不同于其他物种dsx只有一种雄性特异剪接体的情况[82]。dsx除了能通过可变剪接调控雌雄性别分化外,还发现存在基因复制调控雌雄二型的分化。如Rodriguez-Caro等[74]在菊黄花粉蝶Zerenecesonia中发现了dsx的直系同源基因dsxA及其复制产生的旁系同源基因dsxB,dsxA在雄性翅中表达,dsxB在雌性翅中表达,从而调控翅膀雌雄二型的发育。这项研究的发现,表明dsx在控制昆虫性别分化中的功能多样。 昆虫遗传调控技术是通过对昆虫的基因进行整合,让靶标基因调控昆虫的生长发育,从而导致害虫种群衰退甚至灭亡。鉴于dsx基因的保守性,目前在鳞翅目昆虫中,dsx是昆虫遗传调控中常用的可遗传性别决定靶标基因[85]。其中基于dsx可变剪接构建的昆虫不育技术(SIT)和释放携带雌性特异显性致死基因昆虫技术(female-specific release of insects carrying dominant lethal, fsRIDL),已在家蚕、斜纹夜蛾、小菜蛾等昆虫中进行研究。 SIT是指通过物理、化学处理或遗传不育获得不育雄虫,然后将大量的不育雄虫释放到野外与野生型雌虫进行交配,导致雌虫不育或产生的后代不育,从而达到减少害虫种群数量的目的。以草地贪夜蛾Sfdsx基因外显子2、4和5为靶标分别设计构建突变体,其中外显子2是雌雄虫dsx剪接体共有的区域,外显子4是dsx雌虫剪接体特有的,而外显子5是dsx雄虫剪接体所特有的(图2);让这3种突变体分别与野生型的雌雄虫配对,发现与野生型相比,这3种突变体繁殖力显著下降。野生型雌虫与雄虫突变体(即突变外显子5)交配后,其产卵量下降率达91%,卵的孵化率为0[80]。在美国白蛾中,利用dsx外显子的特异性,敲除Hcdsx外显子3和5后,分别获得了雌虫和雄虫的不育突变体(图2),发现敲除外显子3的雄虫生殖能力不受影响,让该雄虫突变体与野生型雌虫进行杂交,显示这种突变能在子代中继续遗传给下一代,且当子代雌性个体获得纯合的遗传突变时表现为不育[61]。虽然鳞翅目昆虫dsx的突变能产生雌雄性别特异的不育成虫,但还有待进行后续的田间试验。 图2 草地贪夜蛾和美国白蛾基于dsx可变剪接构建的突变位点示例图Fig.2 Constructed mutation sites based on dsx variable splicing in Spodoptera frugiperda and Hyphantria cunea fsRIDL通过将致死基因与某些能进行性别特异剪接的基因或性别特异性启动子相结合,使致死基因能在雌虫中特异性表达,而同样携带致死基因的雄虫则正常生长发育。当携带致死基因的雄虫释放到田间与野生型雌虫进行交配后,致死基因能在后代中顺利表达,并导致子代雌虫死亡,最终达到消灭害虫种群的目的[86-87]。目前,鳞翅目中常见的fsRIDL系统是基于dsx可变剪接构建的四环素调控系统(Tet-off)。Tet-off有调节元件(tTAV)和反应元件(tetO)两部分,正常情况下,tTAV与tetO相结合,增强tetO下游基因的表达,形成一个正向反馈循环系统;当四环素或四环素类似物等解毒剂存在时,解毒剂与tetO结合,tTAV的表达被抑制[86]。根据鳞翅目昆虫雌雄虫dsx的剪接形式不同,将调节元件tTAV插入雌性特异剪接体所特有的外显子3中,而反应元件tetO则插入到雌雄虫dsx剪接体所共有的外显子2中(图3)。当饲料中有解毒剂时,解毒剂与tetO结合,使得tTAV的转录停止,雌虫生长发育正常;但停止提供解毒剂时,雌虫中tTAV与tetO正常结合, tTAV蛋白不断积累造成对细胞的毒害,最终导致雌虫在幼虫期就死亡。而雄虫中dsx的可变剪接不包含调节元件tTAV,因此有无解毒剂都不会激活tetO下游基因的表达,雄虫均能正常生长发育。基于dsx可变剪接构建的fsRIDL已在棉红铃虫Pectinophoragossypiella、家蚕以及小菜蛾中成功实现[88-89]。在温室中引入Tet-off筛选出来的小菜蛾雄成虫,发现转基因雄成虫竞争野生雌蛾进行交配的能力比野生雄虫强,最终成功导致野生种群数量下降,同时发现释放该转基因雄成虫还能延缓Bt抗性在小菜蛾自然种群中的扩散,具较好的种群控制作用[90]。 图3 基于dsx基因性别特异性可变剪接与Tet-off系统相结合的fsRIDL结构示例图Fig.3 Schematic representation of fsRIDL of Tet-off system constructs based on dsx female- and male-specific variable splicing 不少研究人员在双翅目、鞘翅目和膜翅目昆虫的性别决定通路中都发现tra和tra2基因参与调控dsx基因的可变剪接,在家蚕中也发现tra2的同源基因Bmtra2参与调控Bmdsx,且敲除Bmtra2后,导致雌雄虫在胚胎期死亡[91]。基于Bmtra2基因这一性质,研究人员利用类转录激活因子效应物核酸酶(transcription activator-like effector nuclease, TALEN)技术介导同源重组,将Cas9基因转入家蚕W染色体中,构建了雌性特异表达Cas9的品系;以 PiggyBac转座子的方式将sgRNA(靶标Bmtra2)整合到雄虫染色体中,构建了雄性特异表达sgRNA的品系。2种品系杂交产生的子代中,雌虫Cas9和sgRNA同时表达时,Bmtra2被敲除,在胚胎期死亡;而雄胚胎中无Cas9的表达,成功存活(图4)[92]。这为基于基因组编辑工具对昆虫性染色体实施基因定点整合、实现蚕业早期筛选大量雄蚕以及鳞翅目害虫遗传调控技术提供了理论与实践依据。 图4 通过CRISPR/Cas9技术进行家蚕W染色体连锁靶基因整合操作示例图Fig.4 Diagram of target gene integration operation linked to the W chromosome of silkworms by CRISPR/Cas9 technology 传统的SIT有辐射不育、化学不育、胞质不亲和性染色体易位等,研究较多的是辐射不育[93]。但辐射不育的突变体常产生较大的适合度代价,竞争交配能力弱,难以持续有效地控制害虫的数量;当有新虫源加入种群,依然有大暴发的可能性,需要多次大量释放才能达到预期效果[94]。近年来,随着对昆虫性别决定机制的不断研究,性别决定途径已经并将继续成为昆虫种群调控技术的重要组成部分,对性别决定和性别分化相关基因的研究将促进SIT的发展。如对冈比亚按蚊Anophelesgambiae的dsx基因进行雌性特异的突变,导致雌性纯合突变体完全不育,但并不会影响雄虫的繁殖能力[95]。对dsx雌雄虫特异的剪接体进行基因编辑获得雌性或雄性不育的成虫,已在埃及伊蚊Aedesaegypt、橘小食蝇Bactroceradorsalis、草地贪夜蛾、美国白蛾等多种昆虫中成功应用[61,80,96-97]。除了dsx基因,还有对性别分化相关基因的研究,如利用CRISPR/Cas9技术对地中海实蝇Ceratitiscapitata的tra2基因的ts2位点进行点突变,获得的纯合tra2ts2突变体成功实现了由雌虫到雄虫的性别转换[98]。同样地,利用CRISPR/Cas9基因组编辑技术敲除斜纹夜蛾雄虫分化基因Ser2导致了雄虫不育,而雌虫生殖功能正常。将构建的雄虫不育品系与野生型雌虫进行杂交后,只有少数卵能孵化。研究者进一步检测Ser2突变体雄虫不育表型的可遗传性,发现在斜纹夜蛾中,雄性不育表型能在后代中稳定遗传[59]。除了利用CRISPR直接敲除关键基因,实现雌虫的性别逆转或雄虫不育,基于CRISPR的精确引导SIT技术(precision guided SIT, pgSIT)则通过同时破坏雄虫生殖能力和雌虫生存能力所必需的基因,确保所有存活的F1代都是不育的雄虫,以达到直接释放基因编辑过的卵就能抑制种群的效果,是一种更实用的SIT新技术[99]。该技术已在果蝇和埃及伊蚊中应用,果蝇中同时敲除βTub、sxl基因成功导致100%的雄性不育和雌性致死;埃及伊蚊中同时敲除βTub、myo-fem基因成功导致雄性不育和雌性无飞行能力,无飞行能力的雌虫存活率和繁殖力均明显降低。模拟pgSIT,基于Wolbachia的不相容昆虫技术(incompatible insect technique,IIT)、RIDL和fsRIDL技术对种群密度进行控制,发现直接释放pgSIT处理的埃及伊蚊卵抑制种群的效果最好,表现出强大的应用潜力[99-100]。目前在家蚕、香梨优斑螟Euzopherapyriella中已发现tra2的同源基因[77,101]。Ser2基因已被证实在家蚕、小菜蛾的雄性生殖和不育中发挥重要作用[102]。因此未来继续对鳞翅目dsx、tra2和Ser2等性别分化相关基因的功能进行研究,将会丰富SIT的潜在靶基因,为pgSIT等技术在鳞翅目昆虫中的应用奠定理论基础。 性别决定初始信号在不同昆虫中表现出多样性和专一性,家蚕中以Fem为雌虫分化的初始信号,果蝇以XSE的表达量作为调控性别的初始信号,意大利蜜蜂Apismellifera则以Csd基因的纯合/杂合作为信号[43,103-104]。对性别决定初始信号进行敲入或敲除,能实现雌雄虫完全的性别逆转。如Nix基因是埃及伊蚊雄虫的性别决定初始信号,研究人员构建Nix转基因雌虫品系,成功实现了雌虫100%转化为可育的雄虫,且该性别逆转获得的雄虫能继续稳定地产生后代。同时有模拟显示,释放这种含性别转化纯合基因的雄虫能实现种群的自我维持,会比SIT更有效地抑制害虫种群[105-107]。然而家蚕雄虫中表达Fem时,并未出现从雄性到雌性的性别逆转突变体,推测家蚕中可能还存在另一种主要的性别决定初始信号[108]。因此未来继续对鳞翅目性别决定初始信号进行研究,实现从雌性到雄性的完全性别逆转,或将降低实现雌雄虫分离和害虫防控的成本。2 鳞翅目昆虫性别决定机制研究进展
2.1 鳞翅目性别决定初始信号研究进展
2.2 鳞翅目昆虫Masc基因研究进展
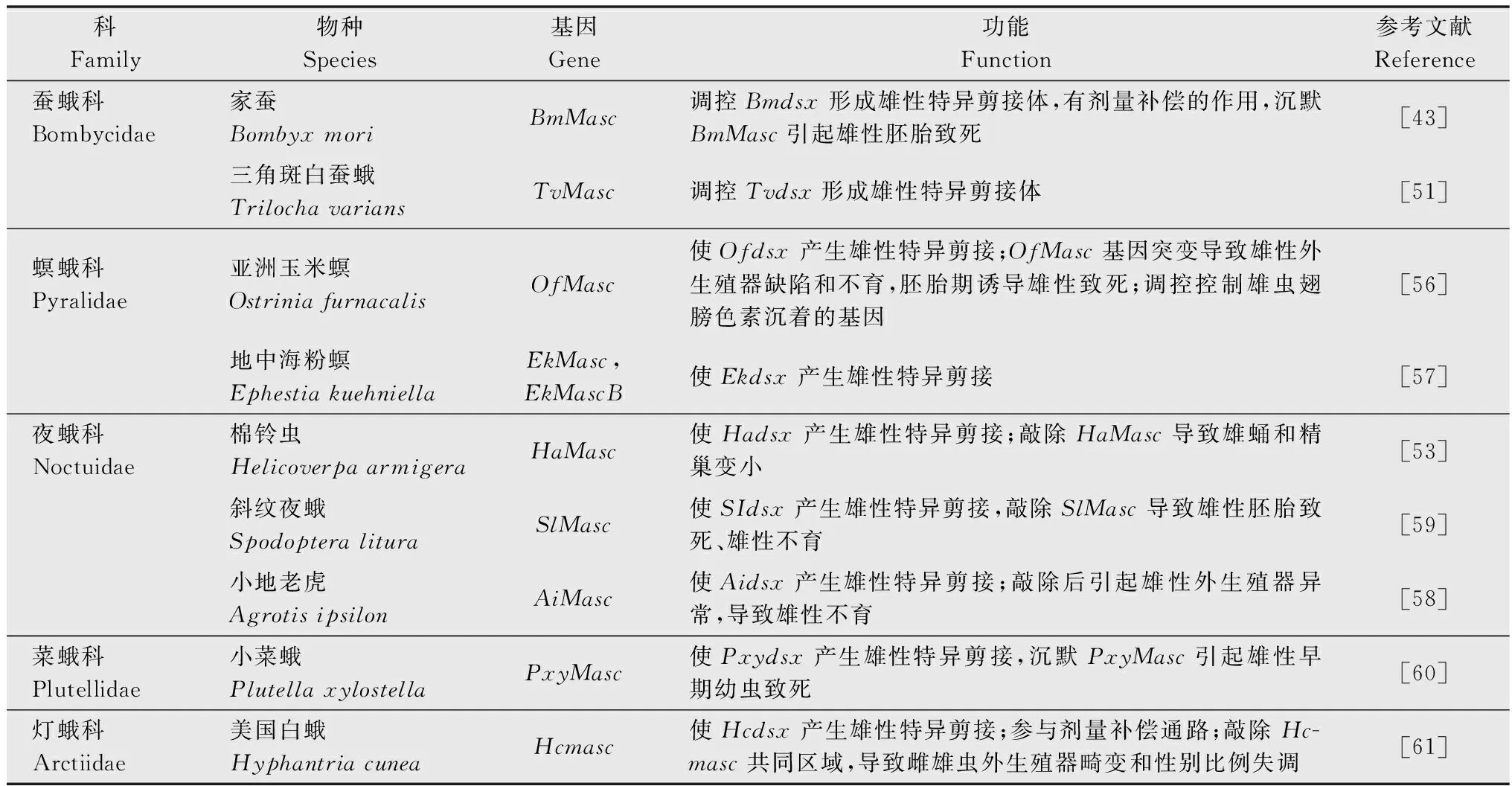
2.3 鳞翅目昆虫dsx基因研究进展
3 鳞翅目性别决定机制在昆虫遗传调控中的应用
3.1 基于dsx可变剪接构建的昆虫不育技术(SIT)研究进展
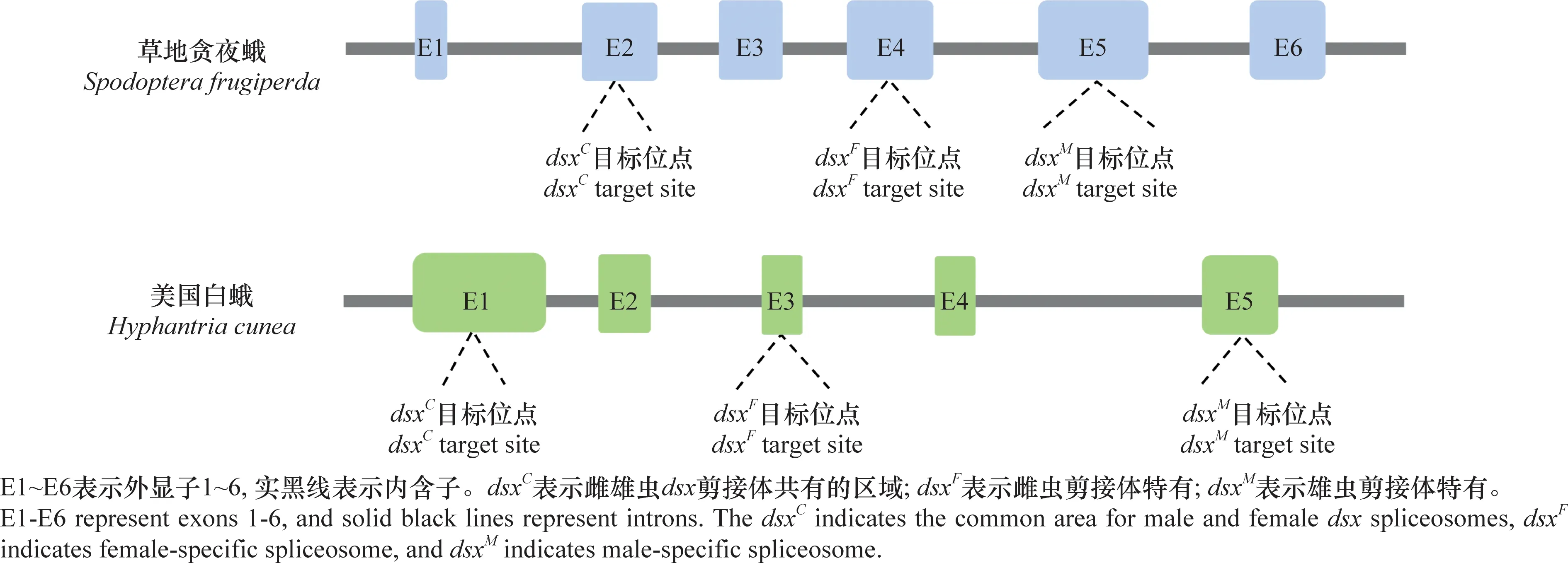
3.2 基于dsx可变剪接构建的释放携带雌性特异显性致死基因昆虫技术(fsRIDL)研究进展
3.3 其他性别相关基因在鳞翅目性别筛选中的应用
4 展望
