稻瘟病抗性分子机制及抗病育种策略研究进展
2023-10-16王如意张熠玚郑文静李爱宏宁约瑟
王如意, 刘 杰, 冯 琴, 张熠玚, 肖 宁, 吴 俊,郑文静, 李爱宏, 宁约瑟*
(1. 中国农业科学院植物保护研究所,北京 100193;2. 全国农业技术推广服务中心,北京 100125;3. 江苏里下河地区农业科学研究所,扬州 225009;4. 湖南农业大学农学院,长沙 410128;5. 辽宁省水稻研究所,沈阳 110101)
1 近10年稻瘟病病害发生危害情况的统计
稻瘟病是由Pyriculariaoryzae侵染引起的对水稻安全生产影响最严重的世界性稻作病害,已经在超过85个国家发生。全世界每年因稻瘟病造成的损失足以养活6 000万人口[1]。由于其在生产上的严重危害性和在科学研究上的重要性,2010年稻瘟病被Science杂志列为食品安全“最严重的生物威胁”之一[2]。2012年稻瘟病菌被国际分子植物病理学界列为“十大植物病原真菌之首”[3]。
稻瘟病在我国不同水稻种植区及水稻不同生育期的不同组织部位均有发生(图1),严重影响了水稻的产量和品质。据全国农业技术推广服务中心数据显示,2012年-2021年我国稻瘟病年均发生面积381.5万hm2次(图2a),年均实际损失36.8万t(图2b),其中2014、2015年连续两年发生面积超过500万hm2次,造成年实际稻谷损失超过50万t(图2)。

图1 稻瘟病发病情况Fig.1 Incidence of rice blast
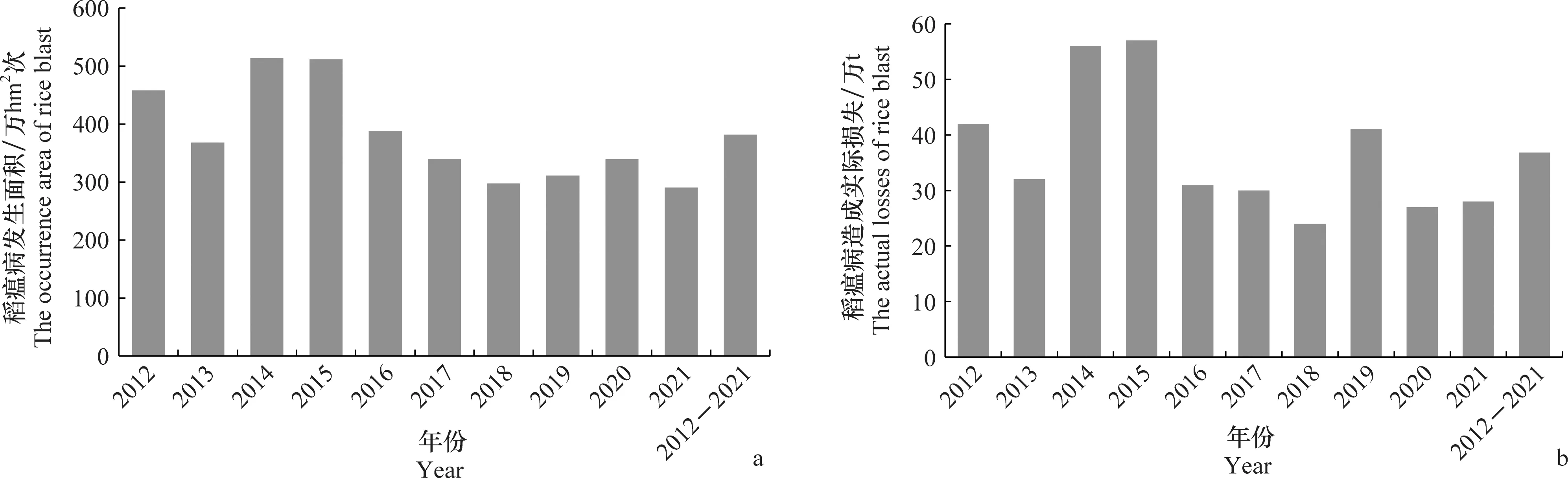
图2 2012年-2021年我国稻瘟病发生面积(a)及引起的实际损失(b)Fig.2 The occurrence area (a) of rice blast and caused actual losses (b) in China from 2012 to 2021
我国稻作区自然生态环境、水稻种植类型与栽培制度复杂多样,稻瘟病的发生具有明显的区域性差异。例如,随着优质食味粳稻的推广,江苏省稻瘟病发生风险也逐步加大,2014年稻瘟病在江苏省偏重发生,发生面积达到100万hm2,占水稻播种面积的43%,严重影响了水稻高产稳产[4]。华南双季稻稻作区以籼稻为主,该区稻瘟菌病原小种分化复杂,稻瘟病发生具有点多面广、地域间发生分布不平衡等特点。据全国农业技术推广服务中心统计,2015年-2021年,广东省稻瘟病年发生面积约26.7万hm2,平均年损失稻谷约为2.5万t。
多年来,“预防为主,综合防治”的植物保护工作方针为我国病虫害的防控指明了方向,为粮食安全生产提供了重要保障[5]。在稻瘟病防治措施中,培育和推广稻瘟病抗性品种被认为是防控稻瘟病最为经济、有效和环保的策略[6]。因此,在国家和有关省农作物新品种审定中,稻瘟病抗性一直被作为水稻新品种审定的重要指标,实行抗性不达标一票否决制度[7]。为控制稻瘟病的发生,广东省大力推广以广谱抗稻瘟病材料‘BL122’ (含稻瘟病抗病基因Pi1和Pi2)为父本的‘粤恢9802’等高抗稻瘟病杂交稻新品种。2013年-2021年,‘粤恢9802’在广东稻瘟病发病区累计推广33万hm2。东北早熟单季稻稻作区是我国粳稻的主产区之一,2018年以来,黑龙江省每年对当地主栽品种进行接种测定,水稻品种整体抗病性有较大提升。全球气候变化以及种植制度的变革加剧了稻瘟菌种群的变化,稻瘟病防控形势依然严峻。2020年和2023年农业农村部先后两次将稻瘟病列入一类农作物病虫害名录。因此,一方面确定水稻品种抗瘟性及发病风险,结合田间生产实际,优先种植在当地发病风险低的水稻品种,降低稻瘟病大面积暴发风险。另一方面,加强对稻瘟病常发区主栽品种的调整,避免单一抗病品种大面积种植,避免因抗病品种的垂直抗性丧失而造成巨大损失。为了应对稻瘟菌种群变化对水稻生产带来的危害,系统深入地研究稻瘟菌与水稻的相互作用,揭示水稻的抗病分子机制,改良水稻品种的稻瘟病抗性,加强对稻瘟病的综合防控,对确保我国粮食安全具有举足轻重的作用。
2 水稻稻瘟病抗病机制研究进展
2.1 稻瘟病抗病基因汇总
截至目前,已经有30多个稻瘟病抗病基因(resistance genes,R)被相继鉴定和克隆。其中,大多数稻瘟病抗病基因,如Pi-ta、Pi2、Pi9、Piz-t、Pizh、Pi5、Pi50、Pik、Pi1、Pikm、Pi54(Pikh)、Pikp、Pid3、Pi25、Pid4、Pid3-A4、Pi36、Pi37、Pi56(t)、Pi63、Pia、Pib、Pi-CO39、Pish、Pi35、Pit、Pb1、Pi64和Pigm等编码核苷酸结合和富亮氨酸重复结构域受体(nucleotide-binding and leucine-rich repeat receptor,NLR)蛋白[8]。还有一些非NLR类抗病基因编码蛋白激酶,如Pid2、Pi68(t)和Pi65分别编码含有B-lectin 结构域的类受体激酶、含有Malectin结构域的类受体激酶和含有多个LRR (leucine-rich repeat)结构域的类受体类激酶[9-11]。此外,Ptr编码一个包含4个Armadillo重复的蛋白[12]。抗病基因的鉴定和克隆为抗病材料的创制和利用奠定了基础。
2.2 稻瘟菌AVR蛋白与水稻NLR蛋白的识别
水稻R基因和稻瘟菌无毒基因(avirulence genes,AVR)的识别遵循“基因对基因”假说。水稻抗稻瘟病R基因与稻瘟菌中AVR基因相对应,目前已报道的AVR/R基因对主要有:Avr-Pita/Pi-ta、Avr-Pik/Pik、AvrPiz-t/Piz-t、Avr-Pia/Pia、Avr1-CO39/Pi-CO39、AvrPi54/Pi54、AvrPi9/Pi9[8]、AvrPib/Pib[13]和Avr-Pii/Pii[14]。研究发现,水稻R蛋白Pi-ta 的 LRR 结构域能够直接和稻瘟菌的 AVR蛋白 Avr-Pita 相互作用,诱导植物的局部细胞死亡,阻止稻瘟菌进一步扩散[15], 这是水稻和稻瘟菌互作系统中首次证明R蛋白和相应的AVR蛋白直接相互作用。随后发现AVR蛋白AvrPi54与R蛋白Pi54能够在水稻原生质膜上直接互作激发特异性抗病反应[16]。近来研究表明,植物中NLR蛋白也以成对的形式发挥作用,称为 Senser NLR和Helper NLR。Senser NLR整合了特殊的结构域来识别病原菌AVR蛋白,而Helper NLR负责起始下游免疫信号。如Pikp由Senser NLR 蛋白Pikp-1和 Helper NLR蛋白Pikp-2组成,Pikp-1含有 HMA 结构域 (heavy-metal-associated domain),能够与Avr-PikD直接相互作用;Pikp-1和Pikp-2 协同行使功能对含有Avr-PikD的稻瘟菌小种产生免疫反应[17]。HMA 结构域氨基酸序列的差异决定了水稻对AVR蛋白的特异性抗性。因此,水稻R基因Pik的多个等位基因(Pikm、Piks、Pikp和Pikh)分别对含有相应Avr-Pik的稻瘟菌小种表现特异抗性[18]。类似地,水稻抗病蛋白Pia由Senser NLR 蛋白RGA5和Helper NLR蛋白 RGA4组成,对携带Avr-Pia或Avr1-CO39的稻瘟菌表现特异的抗性[19]。RGA5能够抑制RGA4的激活,Avr-Pia和 Avr1-CO39与RGA5的HMA结构域特异性结合,解除 RGA5对RGA4 的抑制作用从而激发免疫反应[20]。
大多数水稻R蛋白与对应的稻瘟菌AVR蛋白不直接相互作用,这些R蛋白在水稻中的关键互作因子介导了R蛋白对AVR蛋白的识别。如NLR蛋白Pii和相对应的Avr-Pii均与水稻胞吐作用相关蛋白OsExo70-F2和OsExo70-F3 相互作用,而OsExo70-F2和OsExo70-F3是R基因Pii介导抗性的必需因子[21]。近来发现NLR蛋白Pib和相应的AvrPib与水稻SH3结构域的蛋白质SH3P2相互作用,在正常情况下SH3P2抑制Pib的激活,稻瘟菌侵染时AvrPib与SH3P2互作抑制SH3P2-Pib复合物的形成从而激活Pib[22]。此外,研究发现,转录因子WRKY45和RAI1分别特异地与NLR蛋白Pb1或PID3相互作用,是NLR蛋白抗病途径中的必需因子[23-24]。稻瘟菌AVR基因与水稻R基因的互作机制研究为拓展R基因的抗谱提供了关键理论基础。
2.3 广谱NLR抗病蛋白信号通路
水稻NLR蛋白Piz-t、Pi9和Pigm等对多个稻瘟菌小种具有抗性,表现出广谱抗性特征,受到广泛关注和深入研究。Piz-t特异性识别稻瘟菌AvrPiz-t蛋白并通过多种信号通路激发水稻的免疫反应。AvrPiz-t能够抑制水稻bZIP 类型转录因子APIP5转录活性和蛋白积累,促进效应蛋白激发的细胞坏死,而Piz-t通过靶向APIP5,阻止APIP5介导的细胞坏死[25]。AvrPiz-t可以抑制E3泛素连接酶APIP10的体外泛素化活性抑制水稻的基础防卫反应,APIP10与维管植物单锌指转录因子OsVOZ1与OsVOZ2相互作用促进其通过26S蛋白酶体途径降解,抑制OsVOZ1/OsVOZ2 的表达会削弱Piz-t蛋白积累和对非亲和小种的抗病性[26],说明APIP10通过OsVOZ1/OsVOZ2调控Piz-t介导的免疫反应。此外,抗病蛋白Piz-t促进水稻胰蛋白酶抑制剂APIP4蛋白积累,增强其活性从而增强免疫[27],因此OsVOZ1/OsVOZ2作用于R蛋白Piz-t上游,正调控Piz-t蛋白积累,激活的Piz-t进一步通过其下游蛋白APIP5和APIP4调控稻瘟病抗性。R蛋白Pi9能够特异性识别稻瘟菌AvrPi9蛋白,近来发现AvrPi9与含有类泛素结构域的蛋白ANIP1互作并维持其稳定性,而ANIP1促进稻瘟菌抗性正调控因子OsWRKY62的降解,减弱寄主免疫反应。虽然Pi9也能够稳定ANIP1,但AvrPi9可以促进ANIP1和Pi9的解离从而激活Pi9[28]。目前R基因Pigm相应的稻瘟菌无毒基因还没有报道,研究发现PigmR能够促进具有RRM结构域的转录因子PIBP1在细胞核中积累,PIBP1与细胞壁相关激酶基因OsWAK14和苯丙氨酶基因OsPAL1的启动子直接结合并促进它们的表达,增强水稻对稻瘟病的抗性[29]。此外,PigmR能够稳定去泛素化酶PICI1,PICI1使甲硫氨酸合成酶OsMETS1去泛素化并维持其结构稳定,促进乙烯的生物合成从而激活免疫[30]。因此,广谱NLR抗病蛋白一方面通过APIP5、OsVOZ1/OsVOZ2、OsWRKY62和PIBP1等转录因子促进下游抗病相关基因的表达;另一方面,泛素化/去泛素化修饰酶APIP10、ANIP1和PICI1参与了抗病信号的调控。下游抗病信号通过代谢防御途径的关键酶,比如PAL参与的苯丙氨酸代谢和OsMETS1参与的乙烯代谢途径参与了广谱NLR抗病基因介导的抗病信号通路。
3 水稻感病基因/负调控因子研究进展
感病基因(susceptibility gene,S)是指植物中有利于病原菌侵染的基因,是病原菌成功侵染寄主必需的关键因子[8]。在稻瘟病抗病性研究过程中,发现一些感病基因/抗病负调控因子的功能缺失突变表现广谱抗病性(图3)。虽然这些S基因编码的蛋白没有保守性,但是一些感病基因介导的信号转导存在类似性。比如,Bsr-d1 编码 C2H2类转录因子,Bsr-d1蛋白促进下游过氧化物酶基因的转录导致活性氧(reactive oxygen species,ROS)的消除,使水稻感病。而bsr-d1 突变体导致活性氧增加,表现出对稻瘟病广谱抗病性[31](图3)。ROD1基因编码包含C2结构域的钙感应蛋白,能促进CatB介导的过氧化氢酶活性,抑制活性氧的积累导致感病。而ROD1缺失突变体表现出对稻瘟病的广谱抗性[32](图3)。说明Bsr-d1和ROD1都通过调控ROS的产生介导抗病性。Bsr-k1编码TPR(tetratricopeptide repeats)类型蛋白,能够与苯丙氨酸代谢限速酶基因OsPAL(OsPAL1~OsPAL7)的mRNA结合促进其降解,导致木质素合成减少进而削弱免疫反应。而Bsr-k1功能丧失突变体中木质素合成增多,赋予水稻对稻瘟病菌的广谱抗性[33](图3)。RLK类型激酶(receptor-like kinases)BDR1能够磷酸化MPK3,抑制稻瘟菌诱导的茉莉酸(jasmonic acid,JA)信号和萜类生物合成基因TPS3和TPS29的表达,负调控稻瘟抗性。BDR1功能缺失突变体抑制JA信号和萜类代谢物途径,增强稻瘟病抗性[34](图3)。表明Bsr-k1和BDR1都通过参与抗病代谢物合成介导抗病性。近来发现稻瘟菌侵染水稻时,水稻磷脂酰肌醇-4,5-二磷酸被招募到侵染菌丝周围促进其侵染。水稻感病基因RBL1编码胞嘧啶二脂酰甘油合成酶(CDP-DAG合成酶),参与磷脂酰肌醇-4,5-二磷酸的生物合成。rbl1突变体中细胞膜磷脂酰肌醇-4,5-二磷酸含量显著减少,抑制了稻瘟菌的侵染[35](图3)。感病基因的鉴定及其信号转导的解析为水稻抗病育种提供了新的切入点。
4 其他抗病相关基因
4.1 其他稻瘟病正调控因子
除了稻瘟病抗病基因和感病基因,研究发现一些参与水稻生长发育调控的调控因子兼具广谱抗病性。IPA1是调控水稻理想株型的关键基因,近来发现稻瘟菌能够诱导IPA1磷酸化,促进IPA1与抗病正调控因子WRKY45 启动子的结合,促进其表达,增强水稻对稻瘟菌的广谱抗病性[36]。水稻捕光复合体亚基LHCB5的高表达促进LHCB5的磷酸化水平,磷酸化的LHCB5增加了叶绿体中ROS的累积和对稻瘟病菌多个小种的广谱抗性[37]。水稻中蛋白酶体成熟因子UMP1编码基因的一个天然等位基因UMP1R2115,增加了蛋白酶体的丰度和活性,促进过氧化物酶和过氧化氢酶的降解,导致ROS积累,赋予水稻对稻瘟病菌等的广谱抗性[38]。与抗病基因相比,尽管这些基因表现出不完全抗性,但这些基因介导的抗病性不依赖稻瘟菌AVR基因的限制具有重要的潜在应用价值。
4.2 microRNA介导的稻瘟病抗性
microRNAs (miRNAs) 是一类调控转录后基因表达水平的非编码RNA[39]。miRNAs与AGROUNATE (AGO)蛋白结合形成RNA诱导沉默复合体,该复合体的miRNA与靶基因序列碱基互补配对,通过切割mRNA、促进DNA甲基化或阻遏翻译等方式来抑制下游基因表达[39-42],研究表明多个“miRNA-靶基因”参与调节植物生长发育和抗逆等生物学过程[43]。其中miR398b 靶向4个超氧化物歧化酶(superoxide dismutase, SOD)基因OsCSD1、OsCSD2、OsCCSD和OsSODX。在水稻中过表达miR398b或敲除靶基因OsCSD1、OsCSD2和OsSODX能够增强SOD活性,增加 H2O2的累积,提高水稻对稻瘟病的抗性[44]。miR160a靶向5个生长素响应因子(auxin response factor, ARF)编码基因OsARF8、OsARF10、OsARF13、OsARF18和OsARF22。在水稻中超表达miR160a或敲除OsARF8、OsARF18或OsARF22增强对稻瘟病的抗性[45]。此外,研究发现miRNA及其靶基因也能够负调节稻瘟病抗性。miR319b靶向JA信号通路关键基因OsTCP21。过表达miR319b抑制JA合成通路多个基因表达,促进稻瘟菌的侵染;而过表达OsTCP21增强了JA合成通路中这些基因的表达,抑制了稻瘟菌的侵染[46]。miR1871靶向一个定位于细胞壁的基因OsMFAP1。过表达miR1871或敲除OsMFAP1削弱水稻的基础免疫反应,而抑制miR1871的功能或过表达OsMFAP1不仅提高了水稻对稻瘟菌的抗性,还显著提高了水稻的产量,暗示miR1871可能是一个具有抗病育种应用价值的潜在感病基因[47]。此外,miR168能够靶向并抑制OsAGO1的表达,负调控多个miRNAs的积累。通过负调控miR1320的表达能增强稻瘟病抗性,通过负调控miR535和miR164的表达能增加水稻穗数并延长抽穗时间,最终提高产量。抑制miR168的表达能同时提高稻瘟抗性和水稻产量[48]。这些研究表明,microRNA作为一种非蛋白的抗病相关基因广泛参与水稻对稻瘟病抗性的调控,在水稻抗病育种中具有应用潜力。
5 水稻稻瘟病抗病育种策略
稻瘟病抗病基因、感病基因以及其他抗病相关基因的挖掘、克隆与应用,大幅提升了生产上水稻主推品种的稻瘟病抗性。然而,随着全球气候变化和水稻种植制度的变革,新品种需要进一步拓展抗病谱和广泛适应性,以应对变化的新环境。
5.1 抗病基因的聚合
虽然抗病基因具有垂直抗性,但是抗病蛋白仅能识别包含有相应无毒效应因子的病原小种,限制了单个抗病基因抗病品种的大面积推广。采用多个抗病基因的聚合有助于培育广谱稻瘟病抗性品种。例如:以‘07GY31’水稻材料为基础,将抗病基因Pi9和Piz-t分别与抗病基因Pi54进行聚合,创制了叶瘟和穗瘟抗性均显著提高的新材料[49];类似地,以‘YD6号’水稻材料为基础,将Piz不同等位基因(Pigm、Pi40、Pi9、Pi2和Piz)和Pi1、Pi33以及Pi54分别进行聚合,发现Pigm/Pi1、Pigm/Pi54和Pigm/Pi33组合表现广谱抗性,且对其他农艺性状没有明显影响[50]。另外,Pita和Pi3/Pi5/Pii聚合,以及Pita和Pia聚合也能产生较强的穗瘟抗性[51]。然而,虽然聚合Pib、Pi25和Pi54 能够显著提高稻瘟病抗性,但同时严重影响产量[52]。因此,抗病基因聚合的应用价值还需评价其综合农艺性状表现。通过选用优良骨干亲本作为共同遗传背景,构建不同单基因的精确渗入系,在此基础上再进行聚合,是解决这一技术瓶颈的有效手段。
5.2 分子设计育种
随着水稻全基因组测序的完成,功能基因组学以及生物信息学的发展,分子设计育种成为引领水稻遗传改良的关键技术。该技术在明确全基因组序列的基础上,优化选择最佳亲本基因组组合,通过杂交和分子标记选择等技术,聚合大量优异基因,从而培育高产、优质、高抗和广泛适用性的优良新品种。分子设计育种能够实现从经验育种到定向高效的精确育种转变,大幅提高育种效率。Wei等根据报道的225个水稻QTL基因信息,结合等位变异的序列信息,将关键功能变异位点对应到水稻基因组位置上,获得包含348个变异位点和562个等位基因的图谱,通过收集来自26个国家的404份种质材料,获得了覆盖大部分等位基因(95.5%)的水稻材料[53],为水稻遗传改良提供了丰富的供体资源。研究者从404份材料中发现7份材料中包含抗病基因Pi9,而Pi9位点的单碱基等位基因导致强的稻瘟病抗性,因此,含有这些等位基因的材料可作为育种应用的重要供体[53]。另一方面,高产、优质和抗病多性状聚合是分子设计育种亟待解决的关键科学问题。通过对江苏、浙江、山东等地大面积推广应用的200余份粳稻品种进行重测序和全基因组分析,及关键性状基因定位,发现控制千粒重和每穗粒数等关键性状基因的强化选择是促进该区域粳稻品种产量提高的重要遗传基础。与此同时,发现选育的高产水稻品种稻米的直链淀粉含量呈现显著下降,稻瘟病抗性水平表现降低的趋势,表明稻米品质和抗稻瘟病性状存在显著的负相关。通过全基因组连锁图谱的构建,发现6号染色体Piz基因座感病等位基因连锁是制约品种产量品质抗病平衡的关键因素。以此为基础,利用基因组设计育种策略,通过选择核心亲本和打破关键基因累赘连锁,利用抗病基因Piz-t和Pigm分别创制了高产优质抗病新品系‘XY99’和‘JXY1’[54]。
5.3 感病基因编辑
水稻抗病基因赋予其对病原生理小种的垂直抗性,被育种家优先应用于水稻品种改良,但抗病基因的小种特异性使得其抗病谱较窄,限制了抗病品种的大面积推广。感病基因是寄主植物中协助病原菌成功侵染的关键因子,随着对稻瘟菌致病性的认知和基因编辑技术的发展,通过对感病基因的编辑可以阻止病原菌在寄主体内完成侵染循环,成为提高水稻抗病性的一种新策略。研究表明在‘日本晴’中敲除感病基因Pi21或Bsr-d1增强了水稻对稻瘟病的抗性,敲除感病基因Xa5增强了水稻对白叶枯病的抗性,同时敲除Pi21、Bsr-d1和Xa5 3个感病基因显著提高了水稻对稻瘟病和白叶枯病的广谱抗性,且敲除材料的株高和千粒重等农艺性状无明显变化[55]。在杂交水稻骨干不育系‘隆科638S’中同时敲除感病基因Bsr-d1、Pi21和OsERF922显著增强了对稻瘟病的抗性[56]。以上研究为稻瘟病育种提供了新的种质资源。因此,通过CRISPR-Cas9技术编辑水稻感病基因有望创制广谱抗病新材料,对水稻抗病分子育种和其他作物抗病性改良具有重要指导意义。
5.4 抗病基因的病原诱导表达
病原菌侵染激活植株抗病基因及信号通路赋予植株抗病性,而抗病基因的组成型激活往往导致自我免疫,影响植物的生长发育。例如,拟南芥的抗病关键调控因子NPR1通过调控水杨酸信号增强抗病性。在小麦和水稻中异源表达NPR1分别显著提高对小麦纹枯病、水稻白叶枯病和稻瘟病的抗性。但NPR1的组成型激活影响农作物的产量等性状,限制了其在生产上的应用。在水稻中,利用TBF1基因上游开放阅读框(uORF)在翻译水平上精准调控NPR1的表达,使得在没有病原菌侵染时,NPR1蛋白处于低表达水平;而当有病原菌侵染时,NPR1蛋白快速高表达,阻止病原菌的侵染。uORFTBF1-NPR1水稻材料对稻瘟病、白叶枯病和细菌性条斑病均有较好的抗性,并且不影响其他主要农艺性状[57]。类似地,病原菌诱导的PR1b启动子以及水稻乙醇脱氢酶5′-UTR的翻译增强子共同驱动WRKY45的表达,显著增强水稻对稻瘟病的抗性[58]。因此,病原诱导以及在翻译水平精准调控抗病基因的表达,能够显著提高作物对不同类型病原菌的广谱抗性,同时不影响其他农艺性状。该技术在农作物生产上具有潜在重要应用价值。
5.5 基于结构生物学的抗病蛋白改造
NLR抗病蛋白的结构解析使抗病机制研究有了突破性进展,也为抗病蛋白的改造提供了重要参考。水稻中,稻瘟菌Avr1-CO39蛋白能与水稻R蛋白RGA5的HMA结构域直接互作,参照Avr1-CO39与RGA5-HMA互作界面,基于Avr-Pib与Avr1-CO39结构基础,科研人员对RGA5的HMA结构域进行改造,设计出能识别非对应无毒效应蛋白Avr-Pib的新型抗病蛋白RGA5-HMA2,并证明含有RGA5-HMA2抗病蛋白的水稻对含有Avr-Pib的稻瘟菌具有抗性[59]。类似地,Pikm-1整合了HMA结构域,研究发现该结构域的两个相邻的氨基酸的突变拓展了对其他Avr-Pik效应蛋白的识别[60]。近来,研究者利用特异结合GFP的纳米抗体序列替换Pikm-1的HMA结构域获得Pikm-1α-GFP,当Pikm-1α-GFP和Pikm-2以及GFP共同在烟草中表达时能够产生类似于Pikm-1,Pikm-2和AvrPiKD共表达产生的过敏反应[61],该技术的进一步优化完善有望在水稻中创制广谱抗病新材料。通过改变抗病蛋白特定结构域或关键氨基酸拓展抗病蛋白对效应蛋白的识别,有望有效扩展抗病基因的抗病谱。
6 挑战和展望
6.1 种质资源评价及优异等位基因发掘
从丰富的水稻种质资源中挖掘抗稻瘟病基因是创新种质的有效途径。科学家从82个国家收集了413份不同水稻种质,利用全基因组关联分析(genome-wide association study,GWAS)鉴定种质资源库中的核心抗稻瘟病基因[62]。用5个稻瘟菌小种对413份水稻种质资源进行抗病鉴定,利用GWAS技术鉴定到具有稻瘟病抗性功能的新基因LABR_64[63]。我国科学家开展了代表78万份水稻种质资源95%遗传多样性的3 010份亚洲栽培稻基因组研究,建立了核心种质的基因型和重要农业性状表型数据库,为开展水稻全基因组分子设计育种提供基因来源和遗传信息,为培育高产、优质和多抗水稻新品种奠定基础[64]。Shang等组装了具有基因型和表型变异代表性的251份亚洲栽培稻核心种质材料的基因组。利用泛基因组图谱通过整合NLRs注释信息,构建了水稻泛NLRome,确定了泛NLRs家族基因的共线性,为抗病基因功能和进化研究提供了重要基础[65]。
6.2 利用抗性蛋白互作网络和信号通路挖掘新基因
水稻蛋白质互作组能够为蛋白网络和功能研究提供宝贵信息。Wierbowski等将带条形码接头与核酸分子相连接,获得了覆盖2 300个基因的水稻ORFeome,构建了由289个蛋白质之间的322对相互作用组成的高质量蛋白质-蛋白质互作组图谱[66]。转录因子是调控水稻生长发育和环境适应性的关键分子,科学家构建了包括1 683个水稻转录因子的文库,覆盖水稻转录因子总量的70%左右[67],为水稻转录因子互作组的研究奠定了关键基础。水稻基因组包含1 515个E3泛素连接酶基因,近来研究者通过PCR扩增和大规模基因合成获得了1 499个E3泛素连接酶的全长编码序列(覆盖E3泛素连接酶的98.94%),并以此创制了均一化的水稻E3泛素连接酶酵母文库(UbE3文库)。利用水稻E3泛素连接酶文库发现 F-box类型E3泛素连接酶OsFBK16是OsPAL1~OsPAL7的核心E3泛素连接酶[68]。水稻ORFeome文库、转录因子文库和水稻E3泛素连接酶文库的相继建立为构建水稻蛋白互作组调控稻瘟病抗性奠定了重要基础。
遗传筛选也是阐述抗性基因信号通路的重要方式。例如,水稻U-box类型E3泛素连接酶SPL11负调控稻瘟病和白叶枯病抗性。通过人工诱变得到了spl11突变体的一系列抑制子,其中抑制子SDS2编码单子叶植物特异的SD-1类型的受体激酶。有趣的是,SPL11可以促进SDS2的泛素化降解,负调控水稻免疫,而SDS2能够磷酸化类受体胞质激酶OsRLCK118,进而磷酸化修饰NADPH氧化酶OsRbohB促进ROS产生正调控水稻先天免疫[69]。抗病相关基因抑制子的遗传筛选是遗传水平上解析抗病信号通路的重要途径,遗传筛选与蛋白质互作鉴定有利于抗病相关蛋白互作网络的构建。
6.3 利用新技术创制抗病材料
以CRISPR-Cas9为主的基因编辑技术为水稻突变体材料的创制和功能研究奠定了重要基础。2013年该技术首次应用到水稻中,能够在水稻基因组特定位置使DNA双链断裂,利用细胞内源修复机制产生随机的数个碱基插入或删除,达到基因敲除的目的[70]。单碱基编辑技术的发展实现了特定碱基的高效精准替换,而引导编辑在不引入双链断裂和供体DNA模板的前提下实现小片段DNA的精准插入,缺失以及碱基的多种形式突变,提升了基因组编辑的精准性[71]。此外,通过将供体片段进行硫代修饰和磷酸化修饰后,实现了中等片段包括增强子和启动子的靶向敲入[72]。在此基础上,通过重复片段介导的同源重组方法实现中等片段的替换和原位蛋白标签的精准融合[72]。近年来,科学家开发了能够实现5 kb及以上大片段DNA精准插入的PrimeRoot系统,将稻瘟病抗病基因PigmR精准插入到水稻基因组上实现快速抗病育种[73]。这些基因编辑系统的升级改造将为水稻分子抗病育种提供有力的技术支撑。
6.4 叶瘟和穗瘟抗病机制差异
稻瘟病可以在水稻整个生育期以及水稻不同组织发生,其中叶瘟影响水稻的生长和发育,穗瘟直接影响水稻灌浆和产量。苗期的叶瘟接菌体系成熟,在温室易于操作,而穗瘟的抗病分析需要在抽穗期进行,接菌条件和表型调查易受环境的影响。因此稻瘟病抗性分析往往从叶瘟研究入手。然而,水稻对叶瘟和穗瘟的抗性往往不完全一致。比如含有广谱抗稻瘟病基因Pi2、Pi9、Pi40、Piz-t和Piz的近等基因系材料的叶瘟与穗瘟抗性存在显著差异[74]。在水稻中超量表达14-3-3蛋白编码基因OsGF14b增强对穗瘟抗性,但对叶瘟更敏感[75]。因此,叶瘟抗性效应好的抗病基因对穗瘟抗性效应有待进一步分析,叶瘟和穗瘟抗病分子机制的差异还需要进一步研究。
6.5 稻瘟病抗性与水稻生长发育等的平衡
植物抗病过程激发了免疫相关的激素信号和代谢防御信号通路,是消耗能量的过程。植物需要权衡抗病与生长过程的能量分配,在病原菌侵染时减缓生长发育增强抗病性。免疫反应的激活往往影响植物的生长发育,如何平衡植物抗病性与生长发育是作物高产抗病育种的重点和难点问题。近来研究表明,作物能够通过多种形式达到既高产又抗病的目的。比如,1)对生长信号通路抑制的解除。水稻rbl功能缺失突变体具有稻瘟病广谱抗病性但具有严重的类病斑,影响水稻产量。而RBL基因定点缺失12个核苷酸的植株表现抗病性但只在成株期呈现微弱的类病斑表型[35]。2)关键防御基因的特异性诱导表达。利用uORF1在翻译水平上精准调控NPR1的表达,使得只有在病原菌侵染时,NPR1蛋白才能快速高表达,从而阻止病原菌的侵染,增强水稻的抗病性,但不影响植物生长和产量[57]。类似地,病原诱导表达导致IPA1的磷酸化增强免疫而不影响产量[36]。3)感病基因的敲除。同时敲除Pi21、Bsr-d1和Xa5 3个感病基因显著提高了水稻对稻瘟病和白叶枯病的广谱抗性而不影响其他农艺性状。4)优化自然变异位点平衡植物的抗性和生长。水稻Bsr-d1和ROD1的优异自然变异位点能够折中并平衡水稻的抗性和生长使得增加抗性不影响产量[31-32]。这些材料的鉴定为实现高产抗病材料的创制提供了很好的范例,有助于水稻抗病性改良,实现高产抗病新材料的创制。
