韧带样纤维瘤治疗中的观察与等待策略
2023-10-12侯子伟于秀淳
侯子伟 于秀淳
韧带样纤维瘤(Desmoid-type fibromatosis,DF)又称硬纤维瘤、侵袭性纤维瘤,是一种源于间充质细胞异常增殖、侵袭性较强但罕见转移的中间性肿瘤[1]。每年大约有5~6/百万人发病,30~40 岁是发病的高峰期[2]。临床上根据发病部位将DF分为三类:腹壁型、腹壁外型和腹内型[3]。腹壁型常发生在妊娠时期的腹壁,多与雌激素异常相关,通常在产后消散。腹壁外型表现为肢体或躯干的散发性硬纤维瘤,该类肿瘤常与β-连环蛋白(β-catenin)的CTNNB1 基因突变有关。腹内型DF 常见于有家族性腺瘤息肉病(Familial adenomatous polyposis,FAP)病史的病人,伴有特征性的腺瘤性大肠息肉病(Adenomatous polyposis coli,APC)基因表达缺失。DF的发病分子机制与许多信号通路的异常有关,包括细胞外因子(Wingless/Int1,Wnt)、非受体酪氨酸激酶(Janus kinase/signal transducer and activator of transcription,JAK/STAT)、磷脂酰肌醇激酶(Phosphatidylinositol3-kinase/protein kinase B/mammalian target of rapamycin,PI3K/AKT/mTOR)等信号通路,其中Wnt/β-catenin 是公认的典型异常信号通路[4-5]。目前,FAP 相关的DF 已被证实是因为APC 基因突变或缺失致其失活[4],而散发性DF则是在编码β-catenin的CTNNB1基因的外显子3 中发生激活突变事件[5]。DF 的临床表现一般为无痛性软组织肿块,不同的症状表现与肿瘤部位、大小和进展密切相关。当肿瘤浸润性生长毗邻神经血管时会产生明显的感觉异常、疼痛或神经病变等症状。DF 的临床特点包括:①局部浸润性生长,肿瘤边界往往很难分辨;②具有异质性和多变的自然病史,可表现为生长、稳定甚至消退;③无远处转移能力。
近十五年,DF的治疗方法发生了巨大转变,传统的手术切除逐渐被摒弃[6],取而代之的是保守观察与等待(Wait and see,WS)策略[7]。目前,指南和共识[8-9]已将WS 策略列为DF的一线管理方案,而国内外却缺少对WS 策略的详细综述。为让临床医生深入了解这一保守策略,本文通过检索既往近十五年文献研究,并结合最新指南和共识,详细综述WS策略的临床疗效和最新进展,旨在为临床中应用WS策略治疗管理DF提供可靠指导和参考。
一、文献检索策略
以英文关键词“Desmoid-type fibromatosis”、“Aggressive Fibromatosis”、“Desmoid”、“Wait and see”、“Watchful Waiting”、“Active Surveillance”在PubMed、Web of Science 数据库检索2008 年4 月~2023 年4 月的文献,共检索文献109 篇。设定文献的纳入标准:①研究对象为病理诊断确诊的韧带样纤维瘤病人;②研究内容与WS原则相关;③已正式发表的期刊文献;④对同一样本群体的多篇重复报道,选择内容相对详细的文献。文献排除标准为:①理论性、方法学探讨文献;②无法获取全文的文献;③非英文文献;④多次重复发表、质量偏低的文献。根据文献纳入排除标准,最终纳入的文献有54篇(图1)。

图1 文献纳入流程图
二、WS策略产生的背景
在2000年之前,DF的治疗同软组织肉瘤一样,将手术广泛切除肿瘤作为主流治疗方式,一度被认为是DF 治疗的基石。但由于DF 往往呈浸润性生长并缺乏假性包膜,术者在术中往往很难实现完整切除而导致局部复发。另外,由于创伤可能是DF 发病的高危因素之一,所以有创的手术治疗也容易引起肿瘤复发。因此,选择手术治疗意味着会面临相当高的复发风险,可能会经历二次或多次手术,严重者甚至因截肢而最终残疾,这给病人生理和心理上带来灾难性打击,生活质量严重下降。随着对DF自然病史和临床行为的不断了解和认识,DF 的治疗方式开始趋向于保守。早期多项研究[10-12]认为,相比复发风险较高的手术治疗和安全有效性不确定的各类药物治疗,保守的WS策略似乎可以为病人带来更大的临床获益。在此背景下,WS策略开始应用于部分DF病人的治疗管理,随后被各个机构广泛实施于临床并获得了可观的疗效。
三、WS策略实施的四项基本原则
WS策略也称为积极监测,是指对病人定期观察随访,通过监测症状和影像学变化,评估肿瘤进展后决定下一步治疗的管理方法。它最早仅应用于复发、无法切除以及全身治疗无效的肿瘤管理,并获得了较高的成功率[12]。随着临床中WS策略的不断开展,多数研究证实大部分肿瘤在WS期间趋于稳定状态,甚至约三分之一的肿瘤出现了消退[13-14]。自2006年开始,WS策略逐步作为一线管理方案被系统地扩展应用到包括原发DF 病人在内的所有病人[15]。2020年,欧洲DF协作组在DF全球治疗指南中推荐WS策略作为一线治疗管理方案[8]。笔者根据指南总结出WS 策略的基本原则如下:①该策略适用于绝大多数病人,其中包括所有无症状和轻症病人的一线管理。②对于肿瘤伴随明显症状而未危及生命的病人,WS 策略同样被推荐为诊断后的首要处理方案。③对于一些特殊情况的病人,例如具有慢性疼痛、处于妊娠期和FAP相关的DF病人,也可进行WS。④对于接受过不完全手术、手术切缘阳性(R1或R2)的病人应优先考虑WS策略。
四、WS策略临床实施的具体方法:影像学监测和实体瘤疗效评价标准评估
在临床工作中,WS 管理方案的实施并不复杂。经穿刺活检病理确诊为DF的病人需要在诊断后1~2个月内通过第一次MRI 或CT 进行持续监测,然后每隔3~6 个月进行一次影像学监测和临床专科检查[8]。最新的美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[9]同样建议实行WS 的病人在2~3 年内,每隔3~6 个月进行一次CT或MRI检查,2~3年之后每隔6~12个月进行一次检查,然后根据实体瘤疗效评价标准(Response Evaluation Criteria In Solid Tumours,RECIST)评估肿瘤的进展,进而作出下一步的治疗管理决定。特别注意的是,单次评估的肿瘤进展不应被视为立即开始积极治疗的指征,必须进行长期的连续监测。在WS期间,应鼓励病人尽量推迟积极治疗的决定,直到出现后续肿瘤进展或症状明显加重,并至少再进行两次深度评估。另外,若肿瘤变化不满足RECIST肿瘤进展标准,那么积极治疗不可早于诊断后1年实施。
五、WS策略中的疼痛管理:非甾体抗炎药的应用
疼痛作为DF 的常见临床症状,无论有无进展的影像学证据、功能性症状或病人诉求,它都是转向积极治疗的主要原因[16-17]。鉴于疼痛的发病机制与许多因素相关,学者们普遍认为它不应作为积极治疗的指征[18],并允许在WS期间使用非甾体类抗炎药(Nonsteroidal Anti-inflammatory Drugs,NSAIDs)控制疼痛。此种有效的疼痛控制有利于病人延续观察时间,避免潜在自然消退肿瘤的过度治疗,因此疼痛管理应被视为WS 策略中的优先事项。Sobczuk 等[19]在139 例DF 病人队列研究中指出,超过90%的DF 病人在WS 期间接受了NSAIDs 的治疗,显示了不亚于前期手术的肿瘤无进展生存状况。另外,NSAIDs除了具有良好的抗炎止痛作用外,也可以通过抑制环氧化酶-2(cyclooxygenase-2,Cox2)来调节β-catenin通路达到抗肿瘤的用途[20]。目前,临床中应用最多的NSAIDs 药物是美洛昔康,其次还有塞来昔布、舒林酸、依托度酸等。值得一提的是,NSAIDs药物的使用可能会对WS临床研究的真实结果造成影响,因此将此类病人纳入评估WS的临床研究存在着一定的局限性。
六、WS策略的临床疗效总结
当前,临床中公认对良性肿瘤实行“恶性”治疗管理的观点不可取,积极的治疗反而会让DF 病人获得更差的预后。不论是原发或复发性DF,WS 策略都是合理的一线管理方案,并且不会影响后续治疗的疗效。迄今为止,已有大量研究应用WS作为一线治疗并报道了优良的临床疗效。本文对既往近十五年关于WS 的重要文献进行全面总结[10-12,19,21-39](表1),从单纯WS策略、WS策略与药物、手术对比三个方面对WS策略目前的临床疗效进行综述。
(一)单纯WS策略的临床疗效
最早Bonvalot 等[21]的回顾性研究发现采取非手术治疗(WS和药物治疗)的肿瘤约三分之二生长停止。随后Barbier等[10]对26 例病人实行单独观察政策,结果显示24 例在中位14 个月保持肿瘤稳定,1 例出现消退。Salas 等[11]在一项426例DF 病人采用不同治疗方法的回顾性研究中报道,观察组中27 例病人仅有6 例出现进展,16 例病情稳定,5 例自行消退。2014 年,Briand 等[12]的研究首次证实WS 作为一线管理方案的可行性,在这项多中心回顾性研究中,85%的肿瘤出现停止生长,一半的肿瘤在1 年内稳定,仅有10%的病人因WS失败而退出。近15年有关WS作为一线(或最初)治疗的数篇研究报告了显著的肿瘤消退率(5%~40%)和稳定率(34.3%~71%)[10-12,22-26,28,30-33,35-39]。在最近的一项在荷兰进行的前瞻性临床试验中[39],105例DF病人在接受中位时间33.7个月的WS后,32%的肿瘤保持稳定,28%自发消退,3年无病进展生存期占比(progression-free survival,PFS)为58%。
(二)WS策略与全身药物治疗的疗效对比
WS与药物的疗效对比主要涉及到3项研究。Fiore等[23]在一项大型回顾性研究中报道,142 例病人进行了WS 与药物治疗,两组的5 年PFS 没有差异(49.9%vs.58.6%)。另一项研究中最初接受WS的病人的情况并不比最初接受激素或化疗药物治疗的病人差[24]。值得关注的是,在此研究中2年内没有进展的病人也不需要任何进一步的积极治疗。这一结论在儿科病人中也获得了类似的结果。欧洲儿科软组织肉瘤研究组显示,WS组和化疗组的5年PFS虽存在差异(分别为27%和43%),但差异无统计学意义(P=0.130)[25]。基于以上研究报道,我们可以发现与初始药物治疗相比,初始WS策略不会影响DF的病程发展与结局。

年份2008作者肿瘤评估[例数(%)]与其他治疗比较地区/国家法国研究类型回顾性总样本量(例数)112 Bonvalot等[21]进展3(27.3)稳定-消退-WS(例数)11 2009 2010 2011 2014 2014 2015 2016 2016 2017 2017 2018 2019 2019 2019 2020 2020 2020 2021 2021 2021 2022 2022日本荷兰英国回顾性回顾性前瞻性99 94 105 Tsukmoto等[30]Khan等[22]Schut等[39]16 66 105 7(43.8)19(28.8)42(40)2(12.5)31(47)33(32)7(43.8)16(24.2)29(28)EFS优于手术组意大利、法国法国法国、瑞士法国中国意大利、法国美国加拿大法国法国荷兰加拿大瑞士英国美国加拿大韩国波兰意大利前瞻性回顾性回顾性回顾性回顾性回顾性前瞻性回顾性前瞻性前瞻性前瞻性回顾性回顾性前瞻性回顾性回顾性回顾性回顾性前瞻性142 26 426 73 214 216 47 213 154 771 91 103 96 168 160 227 76 363 87与化疗相比PFS无差异Fiore等[23]Barbier等[10]Salas等[11]Briand等[12]Huang等[26]Colombo等[24]Park等[31]Burtenshaw等[28]Orbach等[25]Penel等[27]van Broekhoven等[33]Turner等[32]Krieg等[35]van Houdt等[36]Cassidy等[34]de Bruyns等[37]Kim等[38]Soblzuk等[19]Ruspi等[29]进展延迟的中位时间与手术组相当PFS优于手术与手术、化疗相比PFS无差异EFS与手术组无差异33(40)1(4)6(22)5(9)4(20)28(40)1(5)4(6)32(59)117(30)5(14)21(42)3(20)60(36)10(27)13(24)47(57)24(92)16(59)42(76)14(70)24(34.3)18(90)31(57)9(17)-25(68)29(58)9(60)60(36)-20(36)54(71)3(4)1(4)5(19)5(9)2(10)15(21.4)1(5)23(37)4(7)-2(5)-3(20)45(27)-22(40)9(11.8)——---与手术相比EFS无差别与手术相比EFS无差别83 26 27 55 20 70 20 58 54 388 37 50 15 168 37 55 76 139 27
(三)WS策略与手术治疗的疗效对比
目前的多数研究已证实初始WS的PFS和无事件生存期(event-free survibal,EFS)不劣于初始手术。Huang 等[26]研究显示WS与延迟进展的中位时间与初始手术相当。Penel等[27]比较初始手术和初始WS 的研究结果显示,两组在EFS 和长期疾病控制方面没有任何差异。而在胸壁、头颈部和上肢等不利解剖部位的病人中,WS 病人的2 年EFS 明显优于初次手术,儿童也有和成人相似的结果[25]。近两年意大利、波兰、日本等医学中心[19,29-30]的研究均证实初始手术与WS 的PFS或EFS相似。Park等[31]同样观察到,与手术组病人相比,WS组的PFS 显著优于手术组(92%vs.60%)。在最新的一项回顾性研究中,Khan 等[22]证实了WS 组的2 年PFS 优于手术组的无复发生存期。因此,与手术治疗相比,采取保守的WS策略不仅可以获得更容易接受的临床结果,同时还可规避手术带来的局部复发和致残风险。
七、何时该退出WS策略:时机的重要性
在最近的一项DF 有关WS 的荟萃分析[40]中表明,涉及25项研究的640名DF病人中,约三分之一的病人退出了WS而转向积极治疗。因此,及时退出WS策略,避免出现严重并发症也是DF 管理的重要环节。全球指南中明确指出退出WS的最佳时机:一旦出现腹内并发症,应避免WS而提供积极治疗,尤其是对于FAP 相关的病人,以及进展部位(如颈部、纵隔和肠系膜)可能危及生命的巨大肿瘤病人。另外,当疾病的症状加重或肿瘤持续间歇性增长,评估肿瘤进展超过3个观察周期时,也应退出WS而选择积极治疗。
八、WS策略失败后的积极治疗方法
(一)应根据不同解剖部位选择局部或全身治疗
当WS策略失败后,应尽早建议病人转向积极治疗策略,目前的治疗方法主要包括手术、放疗、孤立肢体灌注(Isolated limb perfusion,ILP)化疗及介入治疗等局部治疗,以及抗激素+NSAIDs、低剂量化疗、分子靶向等全身性药物治疗。全球指南建议治疗方式通常根据解剖部位不同进行选择,并应由病人逐步决定[8](图2):对于腹壁型DF,考虑到可预期的并发症,手术仍可作为一线治疗方式;而对于所有其他部位DF,手术也可作为全身药物治疗(例如化疗和分子靶向药物治疗)失败后的二线治疗;对于四肢、腰部以及胸壁DF,应优先选择药物治疗,手术治疗仅在预期发病率非常低时考虑选择;对于腹腔内、腹膜后、盆腔、头颈部和胸腔内DF,全身药物治疗应被视为首选治疗方案。
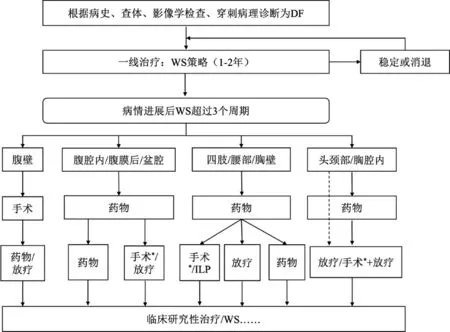
图2 DF治疗管理流程图,*发病率有限的情况下可选择手术
(二)局部治疗
值得注意的是,尽管目前的观点是手术切缘不会影响复发和预后,但如果选择手术切除,也应尽量达到镜下R0 切缘。在高龄、病人主观意愿、肿瘤快速生长并威胁重要器官等特殊的条件下,放疗是一种合理且有效的一线替代方案[41]。另外,除了手术、放疗和药物治疗,ILP[42]和射频[43]、冷冻[44]、超声[45]消融等微创介入疗法可能是四肢和其他有利部位进一步局部治疗策略的选择。
(三)全身性药物治疗
抗激素+NSAIDs 药物治疗是基于调节激素水平和βcatenin 通路来抑制肿瘤生长并缓解疼痛症状的联合用药。虽然,既往研究已证实对成人和儿童DF 具有一定的疗效[46-47],但由于证据等级有限,指南并未将其作为推荐疗法。低剂量化疗通常作为抗激素+NSAIDs 药物治疗失败后,肿瘤快速增长且不可切除的晚期疾病甚至威胁生命的治疗方式[48]。最常用的方案包括甲氨蝶呤+长春碱类联合用药以及基于蒽环类药物[49]的用药方案,但不可避免的细胞毒性使化疗的临床获益十分有限。酪氨酸激酶抑制剂(Tyrosine kinase inhibit,TKIs)作为分子靶向药物,是近几年恶性肿瘤的新兴治疗,其机制主要是通过干预各类靶点影响WNT/βcatenin信号通路,调节间叶细胞的生长及血管再生,从而影响肿瘤的发生、发展。目前证实对DF有效的TKIs药物包括伊马替尼[50]、索拉非尼[51]、帕佐帕尼[52]以及国产的安罗替尼[53]。除上述药物治疗外,最近完成的一项Ⅱ期临床试验显示了γ-分泌酶抑制剂的临床疗效[54],它是通过调节Notch 通路来抑制肿瘤细胞的活性,有可能成为DF进展的潜在治疗方式。
当前,由于缺乏各种全身药物治疗之间规范的比较研究,指南与共识仍然无法提出现有药物治疗方案的确切顺序,只是建议应根据药物的毒性大小、证据水平、总体缓解率、PFS率以及给药难易性逐步选择合适的全身治疗方案[8]。
九、展望
当前,对于DF 治疗管理的探索研究主要集中在开发新的治疗方式、识别肿瘤对治疗反应的预测标记物,并在WS期间确定最可能进展的肿瘤亚群[37]。目前全球虽已形成WS策略作为一线管理方案的共识,但对于观察期间病人功能、疼痛症状和生活质量的评估仍缺乏统一评价工具。另外,目前的各类药物治疗的有效性和安全性多为回顾性或初步研究,未来需要更大样本的前瞻性多中心联合临床试验和随机对照试验来进一步证实。
综上所述,基于DF 自发稳定并消退和极少恶变转移的特性,不论原发性还是复发性DF,WS 策略应作为一线管理选择。在WS期间连续监测评估后判定出现疾病进展或症状的病人,应及时退出。积极治疗手段可以选择抗激素+NSAIDs、低剂量化疗、TKIs 等全身药物治疗,但应该权衡临床获益,经多学科会诊后决定二线治疗方案。同时,药物毒性应由小到大选择使用,根据病人的不良反应严重性和药物耐受性来调整药物剂量。对腹壁等有利解剖部位,当需要积极治疗时,手术可作为一线治疗,但仅限于发病率有限的特殊病人。对于不可手术切除且观察失败的病人,也可尝试ILP 和各类消融等介入治疗。最终,病人在综合治疗后待病情稳定都应继续进入WS策略。