木醋液对几种植物病原真菌的抑菌活性与作用机制
2023-10-12李彦湘丁德东张金花赵吉桃候彩霞
李彦湘,丁德东,何 静,*,张金花,赵吉桃,赵 倩,候彩霞,朱 珠
(1.甘肃农业大学 林学院,甘肃 兰州 730070; 2.陇南市科学技术情报研究所,甘肃 陇南 742500)
植物侵染性病害是由细菌、真菌、线虫、原生动物和病毒等多种微生物引起的[1],其中,真菌是主要致病因子之一,可侵染植物的根、茎、叶、花、果等大部分部位[2]。近年来,真菌病害的频繁发生导致植株生长不良,产量和质量下降,甚至引起植株死亡。现阶段化学防治仍是控制该类病害的主要手段,然而,化学农药的密集使用,严重影响了作物品质,甚至对人类和整个生态环境构成了巨大威胁[3-4]。因此,寻找高效、环保的绿色新型抗真菌药剂已成为亟待解决的问题之一[5-6]。
木醋液是以木材或木材加工废弃物、采伐剩余物,以及森林抚育采伐获得的枝条等为材料,在干馏设备中干馏,导出的蒸汽气体混合物经冷凝分离后得到的液体[7]。因其制备所用原材料的种类、精制方法和热解工艺等,其成分与含量略有差异,但都以酚类和酸类为主,此外还有酮类、醛类、酯类、醇类,以及钙(Ca)、镁(Mg)、钾(K)、铁(Fe)、锌(Zn)、锗(Ge)、锰(Mn)等微量元素[8]。现阶段,木醋液已在农林业[9]、畜牧业[10]、食品加工业[11]、化工业[12]、医药卫生业[13]等领域均得到广泛应用。研究表明,木醋液对多种病原菌有抑制活性,如杨树溃疡病菌、石榴干腐病菌、辣椒枯萎病原菌、人参黑斑病菌、桃炭疽病菌等[14-16],但对其作用机制的研究还不成熟。研究者对木醋液中哪些成分起主导作用的说法并不统一[17]。研究发现,木醋液中的酸性物质[18]或酚类物质[19-20]是其发挥抑菌活性的主要成分。木醋液抑菌机制的研究不仅是一项研究热点,同时也是研究难点[21]。目前,木醋液抑菌机制的研究大多集中在细菌方面,已发现的木醋液对细菌的抑菌机制主要有:1)抑制细菌分裂能力;2)破坏细菌细胞膜结构,使细菌内容物渗漏;3)抑制细菌蛋白合成,扰乱细菌代谢。段晓玲等[22]通过研究木屑木醋液、白桦木醋液、杂木木醋液、蒸馏木屑木醋液4种木醋液对大肠埃希菌、枯草芽孢杆菌、金黄色葡萄球菌的生长曲线、细胞膜通透性、菌悬液可溶性糖和可溶性蛋白含量的影响,发现木醋液的抑菌机制主要是通过抑制细菌生长、破坏细胞膜结构导致内含物外泄,以及抑制细菌蛋白的合成,从而使细菌死亡。Shi等[23]研究表明,竹醋液中的酚类物质可以降低细胞膜的通透性和蛋白酶活性,使菌体生理代谢紊乱,抑制细菌生长。施琳[24]研究表明,山杏壳木醋液的主要成分有机酸类物质能够导致细菌细胞壁破裂,从而使菌体细胞内蛋白质含量骤减,有效阻碍细胞生长的全过程。但有关木醋液对植物病原真菌的抑菌机制还鲜有报道。
本研究通过木醋液对7种供试植物病原真菌的室内毒力测定,筛选敏感菌,并通过考察其对供试敏感菌孢子萌发、菌丝干重、细胞膜通透性、细胞壁完整性、可溶性蛋白、可溶性糖、还原性糖和腺嘌呤核苷三磷酸(ATP)含量等指标的影响,结合电镜观察菌体超微结构变化揭示其作用机制,为木醋液在植物病害绿色防控中的应用提供理论依据,对农林业可持续发展具有重要意义。
1 材料与方法
1.1 供试材料
供试的7种植物病原真菌为木贼镰刀菌(Fusariumequiseti)、腐皮镰刀菌(Fusariumsolani)、杨生盾壳霉(Coniothyriumpopulicola)、尖孢镰刀菌(Fusariumoxysporum)、黄色镰孢菌(Fusariumculmorum)、三线镰孢菌(Fusariumtricinctum)、链格孢菌(Alternariaalternata),均由甘肃农业大学林学院森林保护实验室提供,经活化后在0~4 ℃保存备用。
木醋液:桃壳木醋液购自石家庄宏森木炭有限公司,是以桃壳为原材料在干馏设备中干馏导出的蒸汽气体混合物经冷凝分离后得到液体,呈淡黄色半透明,具有烟熏香味,pH值2.3。
1.2 木醋液对7种病原真菌的抑菌活性
将供试的7种植物病原真菌接种在马铃薯葡萄糖琼脂(PDA)培养基上,于28 ℃培养7 d后取菌饼,分别接种于木醋液体积分数为0、1.5、2.5、3.5、4.5、5.5、6.5、10.5、14.5、18.5、22.5、26.5、30.5 μL·mL-1的琼脂培养基中央,每个处理重复3次,28 ℃培养7 d后,测定菌落生长直径,计算其抑制率。
1.3 木醋液对F. culmorum的影响
1.3.1 孢子萌发和芽管伸长
孢子悬浮液的制备:在PDA平板上接种F.culmorum,28 ℃黑暗培养7 d,用无菌水冲洗孢子并稀释,最终制成6×106mL-1孢子悬浮液备用。
将孢子悬浮液和不同体积分数的木醋液按照1∶1的比例滴在载玻片上,使木醋液的终体积分数为0、1.5、2.5、3.5、4.5、5.5 μL·mL-1(F.culmorum在木醋液体积分数为6.5 μL·mL-1时不生长),混匀后放于滤纸保湿的培养皿中,28 ℃黑暗培养6 h,然后在光学显微镜下观察孢子萌发率和芽管长度,每处理3次重复,每个重复随机取5个高倍镜视野(每个视野下约20个孢子)进行镜检。以芽管长度超过孢子直径一半记为萌发,用下式计算孢子萌发率:
Rg=n/N。
(1)
式(1)中:Rg表示孢子萌发率;n表示孢子萌发数;N表示总孢子数。
1.3.2 生物量
将上述孢子悬浮液加入马铃薯葡萄糖(PDB)液体培养基中,经28 ℃、160 r·min-1避光振荡培养2 d后,过滤菌丝并转移至含药PDB培养基中(木醋液体积分数分别为0、1.5、2.5、3.5、4.5、5.5 μL·mL-1);然后28 ℃、160 r min-1避光振荡培养0、3、6、9、12、24、36、48 h,收集菌丝晾干后称其质量,每处理3次重复。
1.4 木醋液对菌体细胞结构的影响
1.4.1 超微结构
菌丝制备:将制备好的孢子悬浮液加入PDB中,28 ℃、160 r·min-1避光振荡培养2 d后,过滤菌丝并将菌丝转移到新的含药PDB中(木醋液体积分数分别为4.98 μL·mL-1和5.5 μL·mL-1),以无菌水为对照;然后28 ℃、160 r·min-1避光振荡培养6 h,收集菌丝备用。采用Chen等[25]的方法,取上述菌丝固定,脱水、浸透、包埋、切片后,使用透射电镜(Hitachi HT7800/HT7700)观察并拍照。
1.4.2 细胞膜
将F.culmorum在PDA培养基中培养4 d后收集菌丝,用无菌水冲洗3~4次,称取0.2 g菌丝加入10 mL 4.98 μL·mL-1木醋液溶液中,28 ℃、160 r·min-1避光振荡培养,分别于0、3、6、9、12、24、48 h测定电导率,最后加热煮沸20 min,然后测定电导率。以加相同体积的无菌水为对照,每个样品3次重复。以相对渗透率表示细胞膜的通透性,计算公式如下:
Rp=(ECt-EC0)/(ECb-EC0)。
(2)
式(2)中:Rp表示相对渗透率;ECt表示处理相对时间电导率值;EC0表示起始时间电导率;ECb表示煮沸处理后电导率。
将F.culmorum孢子悬浮液在含药PDB中培养(木醋液体积分数为4.98 μL·mL-1),以无菌水为对照。6 h后收集孢子,用适量磷酸盐缓冲液(PBS)冲洗悬浮液,用终质量浓度为10 μg·mL-1碘化丙啶(PI)染色20 min。将染色后的孢子用PBS缓冲液充分洗涤3次,使用激光共聚焦显微镜(Zeiss LSM800德国)观察孢子染色情况,以确定细胞膜的破损程度。
1.4.3 细胞壁
F.culmorum菌丝体细胞壁完整性以碱性磷酸酶(AKP)的泄漏情况来表示[26]。采用上海优选生物科技有限公司试剂盒测定AKP活性。将F.culmorum在PDA培养基中培养4 d后,收集菌丝并称取0.2 g加入10 mL 4.98 μL·mL-1木醋液溶液中,28 ℃、160 r·min-1避光振荡培养,分别于0、3、6、9、12、24、48 h取上清液,于37 ℃恒温条件下测定其在510 nm处的吸光度。按照相应的蛋白质浓度计算AKP活性,以37 ℃条件下每毫克蛋白质每分钟催化产生1 μmol酚为1个酶活力单位。以加相同体积的无菌水为对照,每个处理重复3次。
1.5 木醋液对F. culmorum菌丝体细胞成分的影响
菌丝制备方法同1.4.3节。采用蒽酮比色法[27]测定可溶性糖含量。取0.2 g菌丝加入10 mL蒸馏水中,沸水浴30 min,自然冷却后过滤并将滤液定容至25 mL。取0.5 mL滤液,分别加入蒸馏水、蒽酮-乙酸乙酯、浓硫酸,然后置于620 nm处测定吸光度。按葡萄糖标准曲线计算出相应的可溶性糖含量,以无菌水为对照,每个样品重复3次。
采用考马斯亮蓝G-250法[28]测定可溶性蛋白含量,取0.2 g菌丝研磨至匀浆,离心取上清液加入考马斯亮蓝,在595 nm处测定吸光度,按蛋白质标准曲线计算相应蛋白质浓度,以无菌水为对照,每个样品重复3次。
采用3,5二硝基水杨酸法[29]测定还原性糖含量,取上述上清液1 mL,加入2 mL二硝基水杨酸(DNS),沸水浴5 min,迅速冷却并定容至10 mL,于540 nm处测定吸光度。按葡萄糖标准曲线计算出相应的还原性糖含量,以无菌水为对照,每个处理重复3次。
参考杨书珍[30]的方法,采用高效液相色谱法测定菌体ATP含量。取0.6 g菌丝体,加入3 mL 3%的高氯酸溶液,冰浴研磨均匀后离心10 min,取1 mL上清液,加80 μL 20%的氢氧化钾溶液,4 ℃静置30 min,于10 000×g离心5 min,取上清液进行测定。
高效液相色谱仪为Waters 2695,检测器为Waters 2998 PDA检测器。色谱柱为Hypersil ODS(200 mm×4.6 mm,25 μm),RP C18柱,流动相:A为200 mmol·L-1pH值6.5的KH2PO4-K2HPO4缓冲液,B为3%甲醇,等度洗脱,流速0.7 mL·min-1,进样量10 μL;检测波长为254 nm。
1.6 数据分析
试验数据采用Microsoft Excel 2016、Origin 2018软件处理,利用SPSS 22.0软件进行数据统计和方差显著性分析,采用单因素方差分析和Duncan's新复极差法进行差异显著性检验,显著性水平为α=0.05。
2 结果与分析
2.1 木醋液对7种病原真菌的抑菌活性
由表1可知,木醋液对黄色镰刀菌、三线镰刀菌、杨生盾壳霉、木贼镰刀菌、链格孢菌、尖孢镰刀菌和腐皮镰刀菌均有一定的抑制作用,其EC50值分别为4.98、5.10、5.33、9.69、10.80、26.50、22.04 μL·mL-1。其中,黄色镰刀菌对木醋液最为敏感。因此,本文以黄色镰刀菌(F.culmorum)为供试菌,进行木醋液抑菌机制的相关研究。

表1 木醋液对7种植物病原真菌的抑制作用
2.2 木醋液对F. culmorum的影响
2.2.1 孢子萌发和芽管伸长
由图1可知,木醋液显著(P<0.05)抑制了F.culmorum孢子的萌发和芽管伸长。经28 ℃培养6 h后,对照组F.culmorum的孢子萌发率达90%以上,而5.5 μL·mL-1木醋液处理的F.culmorum孢子萌发率仅为8.99%。低体积分数(1.5、2.5 μL·mL-1)木醋液处理的F.culmorum的芽管长度分别较对照降低21.93%和19.54%,当木醋液处理体积分数≥3.5 μL·mL-1时,芽管长度较对照降低55%以上。
2.2.2 生物量
木醋液对F.culmorum生物量的影响如图2所示,随着木醋液体积分数的升高,F.culmorum菌丝的生物量逐渐降低,且呈剂量依赖性。供试体积分数下,木醋液对F.culmorum菌丝生物量抑制率分别为17.94%、31.90%、48.75%、75.75%、95.22%。
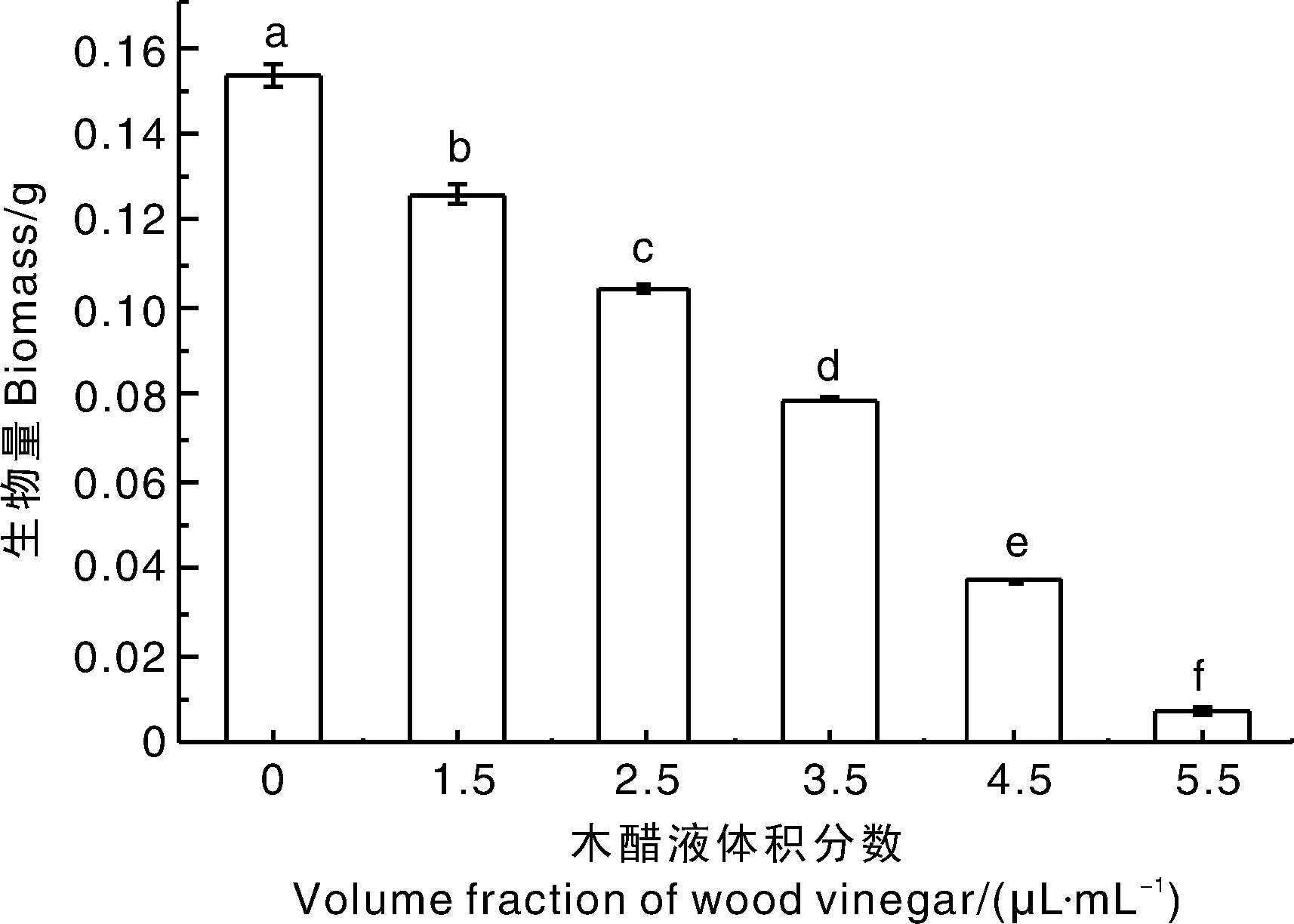
图2 木醋液对黄色镰刀菌生物量的影响Fig.2 Effect of wood vinegar on biomass of F. culmorum
2.3 木醋液对菌体细胞结构的影响
2.3.1 超微结构
由图3可知,未经木醋液处理的F.culmorum,其菌丝细胞壁和细胞膜薄厚均匀,结构完整,细胞基质丰富,细胞器结构完整,分布有序(图3-A);经4.98 μL·mL-1木醋液处理后,细胞壁结构破损,内含物泄漏,细胞内部结构紊乱(图3-B);经5.5 μL·mL-1木醋液处理后,各细胞器结构紊乱,处于降解状态,细胞内含物大量外渗(图3-C)。
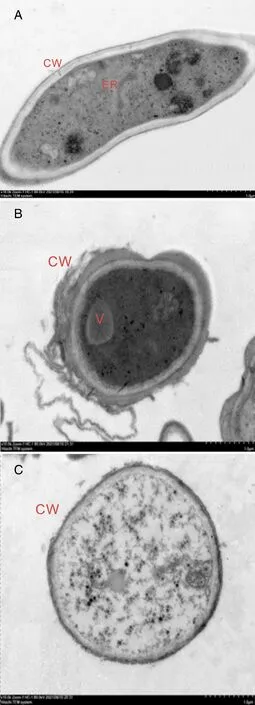
A,对照组;B,4.98 μL·mL-1 木醋液处理;C,5.5 μL·mL-1木醋液处理;CW,细胞壁;ER,内质网;V,液泡。A, Control; B, Treatment with 4.98 μL·mL-1 wood vinegar; C, Treatment with 5.5 μL·mL-1 wood vinegar; CW, Cell wall; ER, Endoplasmic reticulum; V, Vacuole.图3 木醋液对黄色镰刀菌超微结构的影响Fig.3 Effects of wood vinegar on ultrastructure of F. culmorum(2 000×)
2.3.2 细胞膜和细胞壁
PI是一种荧光染料,可穿过受损的细胞膜进入细胞与核酸结合,形成一种红色的荧光。未经木醋液处理的F.culmorum孢子呈现微量荧光,经木醋液处理后,孢子呈现强烈的红色荧光(图4-A),处理组荧光强度是对照组的6.52倍(图4-B)。
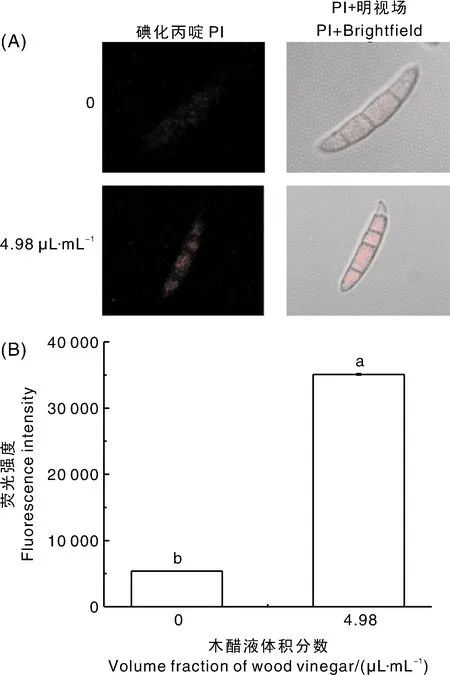
图4 木醋液对黄色镰刀菌细胞膜完整性的影响Fig.4 Effects of wood vinegar on cell membrane integrity of F. culmorum
木醋液对F.culmorum细胞膜通透性的影响见图5-A。在0~12 h,对照组和处理组的菌悬液相对渗透率均迅速上升,12 h时,处理组的相对渗透率是对照组的1.73倍,说明4.98 μL·mL-1木醋液在作用12 h时,对F.culmorum细胞膜破坏力度大。在12~48 h,处理组和对照组的相对渗透率上升程度趋于平缓,但处理组仍极显著(P<0.01)高于对照组。表明木醋液处理增加了F.culmorum细胞膜的通透性,对细胞膜造成了损伤。
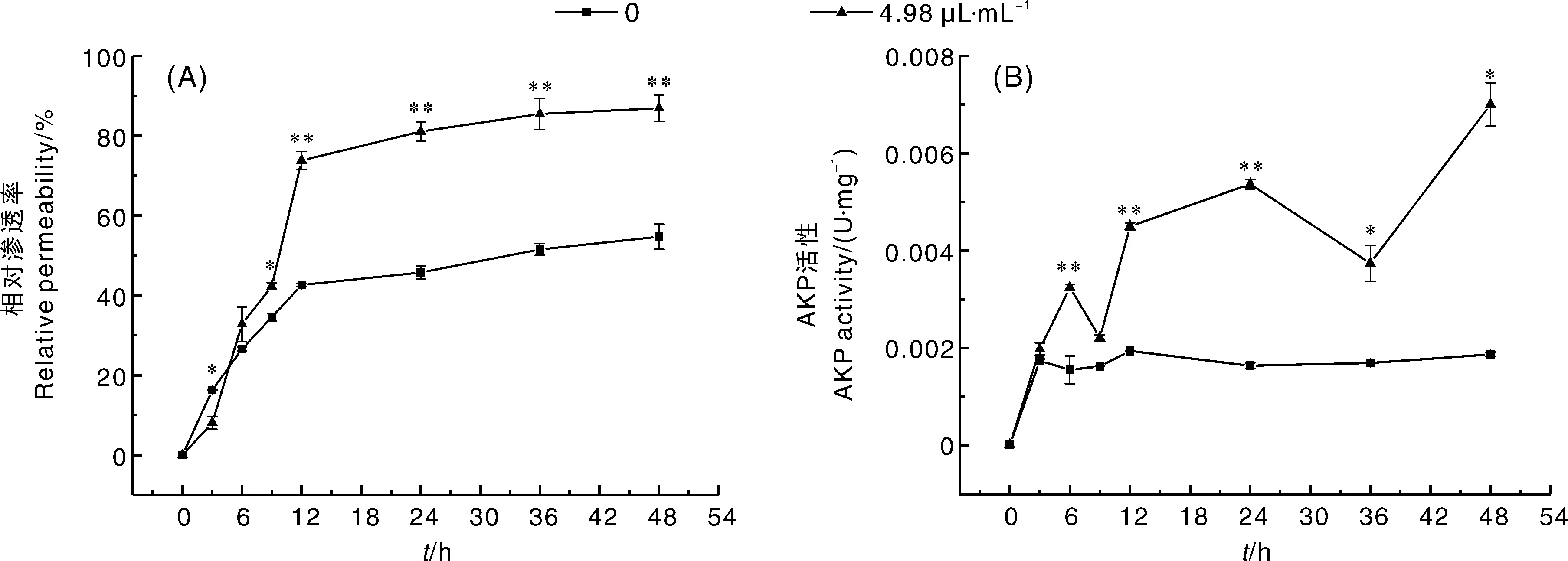
*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下同。* indicates significant difference at P<0.05, and ** indicates significant difference at P<0.01. The same as below.图5 木醋液对黄色镰刀菌相对渗透率和AKP活性的影响Fig.5 Effects of wood vinegar on relative permeability and AKP activity of F. culmorum
木醋液对黄色镰刀菌细胞壁完整性的影响如图5-B所示。木醋液处理黄色镰刀菌后,菌体AKP活性整体呈上升趋势,处理组AKP活性始终大于对照组。对照组在0~3 h AKP活性上升幅度最大,随后趋于平缓。处理组在0~12 h有明显的上升趋势,随后上升幅度有明显的减缓,表明木醋液对菌体的破坏作用主要集中在前12 h。在48 h,AKP活性达到最高值,处理组是对照组的3.74倍。
2.4 木醋液对菌体细胞成分的影响
木醋液对F.culmorum可溶性糖含量的影响见图6-A。在6~9 h,对照组与处理组无显著性差异(P>0.05)。在9~24 h,处理组的可溶性糖含量显著(P<0.05)低于对照组,24 h时,处理组比对照组低41.03%,表明木醋液作用于F.culmorum后,菌体可溶性糖的合成受到抑制,导致菌体分解和合成代谢不平衡,从而使菌体死亡。
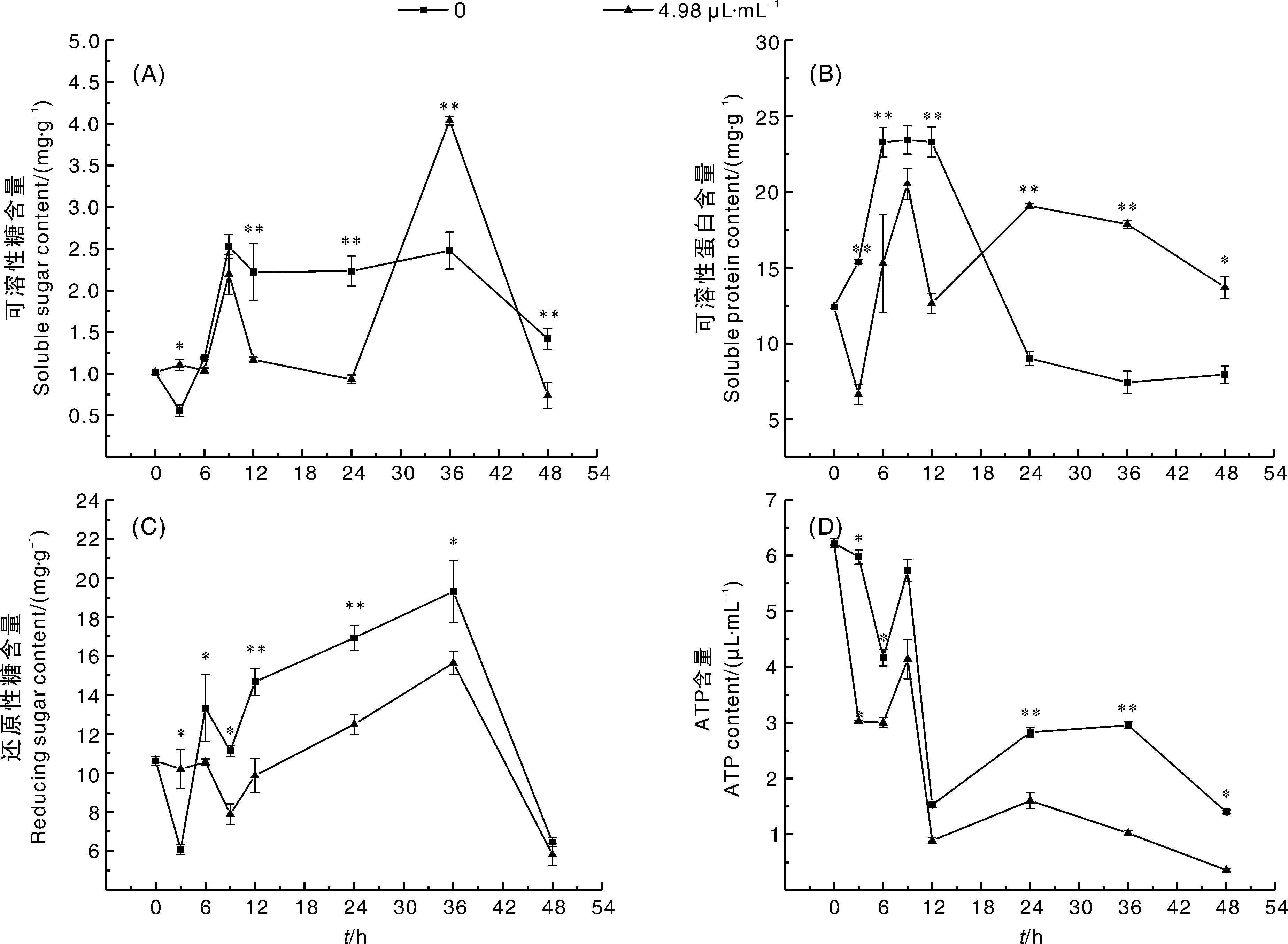
图6 木醋液对黄色镰刀菌可溶性糖、可溶性蛋白、还原性糖和ATP含量的影响Fig.6 Effects of wood vinegar on contents of soluble sugar, soluble protein, reducing sugar and ATP of F. culmorum
木醋液对F.culmorum可溶性蛋白含量的影响见图6-B。随着处理时间的延长,菌体可溶性蛋白含量总体呈下降趋势。在0~12 h,对照组可溶性蛋白含量高于处理组,表明木醋液处理下,菌体蛋白结构被破坏,使之水解或变性,从而抑制蛋白的合成。
由图6-C可知,F.culmorum经木醋液处理后,菌体还原性糖含量总体呈下降趋势,且对照组显著(P<0.05)高于处理组。在36 h,还原性糖含量达到峰值,对照组还原性糖含量为19.30 mg·g-1,是处理组(15.64 mg·g-1)的1.23倍,表明F.culmorum培养液中加入木醋液后,菌体在生长过程中对糖的吸收利用能力降低。
如图6-D所示,F.culmorum经木醋液处理后,ATP含量呈下降趋势,3~6 h和24~28 h,对照组显著高于处理组,推测木醋液处理下F.culmorum菌体能量代谢紊乱。
3 讨论
植物源活性物质以其安全、无公害的特性成为当前研究的热点。木醋液是以农林废弃物为原材料在高温绝氧条件下热解产生的气体经冷凝得到的混合物,因其成分的多样性,具有广谱的抑菌活性[31-32]。Zhang等[33]研究表明,木醋液中的酸和酚显著抑制细菌的生长。郭运玲等[34]研究表明,木醋液对玉米大斑病菌的菌丝生长、孢子萌发有显著的抑制作用。本研究发现,木醋液对7种植物病原真菌均有不同程度的抑菌活性,对黄色镰刀菌的抑制作用最强,造成黄色镰刀菌菌丝生长变慢,孢子萌发率和生物量显著降低,推测木醋液在植物真菌病害的生物防治中具有潜在的应用价值,但具体是何种成分在其抑菌活性中起主导作用,还有待通过进一步的研究进行揭示。
生物细胞膜是许多植物活性物质抑制病原真菌的作用位点[35-36]。Pei等[26]研究发现,香芹酚处理引起茶树疽病菌(Colletotrichumfructicola)菌丝形态异常,细胞质膜破坏,胞内细胞器解体,菌悬液电导率增大,细胞渗透增加。袁康等[37]研究发现,紫苏精油处理后的灰绿曲霉经PI染色后荧光强度明显增加。本研究通过透射电镜观察发现,木醋液作用于F.culmorum时,细胞壁结构破损,内含物泄漏,细胞内部结构紊乱,细胞器损伤;进一步研究结果表明,木醋液使F.culmorum菌悬液相对渗透率增加,PI染色后的孢子荧光强度增加,表明木醋液对黄色镰刀菌的细胞膜造成损伤,这可能是由于木醋液中的有机酸类物质与细胞膜中磷脂多糖等成分互作,破坏膜稳定性。碱性磷酸酶位于细胞壁和细胞膜的间隙之中,正常情况下不会向外分泌,但当细胞遭到破坏后,其会泄漏到细胞外,因此可以通过胞外碱性磷酸酶含量的变化反映细胞壁完整性的变化[38]。F.culmorum经木醋液处理后,AKP活性上升,推测木醋液破坏了菌体细胞壁完整性,从而达到抑菌效果。
糖和蛋白是重要的能源物质[39]。真菌作为异养生物,从外界获取糖类物质,进而合成各种能源物质,为菌体的生长提供能量[40]。尹大川等[41]研究发现,用绿木霉(Trichodermavirens)T43的发酵液提取物处理4种重要林木病原菌后,菌体可溶性糖和可溶性蛋白含量均呈降低趋势,菌体蛋白质结构被破坏,使之水解或变性,从而抑制蛋白质的合成。阮元等[42]研究表明,盐酸小檗碱使小麦赤霉菌菌体还原性糖含量降低,影响小麦赤霉菌对还原性糖吸收和利用。本研究中,木醋液可导致F.culmorum的可溶性糖、可溶性蛋白和还原性糖含量降低,这与前人的研究结果一致。这可能是由于木醋液使胞内物质代谢失衡,物质运输中断,酶和DNA等物质的合成受阻所引起。
ATP为生物体的生理活动提供直接能量,是保证生物体生命活动的必要能量物质,它在生物体中的含量变化可以直接表明生物体的生理活动强度[43]。在本研究中,F.culmorum经木醋液处理后,ATP含量不断降低,表明木醋液处理下F.culmorum细胞内能量物质减少。这可能是由于木醋液抑制了某些产能代谢通路引起的,如三羧酸循环等。
综上,木醋液主要是通过破坏菌体细胞结构、扰乱菌体物质代谢和能量代谢来实现其对植物病原真菌的抑菌作用。本研究结果为木醋液在植物病害绿色防控中的应用提供了理论依据,但本研究仅从细胞结构和生理代谢方面阐述了木醋液的抑菌机制,后续还需从分子方面进一步研究补充印证。
