胃癌病人术后营养不良和肌少症发生现状及其与衰弱的相关性研究
2023-10-12龙玲慧屈惠琴徐予平
龙玲慧,陈 珊,屈惠琴,徐予平
在我国,胃癌的发病率和死亡率仅次于肺癌,居发病率和死亡率第2位。有研究报道,超过80%的胃癌病人营养不良[1]。衰弱是一种老年人生理储备能力下降导致机体易损性增加、抗应激能力减退的非特异性状态[2]。衰弱与多个生理系统的生理储备和功能下降有关。其特征是个体依赖性及不良临床健康结局风险增加[3-6],使机体极易发生跌倒、失能、急性病、住院、医源性问题、死亡等不良事件,给病人、家庭及社会带来巨大的负担。衰弱在预测死亡率和结果方面已被证明是比实际年龄更好的判断工具,并且已开发并验证了预测模型来识别衰弱[7]。肌少症是一种以骨骼肌质量和力量进行性和全身性丧失为特征的综合征。与通常化疗引起的体重减轻或一般恶性肿瘤相关恶病质综合征不同,肌少症与肌肉量有关。研究证实,胃癌病人术后衰弱和肌少症是短期和长期结局的最强预测因素[8-9]。
本研究采用队列研究的方法,通过分析242例胃癌病人术后营养不良和肌少症发生现状,探讨术后营养不良、肌少症与术后3、6、12个月内衰弱的相关性,以期通过纠正术后营养不良来减少术后12个月内因衰弱带来的不良事件发生。
1 资料与方法
1.1 一般资料
采用便利抽样的方法选取2019年1月—2022年6月就诊于我院肿瘤外科的300例胃癌手术病人为研究对象。纳入标准:1)年龄≥18岁;2)符合《胃癌诊疗规范(2018年版)》中胃癌的诊断标准,且经医院病理科、影像科等确诊患有胃部恶性肿瘤,并行肿瘤切除术;3)出院时Barthel量表评分≥20分;4)意识清楚,认知功能正常,与调查人员沟通无障碍;5)病人或家属知情同意,自愿参加研究。排除标准:1)合并其他肿瘤、休克、肿瘤远处转移、肢体残疾等;2)术后并发梗阻、出血等严重并发症。本研究已通过我院伦理委员会审批(编号:KZY2018-012-02)。
1.2 方法
1.2.1 研究方法
本研究采用队列研究的方法,仅对入组病人进行问卷调查及量表评估,未进行任何干预,所有治疗及护理方法均参照我院肿瘤外科胃癌病人术后护理常规进行日常护理及回访。
1.2.2 评价工具
1.2.2.1 营养不良诊断标准
根据体质指数(BMI)判断营养情况[10],分为营养不良(BMI<18.5 kg/m2)、正常(BMI为18.5~<24.0 kg/m2)、营养过剩(BMI≥24.0 kg/m2)。
1.2.2.2 肌少症评估
采用肌肉减少症五条目(SARC-F)问卷评估胃癌术后病人肌少症情况。该量表由我国学者王晓英[11]于2018年进行汉化,包括5个条目,依次为评估力量、行走能力、起立能力、爬楼梯能力和跌倒情况,各条目得分0~2分,总分为0~10分,总分≥4分即可判断存在肌少症风险。该量表的Cronbach′s α系数为0.803,重测信度为0.821,信效度良好[12]。
1.2.2.3 衰弱评估
采用2005年Rockwood等在加拿大健康与衰老研究(CSHA)中提出的临床衰弱量表(CFS)[13]对入组人员进行评价。该量表将老年病人的身体状态分为9个等级,即非常健康、健康、维持健康、脆弱易损伤、轻度衰弱、中度衰弱、严重衰弱、非常严重衰弱及终末期,分别计1~9分。本研究将1级或2级定义为无衰弱,3级或4级定义为衰弱前期,≥5级定义为衰弱。该量表Kappa值为0.74~0.85,Cronbach′s α系数为0.86[14]。
1.2.2.4 一般资料调查
采用我院入院病人一般资料评估量表以及日常生活能力评估量表(ADL)对入组病人一般资料进行调查。
1.2.3 质量控制
严格按照纳入与排除标准选择研究对象,对实施评估的护理人员进行量表的培训和考核,合格后方可进行评估。BMI由本研究者在胃癌病人入院时、出院前分别收集。SARC-F问卷一般在胃癌病人出院前发放,由病人独立填写后回收。CSHA-CFS量表则在胃癌病人术后3、6、12个月回访时进行调查回收,采用面对面、微信或电话回访方式进行。由本研究者用同一语气在保证隐私的情况下进行调查,确保数据的准确性和真实性。
1.2.4 统计学方法
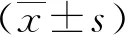
2 结果
2.1 一般资料分析
本研究共纳入300例胃癌术后病人,研究期间有55例先后失访脱落,3例因术后严重并发症出组脱落,最终纳入242例,年龄(55.35±10.23)岁。其中,男157例,女85例,具体一般资料见表1。

表1 242例胃癌病人一般人口学资料
2.2 胃癌病人营养不良、肌少症与衰弱现状分析
收集胃癌病人术前、出院时的BMI,出院前回收SARC-F问卷,在术后3、6、12个月分别采用CSHA-CFS量表进行问卷调查。结果显示:胃癌病人术前37.60%存在不同程度的营养不良,术后出院时营养不良发生率达58.68%;60.74%的病人存在肌少症风险;术后3个月仅有19.42%的胃癌术后病人未出现衰弱,胃癌术后6、12个月衰弱前期与衰弱病人占比超过75%,具体见表2。

表2 242例胃癌病人营养不良、肌少症与衰弱现状
2.3 相关性分析
242例胃癌病人中,术后营养不良合并肌少症病人共有132例,占54.55%。回收的数据分为定性资料和定量资料,定量资料经正态性检验后采用Pearson或Spearman相关分析发现,胃癌病人术后BMI与SARC-F问卷得分呈线性负相关关系(r=-0.626,P<0.001),见图1 A,即术后营养不良和肌少症呈正相关关系;此外,胃癌病人术后BMI与术后3、6、12个月CFS得分呈线性负相关关系(P<0.05),即术后营养不良和衰弱呈正相关关系,见图1 B、C、D及表3。

图1 BMI与胃癌病人术后3、6、12个月衰弱相关性图

表3 胃癌病人术后营养不良、肌少症与衰弱的相关性分析(r值)
3 讨论
3.1 胃癌病人术后营养不良发生率较高
胃癌是全球第五大常见的癌症类型,也是癌症相关死亡的第三大常见原因。据报道,营养不良是术后并发症和预后不良的危险因素[15]。本研究结果显示,胃癌病人术后营养不良发生率达58.68%,稍高于Li等[16]研究中胃癌术后53%的营养不良发生率。国外研究也证实,超过50%的胃癌病人术后发生营养不良[17]。术后营养不良可能与围术期营养摄入、术前营养不良、手术机体消耗等有关。研究证实,营养不良病人切口感染的发生率明显高于营养良好病人。此外,营养不良病人的3年总生存期和无病生存率显著低于营养良好病人[18]。胃癌病人术后营养不良发生率居高不下,营养不良带来的诸多问题亟待解决[10]。
3.2 胃癌病人肌少症筛查对围术期不良风险有积极作用
证据表明,随着病人年龄的增长,肌少症与手术结果之间存在相关性。肌少症的特征是骨骼肌质量和力量的丧失,是导致整体虚弱的主要原因。肌少症存在于大部分晚期胃癌病人中,并显著影响病人对化疗的耐受性、手术并发症、肿瘤复发和生存[19]。此外,一项研究表明,骨骼肌质量指数低的病人年龄较大,白蛋白水平和BMI显著降低,表明骨骼肌质量与胃癌病人的营养状况相关[20]。许多研究表明,术前骨骼肌质量指数是预测胃癌术后并发症和生存率的有用营养决定因素[21]。术前运动和营养支持计划有可能减少肌少症和胃癌高龄病人的肌少症并改善术后结果[22]。
肌少症会影响胃癌手术病人的总住院时间、术后住院时间和严重并发症。此外,肌少症可能导致严重的营养不良并增加围术期不良风险[23]。因此,在对胃癌病人进行术前营养筛查和评估期间,应同时对肌少症进行筛查。
3.3 胃癌病人术后营养不良与未来12个月内衰弱发生密切相关
衰弱是影响胃癌术后病人短期和长期生存的重要因素[24]。本研究结果显示,胃癌病人术后营养不良与术后3、6、12个月衰弱状况呈正相关,即术后营养不良预示着未来1年中衰弱风险增加。衰弱被证实是影响生活质量的重要因素,长期较差的健康相关生活质量又将增加衰弱的风险[25]。通过流行病学调查研究发现,衰弱与不良健康结局相关,包括死亡率、残疾、疾病恶化、跌倒和住院风险[26]。此外,一项荟萃分析指出,衰弱对于预测住院死亡率具有重要意义[27]。衰弱筛查作为一种低成本、简单的筛查方法,可用于预测胃癌病人术后5年生存率。
因此,衰弱可能有助于临床环境中的风险预测和决策,预测和改善衰弱、提高生活质量是当前胃癌病人术后亟待解决的问题。
3.4 本研究的局限性
本研究在收集术后肌少症的相关数据时,仅收集了术后肌少症相关数据,应对胃癌病人术后3、6、12个月的肌少症状况进行延续性评价,与同期CFS得分进行比较。此外,在收集资料过程中,因询问病史环节多数未在单独会议室实施,使研究对象可能有意夸大或缩小某些信息,增加了报告偏倚风险。
4 结论
胃癌病人术后营养不良和肌少症发生率处于较高水平,术后营养不良与未来12个月内衰弱密切相关,术后营养不良可为识别衰弱高危病人、及时干预策略提供指导。
