基于Hippo/YAP信号通路探究粉防己碱抗乳腺癌耐药机制
2023-09-13辛国松王毛毛侯妍秀季宇彬李文兰李海茹
辛国松,王毛毛,侯妍秀,杨 燚,于 淼,季宇彬,李文兰,李海茹
基于Hippo/YAP信号通路探究粉防己碱抗乳腺癌耐药机制
辛国松1, 2,王毛毛1,侯妍秀1,杨 燚1,于 淼1, 2,季宇彬1, 2,李文兰1, 2,李海茹3*
1. 哈尔滨商业大学 药物工程技术研究中心,黑龙江 哈尔滨 150076 2. 国家教育部抗肿瘤天然药物工程研究中心,黑龙江 哈尔滨 150076 3. 哈尔滨医科大学附属第二医院,黑龙江 哈尔滨 150086
研究粉防己碱通过调控Hippo/Yes-相关蛋白同源癌蛋白(homologous oncoproteins Yes-associated protein,YAP)信号通路抗乳腺癌多重耐药的分子机制。采用CCK-8法检测粉防己碱对乳腺癌MCF-7/ADR细胞增殖的影响;采用倒置显微镜、荧光显微镜观察细胞形态;采用流式细胞仪检测细胞凋亡率;采用细胞集落实验检测细胞克隆形成能力;采用Transwell实验检测细胞侵袭能力;采用Western blotting检测细胞耐药外排蛋白[P-糖蛋白(P-glycoprotein,P-gp)、乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)、多药耐药相关蛋白(multidrug resistance associated protein,MRP)],Hippo通路关键节点蛋白[YAP1、大肿瘤抑制激酶1(large tumor suppressor kinase 1,LATS1)、哺乳动物不育系20样激酶1(mammalian Sterile20-like kinase 1,MST1)、转录共活化因子(transcriptional co-activator with PDZ-binding motif,TAZ)]和凋亡关键蛋白[半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)、细胞色素C(cytochrome-C,Cyt-C)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)]表达。粉防己碱对MCF-7/ADR细胞具有增殖抑制作用,半数抑制浓度(half inhibitory concentration,IC50)值为14.20 μmol/L;粉防己碱能够改变细胞形态,部分细胞出现凋亡迹象;粉防己碱显著诱导MCF-7/ADR细胞发生凋亡(<0.01),抑制细胞的增殖分化和侵袭能力,显著下调P-gp、BCRP、MRP1、YAP1、TAZ和Bcl-2蛋白表达(<0.01),显著上调MST1、LATS1、Caspase-3、Cyt-C和Bax蛋白表达(<0.01)。粉防己碱能够通过下调MCF-7/ADR细胞P-gp、BCRP和MRP1蛋白表达,抑制外排蛋白活性,增加细胞内粉防己碱含量蓄积;并通过激活Hippo信号通路,上调MST1蛋白表达,激活LATS1,进而调控下游靶点YAP1和TAZ表达,进一步上调Caspase-3、Cyt-C和Bax蛋白表达,下调Bcl-2蛋白表达,启动细胞凋亡程序,发挥抗肿瘤作用。
粉防己碱;乳腺癌;阿霉素;耐药性;Hippo/YAP信号通路
乳腺癌是女性最常见的恶性肿瘤之一,其发病率逐年上升。据统计,2020年女性乳腺癌已经超越肺癌成为全球癌症发病率最高的癌种。2020年全球新增乳腺癌患者达到226万例,死亡68万例,分别占全球新发癌症病例和死亡病例的11.7%和6.8%,乳腺癌成为女性因癌症死亡的主要原因[1-2]。我国乳腺癌发病率在近30年中每年增长2%~3%,成为威胁女性健康的“头号癌症杀手”,卫生部已将乳腺癌列为我国肿瘤防治的重点之一[3-4]。
防己又称粉防己、汉防己,是一种常用的中药,其主要成分为粉防己碱,在中医中广泛用于治疗哮喘、痢疾发烧等疾病。主要具有抗炎、抗肿瘤、抗糖尿病、抗高血压、抗菌、镇痛、抗氧化、抗疟疾虫、抗血小板等药理作用,近年来粉防己碱的抗肿瘤作用受到众多研究者的关注。临床发现乳腺癌细胞具有极强的增殖分化、侵袭和转移的能力,阿霉素是临床上治疗乳腺癌的常用药物,但阿霉素治疗乳腺癌过程中易产生耐药性,难以达到良好的临床治疗效果。因此目前急需寻找能够抑制乳腺癌细胞对阿霉素耐药性的方法和途径,进一步提高阿霉素的临床疗效[5-7]。导致乳腺癌多重耐药的机制为药物外排蛋白在三磷酸腺苷(adenosine triphosphate,ATP)供能的条件下将进入细胞的药物排出胞外,减少药物在癌细胞内的富集,降低药效,引起癌细胞中的多重耐药性。乳腺癌多重耐药产生的主要耐药蛋白为P-糖蛋白(P-glycoprotein,P-gp)、多药耐药相关蛋白(multidrug resistance associated protein,MRP)、乳腺癌耐药蛋白(breast cancer resistance protein,BCRP),是评价和衡量乳腺癌细胞多重耐药特性强弱的指数[8-11]。中药具有整体观念、高效低毒、多靶点作用调控的特点,相关研究表明多种中药活性成分都能够通过调控药物外排蛋白表达、促进肿瘤细胞凋亡逆转乳腺癌多重耐药,表现出对乳腺癌多重耐药的抑制作用[12-13]。而且相关研究还发现粉防己碱能够通过调控Yes-相关蛋白同源癌蛋白1(homologous oncoproteins Yes-assoc iated protein 1,YAP1)表达从而介导Hippo信号通路诱导肿瘤细胞发生凋亡,推测粉防己碱可以通过介导乳腺癌多重耐药外排蛋白,增加乳腺癌细胞内粉防己碱和阿霉素的蓄积,进而降低YAP表达,激活Hippo信号途径诱导乳腺癌细胞发生凋亡,从而发挥抗肿瘤作用,实现临床应用价值[14-18]。
1 材料
1.1 细胞株
乳腺癌MCF-7/ADR细胞由北京北纳创联生物技术研究员质控中心提供。
1.2 药品与试剂
胎牛血清(批号0201021)购自浙江杭天生物科技公司;粉防己碱(质量分数为98%,批号L1607039)购自阿拉丁试剂有限公司;CCK-8试剂盒(批号C0043)、PMSF(批号ST505)、HRP标记山羊抗大鼠IgG二抗(批号A0192)、Western blotting及IP细胞裂解液(批号072318180723)、30% Acr-Bis(批号093018181017)购自碧云天生物技术有限公司;RPMI 1640培养基(批号AD123707271)购自美国HyClone公司;二甲基亚砜(批号20200901)购自天津中和盛泰化工有限公司;碘化丙啶(PI)染液(批号R20285)美国Sigma公司;聚山梨酯-20(批号20190207)购自美国Biotopped公司;Tris(批号181127)购自美国Amresco公司;SDS-PAGE蛋白上样缓冲液(批号P0015)、兔抗YAP1抗体(批号bs-52418R)、兔抗大肿瘤抑制激酶1(large tumor suppressor kinase 1,LATS1)抗体(批号bs-2904R)、兔抗哺乳动物不育系20样激酶1(mammalian Sterile 20-like kinase 1,MST1)抗体(批号bs-3504R)、兔抗转录共活化因子(transcriptional co-activator with PDZ-binding motif,TAZ)抗体(批号bs-12367R)购自北京博奥森生物技术有限公司;兔抗P-gp抗体(批号WL01338)、兔抗BCRP抗体(批号WL03192)、兔抗MRP1抗体(批号WL01027)、兔抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号WL01114)、兔抗半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)抗体(批号WL02512)、兔抗细胞色素C(cytochrome-C,Cyt-C)抗体(批号WL04963)、兔抗B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号WL01506)、兔抗Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号WL02385)购自沈阳万类生物科技有限公司。
1.3 仪器
ECO-170P-230型细胞培养箱(美国NBS公司);Adventurer万分之一电子天平(美国OHAUS公司);Model 680型酶标仪(美国NBS公司);EPICS-XL型流式细胞仪、AllegraTM64R型低温高速离心机(美国Beckman-Coulter公司);荧光显微镜(德国Leica公司);680型全自动酶标仪(美国Bio-Rad公司);微量移液器(芬兰百得公司);标准型PB-10型pH计(德国Sartorius公司);GIS-2019型Tannon凝胶成像系统(天能科技有限公司);DYY-7C型电泳仪、M344039型垂直电泳转印槽(北京六一仪器厂)。
2 方法
2.1 细胞复苏及传代培养
将MCF-7/ADR细胞从−80 ℃冰箱取出,水浴加热融化,加入2 mL含10%胎牛血清的RPMI 1640培养基,1500 r/min离心5 min,弃去上清,重悬细胞,平均分到2个培养瓶中,加入5 mL细胞培养液,在5% CO2、37 ℃恒温培养箱中培养。细胞长势良好时进行传代,弃去培养液,用PBS清洗3次,再加入胰蛋白酶溶液消化,反复吹打得细胞悬液,分装到2个细胞培养瓶中,加入5 mL细胞培养液,于细胞培养箱中培养。
2.2 CCK-8法检测粉防己碱对MCF-7/ADR细胞增殖的影响
MCF-7/ADR细胞以2×104/mL接种于96孔板中,每孔100 μL,于培养箱中培养24 h。分别加入1、2、4、8、16、32 μmol/L粉防己碱100 μL,对照组加入100 μL培养基,每组设置6个平行孔。将96孔板放入培养箱培养48 h,每孔加入10 μL CCK-8试剂,继续培养4 h,用酶标仪检测吸光度()值。
2.3 倒置显微镜和荧光显微镜观察粉防己碱对MCF-7/ADR细胞形态的影响
MCF-7/ADR细胞以3×104/mL接种于6孔板,于培养箱中培养24 h。设置对照组和粉防己碱(7、14、28 μmol/L)组,各给药组加入1 mL粉防己碱,对照组加入1 mL培养基。培养48 h后,用倒置显微镜观察并拍照;每孔中加入1 mL多聚甲醛固定1 h,弃去上清液,冲洗后加入200 μL Hoechst 33258染色液,水浴加热30 min后,用荧光显微镜观察并拍照。
2.4 流式细胞仪检测粉防己碱对MCF-7/ADR细胞凋亡的影响
按“2.3”项下方法进行分组和给药,培养48 h后,吸取上清液,加入胰蛋白酶消化后离心,弃去上清液,加入70%冰乙醇,固定24 h后离心。加入Annexin V和PI染液800 μL,用尼龙网将染色后的细胞过滤。采用流式细胞仪检测细胞凋亡情况。
2.5 集落实验检测粉防己碱对MCF-7/ADR细胞克隆能力的影响
取对数生长期、生长状态良好的MCF-7/ADR细胞,PBS洗涤后加入胰蛋白酶消化,离心后弃去上清液,重悬细胞,用台盼兰染色后以1×103/孔接种于96孔板,培养12~18 h。PBS清洗后,按“2.3”项下方法进行分组和给药,连续培养7 d后弃去培养基,PBS洗涤后用甲醇固定10 min。洗涤后用吉姆萨染液染色,洗涤干燥后置于倒置显微镜下观察细胞集落形成率并拍照。
2.6 Transwell实验检测粉防己碱对MCF-7/ADR细胞侵袭能力的影响
MCF-7/ADR细胞以1×105/mL接种于6孔板,每孔1 mL,培养24 h。按“2.3”项下方法进行分组和给药,培养48 h后,弃去培养液,用PBS洗涤1次,每孔加入0.1 mL 10%甲醇溶液,固定细胞30 s。吸去甲醇溶液,每孔加入0.1 mL结晶紫染液,室温孵育20 min。弃去染色液,用蒸馏水洗涤各孔,将培养板倒置于吸水纸上吸干水分。自然干燥或37 ℃烘干后在显微镜下观察并拍照。
2.7 粉防己碱对MCF-7/ADR细胞耐药蛋白、Hippo通路和凋亡相关蛋白表达的影响
按“2.3”项下方法进行分组和给药,培养48 h后,收集细胞,加入含PMSF的细胞裂解液,裂解30 min后离心15 min,取上清液,煮沸使蛋白变性,采用BCA试剂盒定量蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭2 h后加入一抗,4 ℃孵育过夜;洗膜后加入二抗,室温孵化2 h,洗膜后加入化学发光试剂,显影并用显色仪拍照。
2.8 统计学分析
3 结果
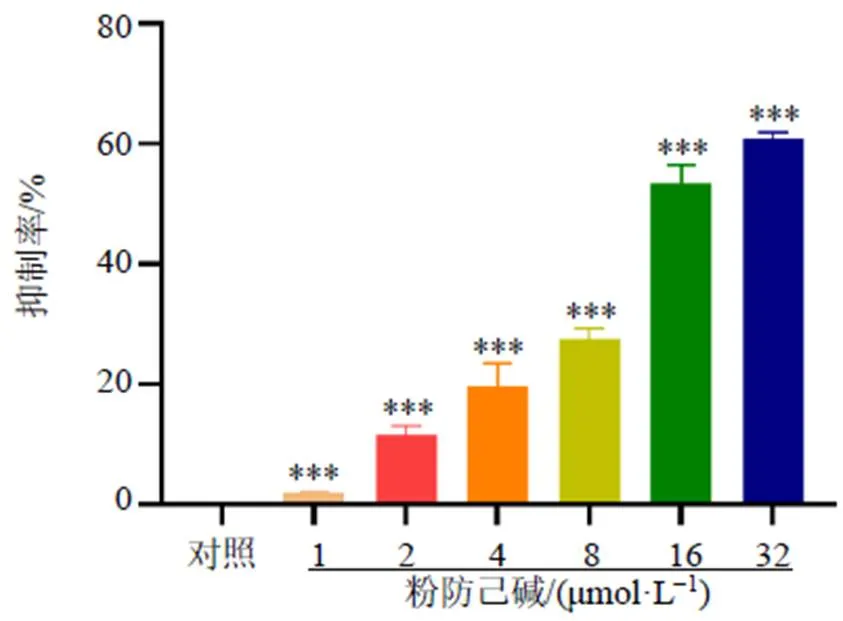
3.1 粉防己碱对MCF-7/ADR细胞增殖的影响
如图1所示,粉防己碱对MCF-7/ADR细胞具有增殖抑制作用,其半数抑制浓度(half inhibitory concentration,IC50)为14.20 μmol/L,并参考IC50值设定后续粉防己碱给药剂量为7、14、28 μmol/L。
3.2 粉防己碱对MCF-7/ADR细胞形态的影响
采用倒置显微镜、荧光显微镜观察粉防己碱对MCF-7/ADR细胞形态的影响,如图2所示,与对照组比较,粉防己碱使肿瘤细胞形态有一定改变,随着给药浓度的增加,细胞大部分变圆漂浮于培养基中,并且出现凋亡小体,且细胞膜破碎明显,细胞排列稀疏,细胞核的荧光强度最强。
与对照组比较:**P<0.01 ***P<0.001,下图同
3.3 粉防己碱对MCF-7/ADR细胞凋亡的影响
如图3所示,与对照组比较,各剂量粉防己碱组MCF-7/ADR细胞凋亡率均显著升高(<0.01),呈剂量相关性。
3.4 粉防己碱对MCF-7/ADR细胞克隆能力的影响
单个MCF-7/ADR细胞在体外持续增殖6代以上,其后代形成1个细胞集落,且每个克隆均包含50个细胞以上,大小为0.3~1.0 mm。如图4所示,对照组肿瘤细胞的集落数量较多,粉防己碱给药组集落数量较少,且呈剂量相关性。表明粉防己碱可以抑制MCF-7/ADR细胞的克隆形成能力。
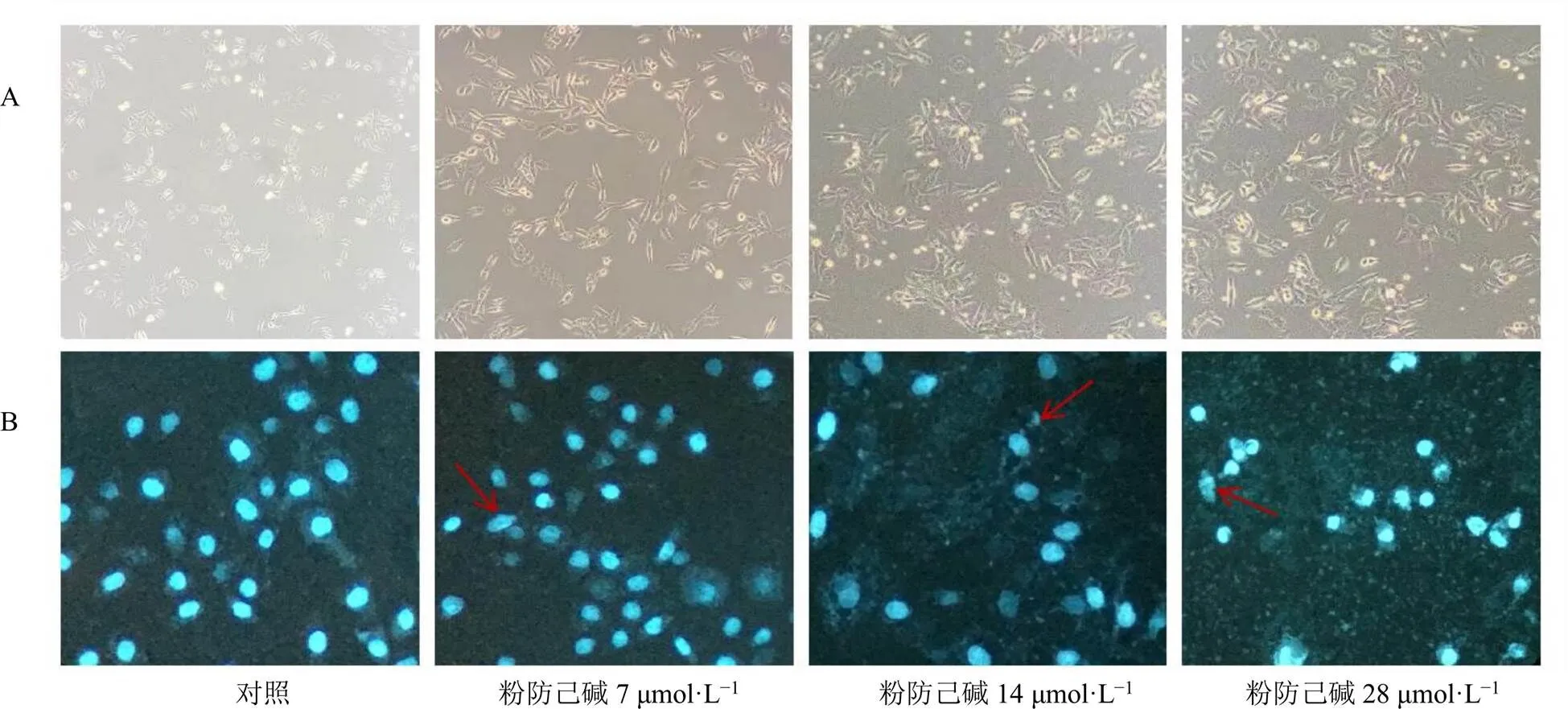
A-倒置显微镜下细胞形态(×100) B-荧光显微镜下细胞形态(×200)
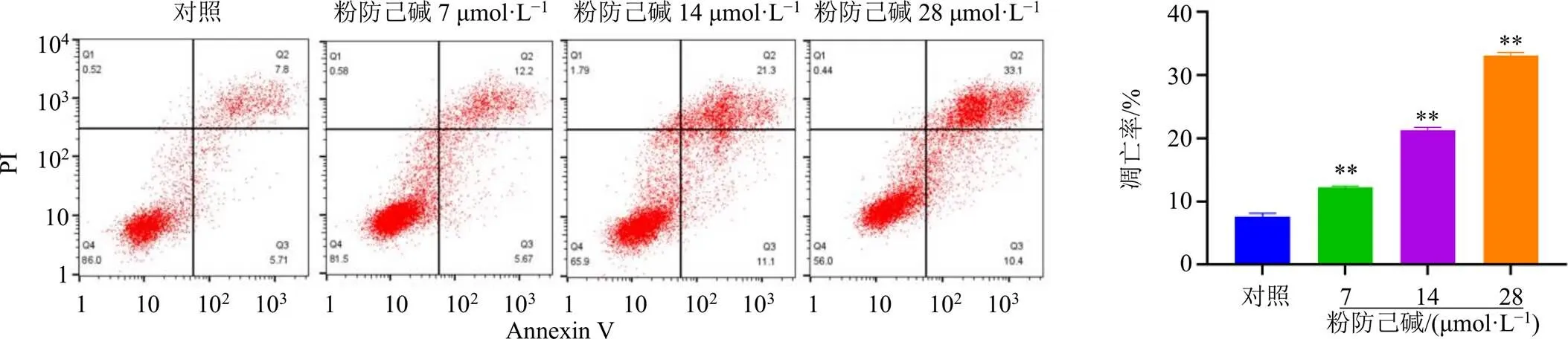
图3 粉防己碱对MCF-7/ADR细胞凋亡的影响(, n = 3)
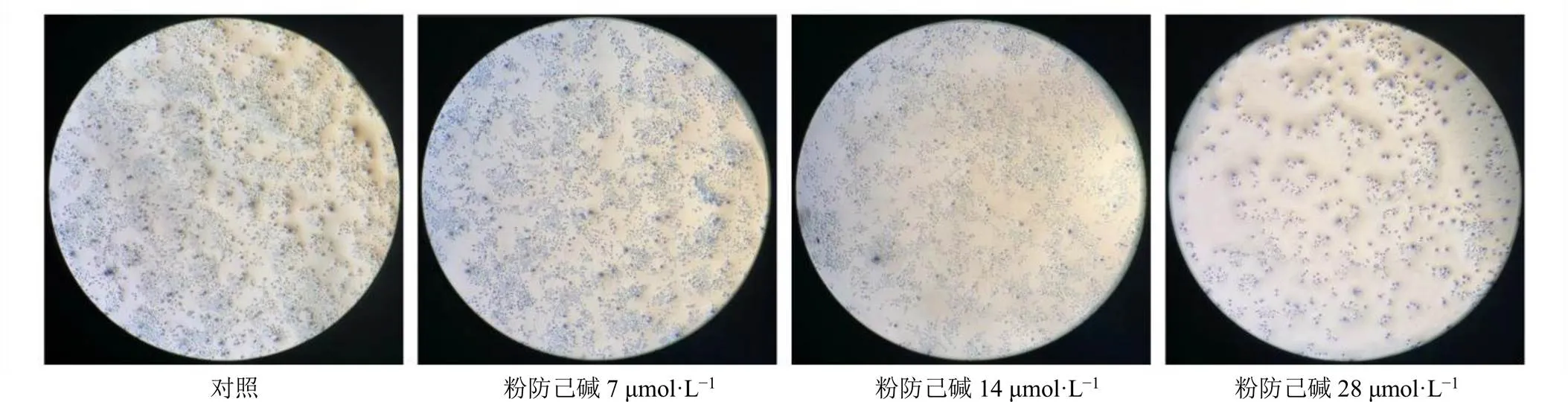
图4 粉防己碱对MCF-7/ADR细胞克隆能力的影响(×40)
3.5 粉防己碱对MCF-7/ADR细胞侵袭能力的影响
如图5所示,与对照组比较,粉防己碱给药组紫色区域呈剂量相关性地减少,且颜色明显变浅。表明粉防己碱能够显著抑制MCF-7/ADR细胞的侵袭能力。
3.6 粉防己碱对MCF-7/ADR细胞耐药蛋白、Hippo通路和凋亡相关蛋白表达的影响
3.6.1 粉防己碱对MCF-7/ADR细胞耐药蛋白表达的影响 如图6所示,粉防己碱各剂量组能够有效降低MCF-7/ADR细胞P-gp、BCRP和MRP1蛋白表达水平(<0.01),且呈剂量相关性。
3.6.2 粉防己碱对MCF-7/ADR细胞Hippo通路关键调控蛋白表达的影响 如图7所示,与对照组比较,粉防己碱各剂量组MCF-7/ADR细胞中MST1和LATS1蛋白表达水平均显著升高(<0.01),YAP1和TAZ蛋白表达水平均显著降低(<0.01),且呈剂量相关性。
3.6.3 粉防己碱对MCF-7/ADR细胞凋亡相关蛋白表达的影响 如图8所示,与对照组比较,粉防己碱各剂量组MCF-7/ADR细胞中Caspase-3、Cyt-C和Bax蛋白表达水平均显著升高(<0.01),Bcl-2蛋白表达水平均显著降低(<0.01),且呈剂量相关性。
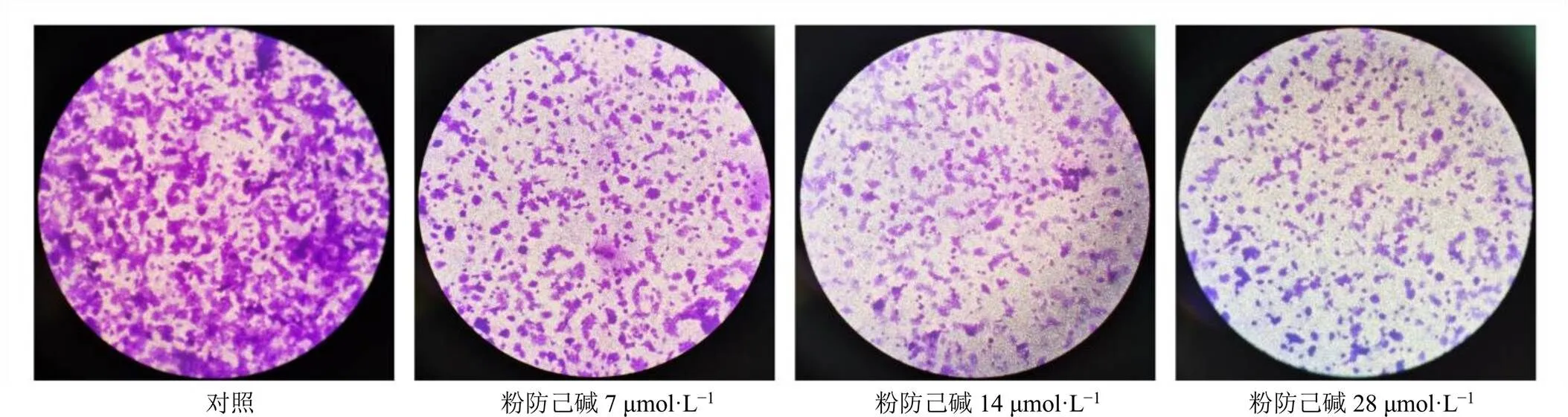
图5 粉防己碱对MCF-7/ADR细胞侵袭能力的影响(×100)
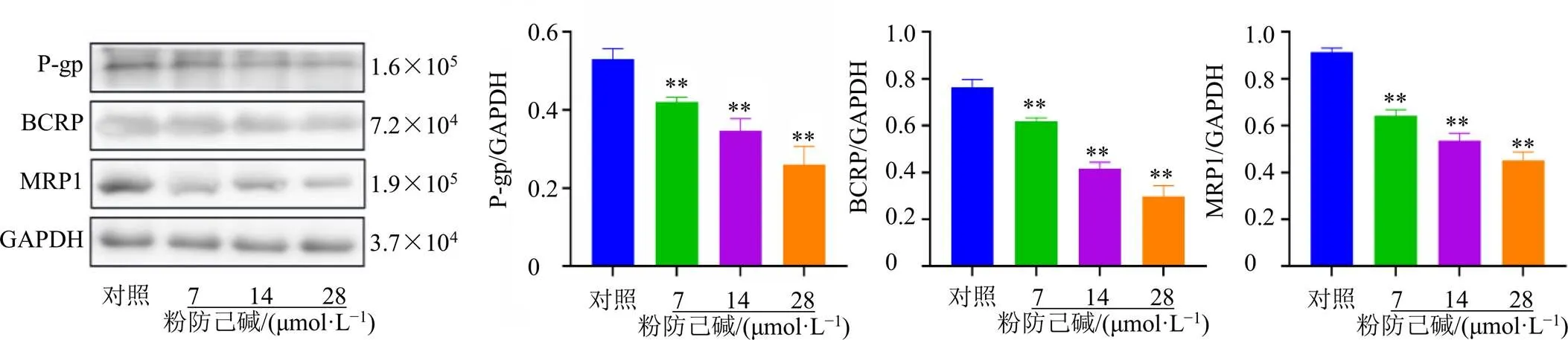
图6 粉防己碱对MCF-7/ADR细胞P-gp、BCRP和MRP1蛋白表达的影响(, n = 3)
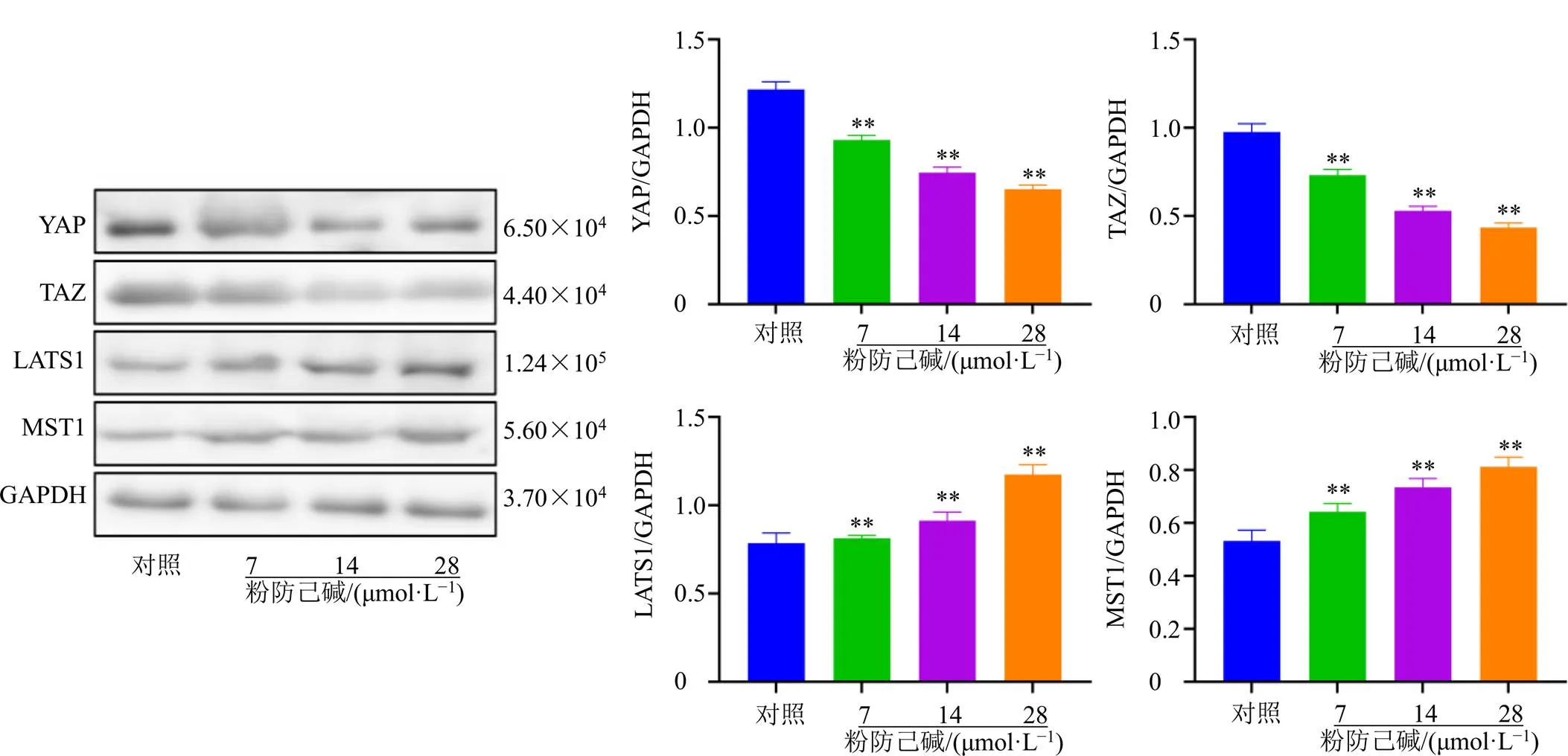
图7 粉防己碱对MCF-7/ADR细胞YAP1、TAZ、LATS1和MST1蛋白表达的影响(, n = 3)
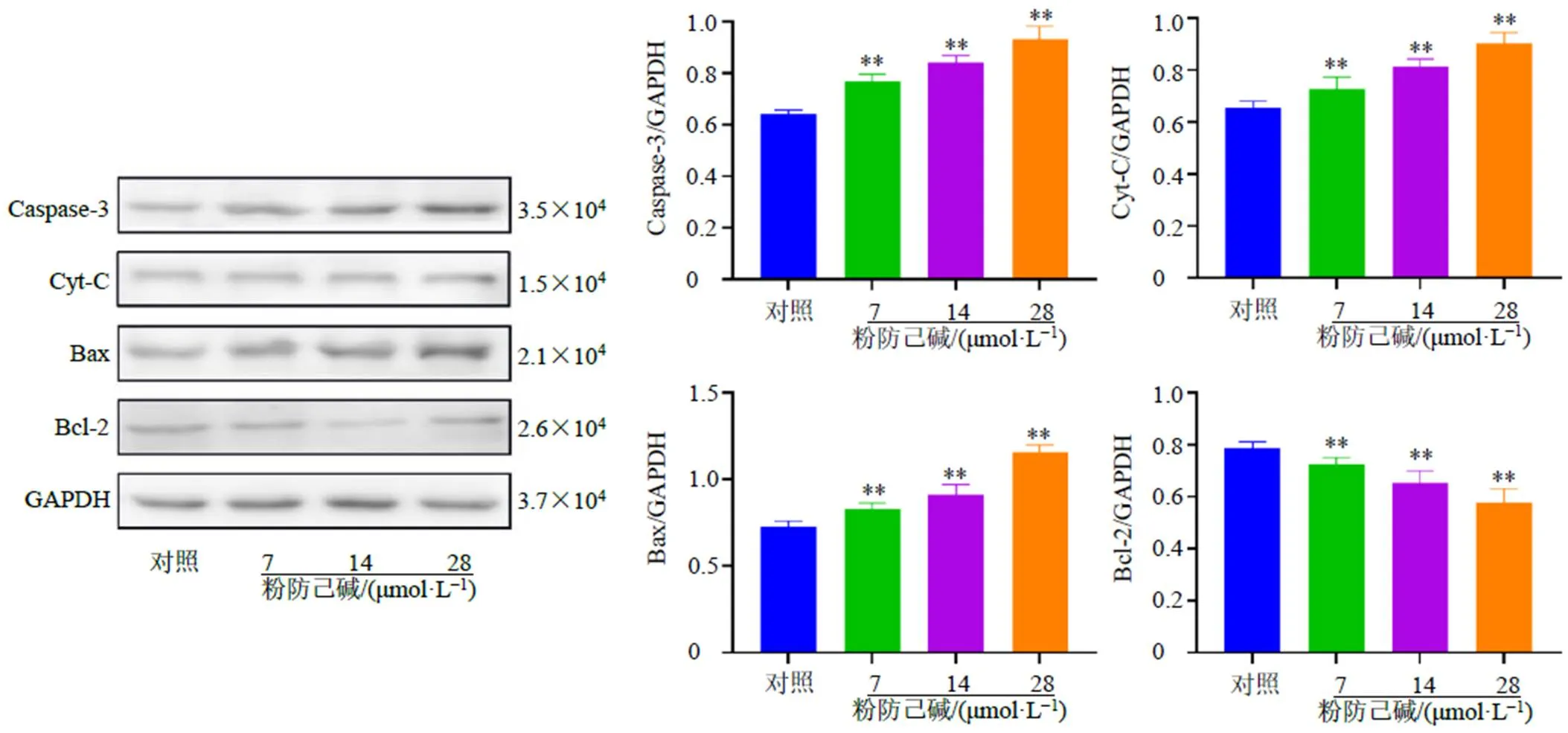
图8 粉防己碱对MCF-7/ADR细胞Caspase-3、Cyt-C、Bax和Bcl-2蛋白表达的影响(, n = 3)
4 讨论
乳腺癌是一种严重危害妇女健康的恶性肿瘤,其增殖、分化、侵袭、转移等特性使其在临床上难以得到有效治疗。阿霉素是目前临床上广泛使用的一种抗肿瘤药物,但由于其在抗肿瘤作用下容易发生耐药性,导致疗效不佳。如何克服乳腺癌的耐药性是目前亟待解决的问题。根据有关文献报道,乳腺癌产生多重耐药的机制为在ATP供能的情况下,药物外排蛋白会将进入细胞的药物排出胞外,减少了药物在肿瘤细胞中的富集,进而降低了药效,产生了肿瘤细胞的耐药性,P-gp、MRP及BCRP是评估乳腺癌多重耐药特征的重要指标[19-21]。中药具有高效、低毒、多靶点、多通路调控的作用特点,其多个有效成分能够调控外排蛋白的表达,从而抑制肿瘤细胞凋亡,进而逆转多药耐药,因此筛选一种中药活性组分逆转乳腺癌多重耐药机制潜力巨大。相关研究表明,粉防己碱可以有效地逆转肿瘤对卡铂、顺铂、紫杉醇等的耐药性,因此,推测粉防己碱可能是通过调节乳腺癌多药耐药外排蛋白的活性,提高药物在胞内的蓄积,并诱导肿瘤细胞凋亡,从而起到抗肿瘤作用[22-24]。
本研究采用CCK-8法检测粉防己碱的IC50值,利用倒置显微镜、荧光显微镜等观察粉防己碱对肿瘤细胞形态的影响,并通过流式细胞仪测定了其对肿瘤细胞凋亡的影响,结果表明粉防己碱对肿瘤细胞的生长有显著影响,并具有一定的剂量相关性。表明粉防己碱能够有效抑制乳腺癌对阿霉素的耐药性。为探究粉防己碱对肿瘤细胞增殖分化和侵袭能力的影响,进行细胞集落实验和Transwell实验。结果显示,粉防己碱能够抑制乳腺癌细胞克隆形成能力,有效降低肿瘤细胞增殖分化和侵袭能力。为进一步探究粉防己碱在MCF-7/ADR细胞中逆转多药耐药的机制,利用Western blotting对耐药蛋白P-gp、BCRP、MRP1的表达进行检测。结果表明,粉防己碱可以通过下调P-gp、BCRP和MRP1蛋白表达水平,减少肿瘤细胞膜蛋白的外排,提高阿霉素在肿瘤细胞内的蓄积,从而提高药物的疗效,并通过阻断P-gp蛋白所介导的多重耐药通路,达到逆转乳腺癌细胞对阿霉素耐药的目的。
以Hippo信号通路为切入点,深入探究粉防己碱对MCF-7/ADR细胞的影响及其分子作用机制。采用Western blotting对Hippo通路中的关键节点蛋白MST1、YAP1、LATS1、TAZ进行分析,发现粉防己碱能够激活Hippo通路上的MST1蛋白,从而提高MST1的表达水平,激活LATS1,活化的LATS1对下游靶基因YAP1和TAZ进行调控,将其磷酸化,降低其含量,从而抑制乳腺癌细胞的增殖和分化[25-26]。Caspase-3、Cyt-C、Bax、Bcl-2是调节凋亡的重要蛋白,Bax和Bcl-2二者通过形成同源和异源二聚体来调节细胞凋亡。Caspase-3可以通过抑制凋亡抑制物,破坏细胞结构使蛋白丧失功能,Cyt-C可以介导细胞凋亡[27-31]。采用Western blotting检测凋亡蛋白Caspase-3、Cyt-C、Bax、Bcl-2表达的变化。结果显示,粉防己碱能够通过上调Caspase-3、Cyt-C和Bax蛋白表达,下调Bcl-2蛋白表达,诱导细胞发生凋亡,表明粉防己碱能够诱导MCF-7/ADR细胞发生凋亡,启动细胞凋亡程序。
综上,粉防己碱可能通过降低P-gp、BCRP、MRP1蛋白在肿瘤细胞内的表达,抑制肿瘤外排蛋白表达活性,增加粉防己碱与阿霉素在乳腺癌细胞中的含量蓄积;并进一步激活Hippo信号通路,上调MST1蛋白表达,活化LATS1,调节YAP1,并促进YAP1的磷酸化,通过下调YAP1和TAZ的表达,抑制乳腺癌细胞增殖分化,促进乳腺癌细胞凋亡,从而达到抗肿瘤的目的。本研究为解决临床乳腺癌对阿霉素的耐药性提供新的研究思路和方法参考,也为粉防己碱的进一步研究与开发奠定基础和提供数据支持。
利益冲突 所有作者均声明不存在利益冲突
[1] DeSantis C, Siegel R, Bandi P,. Breast cancer statistics, 2011 [J]., 2011, 61(6): 408-418.
[2] WHO. Global health estimates 2020: Deaths by cause, age, sex, by country and by region, 2000-2019 [EB/OL]. [2021-02-20]. https://www.who.int/data/gho/data/themes/mortality- and global-health-estimates/ghe-leading-causes-of-death.
[3] Fan L, Goss P E, Strasser-Weippl K. Current status and future projections of breast cancer in Asia [J]., 2015, 10(6): 372-378.
[4] 杜建姝. 中国乳腺癌现状 [J]. 世界最新医学信息文摘, 2019, 19(46): 371-372.
[5] Cao J, Zhang M D, Wang B,. Chemoresistance and metastasis in breast cancer molecular mechanisms and novel clinical strategies [J]., 2021, 11: 658552.
[6] Shi R Z, He Y F, Wen J,. Epithelial cell adhesion molecule promotes breast cancer resistance protein-mediated multidrug resistance in breast cancer by inducing partial epithelial-mesenchymal transition [J]., 2021, 45(8): 1644-1653.
[7] 林慧, 吉丽银, 符策岗. 乳腺癌化疗耐药的分子机制 [J]. 中国组织化学与细胞化学杂志, 2022, 31(2): 194-201.
[8] Pan Y, Chen Q, Li N,. CTAB reversed drug-resistance mediated by AMPK-HIF-1 alpha-P-gp pathway in breast cancer [J]., 2020, 49(2): 154-155.
[9] Li W J, Chen X H, Zeng J C,. Theoretical insight into the multiple interactions of quinazoline inhibitors with breast cancer resistance protein (BCRP/ABCG2) [J]., 2020, 38(14): 4336-4343.
[10] Raman D, Cimpean A M, De Miglio M R. Editorial: Drug resistance in breast cancer-mechanisms and approaches to overcome chemoresistance [J]., 2023, 12: 1080684.
[11] 罗锦琳, 欧阳慧婷, 邹联洪, 等. 乳腺癌内分泌耐药机制的研究进展 [J]. 实用预防医学, 2022, 29(4): 510-512.
[12] Tarapcsák S, Szalóki G, Telbisz Á,. Interactions of retinoids with the ABC transporters P-glycoprotein and breast cancer resistance protein [J]., 2017, 7: 41376.
[13] Khan A, Ali L, Wei D Q. Editorial: Breast cancer resistance, biomarkers and therapeutics development in the era of artificial intelligence [J]., 2022, 9: 1034990.
[14] Watanabe A, Momo, Tanaka K,. Drug-drug interaction between apalutamide and atorvastatin through breast cancer resistance protein in an outpatient [J]., 2022, 60(8): 367-369.
[15] Yan C, Yang H J, Su P,. OTUB1 suppresses Hippo signaling via modulating YAP protein in gastric cancer [J]., 2022, 41(48): 5186-5198.
[16] 王明珠, 周阳, 何凯桐, 等. Hippo通路在肿瘤发生发展中作用机制的研究进展 [J]. 现代肿瘤医学, 2022, 30(16): 3061-3064.
[17] 于文静. 粉防己碱通过Hippo通路抗肝癌作用机制研究 [D]. 哈尔滨: 哈尔滨商业大学, 2020.
[18] Liu X F, Han Q, Rong X Z,. ANKHD1 promotes proliferation and invasion of non‑small‑cell lung cancer cells via regulating YAP oncoprotein expression and inactivating the Hippo pathway [J]., 2020, 56(5): 1175-1185.
[19] Zattoni I F, Delabio L C, Dutra J P,. Targeting breast cancer resistance protein (BCRP/ABCG2): Functional inhibitors and expression modulators [J]., 2022, 237: 114346.
[20] Wang J, Gan C P, Retmana I A,. P-glycoprotein (MDR1/ABCB1) and breast cancer resistance protein (BCRP/ABCG2) limit brain accumulation of the FLT3 inhibitor quizartinib in mice [J]., 2019, 556: 172-180.
[21] Lu J, Wang Y C, Shi Z J,. 3-Acetyl-11-keto-beta-boswellic acid decreases the malignancy of taxol resistant human ovarian cancer by inhibiting multidrug resistance (MDR) proteins function [J]., 2019, 116: 108992.
[22] N Bhagya. Network pharmacology based investigation on the mechanism of tetrandrine against breast cancer [J]., 2023, 3(1): 100381.
[23] Samsuzzaman M, Jang B C. Growth-suppressive and apoptosis-inducing effects of tetrandrine in SW872 human malignant liposarcoma cells via activation of Caspase-9, down-regulation of XIAP and STAT-3, and ER stress [J]., 2022, 12(6): 843.
[24] 杨燚, 王毛毛, 于淼, 等. 基于网络药理学、分子对接和体外实验探讨防己生物碱类活性成分逆转乳腺癌耐药的作用机制 [J]. 中草药, 2023, 54(9): 2841-2851.
[25] 任宇亮, 吴慧, 左春妹, 等. Hippo信号通路在乳腺癌发生、转移和治疗中的作用 [J]. 湖北医药学院学报, 2022, 41(6): 646-651.
[26] 祝景伟, 佟经伟, 许培权. Hippo信号通路中TAZ、YAP在三阴性乳腺癌中的表达及意义 [J]. 陕西医学杂志, 2020, 49(8): 940-943.
[27] 张娜娜. Caspase-3和Bcl-2表达与乳腺癌细胞凋亡及其临床病理特征的相关性分析 [J]. 实用癌症杂志, 2021, 36(10): 1609-1613.
[28] 刘斌, 游金辉. 乳腺癌与Bcl-2、Caspase-3的相关性研究与应用 [J]. 川北医学院学报, 2017, 32(4): 638-642.
[29] 裴岩岩, 李雅, 闫春生, 等. 黄芪甲苷通过Bax/Bcl-2/ Caspase-3信号通路诱导人乳腺癌MCF-7细胞凋亡的机制研究 [J]. 中药新药与临床药理, 2019, 30(9): 1077-1082.
[30] Jiang X F, Liu Y S, Zhang G J,.-emodin induces breast tumor cell apoptosis through upregulation of miR-15a/miR-16-1 that suppresses BCL2 [J]., 2020, 2020: 5108298.
[31] Li Y N, Ning Ni, Song Lei,. Derivatives of deoxypodophyllotoxin induce apoptosis through Bcl-2/ Bax proteins expression [J]., 2021, 21(5): 611-620.
Mechanism of tetrandrine against drug resistance in breast cancer based on Hippo/YAP signaling pathway
XIN Guo-song1, 2, WANG Mao-mao1, HOU Yan-xiu1, YANG Yi1, YU Miao1, 2, JI Yu-bin1, 2, LI Wen-lan1, 2, LI Hai-ru3
1. Engineering Research Center for Medicine, Harbin University of Commerce, Harbin 150076, China 2. National Ministry of Education Anti-tumor Natural Drug Engineering Research Center, Harbin 150076, China 3. Second Affiliated Hospital of Harbin Medical University, Harbin 150086, China
To study the molecular mechanism of tetrandrine against multidrug resistance in breast cancer by regulating Hippo/homologous oncoproteins Yes-associated protein (YAP) signaling pathway.CCK-8 method was used to detect the effect of tetrandrine on proliferation of MCF-7/ADR cells; Inverted microscopy and fluorescence microscopy were used to observe cell morphology; Flow cytometry was used to detect cell apoptosis rate; Cell colony assay was used to detect cell clone formation ability; Transwell experiment was used to detect cell invasion ability; Western blotting was used to detect expressions of resistance efflux proteins [P-glycoprotein (P-gp), breast cancer resistance protein (BCRP) and multidrug resistance associated protein (MRP)], Hippo pathway key node proteins [YAP1, large tumor suppressor kinase 1 (LATS1), mammalian Sterile 20-like kinase 1 (MST1), transcriptional co activator with PDZ binding motif (TAZ)], and apoptosis key proteins [cysteine aspartate protease-3 (Caspase-3), cytochrome C (Cyt-C), B-cell lymphoma-2 (Bcl-2) and Bcl-2 associated X protein (Bax)].Tetrandrine had a proliferative inhibitory effect on MCF-7/ADR cells, with a half inhibitory concentration (IC50) value of 14.20 μmol/L; Tetrandrine could change cell morphology and some cells showed signs of apoptosis; Tetrandrine significantly induced apoptosis in MCF-7/ADR cells (< 0.01), inhibited cell proliferation, differentiation and invasion ability, significantly down-regulated the expressions of P-gp, BCRP, MRP1, YAP1, TAZ and Bcl-2 proteins (< 0.01), and significantly up-regulated the expressions of MST1, LATS1, Caspase-3, Cyt-C and Bax proteins (< 0.01).Tetrandrine can inhibit efflux protein activity and increase intracellular accumulation of tetrandrine by down-regulating the expressions of P-gp, BCRP and MRP1 proteins in MCF-7/ADR cells. And tetrandrine exerts anti-tumor effects by activating Hippo signaling pathway, upregulation of MST1 protein expression, activation of LATS1, and regulation of downstream target YAP1 and TAZ expressions, further upregulation of Caspase-3, Cyt-C, and Bax protein expressions, down-regulation of Bcl-2 protein expression, initiation of cell apoptosis program.
tetrandrine; breast cancer; adriamycin; drug resistance; Hippo/YAP pathway
R285.5
A
0253 - 2670(2023)18 - 5960 - 08
10.7501/j.issn.0253-2670.2023.18.014
2023-04-18
中国博士后面上项目(2021MD703828);黑龙江省自然科学基金优秀青年项目(YQ2022H002);黑龙江省博士后资助项目(LBH-Z20172);哈尔滨商业大学产业化项目支持计划(XL0086)
辛国松(1984—),男,副研究员,博士(博士后),硕士生导师,研究方向为抗肿瘤中药药理学。E-mail: 13766801150@163.com
李海茹(1988—),女,副教授,博士(博士后),硕士生导师,研究方向为中药药理学。
[责任编辑 李亚楠]
