同时性三重原发癌合并胃间质瘤1例*
2023-08-28王鑫俞凯杰詹镇润赵红
王鑫,俞凯杰,詹镇润,赵红
046000 山西 长治,长治医学院附属和平医院 呼吸与危重症医学科(王鑫、赵红),病理科(俞凯杰),心血管内科(詹镇润)
在同一个体上同时或先后发生2种或2种以上的原发性恶性肿瘤,称为多原发癌(multiple primary malignancies,MPM)。随着肿瘤发病率的增加、癌症诊治水平的提高,目前临床上关于MPM的报道逐渐增多,但三重原发肿瘤合并间叶源性肿瘤的病例在临床中较为少见[1]。现将我院收治的1例同时患有食管胃交界神经内分泌癌、肺腺癌、肾脏透明细胞癌合并胃间质瘤的MPM患者的临床资料总结如下,并结合相关文献,以提高临床对该疾病的认识。
1 病例资料
患者,男,69岁,因“上腹部不适1月余”于2020年7月26日入院。该患者入院前1月无明显诱因出现上腹部不适,性质描述不清,发作无规律性,伴乏力,不伴恶心、呕吐、腹泻、腹痛、发热等不适,后逐渐出现吞咽不利,以进干、硬、生、冷食物时症状明显,间断性打嗝,食欲不振,入院前1周就诊于我院消化科门诊,完善胃镜检查(图1)示食管下段贲门癌。自发病以来,患者精神、睡眠尚可,大小便正常,近期体重无明显增减。既往体质健康。有吸烟史50余年,约30支/日。婚育史、家族史无特殊。入院查体:体温36.8℃,脉搏88次/min,呼吸20次/min,血压112/76 mmHg。营养稍差,慢性面容,全身浅表淋巴结未触及肿大。桶状胸,双肺呼吸音粗,未闻及干、湿性啰音,心、腹无异常体征,双下肢无水肿。
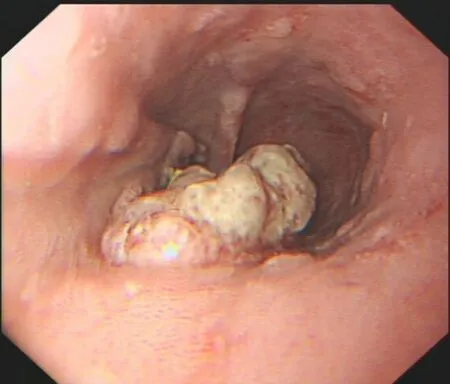
图1 电子胃镜检查结果Figure 1.Results of Electronic Gastroscopy
入院后完善相关辅助检查。血常规:白细胞10.9×109/L(↑),红细胞3.87×1012/L(↓),血红蛋白114 g/L(↓),单核细胞绝对值0.81×109/L(↑),中性粒细胞绝对值7.01×109/L(↑)。C反应蛋白:76.36 mg/L(↑)。血生化:血清白蛋白31.1 g/L(↓),余肝功、肾功、血糖等指标未见明显异常。血气分析、凝血系列、纤溶、术前感染系列、消化道肿瘤标志物未见明显异常。2020年7月27日行胸腹部增强CT(图2)检查显示左肺尖部见实性结节,大小约4 mm×5.7 mm,右肺中叶小片样高密度影。胃充盈欠佳,食管胃结合部壁不规则样增厚、走行僵直有强化,较厚处约13 mm,浆膜面可见少许短细索条。左肾中极可见凸出肾轮廓外(小于50%)的类圆形肿物影,其内可见片样囊变坏死影,肿物最大截面约41 mm×42 mm;增强扫描后动脉期肿物呈显著不均匀强化,排泄期扫描肿物强化程度低于临近肾实质。结合患者症状及相关辅助检查临床考虑MPM的可能性大,于2020年8月6日同时行腔镜下左后侧入路左肾癌根治术+左侧剖胸食管下段贲门癌根治术+左肺上叶楔形切除术,术后病理检查结果(图3)示:胃食管交界溃疡型肿瘤,镜下可见肿瘤细胞小至中等,形态一致,胞浆嗜酸性。肿瘤细胞核呈较规则的圆形或卵圆形,染色质点彩状,可见大量核分裂。(左)肺上叶浸润性癌,镜下多形性肿瘤细胞呈巢片状细胞巢,肿瘤组织缺乏腺泡、腺管和乳头结构,肿瘤细胞异型性明显,可见核分裂。(左)肾肿瘤,镜下可见癌细胞呈圆形,体积大,细胞膜清楚,胞质透明或颗粒状,细胞核位于中央,圆形或卵圆形,400倍镜下见核仁,诊断透明细胞型肾细胞癌,ISUP/WHO 2016核分级:Ⅰ~Ⅱ级。另外,术中还查见胃小弯处有一梭形细胞肿瘤,最大径0.5 cm。切除标本HE染色后,镜下可见肿瘤组织呈编织状或旋涡状,肿瘤细胞呈单一梭形或上皮样细胞,见核旁空泡,炎细胞及血管不显著,考虑为微小型间质瘤。免疫组化结果显示,食管胃交界肿瘤:Ki-67(95%),CgA(散在+),Syn(弥漫+),CD56(+),MLH-1(+),MSH2(+),MSH6(+),PMS2(+),Her-2(-);(左肺上叶)肿瘤:Ki-67(50%),P40(弱+),P63(+),TTF-1(+),NapsinA(-),CK20(-),CK7(+),CgA(-),Syn(-),CD56(-)。结合形态学结构及免疫组化结果,最终诊断为食管胃交界神经内分泌癌、左肺上叶浸润性腺癌(低分化)、左肾透明细胞癌、胃间质瘤。
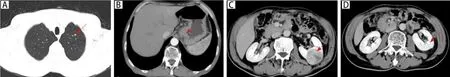
图2 胸腹部增强CT结果Figure 2.Results of Contrast-Enhanced CT of the Chest and Abdomen
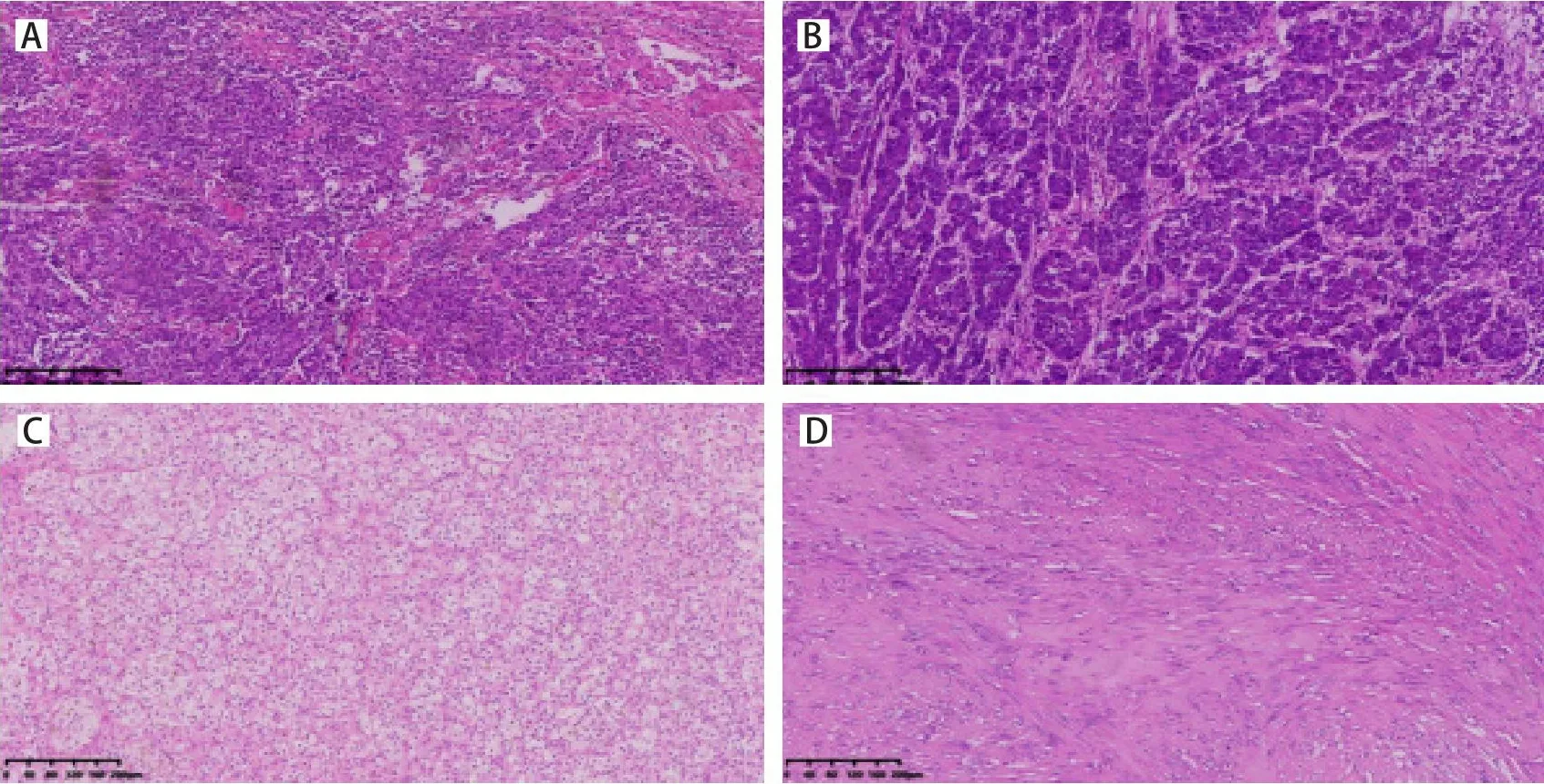
图3 术后病理学检查结果(HE染色,×100)Figure 3.Postoperative Pathological Findings (HE Staining, ×100)
患者术后症状好转,建议继续静脉化疗,患者拒绝,院外口服替吉奥胶囊、甲磺酸阿帕替尼化疗药物10余天,因自感不适后自行停药,术后于2021年3月17日复查胸、腹部CT示贲门癌术后、左肺上叶结节切除术后及左肾切除术后改变。患者随访至今仍存活,期间复查未见复发或转移肿瘤,一般情况尚可。
2 讨 论
MPM的发生率很低,多数文献将其作为一种现象来报道,诊断沿用Warren[2]所提的标准:(1)每一个肿瘤必须由组织病理学证实为恶性;(2)每一个肿瘤在位置上必须是分开和独立;(3)必须排除可疑的转移癌或复发癌。根据发生时间的间隔MPM可分为:同时性,即与第一原发癌发病的间隔时间<6个月;异时性,即与第一原发癌发病的间隔时间≥6个月[3]。本患者经术后送检的病理组织确诊,肿瘤部位独立且病理类型不同,排除转移癌的可能,符合上述诊断标准。本案例属于同时性三重癌:食管胃交界神经内分泌癌、肺腺癌、肾脏透明细胞癌,同时合并间叶源性肿瘤特征的胃间质瘤。
MPM并非罕见,不同文献报道略有差异,国外文献报道其发病率较高,为0.73%~11.7%,而国内文献报道发生率仅为0.99%~1.3%[4]。多数研究发现,MPM中同时性MPM占比较小,生存率较异时性MPM患者低,5年总生存期从54%到63%不等[5-6]。其检出率与医生对MPM的认识和重视程度、医院的诊疗水平和随访状况相关。
关于MPM的病因至今不明,一般认为是多种致病因素共同作用的结果,包括常见的病因风险因素(即遗传学、环境暴露、生活方式选择)和癌症治疗的晚期效应[7]。有肿瘤家族史的患者相较无肿瘤家族史的患者发生MPM的机会增加,部分患者存在肿瘤易感性[8]。基因突变在MPM的发生发展中起着重要的作用,例如,林奇综合症中包括多个基因(MLH1、MSH2、MSH6)的突变,与结直肠癌、子宫内膜癌、卵巢癌、上消化道癌、脑癌等的风险增加有关[9]。也有文献指出,DNA损伤修复缺陷涉及的FA/BRCA通路可能也是MPM的原因之一[10]。因此,某些基因的缺失、突变和失活可能与MPM相关。本例患者为三重原发癌,考虑其发生可能与遗传易感性有关,但因患者个人原因未能完善基因检测。环境因素和生活方式也会导致MPM的发生风险增加,有研究指出,在MPM患者中,从未吸烟的患者比持续吸烟的患者生存时间更长,戒烟的患者比未戒烟的患者生存时间更长,持续的吸烟可能是第二原发肿瘤的发生的关键因素[11]。本例患者有长期吸烟史,入院时未戒烟,因此吸烟可能也是该患者发生MPM的高危因素。与既往没有癌症史的人群相比,患有第一原发癌的患者发生新原发癌的风险增加[12]。此外,癌症治疗的晚期效应也影响着MPM的发生,化疗和放疗是一把双刃剑,既可治疗肿瘤又可引发第二原发肿瘤,会损伤正常细胞DNA、引起机体免疫力下降而诱发肿瘤,有报道指出肝癌患者肝移植术后发生第二原发癌的概率可升高至4.2%,这可能与肝移植和免疫抑制剂的使用有关[13]。
第二原发性癌症对第一原发性癌症有特定的依赖性,风险评估因首次癌症的类型而差异很大,在最初诊断为口腔癌、咽癌、喉癌、食道癌、肺癌和霍奇金淋巴瘤的患者中最高[14-15]。MPM中肺癌可能与消化系统肿瘤密切相关,有研究表明MPM中结肠癌、直肠癌和食管癌最常合并的肿瘤是肺癌,一项来自中国的调查结果显示,MPM患者中合并肺癌的发生率为3.4%[16]。本例患者为肺癌合并食管胃交界神经内分泌癌,这与以往结果报道一致。MPM中合并肾癌的比例较低,首发癌为肾癌的比例为2.7%,与肾癌在所有单发肿瘤中的比例为1.3%相比,肾癌在MPM中的比例要比单发恶性肿瘤高[14]。从病理上来说,透明细胞乳头状肾细胞癌比透明细胞癌及乳头状肾细胞癌更容易出现第二原发癌,而本例肾癌的病理类型则为透明细胞癌[17]。胃间质瘤是胃肠道最常见的原发间叶源性肿瘤,在生物学行为上可从良性至恶性,目前关于MPM合并胃间质瘤的相关报道较为少见。本例肿瘤大小为0.5 cm,术前胃镜检查未发现,行贲门癌根治术时才查见。镜下未见核分裂,切除术后危险度评估为极低危,疾病进展风险评价为0,考虑良性可能性大,但有极少数病例曾显示侵袭性行为,目前关于<2 cm胃间质瘤的监测和管理指南,一直被认为存在争议或缺乏循证医学证据,其潜在的恶性潜能仍需关注[18-19]。
临床上MPM容易引起诊断和治疗的困难,原发癌在诊断中容易与肿瘤复发或转移相混淆,治疗原则及预后方面两者也很大差异。在有既往癌症病史和潜在的抗癌治疗的患者中,可能很难建立额外的原发性诊断,而且找到一种既能涵盖几种癌症类型,又不会增加药物毒性及相关作用,且不会对总体结果产生负面影响的抗癌治疗策略也是一种挑战[7]。有文献指出大多数第二原发癌发生在第一原发癌确诊后6个月以上,因此肿瘤患者治疗后出现新发病灶除了考虑转移与复发外,还应注意排除新的原发癌的可能,直肠癌的筛查应在6个月内进行,肺癌的筛查应在结肠癌发现后6个月内进行[20]。临床工作中,首先要提高对MPM的认识,牢记癌转移的规律和部位,无论什么时候同时发现两处以上肿瘤,不要盲目过早下癌症转移或复发的诊断结论,要仔细询问病史、完善各项检查、术前活检明确是MPM还是转移癌,尤其是接受过抗肿瘤治疗的癌症患者。
异时性MPM患者比同时性MPM患者具有更好的预后,一项来自土耳其的调查中,两者的中位生存期分别为91个月和30个月,其2年、3年和5年总生存率分别为92%、88%、80%和86%、75%、63%[5,16]。此外,一项来自中国的研究也表明异时性MPM生存期更长,4例同时性MPM和58例异时性MPM患者的中位生存期分别为12个月和108个月,且异时MPM中两癌间隔时间越长,预后越好[21]。但无论是同时性MPM还是异时性MPM,手术、放疗和化疗均是MPM预后的保护因素,且接受以手术为主的综合治疗(手术联合化疗或放疗)的MPM患者比接受单纯手术的MPM患者具有更长的生存时间[22]。因此在治疗上,对于MPM患者应根据相应的肿瘤分期,结合患者目前情况,严格把握手术适应证,必要时选择放疗或化疗等综合治疗方法,以提高患者的生存率及生存周期。本例患者肿瘤分期肺腺癌(T1N0M0)、食管胃交界神经内分泌癌(T4N0M0)、肾脏透明细胞癌(T2bN0M0)、胃肠间质瘤(T1N0M0),采用手术根治性治疗手段,随访至今依旧存活,未发现复发及转移。
综上所述,MPM作为一种并不罕见的疾病,应得到临床医师的关注,做到早发现、早诊断、早治疗,对原发癌应力求进行根治性治疗,并根据肿瘤的生物学特征以及患者的实际情况,辅以放化疗、靶向治疗、免疫治疗等个性化综合治疗,以改善患者生活质量,延长生存周期。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
