非侵入物理疗法
——红光照射改善脂多糖诱发小鼠抑郁样行为*
2023-07-19赵丹睿张凤吉刘懿莹吴一箐赵夯廖海康潘文浩程建华童志前
赵丹睿 张凤吉 刘懿莹 吴一箐 赵夯 廖海康 潘文浩 程建华* 童志前*
(温州医科大学精神医学学院,老年研究院,附属第一医院,浙江省阿尔茨海默病研究重点实验室,瓯江实验室,温州 325035)
抑郁症是一种临床症状表现为情绪低落[1]、快感缺失的常见情感障碍类疾病[2]。2020年全球重度抑郁症患者约为1.93亿人,受新冠疫情影响全球预计新增5 300万重度抑郁症患者[3]。中国重度抑郁症的终身患病率达3.3%[4]。抑郁的发生有多种学说。基于“单胺假说”的5-羟色胺(5-hydroxytryptamine,5-HT)再摄取抑制剂是临床使用最广泛的抗抑郁药物[5],然而单胺假说无法解释药物作用潜伏期的出现[6]。临床一线抗抑郁药物的治疗无效率也达33%~66%[7];同时还出现药物抵抗、性功能障碍、低钠血症等副作用[8]。近几十年来,炎症反应被认为是重度抑郁发生的关键原因[9]。越来越多的证据表明,外周炎症因子,如IL-1β与IL-6,可穿过血脑屏障[10],从而诱发抑郁[11-12]。
低浓度气态甲醛重复暴露诱发小鼠出现抑郁样行为[13];液态甲醛注射的小鼠也出现抑郁及焦虑样行为[13]。以上研究表明,甲醛可诱发小鼠抑郁样行为。离体实验显示甲醛可直接刺激免疫细胞释放大量的炎症因子,如IL-1β、IL-6、TNF-α[14]。以上研究说明,甲醛参与炎症因子的生成。目前,注射脂多糖(lipopolysaccharide,LPS)被广泛用来构建抑郁模型[15],外周腹腔注射LPS具有操作便捷、安全性较高,且可产生中枢神经炎症反应的优势。但单次注射LPS诱发的抑郁样行为仅持续24 h左右[16],而重复多次注射LPS可制备出慢性抑郁小鼠模型,症状持续较为持久[17],且该模型与临床抑郁患者的症状更为相似。虽然外周注射LPS诱发慢性抑郁的机制不清,但研究表明LPS可上调血液中的氨基脲敏感胺氧化酶(semicarbazidesensitive amine oxidase,SSAO,一种甲醛生成酶)的活力[18]。这提示,LPS可能激活SSAO产生甲醛,而甲醛直接刺激炎症因子释放,诱发抑郁。
近20年来,光生物调节作用(photobiomodulation,PBM)疗法逐步被用于临床治疗抑郁等心理疾病[19]。如红光(red light,RL)/近外红光(near-infrared,NIR)具有抗炎作用[20],可减少小鼠抑郁样行为[20-21]。本课题组前期研究发现,630 nm红光照射作为一种非侵入性手段,可以有效激活甲醛脱氢酶(formaldehyde dehydrogenase,FDH),并消除小鼠脑中蓄积的甲醛[22]。基础和临床结果都显示,红光具有良好的穿透性,红光照射未发现明显不良反应,是一种潜在的临床治疗抑郁的方法。
基于上述研究结果,本实验探索甲醛是否是LPS诱发抑郁发生的关键触发因子,630 nm红光疗法是否对慢性抑郁模型小鼠的抑郁样行为具有改善效应,从而为临床使用红光疗法提供理论依据。
1 材料与方法
1.1 实验动物
健康雄性C57BL/6J小鼠,9周龄,无特定病原体(specific pathogen free,SPF)级。动物进入动物房后适应性饲养1周后分笼喂养,每笼4只,室内温度为(25±2)℃,12 h光照周期,照明时间模拟白昼(每日7:30~19:30),每周两次更换垫料,并及时予以充足的饲料及水。全部实验根据温州医科大学伦理委员会指导原则进行,伦理批号:xmsq20022-1135。
1.2 实验试剂与耗材
1.2.1 实验试剂
Mouse IL-1β ELISA Kit,碧云天生物技术有限公司,货号:PI301。Rabbit Mouse IL-6 ELISA Kit,碧云天生物技术有限公司,货号PI326。Mouse TNF-α ELISA Kit,碧云天生物技术有限公司,货号PT512。小鼠氨基脲敏感胺氧化酶(SSAO)酶联试剂盒/Mouse SSAO ELISA kit,北京奇松生物科技有限公司,货号:QS451642-96T。Mouse IL-1β ELISA Kit,武汉伊莱瑞特生物科技股份有限公司,货号E-EL-M0037c。Mouse TNF-α ELISA Kit,武汉伊莱瑞特生物科技股份有限公司,货号E-EL-M3063。LPS(reagent grade),碧云天生物技术有限公司,货号ST1470。Na-FA荧光探针,济南大学生物医学成像中心赠送。甲醛,美国 Thermo Fisher Scientific公司,货号F1635。DMSO,北京索莱宝科技有限公司,货号D8731。
1.2.2 实验耗材
一次性丁腈手套,Biosharp,货号BC010-L。1.5 ml EP管,Labselect,货号MCT-001-150。15 ml离心管,Labselect,货号CT-002-15A。30 ml离心管,Labselect,货号CT-002-50A。200 μl黄色袋装吸头,Biosharp,货号BS-200-T。1 000 μl蓝色袋装吸头,Biosharp,货号BS-1000-T。
1.3 实验仪器与设备
移液枪,德国 Eppendorf公司,型号31110008。酶标仪,美国 Molecular DEVICES公司,型号Spectra Max i3x。多功能酶标仪,美国BioTek公司,型号Synergy Neo2。超低温冰箱,赛默飞世尔科技(中国)有限公司,型号905。涡旋振荡器,海门其林贝尔仪器制造有限公司,型号VORTEX-5。净化工作台,上海博讯医疗生物仪器股份有限公司,型号SW-CJ-2FD。微量高速冷冻离心机,瑞沃德生命科技有限公司,型号M1324R。超声波细胞粉碎机,宁波新芝生物科技股份有限公司,型号SCIENTZ-IID。红光治疗仪(专利号:ZL 2015 1 0354267.5.)[22]。小动物活体光学成像,PerkinElmer,型号IVIS Spectrum。
1.4 小鼠分组
将雄性C57BL/6J小鼠随机分为3组:a. 溶剂对照组(Con组,仅腹腔注射PBS);b. LPS组,按浓度梯度进行腹腔注射LPS;c. 630 nm红光治疗组,与LPS相同模式建立抑郁模型,并在LPS注射1周后使用630 nm LED-RL(0.5 mW/cm2)照射,每周持续5 d,每次30 min,与下一周照射之间间隔2 d。每组12只,分3笼饲养,每笼4只标尾并记录。腹腔注射时间均为早上9点,红光治疗时间为腹腔注射后4 h,即当天的下午1点。每周最后一天进行行为学评估,实验共进行4周。
1.5 LPS诱导慢性抑郁模型的构建
LPS腹腔注射是构建抑郁样模型的常见方法之一,具有操作简单快捷、致死率低等优势。外周注射LPS可参与中枢神经炎症反应,由外周炎症导致中枢神经炎症的发生以诱导抑郁模型的建立,符合由外周炎症诱发抑郁的临床疾病特征。由于单次注射LPS后,小鼠可出现急性抑郁样行为,在24 h左右出现顶峰,后逐渐消退[16],同时为避免LPS引发的败血症等不良反应以及小鼠对相同浓度LPS产生耐受性[23],本实验采用重复多次注射浓度梯度LPS的方式来构建持续慢性LPS抑郁模型[17]。实验共注射4周LPS。前2周每周的第3~5天连续注射3 d(0.208/0.415/0.83 mg/kg),与下一周注射之间间隔4 d;后2周每周的第3~6天连续注射4 d(0.208/0.415/0.83/0.83 mg/kg),与下一周注射之间间隔3 d。
1.6 抑郁样行为学评价
1.6.1 糖水偏爱实验(sucrose preference test,SPT)
糖水偏爱实验可以客观反映抑郁症动物快感缺失表现[13]。造模前给小鼠双瓶供水24 h(1%浓度葡萄糖150 ml与清水150 ml),12 h时将清水与1%葡萄糖溶液交换位置以消除小鼠对于瓶子位置的偏爱。禁水禁食24 h后再度给予水150 ml与1%浓度葡萄糖150 ml并持续24 h。24 h糖水偏爱实验前后双瓶分别称重并计算糖水偏爱系数,糖水偏爱系数为糖水摄入量/(糖水摄入量+清水摄入量)×100%。
1.6.2 旷场实验(open field test,OFT)
旷场实验是检测小鼠自发活动行为的经典行为学实验[13]。实验装置为小鼠旷场反应箱规格为50 cm×50 cm×40 cm(长×宽×高),利用行为学软件框出中间区域,小鼠可在箱内自由活动。实验时,开启摄像,将小鼠按同一个方向置于旷场箱底部中央区域,使其适应1 min后正式记录轨迹5 min,进入中间区域、中心区停留时间等数据均由软件设置。对下一只小鼠进行实验前,先去除排泄物,用75%酒精擦拭装置箱,再以干净纸巾擦干,避免实验装置内原有动物气味对实验结果的干扰。
1.6.3 强迫游泳测试(forced swimming test,FST)
强迫游泳实验是有效评估小鼠绝望行为的行为学检测方法[13]。准备高50 cm、直径20 cm的圆柱形玻璃水箱,注水至小鼠在游泳期间无法用脚或尾巴接触水箱底部且确保老鼠不能逃脱的高度。温度计测量水温(23~25°C),使用浅色分隔板分离各个水箱以确保小鼠之间无法互相观望。实验持续时间6 min,记录后4 min小鼠在水中总不动时间。实验结束后立即取出小鼠放在吸水纸上吸干后放回鼠笼。
1.6.4 悬尾实验(tail suspension test,TST)
悬尾实验是有效评估小鼠绝望行为的行为学检测方法[13]。实验开始前先在小鼠尾巴距尾尖2 cm处(防止小鼠顺胶布攀爬)粘一条胶布,用架子夹住胶布,并悬挂至距桌面30 cm高处,开启行为学检测软件并摄像记录,总悬挂时间为6 min,记录后4 min内累计不动时间(不动状态即小鼠停止挣扎不动或无任何活动)。实验完成后仔细清理悬尾箱,并用75%的酒精来擦拭悬尾箱底及内壁,避免遗留气味对下次实验产生影响。
1.7 甲醛检测及甲醛相关酶检测
1.7.1 整脑甲醛荧光成像
小鼠腹腔内注射5 μmol/L的Na-FA(甲醛荧光探针),30 min后用1.25%三溴乙醇溶液麻醉,将小鼠颈椎脱臼处死,取出脑组织,PBS冲洗表面血液及杂质。将同组的脑组织置于同一玻璃器皿中,不同组之间进行区分标记,吸干脑组织周围水分后放入成像暗箱平台。以上步骤均在冰上避光操作。选择激发和发射滤片(λex/λem=430 nm/540 nm),调整软件进行成像[22]。
1.7.2 血液与脑组织内甲醛定量检测(Na-FA荧光定量法)
a. 样本制备
第2、3、4周行为学检测结束后12 h将每组3~6只小鼠称重,根据小鼠体重腹腔注射对应体积的3%三溴乙醇麻醉液(0.1 ml,5 g)。待小鼠肌肉松弛、反射消失后,剪去胡须及眼周毛发眼球取血,将血液收集到EP管中,冰上快速剥离脑组织,取出皮层、海马、中脑备用。组织样本保存于-80℃低温冰箱。小鼠脑组织称重后,按1∶9的比例加入PBS,并用超声波破碎仪破碎至匀浆至无明显块状组织为止,在此期间设置低温高速离心机,使其预冷至4℃后将组织匀浆离心(12 000 r/min×30 min)后取上清,并将上清液转移至新的EP管中。
b. 操作步骤
使用黑色96孔板,每空分别加入40 μl小鼠组织样本或甲醛标准品、120 μl PBS、40 μl Na-FA工作液。在室温环境中孵育30 min后检测荧光强度(λex/λem=440 nm/543 nm)。根据甲醛标准品荧光强度绘制标准曲线,并计算小鼠组织样本甲醛浓度[22]。
1.7.3 血清SSAO检测
根据SSAO试剂盒说明书进行。标准品和样本孔中每孔50 μl标准品或待检样品,后依次按照说明加入辣根过氧化物酶(HRP)标记的检测抗体100 μl、底物50 μl、终止液50 μl,15 min内,在450 nm波长处测定各孔的吸光度(A)值。绘制标准曲线,按照曲线方程计算各样本中SSAO的浓度。
1.8 小鼠脑组织相关炎症因子检测
1.8.1 脑组织IL-1β活性检测
根据Mouse IL-1β ELISA Kit说明书进行。小鼠大脑皮层样本以原液作为样品进行检验;海马样本用样品分析缓冲液1∶1稀释,并用标准平稀释液补至200 μl,即50 μl原液加入50 μl样品分析缓冲液,后加入100 μl标准瓶稀释液体;中脑样本以样品分析缓冲液1∶1稀释。每孔依次按说明加入样品或不同浓度的标准品(100 μl/孔)、生物素化抗体100 μl/孔、辣根过氧化物酶(100 μl/孔)、显色剂TMB溶液(100 μl/孔)、终止液(50 μl/孔),每次加入前均洗板5次。最后用酶标仪测定450 nm波长处的A值,绘制标准曲线,根据公式计算待测样本中的IL-1β活性。
1.8.2 脑组织TNF-α活性检测
根据Mouse TNF-α ELISA Kit说明书进行。实验操作同上。
1.9 统计分析
采用GraphPad Prism 9软件进行统计学分析,实验数据以均数±标准差表示,两组之间数据采用t检验分析多组之间比较采用One-way ANOVA分析,P<0.05为有统计学意义。
2 结果
2.1 LPS注射第一周诱发抑郁样行为并伴随脑甲醛蓄积和炎症反应
实验流程见图1a。实验结果显示,注射LPS 1 h后,小鼠脑部甲醛即整体升高(图1b),一周后行为学结果表明LPS实验组小鼠即出现抑郁样行为:LPS组小鼠旷场实验中总运动距离、中心区运动距离显著减少(图1c,d),悬尾不动时间无显著差异(图1e),强迫游泳不动时间显著增加(图1f),糖水偏好系数显著降低(图1g)。
注射LPS 1周后,皮层甲醛含量无明显变化(图1h),海马、中脑中的甲醛含量均显著上升(图1i,j)。第1周LPS组血液中SSAO含量较Con组显著上升(图1k)。ELISA检测结果显示,皮层、海马、中脑中TNF-α因子也均较Con组显著上升(图1l~n),IL-6在中脑中显著上升(图1o)。
以上结果表明,LPS一周即诱发脑部特别是中脑甲醛蓄积、炎症因子增加,并出现抑郁样行为。
2.2 630 nm红光照射改善第二、三周LPS诱发的炎症反应、甲醛蓄积、抑郁样行为
每周各组药物及红光治疗方案见图2a,实验开始第二周起,每周第2~6天进行红光照射治疗,每周间隔2 d。实验结果显示,注射LPS两周后,较Con组,LPS组小鼠旷场实验中总运动距离、中心区运动时间显著降低(图2b,c)。较LPS组,红光治疗组小鼠旷场实验中总运动距离、中心区运动时间均显著升高(图2b,c)。较Con组,LPS组悬尾不动时间无明显变化,强迫游泳实验不动时间显著增长;较LPS组,红光治疗组悬尾实验、强迫游泳实验中总不动时间显著减少(图2d,e)。小鼠运动路线图见图2f。
注射LPS 3周后,较Con组,LPS组小鼠旷场实验中总运动距离、中心区运动距离显著减少。较LPS组,红光治疗组总运动距离显著增加,中心区运动距离无显著变化(图2g,h)。较Con组,LPS组悬尾不动时间显著增加,强迫游泳不动时间无显著差异;较LPS组,红光治疗组悬尾不动时间显著减少(图2i),强迫游泳不动时间无显著差异(图2j)。小鼠运动路线图见图2k。较Con组,LPS组糖水偏好系数显著降低,红光治疗组则无显著差异(图2l)。
中脑甲醛检测中,第2周LPS组中脑甲醛显著低于Con组,红光治疗组中脑甲醛则无明显差异(图2m)。第3周的甲醛相关检测中,LPS组小鼠中脑甲醛含量较Con组显著上升(图2n)。
以上结果表明,重复浓度梯度注射LPS小鼠持续表现抑郁样行为,中脑甲醛发生波动变化并最终蓄积,红光照射则显著改善小鼠抑郁样行为,维持中脑甲醛正常代谢。
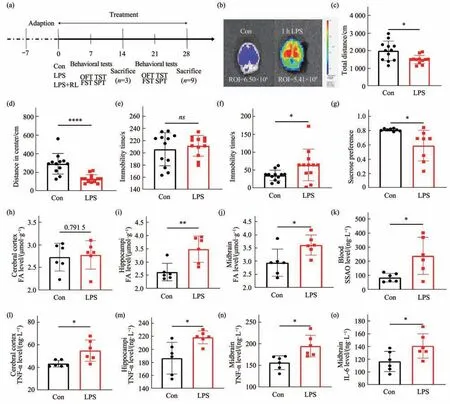
Fig. 1 LPS-injected mice showed formaldehyde (FA) accumulation, inflammation reaction, and depressive-like behaviors in the first week

Fig. 2 Red light treatment alleviated the depressive behaviors in LPS-injected mice in 2nd and 3rd week
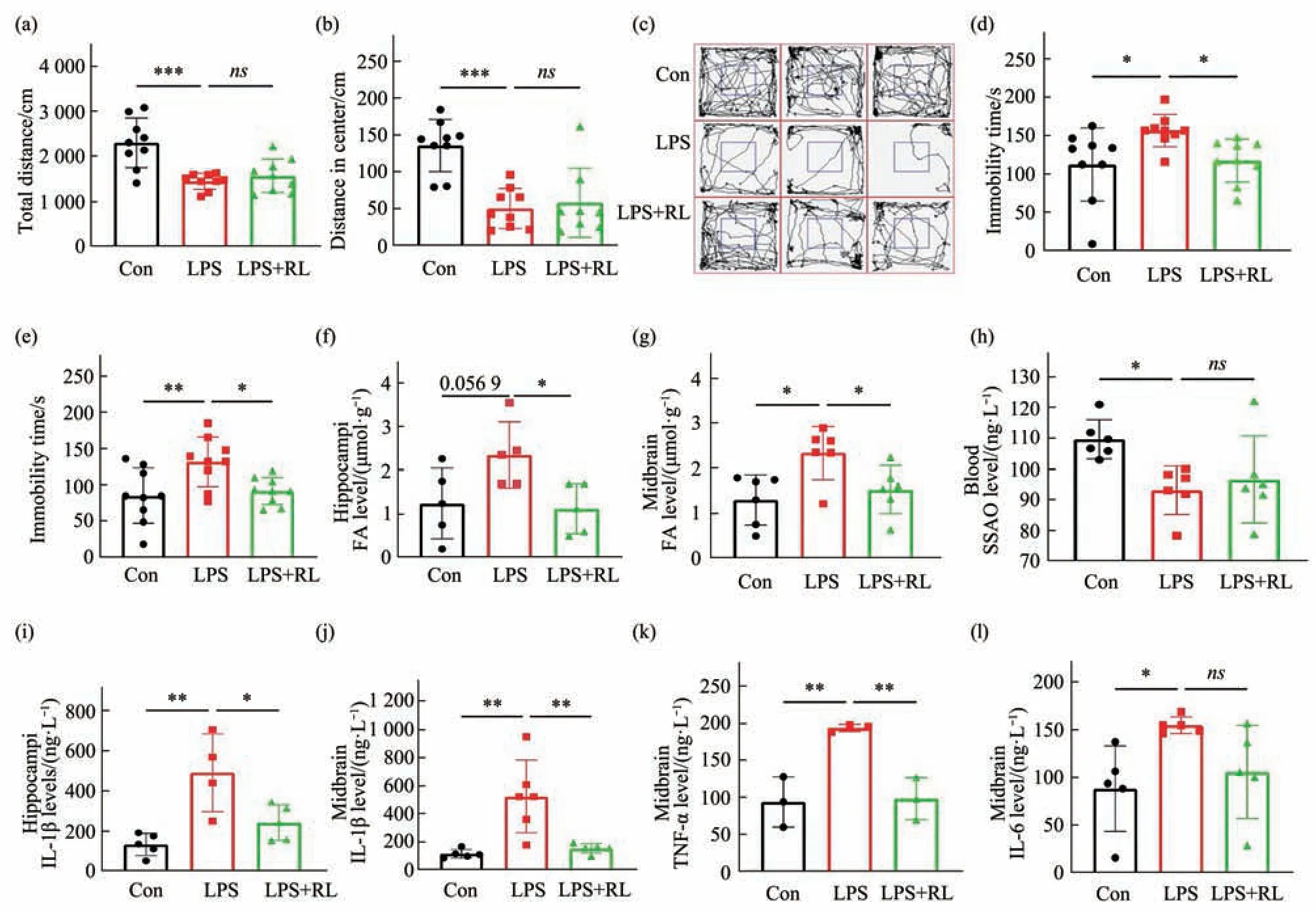
Fig. 3 Red light treatment inhibited neuroinflammation and alleviated depressive behaviors in LPS-injected mice in the 4th week by scavenging FA in the hippocampus and midbrain
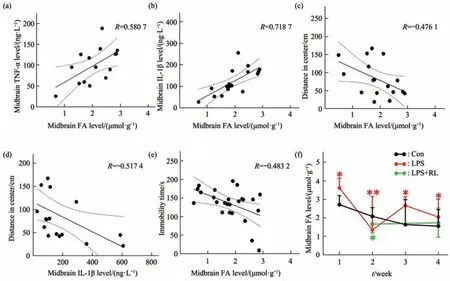
Fig. 4 The correlation between the levels of IL-1β, TNF-α, or FA and indexes of depressive-like behaviors
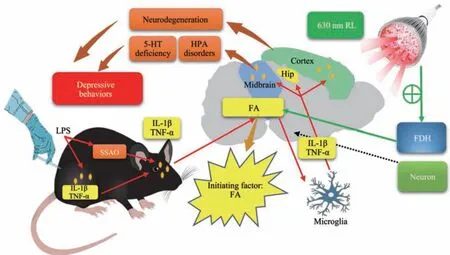
Fig. 5 Mechanism of red light-alleviated depression-like behaviors in LPS-induced chronic depression model mice by scavenging midbrain FA levels
2.3 630 nm红光照射改善第四周LPS诱发炎症反应、甲醛蓄积、抑郁样行为
第4周行为学检测表明,较Con组,LPS组小鼠旷场实验中总运动距离、中心区运动距离显著降低。较LPS组,红光治疗组总运动距离、中心区运动距离均无显著差异(图3a,b)。小鼠运动轨迹见图3c。较Con组,LPS组悬尾实验、强迫游泳不动时间显著增加;红光治疗组悬尾、强迫游泳不动时间较LPS组显著减少(图3d,e)。
注射LPS 4周后,甲醛相关检测中,LPS组小鼠海马甲醛含量呈上升趋势,中脑甲醛含量较Con组显著上升,红光治疗组小鼠较LPS组在海马、中脑中甲醛含量均显著下降(图3f,g)。
LPS组小鼠血液中SSAO含量显著下降,红光治疗组较LPS则无显著差异(图3h)。
ELISA检测结果显示,LPS组小鼠海马IL-1β显著升高,红光治疗组小鼠则较LPS组显著下降(图3i)。较Con组,LPS组中脑IL-1β、TNF-α、IL-6因子均显著上升;较LPS组,红光治疗组中脑中IL-1β、TNF-α因子均较LPS组显著下降(图3j~l)。
以上结果表明,第4周LPS注射小鼠持续表现抑郁样行为,红光治疗显著消除中脑甲醛蓄积,并抑制神经炎症发生,改善小鼠抑郁样行为。
2.4 LPS诱发蓄积的甲醛和炎症因子、抑郁样行为正相关
对甲醛与TNF-α、IL-1β进行回归分析发现,中脑甲醛含量与TNF-α、IL-1β水平正相关(图4a,b),这提示了中脑甲醛蓄积与神经炎症发生高度相关。中脑甲醛含量与小鼠旷场实验中心区运动距离(图4c)、悬尾实验不动时间(图4d)负相关,这提示了中脑甲醛蓄积与小鼠抑郁样行为高度相关。同时,中脑IL-1β水平与小鼠旷场中心区运动距离也成负相关(图4e),这提示了中脑炎症反应水平与小鼠抑郁样行为高度相关。对中脑甲醛含量的进一步分析中,在LPS重复注射的1~4周内,LPS组中脑甲醛含量在第1周急性升高,并在第3、4周蓄积;红光治疗组中脑甲醛含量则均与Con无明显差异(图4f)。
以上结果提示,在LPS诱导的小鼠慢性抑郁模型中,中脑内源甲醛蓄积是抑郁发生的促发因素,诱导神经炎症反应的发生并导致小鼠抑郁样行为。
3 讨论
本实验主要聚焦两个尚未阐明的问题:一是甲醛与SSAO在小鼠慢性抑郁模型中的变化及作用机制;二是630 nm红光是否通过清除甲醛蓄积改善抑郁样行为。结果表明,LPS通过激活SSAO急性生成大量甲醛,并主要蓄积于中脑,急性升高的内源甲醛激活脑胶质细胞等生成IL-1β、TNF-α等炎症因子,产生神经炎症反应并导致抑郁样行为的发生,630 nm红光照射则通过激活FDH清除急性升高的甲醛,稳定内源甲醛代谢,抑制神经炎症发生,改善抑郁症状(图5)。这提示蓄积的脑内源甲醛可能是治疗抑郁的新靶点,消除脑内源甲醛可减轻其产生的一系列神经炎症、氧化应激等反应,而纳米红光可清除甲醛蓄积,对抑郁具有改善作用。
3.1 甲醛可能是触发抑郁发生的关键分子
现有的抑郁症的相关研究并未过多关注SSAO以及甲醛的变化。研究表明,腹腔注射的LPS仅有极少量能够穿透血脑屏障(blood-brain barrier,BBB)[24],重复多次外周注射LPS即使破坏BBB,也并不会增加对中枢对LPS的摄取。这说明外周注射的LPS并不直接在脑区内发挥作用来诱发抑郁行为。进一步分子机制研究发现,外周注射LPS主要引起脑毛细血管后小静脉因SSAO/血管黏附分子1(VAP-1)导致的中性粒细胞的黏附,而中性粒细胞并未进入脑实质[25-26]。而大量证据表明外周注射LPS后激活了大脑免疫反应[27-28],诱导IL-1β、TNF-α等细胞因子在脑中的表达[29]。现有研究表明,LPS诱导的中枢神经炎症与外周炎症机制不同,SSAO可能在LPS诱导的神经炎症中发挥重要作用,且神经炎症的发生可能与SSAO的脱氨基产物甲醛[30]有关。而LPS可诱导SSAO活性上升,其分解单胺等底物产生的甲醛等产物水平急剧上升[18]。SSAO分解内源甲胺脱氨基生成甲醛,是内源甲醛的重要来源,同时生成过氧化氢、一氧化氮(NO)等产物[31],作为一种生理性小分子物质[32],甲醛可穿过BBB[33],并在脑区参与神经炎症、氧化应激[14,34]等反应,从而影响认知及空间记忆。本实验发现整脑甲醛荧光成像显示注射LPS 1 h后中脑内甲醛含量显著上升(图1b),且甲醛与炎症因子的回归分析(图4a,b)显示中脑甲醛含量与炎症因子浓度呈正相关,均支持了上述观点。另外,甲醛暴露不仅将增强小鼠前额叶皮层的氧化应激,诱导IL-17、IL-1β等炎症因子的产生,进而促进小鼠大脑的神经炎症[35],LPS注射且甲醛暴露小鼠的巨噬细胞模型中促炎细胞因子释放增加、NO分泌升高[14],均证实过量甲醛对于脑胶质细胞的刺激不但可促进炎症因子的释放,还消除IL-1β的神经保护作用,进而加剧神经炎症的发生。本实验的实验结果证实,中脑中甲醛含量与IL-1β、TNF-α水平呈正相关,内源甲醛蓄积参与神经炎症反应。
3.2 慢性抑郁小鼠血浆SSAO的变化
本实验对血清SSAO酶的检测中,虽然第1周LPS组SSAO含量显著上升,但在第4周的血浆SSAO含量检测中,发现LPS组血浆SSAO含量较Con组显著下降。同时,临床研究也发现抑郁患者血清SSAO活性的检测中发现未经过治疗干预的重度抑郁患者SSAO活性显著降低[36],在大鼠急慢性炎症模型中同样发现了SSAO活性的下降[37]。由于SSAO此前并未在抑郁症、神经炎症等领域受到广泛关注,因此相关机制并不明了。目前可能针对抑郁及炎症模型中SSAO活性及含量降低可能的解释有:a. SSAO活性下降是对单胺含量下降的适应性结果[36];b. SSAO在炎症发生早期发挥作用,而随着膜结合形式的VAP-1在介导中性粒细胞外渗后失活或脱落[37]。然而由于缺乏相关实验支持,上述假说仍无从证实。可以肯定的是,大量研究表明,在炎症早期SSAO/VAP-1在外周炎症部位被激活[38],并介导中性粒细胞的黏附、外渗,在侧脑室注射LPS诱发的神经炎症中,脑后微血管SSAO/VAP-1同样被激活[18,25]。本实验中整脑甲醛荧光成像同样表明,在实验组注射LPS 1 h及1周后,整脑中,作为SSAO代谢产物之一的甲醛含量上升,佐证了LPS单次注射后SSAO活性急性上升,并参与LPS诱导的神经性炎症的观点[39]。并且它的产物——甲醛是诱发炎症因子上升的触发因素。
3.3 炎症因子参与抑郁机制的多条通路
近来,神经炎症被认为是抑郁症的特征性反应之一[9]。有研究发现,炎症因子激活的犬尿氨酸通路对5-HT、下丘脑-垂体-肾上腺素(hypothalamus-pituitary-adrenocortical,HPA)轴活性、海马神经发生的影响[40]。一方面,TNF-α通过激活吲哚胺2,3-双加氧酶,分解生成5-HT的底物色氨酸代谢为犬尿氨酸[41],从而减少5-HT生成,表现抑郁症状[42]。另一方面,炎症因子已被证实可直接刺激位于中脑的下丘脑,并过度激活HPA轴,促进糖皮质激素的大量释放[43],IL-1β可诱导促肾上腺皮质激素释放激素的过度释放从而促进糖皮质激素受体抵抗[12],进而损害HPA轴的负反馈调节。同时糖皮质激素的促炎特性也得到越来越多证据的支持[44]。本实验证实,中脑、海马甲醛蓄积导致TNF-α、IL-1β、IL-6的上升,参与神经炎症反应。
3.4 630 nm红光调节甲醛代谢抑制神经炎症
630 nm红光照射作为一种新型PBM治疗方法已经被用于挽救认知与记忆[22,45]。前期研究已表明,使用波长630 nm的LED-RL(0.5 mW/cm2)能穿透小鼠的头骨和腹部,其中颅骨的穿透率是49%,腹部的穿透率为43%,且无明显热效应[22]。目前PBM治疗抑郁的最佳参数尚未明确,虽然近外红光显示有更强的穿透力,但其对大脑的热效应明显,不利于临床治疗使用[46]。另外,近红外光的临床试验中,有头痛、眼疲劳、睡眠不安和失眠等不良反应的发生[47]。
现有对红光治疗抑郁的研究,主要是其对线粒体电子传递链的末端酶细胞色素c的影响。红光可通过提高细胞色素c的活性,促使NO从双核中心解离,增加线粒体膜电位,进而促进ATP的释放,增强神经保护和代谢能力[20]。本研究主要探究红光激活甲醛脱氢酶,降解甲醛,减轻神经炎症的通路。在本研究中630 nm红光改善小鼠抑郁样行为的机制主要表现在两个方面。一是,630 nm红光照射直接激活FDH及时清除急性上升的甲醛[22]。本实验治疗组结果表明,激活FDH不仅在抑郁症病程早期避免了高浓度甲醛的蓄积,避免参与诱发神经炎症反应、影响神经细胞代谢产生神经毒性,同时也改善了抑郁症病程后期因LPS重复注射导致甲醛反复升高而造成的脑部甲醛异常蓄积的状况。二是,630 nm红光照射激活细胞色素c[19],挽救了因内源甲醛被神经元细胞分解代谢而产生的甲酸盐对细胞色素c的抑制作用[48],避免糖酵解持续升高导致的神经细胞毒性[49]。本研究发现630 nm红光治疗照射1周后即改善小鼠抑郁样行为,因此在抑郁症早期干预中可能更具有重要的临床应用价值。
4 结论
单次LPS外周腹腔注射激活SSAO导致小鼠脑部甲醛急性上升,重复多次LPS外周注射导致小鼠中脑、海马甲醛蓄积,甲醛作为抑郁发生的促发因素参与神经炎症反应、产生神经毒性,导致小鼠抑郁样行为。630 nm红光照射消除甲醛蓄积,并抑制神经炎症反应,改善小鼠抑郁样行为。因此,红光疗法,一种无创物理疗法,有可能成为临床抑郁干预的新策略。