高强度间歇训练:调节骨骼肌质量及功能的新手段*
2023-07-19杨旸张译尹吕红艳曹师承姚婷婷衣雪洁5
杨旸 张译尹 吕红艳 曹师承 姚婷婷 衣雪洁5,**
(1)沈阳体育学院,沈阳 110102;2)上海体育学院运动科学学院,上海 200438;3)辽宁师范大学体育学院,大连 116029;4)中国医科大学运动医学教研室,沈阳 110122;5)沈阳体育学院运动与健康研究中心,沈阳 110102)
骨骼肌是人体最大的代谢器官,在运动和代谢中起着重要作用[1]。适宜的骨骼肌质量(肌纤维数量和体积)是骨骼肌实现生理功能的基础[1]。研究显示,个体进入老年期后骨骼肌质量随年龄的增长而呈下降趋势,这将导致身体机能降低和过早死亡风险增加等健康风险[2-4]。中年期肌肉质量峰值与老年期的肌肉质量和力量密切相关,提示在早期上调骨骼肌质量对于预防衰老导致的骨骼肌质量和功能下降至关重要。骨骼肌的主要功能是牵拉骨骼产生运动,而实现这一功能的能量则由骨骼肌血管中的血液将氧气和供能物质运输到线粒体进行分解所产生。研究证实,不同的运动方式可以启动独特的分子机制,进而调节骨骼肌的质量和功能[5]。抗阻力训练(resistance training,RT)通过骨骼肌对抗外部大强度负荷的收缩,促进肌纤维蛋白合成[6],增加肌肉的横截面积(cross sectional area,CSA)、瘦体重和力量[1]。值得注意的是,尽管瘦体重和力量都是老年人全因死亡率的独立预测因子[7],然而老年人参与RT的程度仍然很低,这可能是因为老年人需要专门的设备和正确的技术来防止受伤[7]。有氧训练可以促进血管生成以及通过刺激骨骼肌细胞信号级联,进而调节编码线粒体基因和蛋白的表达[1]。线粒体数量增加可以上调骨骼肌的氧化能力和心肺功能,而后者与心血管疾病风险和全因死亡率成反比[8]。有研究报道“缺乏时间”是希望参加有氧训练人群的最常见问题[8]。因此,方便、省时地维持和提高肌肉质量和功能的运动方式是预防和改善肌肉减少的重要对策。高强度间歇训练(high-intensity interval training,HIIT)可能是一种可行的、替代RT和有氧训练来增加肌肉质量(图1)和功能(图2)的运动手段。HIIT的特点是短时间(≤ 4 min)高强度运动(80%~100% 最高心率)并且间隔短时间的休息或恢复。以往研究表明HIIT可以上调骨骼肌蛋白质合成速率和下调萎缩速率、引发肌肉重塑和调节肌纤维类型(表1)、促进血管生成和血流灌注、介导骨骼肌线粒体含量上调和功能改善、增加肌肉力量和与膳食补充具有协同作用,但目前尚未有专门的综述对以上这些HIIT调节骨骼肌质量及功能的研究和机制研究进行系统地总结与报道。此外,部分相关研究的结果存在矛盾,这可能与受试人群特征(身体状况、受训练水平、性别)、运动特征(强度、持续时间、运动间歇的持续时间、活动模式)、检测手段有关,本综述对以上事项进行梳理,以期为HIIT预防和改善肌肉丢失和功能下降提供理论依据和应用策略。

Table 1 Promotes muscle remodeling and modulates muscle fiber types表1 HIIT促进肌肉重塑和调节肌纤维类型
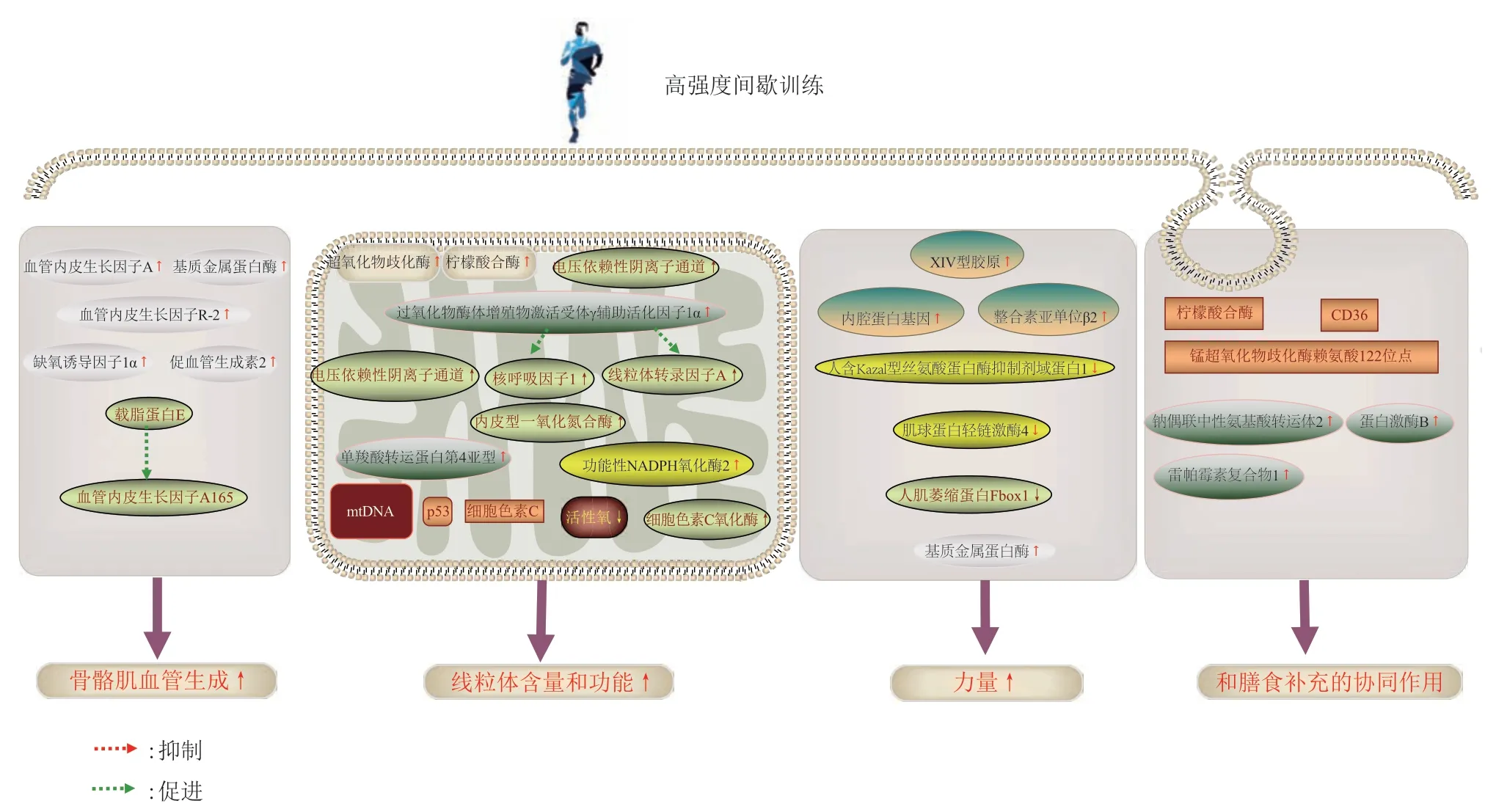
Fig. 1 Regulation and mechanism of HIIT on skeletal muscle quality图 1 高强度间歇运动对骨骼肌质量的调节作用及可能机制
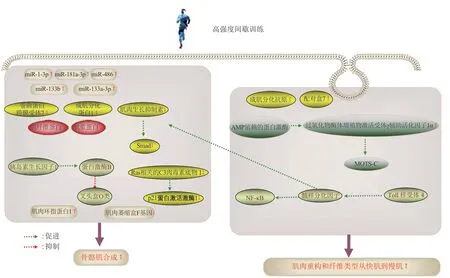
Fig. 2 Regulation and mechanism of HIIT on skeletal muscle function图2 高强度间歇运动对骨骼肌功能的调节作用及可能机制
1 HIIT概述
1912年荷兰长跑运动员Hannes Kolehmainen最早采用HIIT来提高运动成绩。1960年Reindell等[9]正式提出HIIT是重复进行短期高强度和休息/低强度恢复交替训练的明确概念。Astrand等[10]在1960年首次观察到HIIT能让运动员保持或接近较长时间的最大摄氧量(maximal oxygen uptake,VO2max)和提高耐力素质。值得注意的是,近年来由于HIIT能在短时间内提高受试者身体素质和机能的特点被多次报道,才促使学者们将HIIT研究的焦点从运动场上转向临床[5]。研究显示,HIIT的核心要素是运动强度,最大特点是短时间、高耗能。由于其高强度的特性,多项研究显示其与RT都具有增加肌肉力量[11]、增加CSA[12]等功能。并且与常规有氧运动相比,HIIT能在训练后数小时内快速提高运动后的热量和氧气消耗,即出现“运动后过量氧耗”,加快机体新陈代谢[13]。因此,它不仅能够提高运动效率,还能诱导出运动后与长时间有氧运动相似甚至更好的生理适应[14],改善血管功能和加速血液循环[15]、促进线粒体功能[16]、调控糖脂代谢[17-18]、提高胰岛素敏感性[19]等多种功能。此外,HIIT的设计多种多样,如骑行、跑步等,具有很高的灵活度和娱乐性,使健身者能享受运动乐趣,养成坚持运动的习惯[20]。HIIT还可以通过调节运动强度、时间等对久坐人群、心血管疾病患者和老年人根据自身状态安全地进行运动康复训练[21-24]。但是这种训练方式对不同人群产生的运动效益是受如运动强度、持续时间、运动间歇的持续时间及活动模式等多种因素影响。这提示未来的研究应该细化这一标准才能得到有效的结果。
2 HIIT对骨骼肌质量及功能的作用
2.1 上调骨骼肌蛋白质合成速率和下调萎缩速率
肌肉蛋白质合成速率上调是判断肌肉质量提高的重要标志[25]。研究显示急性HIIT和单次冲刺间歇训练(sprint interval training,SIT)可以诱导肌肉蛋白合成(muscle protein synthesis,MPS)[26-27]和肌肉体积增加[28]。Rundqvist等[29]使用“组学”技术检测青年骨骼肌SIT(3×30 s全力)后2 h基因表达谱,结果显示促肌肉生长基因卷曲蛋白跨膜受体7(Frizzled 7,FZD7)和成肌分化蛋白1(myogenic differentiation,MyoD1)水平显著增加,骨骼肌生长抑制因子肌肉生长抑制素(myostatin)表达显著下调。未经训练的年轻男性单次HIIT(12×1 min VO2peak,1 min休息)后即刻、4 h和 8 h检测股外侧肌,显示仅在8 h后与肌肉生长有关的miR-1-3p、miR-133a-3p、miR-133b、miR-181a-3p和miR-486表达增加[30]。Bell等[26]比较老年男性单次HIIT(95%最大心率(HRmax)10×1 min)、RT(3×95%最大完成10次的重量压和伸腿(10RM))或中等强度持续训练(moderateintensity continuous training,MICT)(70%HRpeak,30 min)后观察到蛋白质分数合成率(fractional synthesis rate,FSR)与静息组相比,HIIT组运动后24和48 h肌纤维FSR显著增加[26]。其中运动后24 h,HIIT诱导的肌纤维FSR增加幅度小于RT,但大于MICT。此外,HIIT是唯一能增加运动后24 h肌浆蛋白合成的运动方式[26],这可能是由于增加了线粒体蛋白质合成并提示即使同样增加FSR,HIIT可能与其他形式运动促进蛋白质合成的时间和具体的蛋白类型不同。
HIIT增加没有训练习惯的年轻受试者在不同运动形式,如:骑行[31]和跑步[32]后的骨骼肌CSA,上调中年大鼠骨骼肌质量[33],延缓老年大鼠骨骼肌质量降低[34-35]。Moghaddam等[36]观察到健康受试者6 次不同运动和休息时间的HIIT(6组10 s、5 s 和 20 s、10 s运动和休息)后股直肌CSA增加。健康青年男性16周自行车HIIT(8~12×60 s,>90% VO2peak)或骑车加臂力计测试HIIT(自行车4~6×60 s,>90% VO2peak+ 60 s臂力计,>90%最大功率(Wmax))后股四头肌CSA增加,但仅有骑车加臂力计测试的HIIT增加躯干和腹部肌肉的CSA,这提示HIIT对肌肉的增长可能仅针对锻炼部位[12]。训练有素的自行车手9周SIT(2次/周+12~16 次30 s全力+90 s,50 W以下主动休息)和HIIT(1次/周+5~7次+5 min 85%~95% 无氧功率(anaerobic power,AP)max+50% APmax 12 min休息)后股四头肌厚度减少。这可能是因为受试者都是优秀运动员且运动休息时间不足(组间休息时间为90 s),导致具有分解代谢功能的蛋白质表达增加,而具有合成代谢功能的蛋白质表达减少,这提示不同锻炼水平和休息时间可能是运动介导肌肉质量的重要干预因素[37]。此外,老年男性8周HIIT(7×120 s+80%~90% VO2max)后增加股四头肌CSA和体积,而双能X线吸收仪(dual energy X-ray absorptiometry,DXA)检测到瘦体重没有显著变化[38],这结合另一项同时使用磁共振成像(magnetic resonance imaging,MRI)和DXA来估计HIIT后训练诱导的肌肉质量变化的结果,即MRI检测到CSA变化,而DXA却没有测量到CSA变化,这提示选择不同的检测工具可能会对实验的结果造成影响[12]。8周HIIT(3 d/周,30 min,5×4 min,85%~95% VO2max,55%~60% VO2max,2 min主动休息)通过调节类胰岛素样生长因子1/蛋白激酶B(protein kinase B,Akt)/叉头框蛋白和myostatin/Smad信号转导通路诱导腓肠肌CSA和重量显著增加[39]。与对照组相比,雄性大鼠8周HIIT(5 d/周+6×3 min 80% VO2max+3 min 40%VO2max休息)后增加肌肉合成标志蛋白肌肉环指蛋白1、降低肌肉萎缩标志物肌肉萎缩盒F基因的表达[40]。糖代谢异常是导致骨骼肌萎缩的重要原因,HIIT 而不是 MICT降低腓肠肌葡萄糖摄取调节剂Ras相关的C3肉毒素底物1(Ras-related C3 botulinum toxin substrate 1,Rac1)及其下游靶点p21蛋白激活激酶1 mRNA表达,并增加Rac1蛋白质表达[41]。
综上,急性SIT可能是通过介导FZD7、MyoD1和myostatin诱导肌肉蛋白合成和增加肌肉体积[29]。但是由于运动强度和持续时间的不同,单次HIIT是否具有相同的变化目前并无报道。此外,结合8 h后microRNA,24 h肌浆蛋白表达变化[26],提示在运动后的取材时间可能是研究单次HIIT对骨骼肌合成基因和蛋白质机制的重点。长期HIIT对不同年龄段的骨骼肌质量均有上调或延缓减少的作用,但是未来检测需要注意是否为锻炼的部位[12]、受试者训练水平的高低[37]和检测仪器的联合使用[12]。HIIT是上调肌肉合成[39],下调肌肉萎缩[40-41]的运动手段。并且肌肉的质量受合成和分解两种代谢所调节,但目前关于HIIT后分解代谢的报道较少,这可能与以往研究发现肌肉质量HIIT后是增加相关,但有研究显示优秀运动员HIIT后肌肉质量降低[37],这提示如果将HIIT作为提升运动员肌肉质量的训练手段还应关注其与其他专项训练的休息时间。值得注意的是,由于很难在细胞上模拟HIIT的运动方式,并且目前基因敲除小鼠在HIIT领域未见报道,因此想要深入研究HIIT的具体机制,基因敲除小鼠可能是突破点。
2.2 促进肌肉重塑和调节肌纤维类型
卫星细胞是调控骨骼肌重塑的重要因素[42]。Nederveen等[43]比较老年男性HIIT(10×1 min+95% HRpeak)、阻力运动(三组双侧压、伸腿,95% 10RM)和MICT(骑车30 min,70%HRpeak)后观察到,虽然仅RT后24和48 h时I型纤维促卫星细胞分化基因配对盒7(paired box 7,Pax7)含量升高,而卫星细胞活性因子成肌分化抗原和Pax7的基因和蛋白质仅在HIIT后即刻升高。但是这不排除HIIT可以在运动后恢复期间(运动后 >48 h)诱导卫星细胞增加的可能性。6周HIIT(3次/周3次全力20 s冲刺,阻力0.05 kg/kg)、MICT和CT后在任何一种训练干预下都没有观察到肌核含量或肌肉纤维CSA的变化,尽管在3种运动之后活跃和分化的卫星细胞的数量都增加[44]。Joanisse等[45]报道年轻妇女HIIT(3次/周10×1 min)后,尽管肌肉活检显示I、II型或混合纤维的肌核含量或CSA无明显变化,但96 h后混合纤维中卫星细胞数量显著增加[45]。12周传统或阶梯训练能够有效改善冠心病患者卫星细胞和肌核含量降低,且I型纤维和II型纤维的卫星细胞数量均增加,且II型的变化更显著[46]。这提示HIIT可能不仅是对卫星数量有上调作用,根据不同纤维类型其上调速度可能也不相同。Snijders等[47]观察老年男性12周联合训练(每周1次HIIT和2次RT)后,在没有肌肉纤维肥大或肌核含量变化的情况下,外侧肌群卫星细胞数量增加。在单次RT(2×10次重复,最多45°腿部推举和腿部伸展练习)和HIIT后(12×1 min最大摄氧量峰值,1 min的休息间隔)4~8 h,卫星细胞生成标志成肌调节因子在骨骼肌中表达上调,且两组无显著差别。而HIIT后8 h骨骼肌卫星细胞的增殖和分化的调节有关miRNAs上调[30]。值得注意的是,miRNA的表达可能被限制在运动后8 h,因为它遵循卫星细胞的转录活性[30]。
哺乳动物骨骼肌纤维分为4种类型:I型(慢缩型)、IIa型(快缩氧化型)、IIx和IIb纤维(快缩糖酵解型)[48]。8周MCAT组(5次/周+60%TVmax 56 min)比目鱼肌(soleus,SOL)(I型纤维较多)[49]以及HIIT(5 d/周7×80% speed max 4 min+40% speed max 4 min)后SOL和胫骨前肌的CSA升高,说明MCAT可能仅诱导慢肌纤维肥大,而HIIT同时诱导快肌和慢肌肥大。这可能是由于肌纤维募集反应与运动强度呈正比,强度较低时仅动员慢肌,随运动强度增加快肌纤维逐渐被募集[50]。此外,两组运动均能促进I型肌纤维比例增加、II型肌纤维比例减少,这提示HIIT可能可以改善相关疾病导致的肌肉类型转换[50-52]。最新研究证实连续3周HIIT(5次/周+4×4 min乳酸阈值跑速+60%~70%(最大跑速-乳酸阈值跑速),主动恢复乳酸阈值跑速3 min)可改善大脑中动脉闭塞小鼠模型(模拟中风)导致的骨骼肌质量损失、I型纤维的比例减少和II型纤维的上调[51]。久坐不动的年轻女性6周HIIT(90% HRmax 10×60 s+50W 60 s休息)后发现短期HIIT能够增加股外侧肌(vastus lateralis,VL)中I型和 II型纤维的线粒体含量[53]。肌纤维类型转换因子过氧化物酶体增殖物激活受体γ共激活因子1α[54](peroxisome proliferator activated receptor γ coactivator-1α,PGC-1α)敲除鼠I型纤维降低[55]。最新研究证实,在HIIT组SOL中PGC-1α mRNA水平明显高于MICT组,而EDL的PGC-1α mRNA水平在两个训练组之间没有显著差异[52]。
综上,HIIT可能会激活与肌肉纤维肥大无关的卫星细胞增殖,进而介导细胞修复的重构[56],而对肌细胞核的作用可能取决于受试者的状态如病理[46]或衰老[47],然而这一结论还需要更多的实验来证实[44-45](表1)。由于miRNAs的表达只在HIIT后8 h发生变化,因此有可能在更晚的时间点发生更明显的miRNAs变化。此外,检测 HIIT后卫星细胞数量的变化应该要应该考虑到将检测的时间选择在48 h以后[43-46]。未来的研究将同时测量miRNA的表达与其他表观遗传学指标,如DNA甲基化和组蛋白修饰,以及它们与mRNA表达和卫星细胞活性的关系,这将为更好地了解不同运动模式下优先激活/失活的转录途径提供更多的信息。肌肉的重塑依赖于巨噬细胞炎症反应的变化,肌肉损伤修复前期M1型巨噬细胞分泌炎性细胞因子,促进CD4+/Th1细胞从血液循环进入肌肉,加速肌纤维和蛋白质降解。修复后期M2巨噬细胞可释放抗炎细胞因子,参与损伤部位的吞噬和清洁,促进肌肉组织修复。HIIT和MICT都可以防止大脑动脉闭塞小鼠腓肠肌质量损失。RNA-seq分析显示HIIT是通过下调CD86+(M1型)巨噬细胞和通过抑制Toll样受体4/髓样分化因子/核因子κB(NF-κB)上调CD163+(M2型)巨噬细胞来调节巨噬细胞活化[51]。本课题组前期研究显示有氧运动可以有效下调下丘脑[57]和心脏组织[58]炎症反应,以往研究显示高强度运动会上调下丘脑炎症反应[57],而在骨骼肌中HIIT抑制炎症作用可能与间歇时间有密切关系,因此对SIT与HIIT在炎症的作用及其机制进一步研究是十分有必要的。此外,由于HIIT的高运动强度,其对于不同肌纤维类型的肌肉均具有肌肉类型转换的功能,可促进快肌纤维转换为慢肌。本课题组前期实验证明PGC-1α调节线粒体衍生肽MOTS-C[59],而MOTS-C最新被报道与衰老导致的肌纤维类型由快到慢的变化相一致[60],这提示MOTS-C可能是介导骨骼肌纤维类型变化的关键,但其与HIIT之间的关系未见报道。AMP依赖的蛋白激酶(adenosine 5'-monophosphate (AMP)-activated protein kinase,AMPK)[61]作为重要的肌肉转换因子,本课题组前期通过骨骼肌细胞实验证明肌肉纤维转换的重要因子AMPK[62]和沉默信息调节因子1(silent information regulator 1,SIRT1)[59]均为PGC-1α上游因子[63-64],这可能提示HIIT是通过AMPK和SIRT1调节PGC-1α进而促进快肌纤维转换为慢肌纤维。值得注意的是本课题组还证明MOTS-C与骨骼肌脂联素(adiponectin,ADPN)表达水平呈环状的相互调节关系,因此MOTS-C是直接介导骨骼肌的纤维类型变化还是作用于ADPN-PGC-1α通路最终介导肌纤维类型变化以及HIIT是否作为重要的干预方式可能是新的研究方向。
2.3 促进骨骼肌血管生成和血流灌注
血管生成是指在自然发育或组织修复过程中原始血管生长出新血管的现象[65]。健康老年人6周HIIT(3次/周+50 W 5×1 min 85%~105% Wmax+90 s恢复)后无氧阈值、收缩压以及骨骼肌微血管对急性收缩活动的反应能力上调,这可能反映HIIT 后大血管扩张性增强、内皮功能改善和肌肉毛细血管化增殖[15]。12周HIIT(3次/周+10×60 s 90% HRmax+60 s自由自行车)与MICT(30 min 80%~90%通气阈)干预后2型糖尿病患者摄氧反应时间常数(τV˙O2p)显著降低,而肌肉氧合动态反应指标氧合血红蛋白和肌红蛋白反应的表达没有受运动干预的影响,这提示HIIT可能通过刺激肌肉引起的血液再灌注或是改善运动肌肉中毛细血管数量和结构导致训练诱导的微血管氧输送/利用的变化。此外τV˙O2p的降低出现在训练3周后,此后尽管训练强度逐渐增加,但没有进一步的显著变化[66]。与SIT相比(4~7×30~40 s全力+长时间被动恢复),4周9次HIIT(2~3组+8~20×15~30 s 110% APmax,运动/休息时间比为1∶1,50%APmax主动恢复)导致VL肌肉氧化能力指标血氧饱和度大幅增加。HIIT与肱二头肌和VL更大的最大氧合量相关,而SIT与背阔肌更大的最大氧合量相关。这提示HIIT和SIT可能因为强度和持续时间不同对不同肌肉的氧合作用影响不同,未来应该针对不同的运动形式选择不同的肌肉进行测量[67]。4周HIIT(3次/周+单腿伸肌锻炼+1 min 90%VO2max 30 s的静息)和SIT(3~4次/周150%VO2max 1 min休息)后受试者骨骼肌毛细血管密度和内皮细胞数量增加[68]。这提示HIIT能够有效改善增龄导致的骨骼肌毛细血管化、微血管血流下降。遗憾的是,该实验只测取了股四头肌。因此,HIIT影响不同部位肌肉中微血管血流的能力仍有待探究[15]。有趣的是,安静原发性高血压患者与正常血压者4周HIIT(3次/周+4×1 min 90%VO2max休息1 min)后,两组受试者安静时交感缩血管反应均无显著性变化,前臂血流量和股血管传导性升高,握力运动中交感缩血管反应减弱,这提示HIIT可能使高血压患者安静时通过增加血流量骨骼肌血流灌注得到改善,增强代谢活跃的工作肌得到充足的血流灌注和氧供应。此外,由于该实验HIIT主要为下肢运动,但同样可以改善维持充足组织灌注上肢功能性抗交感,提示运动对功能性抗交感的作用可能不存在部位特异性[69]。
研究显示血管内皮生长因子(vascular endothelial growth factor,VEGF)和缺氧诱导因子(hypoxic inducible factor,HIF)能够与内皮细胞上的受体有效结合进而调节血管生成[70-71]。6周HIIT(4次/周+6~7组20 s 170% VO2max+10 s休息)后基因谱显示VEGFA是骨骼肌蛋白互作网络中的枢纽基因,这提示HIIT可能是通过VEGFA对骨骼肌血管的生成进行调控[72]。促血管生成素2(angiopoietin 2,Ang2)使内皮细胞失稳,从而促进VEGF对内皮细胞活化的影响,而Ang1功能相反[73]。慢性心力衰竭男性患者3个月HIIT(4 min 4×80% VO2max+50% VO2max 3 min)与HIIT联合力量训练后均可上调骨骼肌VEGF、VEGFR-2、HIF-1α、诱导血管生成因子基质金属蛋白酶和Ang2 mRNA表达水平增加,且两组没有差异。这表明运动刺激内皮细胞失稳/活化是毛细血管重塑和血管生成过程的一部分。此外,虽然血管生成素酪氨酸激酶蛋白受体2(TEK receptor tyrosine kinase 2,Tie2)和Tie2激动剂Ang1 mRNA没有明显变化,但是发现Tie2与训练前后毛细血管纤维数量变化密切相关,这可能是Ang1 和Ang2与其受体Tie2竞争性相互作用的结果,即毛细血管失稳和稳定都是促进血管生成的不同阶段[73]。6周HIIT(3次/周+4组5×10 s 100%最大跑速度+休息20 s+组间5 min)和MICT组(40 min 40% 最大跑速度)后,载脂蛋白E(apolipoprotein E,ApoE)-/-HIIT小鼠EDL中VEGFA异构体VEGF-165的mRNA表达显著低于MICT小鼠。这可能表明,ApoE可能是HIIT促血管生成的重要介导因子。
综上,HIIT可以促进骨骼肌血管生成和血流灌注,但是对氧合指标的调节作用依旧矛盾[66-67]。此外,训练的周期[66]、训练的形式(如训练的强度和运动持续时间)[67]对不同血流灌注相关指标的影响值得进一步探索。HIIT对未锻炼部位血管生成指标的影响亦不明确。机制方面,遗憾的是上述两个实验只研究了基因层面,没有对形态学和蛋白质层面进行检测,未来这将是研究的重要方向[73-74]。并且HIIT后血管生成的不同阶段中因子的变化也将会为探究HIIT对血管生成研究的重要补充。
2.4 介导骨骼肌线粒体含量上调和功能改善
线粒体是细胞动力来源,它能为肌肉收缩提供 ATP 并通过增加自身体积/密度(线粒体生物发生)来响应运动训练。PGC-1α可以通过结合和激活转录因子线粒体转录因子A(mitochondrial transcription factor A,TFAM)[75]和核呼吸因子1/2(nuclear respiratory factor-1/2,NRF-1/2)[76]来调节线粒体生物发生。研究显示HIIT能有效改善骨骼肌增龄性PGC-1α降低[77]。França等[78]观察到与高脂饮食组相比,HIIT(4次4 min 80%氧储备指数和4次3 min 60%氧储备指数)后高脂大鼠骨骼肌PGC-1α 蛋白表达显著上调。Ahmadi等[52]观察到8周HIIT(5次/周2~10组+4 min 28~40 m/min+2 min 16 m/min)后大鼠SOL和趾长伸肌(extensor digitorum longus,EDL)PGC-1α、HIF-1α和乳酸代谢因子单羧酸转运蛋白第4亚型(monocarboxylate transporter 4,MCT4)mRNA水平显著高于对照组和等热量消耗MICT组,这提示HIIT可能是上调骨骼肌线粒体生物发生和促进线粒体供能的更有效运动方式。Wilson等[79]报道12周HIIT(6~8组+20 s全速跑+40 s 8 m/min的主动休息)无法显著影响PGC-1α蛋白表达水平,这可能是由于该研究中HIIT的运动量较低。值得注意的是不仅是长期运动,单次的间歇性运动(30×1 min 70% VO2max,1 min主动休息)同样比单次持续运动(70% VO2peak 30 min)更显著的激活PGC-1α蛋白[80]。最新研究显示运动可以增加肌肉特异的PGC-1α和PGC-1β双基因敲除小鼠的线粒体呼吸链复合体I(mitochondrial respiratory complex,COX)的含量[81]。这提示运动可能不只依赖于PGC-1α机制。结合Henríquez-Olguín等[82]观察到与野生型(wild type,WT)小鼠对比,6周HIIT(3次/周2 min 15~22 m/s+2 min休息)对缺乏功能性NADPH氧化酶2(nicotinamide adenine dinucleotide phosphate oxidases 2,NOX2)小鼠肌肉线粒体定位标志超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶、COX I、III、IV,线粒体动力指标线粒体动力相关蛋白(dynaminrelated protein 1,Drp1)和线粒体融合素基因-2(mitofusin-2 gene,Mfn-2)等基因和蛋白质表达以及线粒体碎片化的反应较小。这表明NOX2是骨骼肌对HIIT适应所必需的线粒体有关因子,HIIT对线粒体的形态和功能的介导是多途径的[82]。此外,不同的骨骼肌线粒体指标如柠檬酸合酶(citrate synthase,CS)活性与氧化磷酸化(oxidative phosphorylation,OXPHOS)蛋白在短期训练后表现出不同变化[83],结合Lim等[46]观察到TRAD(30 min 60%~80%心率储备)和STAIR(3次上下楼梯(12步)+RPE 14~15/20)在4周和12周后都增加PGC-1α蛋白的表达,而细胞色素C氧化酶(cytochrome c oxidase,COX)IV蛋白没有差异,这提示基于单个标志物的变化来评估训练有效性还有待商榷。
以往研究显示,运动强度是改善线粒体功能的关键,而运动持续时间对于提高线粒体含量是至关重要的[84-86]。长期HIIT干预后骨骼肌CS活性[87]和线粒体含量显著增加[88],这提示HIIT可能同时改善线粒体功能及含量。值得注意的是,Granata等[89]观察到不同强度和持续时间的HIIT对线粒体功能指标OXPHOS亚基蛋白质含量、线粒体呼吸、电子传递链(electron transport chain,ETC)酶活性、线粒体核糖体亚基表达、参与线粒体翻译起始和延伸蛋白质的对象及变化以及同一基因选择编码的蛋白质均有不同[90],并且对线粒体功能的影响可能优先从参与三羧酸循环(tricarboxylic acid cycle,TCA cycle)和脂肪酸β氧化(fatty acid beta-oxidation,FAO)途径的蛋白质合成开始,而与线粒体膜脂质(磷脂酰乙醇胺和磷脂酰胆碱)和甘油三酯相关途径可能反应较晚,并且该研究对差异表达的转录本进行基因富集分析后没有发现参与线粒体呼吸功能的通路有显著变化。这提示即使同样是HIIT,不同的强度与持续时间对骨骼肌线粒体功能及影响的先后次序也不相同,未来对这一领域研究应该要注意到这一点[89]。此外,该研究还提到大部分线粒体指标出现上调发生在HIIT运动的前几天[89]。梁春瑜等[91]观察到第4~10周时,HIIT(5次/周+50 min 50%、70%、90% VO2max交替训练)组之间的调节线粒体能量产生指标AMPK蛋白[92]表达水平均无显著差异。结合在人类骨骼肌中PGC-1α的mRNA和核含量在单次HIIT(5×4 min 80%峰值输出功率(peak power output,PPO))后3 h增加,而连续20 d 2次/d的HIIT则会减弱这种对单次HIIT的响应[93]。进一步研究显示HIIT(90% HRmax 10×1 min+1 min 50W阻力休息)和MICT(45 min 65% HRmax)诱导大量参与线粒体呼吸因子在最后一次训练后的第二天上调。而当运动后参与者连续4 d不运动时,两组的相关蛋白质都恢复到训练前的水平[16]。综上,这提示尽管训练强度和运动时间存在很大差异,但两种运动后诱导的长期代谢适应急性改善可能是最近一次或多次锻炼产生的因素介导的,而不是由训练产生的适应性调节,HIIT作为一种运动方式可能短期的效果更为明显,而后期会存在适应性变化[16]。p53激活可以促进细胞色素C(cytochrome,CYT-C)释放到细胞质中进而导致细胞凋亡。久坐组4次高强度间运动(high-intensity intermittent exercise,HIIE)(Wingate载荷:0.050 kg/kg体重)后5 min和24 h Cyt-C的表达增加,运动习惯组无明显变化,而两组在HIIE后5 min内P53表达均升高,这可能表明P53和Cyt-C释放之间的某个阶段,经常锻炼的人与久坐不动的人对线粒体信号通路的调控是不同的[94]。此外,优秀耐力运动员4周HIIT(3次/周8×5 min+2 min恢复+前6次85% HRmax+后2次5×15 s全力冲刺+45 s恢复)后线粒体应激反应与耐力成绩和VO2max增加是同时发生,这提示运动适应在不同运动习惯和水平中的人群中可能有不同的时间进程[95],未来在受试者的选取和选择上应该要注意到这一点。
研究证实运动可以改善衰老导致的线粒体代谢受损[96]。4周HIIT(3次/周+5×1 min 100%~115%的最大负荷90 s空载循环)后老年人骨骼肌CS活性、COX II和III上调[97]。久坐老年人6周HIIT(3次/周+2~6组5×1 min 121%~138% Wmax+ 30 s恢复)后抗氧化应激标志物SOD和CS蛋白表达均增加。这提示HIIT可能通过增加线粒体含量来诱导老年受试者骨骼肌的良好适应并在维持肌肉氧化能力并减缓与衰老相关的肌肉减少症中起重要作用[98]。该研究还发现男性骨骼肌COX II和III连接底物的解偶联呼吸上调,但女性中未观察到该现象,这表明HIIT的调节机制可能存在性别差异。核-线粒体失衡和线粒体未折叠蛋白质反应(mitochondrial unfolded protein response,UPRmt)是线粒体蛋白质和功能稳态方面发挥关键作用的机制[99]。Cordeiro等[99]观察到 4周HIIT(4次/周+4组85%~90% VO2max +1 min 8 m/min休息)可以上调老年小鼠骨骼肌中CS、核-线粒体失衡标志COX/琥珀酸脱氢酶复合体A亚基比率和UPRmt标志物ATP依赖的金属蛋白酶1、线粒体离子肽酶基因表达。此外,HIIT还增加了线粒体生物发生标志物电压依赖性阴离子通道、NRF-1和TFAM含量,以及DNA拷贝数标志线粒体编码基因mt-ND1、mt-CytB和mt-D-loop的表达,这提示HIIT可能是一种多途径改善衰老过程中骨骼肌线粒体代谢功能障碍的手段[99]。病理状态下,糖尿病小鼠8周HIIT(5次/周+5~12×2 min 80%~85% speed max 1 min主动休息)改善Drp1及Mfn2蛋白[100]。原发性高血压(HYP)与健康正常血压男性6周HIIT(2~3次/周+80%~90% HRmax 5 min+3 min休息)后HYP患者线粒体体积/生物发生因子CS、COXV、内皮型一氧化氮合酶(NO synthetase,NOS)的表达增加[101]。值得注意的是,基于融合蛋白Mfn2表达下调,尚不清楚运动训练是否刺激了高血压患者的线粒体融合。这提示HIIT在不同疾病中对线粒体作用的复杂性,而该实验中并没有使用观察线粒体的形态学指标,因此未来应该加入电子显微镜成像手段,进一步观察病理状态下和HIIT相关的融合/分裂标志物的改变是否与线粒体网络的形态变化有关[100-101]。
2.5 增强肌肉力量
HIIT(12×1 min VO2peak冲刺)对6 min步行距离能力有很大提升,对握力有中等影响,表明HIIT可以提高老年人的身体功能能力。这可能会转化为行动不便的老年人身体功能的显著改善[102]。尽管两周HIIT和MICT对骨骼肌氧化能力和主观感受等级的影响相似,但对诱导年轻男性的神经-肌肉特征不同[103-104]。高密度肌电图显示,与MICT相比,HIIT提高肌肉纤维传导速度、最大伸膝扭矩和高阈值运动单位的放电率等与最大力量产生密切相关的因素[103]。这提示HIIT可能会增加受试者肌肉力量,特别是在对相对剧烈运动敏感的人群(未受过训练的人群/老龄化人群)。Bornath等[105]观察到采用格斗绳HIIT(10×30 s+60 s休息)3次/周,3周后,男性、女性肩部屈伸最大力量(maximum voluntary contraction,MVC)显著提高。后3周HIIT增加格斗绳重量后,男、女性受试者肩部屈伸MVC再次增加。此外,与男性相比,女性等长MVC更明显,这可能是因为女性缺乏训练所以运动基础水平较低,而且以往女性阻力训练不像男性那样强调上半身锻炼。8个月HIIT(5次/周9×1 min 85% 95% VO2max)使老龄大鼠抓力高于对照组,这可能与增长的腓肠肌、股四头肌、SOL以及EDL指数有关[35]。Buckley等[106]采用多种运动形式的多模式HIIT(6×60 s全力运动+3 min被动恢复)对成年女性进行干预后发现被试深蹲、卧推和硬拉力量均有显著提高,而划船HIIT(6轮+60 s全力划船+3 min被动恢复)组任何肌肉表现变量都没有增加,这提示HIIT对力量的增长可能与运动的部位密切相关,未来应该要注意这一点。Robinson等[107]比较青年和老年人12周HIIT(4× 4 min+90% VO2max)最后一次训练72 h后骨骼肌转录组和蛋白质组数据,结果显示,老年人细胞外基质的XIV型胶原α1链和内腔蛋白基因,以及参与整合素信号传递的整合素亚单位β2增加。这可能与增强的细胞外基质抗拉强度、细胞与细胞外基质的粘连和机械转导信号有关[108]。与年轻人相比,HIIT后老年人肌动蛋白细胞骨架调节因子肌球蛋白轻链激酶4和结合胰岛素样生长因子人含Kazal型丝氨酸蛋白酶抑制剂域蛋白1下调。这提示增加对肌小节的机械支持以促进更高强度的收缩可能是对HIIT的一种独立于年龄的特征性分子反应[107]。8周高强度间歇静态力量训练增加大鼠的握力,这可能是运动会抑制骨骼肌特异性泛素连接酶的表达,从而增加神经支配的肌肉收缩并降低萎缩相关的人肌萎缩蛋白Fbox-1或NF-κB活化的转录,以及蛋白质丢失[109]。Miyamotoi-Mikami等[110]对健康年轻男性实施6周Tabata式坐姿骑车(6~7×20 s 170% VO2max)后肌球蛋白重链1、肌球蛋白轻链激酶2和伴肌动蛋白相关锚定蛋白等可能编码在收缩功能中起作用的基因显著变化[110]。然而该实验中肌肉活检是在最后一次训练后48~72 h,鉴于许多运动敏感的转录本的暂时性,其表达变化可能被遗漏了。此外,除了mRNA水平的变化外,肌肽合成酶1、肌球蛋白轻链激酶4的蛋白表达增加[110]。肌肽合成酶是一种增加了钙对收缩器的敏感性的蛋白质[111]。骨骼肌钙调蛋白依赖的蛋白激酶肌球蛋白轻链激酶磷酸化肌球蛋白的调节轻链进而在力量产生中提供支持[112]。久坐不动中年男性12周HIIT(30~60 s 90%~130% Wmax+50 W 1 min恢复)步行/跑步HIIT腿部力量没有增加,但是骑行HIIT力量增加[113]。这可能提示不同的锻炼工具可能是决定研究结果的重要因素,然而,参与者是在肌肉活检后约24~48 h进行超声检查,不能排除股外侧的骨骼肌肉的局部水肿/肿胀可能影响MT测量的可能性[14]。此外,停训后尽管运动时间、有氧能力下降,I型和II型纤维CSA降低,但运动训练诱导的肌肉力量增长在2.5周后仍保持不变。因此,未来关于停训后神经因素的测量值得进一步研究[112]。
综上,HIIT可能是有效促进提高运动敏感人群力量的运动方式,其机制可能围绕肌肉增长、抗萎缩、增加对钙离子的灵敏,上调细胞外基质的抗拉强度。但是其在力量提升方面受到锻炼部位的限制。此外,组学研究显示HIIT可能对不同年龄段力量提升的机制不同这可能是需要注意的[107],且未来的组学需要将检测时间放在运动后的48 h以内。并且HIIT作为一种增加力量的训练方式,其是否有可能在少量增加肌纤维面积(避免柔韧和灵敏素质降低)的前提下大幅度增加力量,来帮助以力量为重要项目特征的运动员提升和保持力量训练效果,这也是有待进一步研究的问题。
2.6 HIIT和膳食补充的协同作用
膳食蛋白质,特别是必需氨基酸亮氨酸,增加MPS[114-116]和卫星细胞活性[117]。在常量营养素中,运动后的蛋白质摄取是骨骼肌重建的关键,它通过将氨基酸转移合并到骨骼肌蛋白质中来促进MPS[6]。事实上,肌纤维蛋白的净增加只有通过运动后的蛋白质补充才能实现[118]。Coffey等[119]发现年轻男性HIIT/SIT前在摄入含有24 g乳清蛋白(4.8 g亮氨酸)和50 g麦芽糊精的运动前膳食或安慰剂后,SIT(10×6 s+60 s主动休息)后肌原纤维蛋白合成率增加,而这种增加与几种影响翻译启动的关键信号蛋白的磷酸化状态显著增加有关,如Akt、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、核糖体蛋白S6激酶β1和核糖体蛋白S6。Rundqvist 等[29]研究单次SIT(20 min 3×30 s全力)后年轻男子在第一次冲刺前5 min和其余每次冲刺后15 min摄入必需氨基酸和麦芽糊精。与安慰剂相比,摄食后骑行冲刺中钠偶联中性氨基酸转运体2、Akt和mTOR 1基因和蛋白质表达增加[29]。此外,运动后血浆和肌肉的FSR比率与直接营养相比更高[29]。总之,这支持肌原纤维和混合肌肉蛋白质合成的分子急剧变化,即在增加蛋白质供应的情况下进行HIIT可能促进肌肉肥大的协同增加[29]。代谢组学多变量分析的代谢物图谱差异显示,与营养条件无关,急性SITE上调线粒体生物发生指标PGC-1a,SIRT1、底物氧化因子丙酮酸脱氢酶激酶4,过氧化物酶体增殖物激活受体mRNA水平。SIT后浓缩乳清蛋白组(whey protein concentrate,WPC)和水解乳清蛋白组(whey protein hydrolysates,WPH)的CS活性均升高。WPC组3周运动后参与脂肪酸代谢基因SIRT4下调幅度明显大于WPH组,有趣的是,这与CD36基因表达的结果相反,这提示同样的HIIT运动后,补充不同的蛋白质可能会引起线粒体功能相关指标的不同变化。此外,与营养条件无关,SIT后均可增强有氧和无氧运动能力。3周后观察到,与WPC组相比,WPH组训练后疲劳指数显著改善[120]。WPH条件下,急性SIT后肌肉合成代谢标志苏氨酸、增加肌肉蛋白质质量和抗肌萎缩甘氨酸以及生成氨基酸和代谢中间产物的抗疲劳标志鸟氨酸水平上调。几乎参与骨骼肌收缩的蛋白质都是乙酰化的,高乙酰化导致肌肉蛋白水解和萎缩。与WPC和禁食相比,3周运动后WPH组静息泛乙酰化状态明显下降。安静状态下SIRT1活性无明显变化,但SIRT家族脱乙酰酶下游靶锰超氧化物歧化酶赖氨酸122位点乙酰化水平降低,这提示HIIT降低乙酰化可能是通过锰超氧化物歧化酶赖氨酸122位点途径[120]。12周HIIT(3次/周5×3 min+90%HRpeak+3 min 70% HRpeak)后无论营养条件,HIIT都会增加中年肥胖者肌肉力量。值得注意的是,长期HIIT增加蛋白质供应的累积效应是否会在几周或几个月内引起类似或更大的MPS发生率增加暂不明确。此外,Leuchtmann等[121]研究12周自行车HIIT后乳清蛋白摄取(30 g)的效果,发现老年男性的肌肉CSA没有变化[122]。中年T2DM患者中,10周混合模式间歇训练(包括HIIT和每隔一天低强度阻力运动)结合每次运动前后20 g乳清蛋白,与非蛋白等能量对照饮料相比,侧肢CSA没有进一步增加[123]。然而,该研究没有报告总的每日蛋白质摄入量,因为满足每日膳食蛋白质摄入量对于运动性肌肉肥大的增加似乎是至关重要的。此外,鉴于VO2max增加,而不是1 RM(完成1次的最大力量)增加[114],不能排除混合模式间歇训练可能对合成代谢效应的延迟,特别是综合力量和有氧训练通常会抵消单一模式训练后获得的部分肌肉力量增长[124]。
综上,HIIT补充蛋白质后,可以有效促进肌肉合成,而与上调的线粒体功能无关,然而由于仅报道了SIT,因此这一结论还有待证实。有趣的是,本课题组研究显示MOTS-C[59,62,125]降低衰老导致的乙酰化作为导致骨骼肌萎缩的重要因素,未来HIIT与不同的营养补剂结合将会是研究骨骼肌质量和功能的重要问题。此外,有实验还显示HIIT组的平均每日卡路里摄入量减少了8.8%。这可能是高蛋白饮食带来的饱腹感增加所致。因此,大量营养素比例的改变也可能在高脂加运动组的有益效果中发挥作用。还需要进一步的研究来测试这种可能性[126]。
3 结论
HIIT作为一种较新的锻炼手段,与常规有氧运动的运动量或能量消耗相当时,HIIT可作为更有效的替代方式给受试者提供类似或更好的生理益处,尤其是改善骨骼肌的形态和功能。HIIT可从上调骨骼肌蛋白质合成速率和下调萎缩速率、促进肌肉重塑和调节肌纤维类型、促进血管生成和血流灌注、介导骨骼肌线粒体含量上调和功能改善、增加肌肉力量,以及与膳食补充的协同作用等影响骨骼肌质量及功能。但迄今为止,相关领域的研究仍存在一些亟待解决的问题:a. 同样是HIIT运动,但由于强度和持续时间不同对线粒体具体功能调节不同,其机制并不明晰;b. 机体存在对运动的适应性,长期HIIT后某些指标在运动后期暂停,这是否提示HIIT带来的功能变化可能是单次叠加;c. HIIT相关动物模型过于强调消耗的热量和运动距离相同,这导致其运动时间没有体现出HIIT特点的短时、高效。此外,敲除模型以及在细胞层面上模拟HIIT的加入可能会为未来研究增添亮点。