N,Br-CDs作为荧光传感器连续检测银离子和生物硫醇
2023-07-13雷甜甜陈宽宋功武何瑜
雷甜甜,陈宽,宋功武,何瑜
(湖北大学化学化工学院, 湖北 武汉 430062)
0 引言
CDs以其优异的光学性能、低毒性、优异的水溶性、制备和改性方便等优点近年来受到人们的关注[1].目前,CDs已应用于各个领域,如传感、治疗、生物成像和光电子器件[2].目前为止,大多数已报道的CDs在紫外线或蓝光激发下表现出蓝绿色荧光,但是生物基质具有蓝色自荧光的干扰和紫外激发光的严重光损伤[3],这限制了它们在生物医学领域的进一步应用.同时,一些报道CDs长波长发射的研究普遍存在两个问题:1)不是红色发射(λmax< 620 nm)[4],2)在水中测定的量子产率(QYs)与典型的蓝色发射CDs相比相对较低[5].因此,制备高效长波长发射CDs是至关重要的.
银离子(Ag+)是水体污染中最主要的有害重金属之一[6],由于其生物积累性和潜在毒性,Ag+能够与酶/蛋白质结合并导致其失活[7].因此,发展快速、有选择性的Ag+检测方法具有重要意义.此外,生物硫醇,如谷胱甘肽(GSH)、半胱氨酸(Cys)、同型半胱氨酸(Hcy)在细胞生长、代谢和维持适当的氧化还原状态中发挥重要作用[8].许多研究表明,细胞内生物硫醇的失衡与疾病密切相关,因此,有效检测生物液体中的生物硫醇在生物化学和临床化学中具有重要意义[9].生物硫醇的定量分析方法很多,包括高效液相色谱(HPLC)、比色法、电化学方法和质谱(MS)等[10].近年来,荧光法因其具有选择性好、实时、灵敏度高、操作简便等优点而被广泛应用于生物硫醇的检测中.特别是荧光“开关”技术已应用于Ag+和生物硫醇的顺序检测.之前,Huang等人合成了P-DNA-1@MOF杂交体用于Ag+和生物硫醇的荧光检测[11].Borse等人制备了氮掺杂多荧光CDs,用于“turn off-on”银离子-生物硫醇双传感[12].因此,探索更多的荧光“开关”法来检测Ag+和生物硫醇很有前景.
前面我们已经提到掺杂低电负性的杂原子可以引起CDs荧光红移,在这个基础上,我们尝试把氟替换为电负性更低的溴,希望能得到发射波长更长的CDs.我们这次以4-溴邻苯二胺和多巴胺为前体,通过水热法合成了氮溴共CDs(N,Br-CDs).N,Br-CDs具有强烈的红光,发射波长为640 nm,相对量子产率高达24.6%.再通过Ag+猝灭其荧光,生物硫醇恢复其荧光,我们构建了一种荧光开关传感器用来连续检测Ag+和生物硫醇,此方法已适用于人尿中生物硫醇的检测.
1 实验部分
1.1 实验材料与试剂4-溴邻苯二胺购自上海麦克林生化科技有限公司,多巴胺、谷胱甘肽(GSH)和半胱氨酸(Cys)购自阿拉丁试剂有限公司,同型半胱氨酸(Hcy)购自梯希爱(上海)化成工业发展有限公司,硝酸银、醋酸和醋酸钠购自国药集团化学试剂有限公司.
1.2 实验器材紫外-可见分光光度计;荧光分光光度计;傅里叶变换红外分光光度计;透射电子显微镜;高分辨透射电子显微镜;X射线光电子能谱仪.
1.3 N,Br-CDs的制备称取0.383 g多巴胺和0.093 6 g 4-溴邻苯二胺,于5 mL超纯水中均匀混合,再将混合液转移到聚四氟乙烯内衬的不锈钢反应釜中,在180 ℃条件下反应8 h,让反应釜自然冷却至室温.冷却后,将所得到的反应物离心(8 000 r/min)10 min取上清液,用微孔膜(0.22 μm)过滤后透析6 h,干燥,得到深蓝色固体,配置成N,Br-CDs溶液(2 mg/mL).
1.4 银离子检测取不同浓度的Ag+和35 μL CDs溶液分别配成3 mL(Ag+的浓度为0~13.3 μmol/L),并用醋酸-醋酸钠(HAc-NaAc)缓冲溶液调节pH至5,分别测定在570 nm激发波长下的荧光光谱,并记录640 nm处的荧光强度.
1.5 生物硫醇的检测在上述复合反应液中(Ag+的最终浓度为13.3 μmol/L)加入不同浓度的生物硫(GSH、Cys、Hcy的浓度分别为0~7.5 μmol/L、0~11.7 μmol/L、0~5.8 μmol/L),并用HAc-NaAc缓冲溶液调节pH至5,分别测定在570 nm激发波长下的荧光光谱,并记录640 nm处的荧光强度.
1.6 尿液中生物硫醇的检测在实际样品的检测中,以人尿样作为分析物,尿液样本由男性志愿者捐赠.在检测生物硫醇之前,通过加入三苯基膦将尿样中的二硫化物还原成流离的硫醇,离心(8 000 r/min,20 min)取上清液,加入超纯水稀释到合适浓度,用HAc-NaAc(0.2 mmol/L,pH=5.0)缓冲溶液调节pH至5.0用自制的Cys溶液作为回收研究的标准样品,采用标准加入法测定人尿中生物硫醇的总含量.
2 结果与讨论
2.1 材料的表征和分析对所得的样品进行了结构表征,由透射电镜的测试结果可知(图1),这种红色N,Br-CDs在水溶液中具有较好的单分散性,其平均尺寸约为2.68 nm,具有高结晶度,晶格间距为0.31 nm.

图1 (a)N,Br-CDs的透射电子显微镜图(内嵌是高倍透射电子显微镜图)及其(b)粒径分布
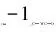

图2 (a)N,Br-CD的红外图谱;(b)N,Br-CD的XPS总谱;(c)C 1s谱;(d)N 1s谱;(e)O 1s谱和(f)Br 3d谱
2.2 N,Br-CDs检测Ag+和生物硫醇的可行性的探究一般情况下,金属离子如Hg2+、Cu2+、Fe3+、Ag+和Pb2+可以有效地猝灭CDs的荧光发射.在我们的工作中,N,Br-CDs可能被Ag+有效猝灭.由于具有较强的氧化能力,限制在N,Br-CDs表面的Ag+在激发时很容易从N,Br-CDs的最低未占据分子轨道(LUMO)捕获电子,从而抑制电子从LUMO向N,Br-CDs的最高占据分子轨道(HOMO)的再跃迁,从而减弱荧光.随着生物硫醇的加入,GSH、Cys和Hcy的巯基与金属离子具有更强的配位作用,生物硫醇可将络合物中的金属离子夺取并与之形成更稳定的络合物即Ag+离开N,Br-CDs表面,同时使配体的荧光恢复,从而实现对生物硫醇的检测.
为了验证这一假设,我们取35 μL N,Br-CDs溶液、10 μL AgNO3溶液(5 mmol/L),配成3 mL,测量其荧光,然后加入35 μL GSH(0.5 mmol/L)充分混合(Cys、Hcy同理),再记录其荧光变化.如图3所示.N,Br-CDs的荧光被银离子猝灭后加入生物巯基(GSH、Cys、Hcy)均有恢复,由此说明本实验是可行的.
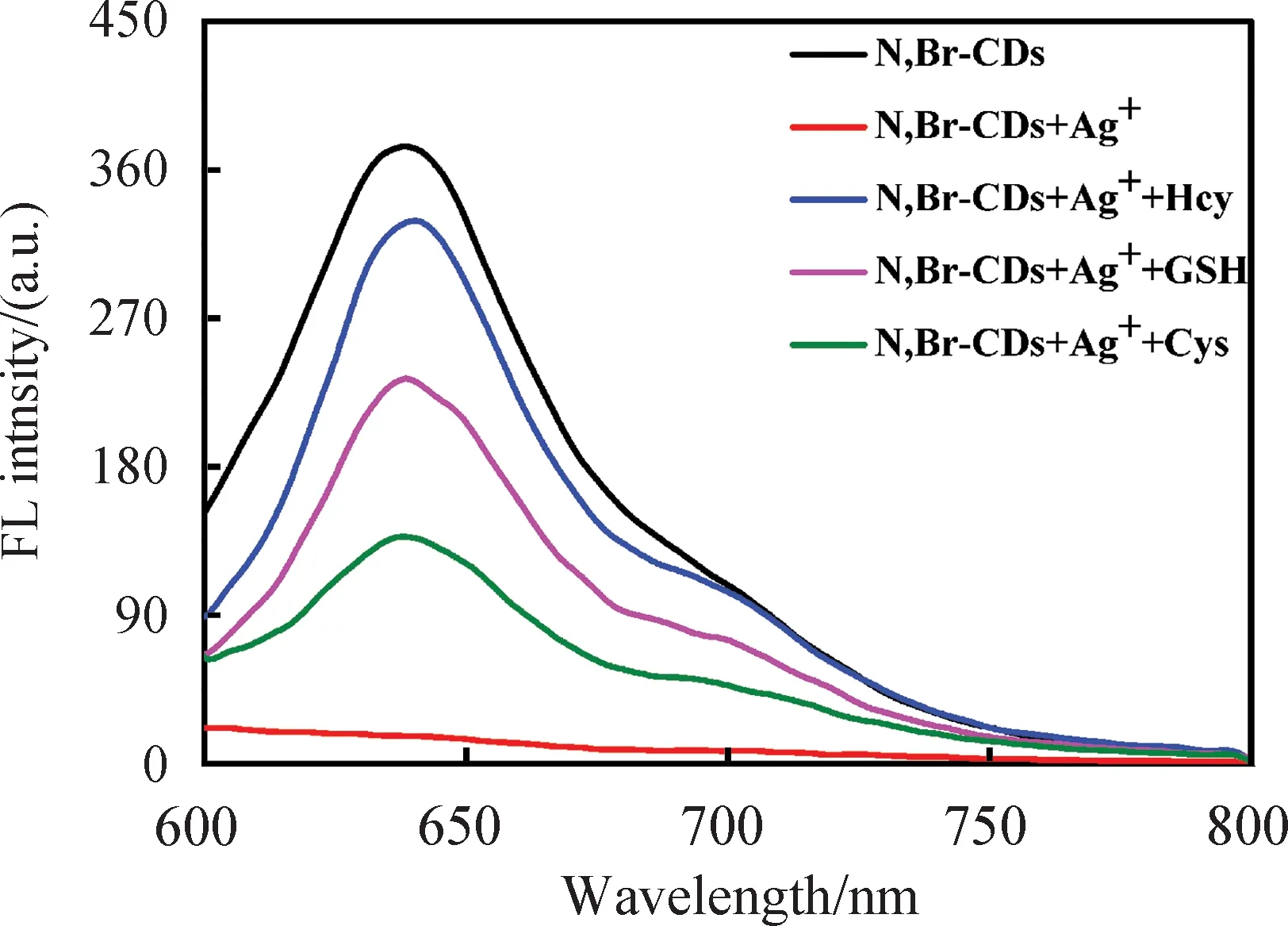
图3 N,Br-CDs连续检测Ag++生物硫醇的可行性
2.3 检测Ag+的线性范围和选择性如图4(a,b)所示,在pH=5的条件下,随着N,Br-CDs溶液中的Ag+浓度的上升,640 nm处的荧光逐渐下降,且Ag+的浓度在0.167~13.3 μmol/L范围内具有良好的线性,其线性回归方程Y=0.070[C]+0.086([C]为Ag+浓度,单位为μmol/L),线性相关系数为0.95.根据3σ/k原则,检出限(LOD)为42 nmol/L.
为了探究N,Br-CDs对Ag+的选择性,我们用同浓度的Na+、K+、Mg2+、Ni2+、Al3+、Fe3+、Cu2+、Ca2+、Zn2+、Ba2+、Hg2+、Mn2+等离子替代Ag+加入到N,Br-CDs溶液中,并分别测定其640 nm处的荧光强度变化.结果如图4 c所示,只有Ag+能显著引起N,Br-CDs的荧光变化,其余离子对荧光强度几乎没有影响.此结果表明N,Br-CDs对Ag+具有良好的选择性.
2.4 检测生物硫醇的线性范围和选择性将10 μL不同浓度的生物硫醇加入N,Br-CDs-Ag+复合反应液中,随着生物硫醇的浓度增加,荧光逐渐恢复直至不再发生变化, 当GSH、Cys、Hcy的浓度分别达到7.5 μmol/L(图5(a))、11.7 μmol/L(图5(c))、5.8 μmol/L(图5(e))时,荧光恢复率F/F0最高,分别为11.03、11.13和11.93,并在此范围内有良好的线性关系,线性回归方程分别为Y=1.37[C]+0.82([C]为GSH浓度,单位为 μmol/L)(图5(b))、Y=1.94[C]+0.46([C]为Cys浓度,单位为μmol/L)(图5(d))、Y=0.89[C]+0.51([C]为Hcy浓度,单位为 μmol/L)(图5(f)),其线性检测范围分别为0.3~0.75 μmol/L、0.5~11.7 μmol/L、0.3~5.8 μmol/L,根据3σ/k原则,计算出检出限(LOD)分别为22 nmol/L、15 nmol/L和33 nmol/L,表明该探针具有较好的检测生物硫醇能力.
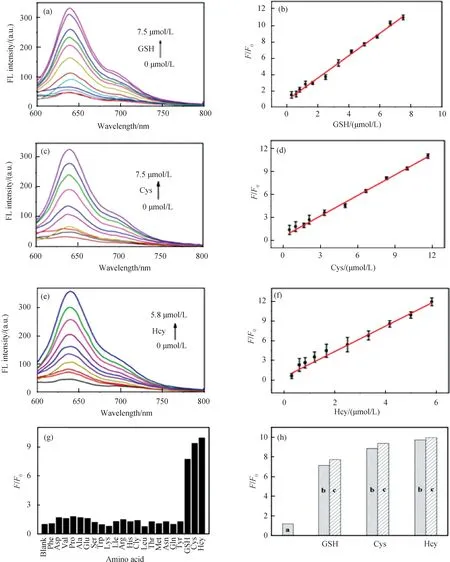
图5 (a, b,c,d,e,f)N,Br-CD检测生物硫醇的荧光变化图谱和对应的线性拟合,N,Br-CDs作为荧光探针对(g)19种天然氨基酸和(h)3种生物硫醇的选择性测试和
我们研究了19种天然氨基酸对于该探针的反应,我们将19种天然氨基酸(1 mmol/L)分别加入N,Br-CDs-Ag+体系中,如图5(g)所示,即使单个氨基酸的浓度明显高于是生物硫醇(GSH、Cys、Hcy的浓度均为5 μmol/L),19种天然氨基酸并未使荧光有明显恢复.为了进一步确定荧光探针对生物巯基的高特异性,在共存的条件下对其选择性进行了测试.如图5(h)所示,实验结果表明,19种天然氨基酸(每种的浓度为1 mmol/L)共存也不能使荧光有明显恢复,我们还分别对GSH、Cys和Hcy进行了测试,每个测试都是在这些氨基酸(1 mmol/L)与生物硫醇(5 μmol/L)的共存情况下进行的.结果表明,该探针对生物巯基具有高特异性.
我们以N,Br-CDs作为荧光探针对于生物硫醇的选择性测试:图5(g)19种天然氨基酸各1 mmol/L,生物硫醇5 μmol/L荧光回复率对比;图5(h)柱a表示19种氨基酸共存(每种1 mmol/L)的情况下荧光恢复率,柱b表示19种氨基酸每种1 mmol/L与各生物硫醇(5 mmol/L)共存的情况下的荧光恢复率,柱c表示各生物硫醇为5 mmol/L时的荧光恢复率.
2.5 人尿中生物硫醇的检测为了研究N,Br-CDs荧光探针在实际样品中的应用,我们在人尿中研究其检测性能.将尿液样本用三苯基膦预处理后稀释20倍(用0.2 mmol/L NaAc-HAc缓冲溶液调节pH=5),并加入一定浓度的Cys获得相应的加标样品,3次测试结果如表1所示,回收率在范围为94%~105%,RSD值小于6.5%,说明该方法适用于检测人尿样中的生物硫醇.
表1 人尿中生物硫醇的分析结果
3 结论
综上所述,采用一步水热法合成了红色荧光的N,Br-CDs,并使用TEM、FTIR、XPS等表征手段对制备的N,Br-CDs进了表征,证明N、Br被掺杂到CDs中;Ag+可以猝灭N,Br-CDs的红色荧光,生物硫醇可以和Ag+形成Ag-S复合物,这将导致Ag+离开N,Br-CDs表面,荧光得以恢复,基于此构建了荧光开关传感器用来连续检测Ag+和生物硫醇,得到的Ag+的线性范围是0.167~13.3 μmol/L,检测限为42 nmol/L;生物硫醇(GSH、Hcy、Cys)的线性范围分别是0.3~0.75 μmol/L、0.5~11.7 μmol/L、0.3~5.8 μmol/L,检出限分别为22、15和33 nmol/L.该方法可检测人尿中的生物硫醇,证明该方法在实际应用中的潜力.
