DNA损伤应答中环状GMP-AMP合成酶的UFMylation修饰潜在作用
2023-06-23宋佳苋朱敏
宋佳苋 朱敏

摘要:为探究环状GMP-AMP合成酶(cyclic GMP-AMP synthetase,cGAS)翻译后修饰参与DNA损伤应答的潜在作用,转染HeLa细胞和HEK-293T细胞,设置未处理组和Etoposide处理组。基于Western blot和免疫荧光染色,确定HeLa细胞质粒转染效率、Etoposide处理前后的DNA损伤效果、DNA损伤前后cGAS的细胞定位情况。采用免疫共沉淀和Western blot检测HEK-293T细胞cGAS的表达及UFMylation修饰。实验结果显示,HeLa细胞稳定表达cGAS,Etoposide处理可造成明显DNA损伤,未处理組cGAS富集于细胞质,处理组cGAS富集于细胞核。HEK-293T细胞稳定表达转染质粒,同时发现UFMylation修饰的cGAS。因此,cGAS参与DNA损伤应答且可能通过UFMylation修饰调控,为翻译后修饰视角研究DNA损伤应答提供理论参考。
关键词:DNA损伤应答;环状GMP-AMP合成酶;泛素折叠修饰因子1;UFMylation修饰
中图分类号:Q527 文献标志码:A
文章编号:1006-1037(2023)02-0020-04
doi:10.3969/j.issn.1006-1037.2023.02.04
基金项目:
国家自然科学基金(批准号:32201061)资助;山东省自然科学基金(批准号:ZR2021QC083)资助。
通信作者:
朱敏,女,博士,副教授,主要研究方向为DNA损伤修复。
先天免疫系统(快速感知和响应感染)和DNA损伤应答(DNA damage response,DDR)作为保持生物体完整性所必需的重要系统,其缺陷导致感染、自身免疫、癌症和衰老等诸多疾病,两者之间串扰所涉及分子因素及潜在机制仍不清楚。DDR能发现且控制细胞内特定DNA损伤,通过修复、耐受、永久失活(不可修复或不可耐受的病变细胞)等方式保护细胞,最大程度降低DNA损伤影响[1-2]。研究发现,12%的转移性癌症患者具有肿瘤抑制基因病原种系突变,其中75%与DNA损伤修复有关[3]。癌症发生是由多因素诱发、多基因参与且涉及基因突变和染色体变化的多阶段复杂过程,其核心特征之一是基因组不稳定性[4-6]。环状GMP-AMP合成酶(cyclic GMP-AMP synthetase,cGAS)是一种胞质DNA感受器蛋白,通过识别、结合细胞质内双链DNA(内源性和/或外源性)被激活,合成第二信使cyclic GMP-AMP(cGAMP),由cGAMP激活定位于内质网的干扰素基因刺激因子(stimulator of interferon genes,STING),进而触发信号级联激活天然免疫。虽然cGAS的激活可通过多种蛋白质翻译后修饰(Post-translational modification,PTM)调节,包括磷酸化、谷氨酰化、泛素化、SUMO化和乙酰化,但cGAS的其他PTM因子仍然知之甚少。Ub样蛋白(UBL)通过一系列酶促反应共价偶联其靶蛋白,如神经前体细胞表达和发育下调8(NEDD8)、干扰素刺激基因15(ISG15)和泛素折叠修饰因子1(UFM1)。UFM1作为新发现的UBL之一,与泛素化类似,通过三步酶促反应与其靶蛋白偶联,包含泛素样修饰剂激活酶5(UBA5, E1),UFM1偶联酶1(UFC1, E2),UFM1特异性连接酶1(UFL1, E3)。DNA损伤相关基因组不稳定性导致微核形成,微核cGAS与DNA损伤标志物如磷酸化的组蛋白H2AX(γH2AX)可共定位[7-8]。已有研究表明,DNA损伤以importin-α依赖方式诱导cGAS入核,通过多聚(ADP-核糖)与PARP1相互作用,抑制PARP1-Timeless复合物形成,从而抑制同源重组修复[9]。细胞核cGAS通过与染色质结合促进其致密化,阻碍RAD51介导的DNA链侵入,抑制同源重组修复[10]。综上,本文基于微核cGAS的作用,过表达HeLa细胞和HEK-293T细胞的cGAS,研究cGAS的UFMylation修饰及DNA损伤前后cGAS的细胞定位,为DNA损伤修复研究提供新思路。
1 材料与方法
1.1 实验材料
HEK-293T细胞系、HeLa细胞系源自ATCC细胞库。DMEM/HIGH-GLUCOSE(山东思科捷生物技术有限公司),胎牛血清(德国PAN-Biotech公司),HA Tag抗体(美国Bethyl公司),FLAG Tag抗体(美国Sigma公司),Protein A beads(美国GE Healthcare公司),γ-H2AX抗体(美国Millipore公司),FLAG-Vector、FLAG-cGAS、HA-UFM1、HA-UFM1(ΔC2)质粒均由本课题组实验室前期构建。
1.2 研究方法
1.2.1 细胞培养 HeLa细胞、HEK-293T细胞均接种于DMEM高糖细胞培养液(含10%胎牛血清、0.5%青霉素—链霉素混合液),置于37 ℃细胞培养箱(5% CO2)内培养。处于对数生长期的细胞通过胰酶消化后,参照聚乙烯亚胺说明书转染。
1.2.2 Western blot检测质粒转染效率 HeLa细胞(计数1.5×105个)接种至六孔板,于四孔分别转染FLAG-Vector、FLAG-Vector、FLAG-cGAS、FLAG-cGAS质粒各2 μg,转染48 h后,取一组FLAG-Vector、FLAG-cGAS质粒转染的细胞用25 μmol/L Etoposide处理2 h。吸除细胞培养液,加入100 μL sample buffer(含细胞裂解成分)裂解细胞,提取细胞全蛋白。采用10% SDS-PAGE胶分离蛋白,转印PVDF膜,经4%脱脂牛奶封闭后,加入FLAG Tag抗体4 ℃孵育过夜。次日,用抗鼠二抗室温孵育PVDF膜1 h,通过化学发光仪器检测信号,确定质粒转染效率。
1.2.3 免疫荧光确定cGAS细胞定位 HeLa细胞(计数1.5×105个)接种至六孔板(预置洁净玻片),于四孔分别转染FLAG-Vector、FLAG-Vector、FLAG-cGAS、FLAG-cGAS质粒各2 μg,记为a、b、c、d组。转染48 h后,a、c组不作处理,b、d组用25 μmol/L Etoposide处理2 h;剩余两孔记为m、n组,均不作转染处理,n组与b、d组同时用25 μmol/L Etoposide处理2 h。各组样本经4%多聚甲醛固定15 min,0.1% Triton X-100处理10 min通透细胞膜,10%山羊血清封闭1 h,分别滴加FLAG Tag一抗(a-d组)和γ-H2AX一抗(m-n组)4 ℃孵育过夜后,室温避光孵育荧光二抗(与一抗种属对应)2 h。加1滴含DAPI的抗淬灭封片剂至载玻片,覆盖细胞爬片,涂抹指甲油固定。通过荧光显微镜观察γ-H2AX(DNA损伤Marker)和cGAS的细胞定位情况。
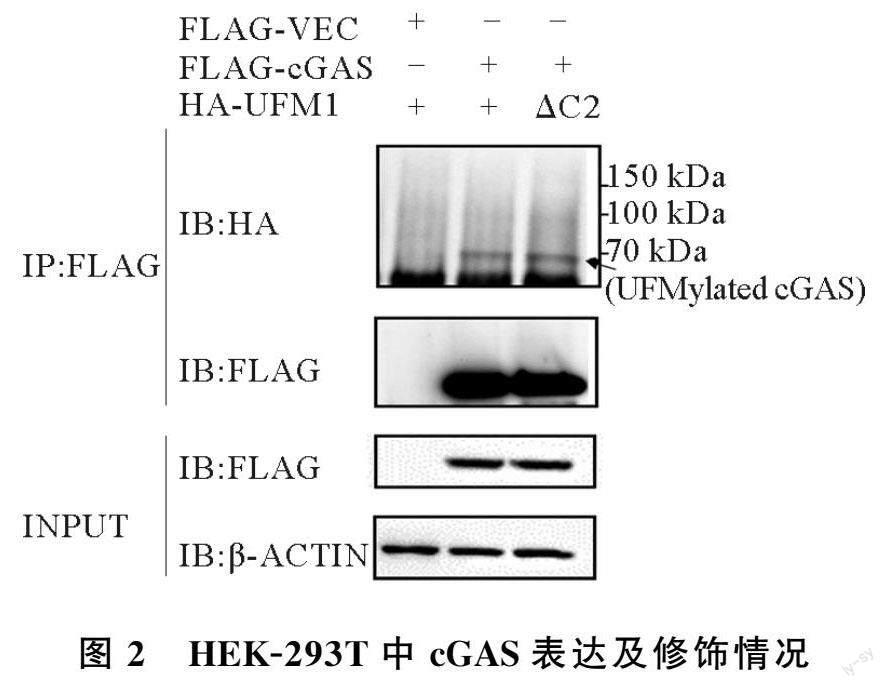
1.2.4 免疫共沉淀确定cGAS的UFMylation修饰 HEK-293T细胞(计数7×106个)接种至10 cm细胞培养皿,记为e、f、g组,分别转染FLAG-VEC+HA-UFM1、FLAG-cGAS+HA-UFM1、FLAG-cGAS+HA-UFM1(ΔC2)质粒(质粒用量为:2.5 μg+2.5 μg)。转染48 h后,室温条件下用100 μL UF buffer(150 mmol/L Tris-HCl, pH 8.0; 5% SDS; 30% Grycerol)裂解细胞30 min,100 ℃煮沸5 min,冷却至室温加入900 μL UF buffer A(50 mmol/L Tris-HCl, pH 8.0; 150 mmol/L NaCl; 0.5% NP-40; 1×PIC)冰浴裂解30 min。14000 rpm,4 ℃离心10 min。取上清液,加入UF buffer A(上清液体积稀释一倍), FLAG Tag抗体,过夜孵育后,加入Protein A beads结合2 h,提取FLAG Tag抗体特异性免疫沉淀蛋白,确定cGAS是否可以发生UFMylation修饰。
2 结果
2.1 DNA损伤后诱导cGAS从细胞质转位至细胞核
为确定DNA损伤前后cGAS的细胞定位,HeLa细胞经质粒转染后作部分DNA损伤处理,通过免疫荧光染色观察Etoposide处理前后cGAS的荧光信号。由图1可知,Etoposide处理的HeLa细胞发现DNA损伤Marker γ-H2AX于细胞核富集,而未处理细胞无明显γ-H2AX富集,即25 μmol/L Etoposide处理2 h可造成明显的HeLa细胞DNA损伤。HeLa细胞转染后的免疫荧光染色结果显示,未加药处理组细胞的cGAS主要定位细胞质中,这与其作为胞质DNA感受器参与先天免疫的功能一致(图1(c))。Etoposide诱导DNA损伤后,cGAS主要定位细胞核中,说明DNA损伤后cGAS发生了核转位,细胞核定位的cGAS可能参与损伤后DNA修复过程。
2.2 cGAS能被UFMylation修饰
cGAS的酶活性受多种PTM调节,为验证cGAS能否发生UFMylation修饰,免疫共沉淀纯化FLAG-cGAS蛋白并通过Western blot检测修饰情况。由图2可知,HEK-293T细胞中FLAG-cGAS可稳定表达,同时发现UFMylation修饰的cGAS(泳道2、3),其中UFM1(ΔC2)为暴露C末端甘氨酸残基的活性状态(泳道3)。这证实外源转入cGAS和UFM1后,与活性状态的UFM1(ΔC2)一致,cGAS可发生UFMylation修饰。
3 讨论
遗传信息传递过程中各种内源性和/或外源性因素会诱发DNA组成、结构异常改变从而影响基因组稳定性。内源性因素主要包括DNA错误复制,DNA不稳定性引发的自身碱基转化、碱基丢失、碱基修饰,以及由细胞正常代谢产生且使DNA碱基氧化、DNA链断裂的自由基[11-13]。据统计,细胞每天最多可发生105次内源性DNA损伤[14]。电离辐射、紫外线、化学诱变剂等物理化学因素引发的DNA损伤,会破坏碱基结构,形成嘧啶二聚体,产生DNA链断裂(SSB、DSB)和DNA交联(链内交联、链间交联、ICL)[15-17]。
正常细胞的胞质DNA积累受限于不同亚细胞位点的DNA酶作用,DNA酶存在于细胞外(DNase I和DNase IL3)、吞噬溶酶体内(DNase II)或胞浆内(DNase III),共同预防自身DNA异常累积[18]。研究表明,MutLα亚基缺失MLH1(其缺陷引发约50%的dMMR癌症)会导致DNA双链断裂,形成异常DNA修复中间产物,最终产生染色体异常,釋放核DNA,激活cGAS-STING途径[19]。经典cGAS-STING信号通路中,cGAS的酶活性受翻译后修饰调节,进而影响先天免疫反应。单纯疱疹病毒-1感染细胞时,RNF185(E3泛素化连接酶)通过介导cGAS(K173和K384位点)K27连接的泛素链形成,会增强cGAS的酶活性,促进下游干扰素应答效应[20]。UFMylation修饰参与内质网应激、胚胎发育、DNA损伤修复等多种生物过程。DNA双链断裂招募磷酸化的UFL1,通过UFMylation修饰单链组蛋白H4,增强募集SUV39H1和Tip60,从而促进DNA损伤时共济失调毛细血管扩张突变(ATM)激酶的激活[21]。此外,MRE11 K282位点的UFMylation修饰通过募集MRN复合物,激活ATM,从而促进同源重组介导的双链断裂修复,维护基因组稳定性[22]。本研究结果证实,细胞内cGAS存在UFMylation修饰,25 μmol/L Etoposide处理后细胞质定位的cGAS富集于细胞核,即DNA损伤后cGAS发生核转位,联结先天免疫和DNA损伤,为阐明两者之间串扰的分子机制,提供理论参考。
4 結论
cGAS-STING信号通路主要响应源自微生物、DNA病毒的外源DNA,以及由于基因组不稳定或线粒体释放的内源DNA,触发先天免疫反应,释放I型干扰素。研究结果表明,cGAS细胞质定位与先天免疫中功能一致。而Etoposide处理造成DNA损伤后,cGAS移位至细胞核,提示cGAS参与DNA损伤后修复过程。细胞内cGAS的UFMylation修饰,为探究cGAS参与DNA损伤修复的翻译后修饰调控提供新靶点。
参考文献
[1]HARPER J W, ELLEDGE S J. The DNA damage response: Ten years after[J]. Molecular Cell, 2007, 28(5): 739-745.
[2]JACKSON S P, BARTEK J. The DNA-damage response in human biology and disease[J]. Nature, 2009, 461: 1071-1078.
[3]ROBINSON D R, WU Y M, LONIGRO R J, et al. Integrative clinical genomics of metastatic cancer[J]. Nature, 2017, 548: 297-303.
[4]BARTEK J, BARTKOVA J, LUKAS J. DNA damage signalling guards against activated oncogenes and tumour progression[J]. Oncogene, 2007, 26: 7773-7779.
[5]MARTINCORENA I, CAMPBELL P J. Somatic mutation in cancer and normal cells[J]. Science, 2015, 349(6255): 1483-1489.
[6]BOVERI T. Concerning the origin of malignant tumours by Theodor Boveri. Translated and annotated by Henry Harris[J/OL]. Journal of Cell Sciense, 2008, 121(Supplement 1): 1-84[2022-10-09]. https://doi.org/ 10.1242/jcs.025742.
[7]HARDING S M, BENCI J L, IRIANTO J, et al. Mitotic progression following DNA damage enables pattern recognition within micronuclei[J]. Nature, 2017, 548: 466-470.
[8]MACKENZIE K J, CARROLL P, MARTIN C A, et al. cGAS surveillance of micronuclei links genome instability to innate immunity[J]. Nature, 2017, 548: 461-465.
[9]LIU H P, ZHANG H P, WU X Y, et al. Nuclear cGAS suppresses DNA repair and promotes tumorigenesis[J]. Nature, 2018, 563: 131-136.
[10] JIANG H, XUE X Y, PANDA S, et al. Chromatin-bound cGAS is an inhibitor of DNA repair and hence accelerates genome destabilization and cell death[J]. The EMBO Journal, 2019, 38(21): e102718.
[11] LINDAHL T, BARNES D E. Repair of endogenous DNA damage[C]//Cold Spring Harbor Symposia on Quantitative Biology. New York, 2000: 127-133.
[12] RYDBERG B, LINDAHL T. Nonenzymatic methylation of DNA by the intracellular methyl group donor S-adenosyl-L-methionine is a potentially mutagenic reaction[J]. The EMBO Journal, 1982, 1(2): 211-216.
[13] KLUNGLAND A, ROSEWELL I, HOLLENBACH S, et al. Accumulation of premutagenic DNA lesions in mice defective in removal of oxidative base damage[J]. Proceedings National Academy of Science of the United States America, 1999, 96(23): 13300-13305.
[14] HOEIJMAKERS J H. DNA damage, aging, and cancer[J]. New England Journal of Medicine, 2009, 361: 1475-1485.
[15] BENNETT J W, KLICH M. Mycotoxins[J]. Clinical Microbiology Reviews, 2003, 16(3): 497-516.
[16] PEAK M J, PEAK J G. DNA-to-protein crosslinks and backbone breaks caused by far- and near-ultraviolet, and visible light radiations in mammalian cells[J/OL]. Basic Life Sciences, 1986, 38: 193-202[2022-10-10]. https://doi.org/10.1007/978-1-4615-9462-8_20.
[17] LAWLEY P D. Effects of some chemical mutagens and carcinogens on nucleic acids[J]. Progress in Nucleic Acid Research Molecular Biology, 1966, 5: 89-131.
[18] AHN J, BARBER G N. Self-DNA, STING-dependent signaling and the origins of autoinflammatory disease[J]. Current Opinion Immunology, 2014, 31: 121-126.
[19] GUAN J H, LU C Z, JIN Q H, et al. MLH1 Deficiency-Triggered DNA Hyperexcision by Exonuclease 1 Activates the cGAS-STING Pathway[J]. Cancer Cell, 2021, 39(1): 109-121+e1-e5.
[20] WANG Q, HUANG L Y, HONG Z, et al. The E3 ubiquitin ligase RNF185 facilitates the cGAS-mediated innate immune response[J]. PLoS Pathogens, 2017, 13(3): e1006264.
[21] QIN B, YU J, NOWSHEEN S, et al. UFL1 promotes histone H4 ufmylation and ATM activation[J]. Nature Communications, 2019, 10: 1242.
[22] WANG Z F, GONG Y M, PENG B, et al. MRE11 UFMylation promotes ATM activation[J]. Nucleic Acids Research, 2019, 47(8): 4124-4135.
