LncRNA CYTOR对大鼠背脊髓神经元细胞损伤及炎性因子的影响
2023-06-15殷德振陈聪王鹏王元浩李宏达
殷德振 陈聪 王鹏 王元浩 李宏达
脊髓损伤是一种具有高致残率与致死率的疾病类型之一,并可促使肢体瘫痪或劳动力丧失,已严重降低患者生活质量,目前脊髓损伤尚无有效的治疗方法[1]。脊髓神经元细胞凋亡及其突出结构及功能丧失是脊髓损伤的病理学基础,缺氧或相关应激条件下,脊髓神经元细胞可产生大量氧自由基从而促使细胞发生氧化应激反应,进而促进细胞凋亡[2]。长链非编码RNA(LncRNA)差异性表达与脊髓损伤密切相关,并可能作为脊髓损伤诊断及治疗的潜在靶点[3,4]。LncRNA CYTOR低表达于损伤的软骨细胞中,上调其表达可抑制软骨细胞凋亡并促进细胞增殖[5]。但LncRNA CYTOR与脊髓损伤相关性研究尚未见报道。Starbase预测显示LncRNA CYTOR与miR-136-5p存在互补序列。研究表明,miR-136-5p在脊髓损伤中表达上调,并可促进炎性因子表达[6]。但笔者发现,LncRNA CYTOR/miR-136-5p分子轴在脊髓损伤的发生发展过程中具体作用机制尚不明确。因此,本研究通过构建大鼠背脊髓神经元细胞细胞损伤模型,探讨LncRNA CYTOR对过氧化氢(H2O2)诱导的大鼠背脊髓神经元细胞损伤过程的影响及与miR-136-5p的关系。报告如下。
1 材料与方法
1.1 材料与试剂 大鼠背脊髓神经元细胞(上海瑄科生物科技有限公司);H2O2(美国Sigma);Trizol试剂(美国Thermo Fisher);miRNA提取试剂盒、反转录试剂盒及PCR试剂盒(北京天根生化科技有限公司);Lipofectamine2000转染试剂(美国Invitrogen);pcDNA、pcDNA-LncRNA CYTOR、miR-NC、miR-136-5p mimics(上海吉玛制药技术有限公司);MTT试剂盒、细胞凋亡检测试剂盒(北京索莱宝科技有限公司);IL-6、IL-21 ELISA检测试剂盒(武汉华美生物工程有限公司);双荧光素酶报告基因检测试剂盒(美国Promega);兔抗鼠Bax、Bcl-2、GAPDH单克隆抗体及辣根过氧化物酶标记的山羊抗兔IgG多克隆抗体(美国Santa Cruz)。9602A酶标仪(北京普朗医疗器械公司);StepOnePlus实时荧光定量PCR仪(美国ABI);FACS Calibur流式细胞仪(美国Beckman Coulter)。
1.2 方法
1.2.1 实验处理及分组:大鼠背脊髓神经元细胞放入含有浓度为100 μmol/L H2O2的培养基培养24 h[7],记为H2O2组。同时将正常培养的大鼠背脊髓神经元细胞记为con组。培养的大鼠背脊髓神经元细胞生长融合至70%时进行转染,转染方法:以不含血清的培养基稀释Lipofectamine2000转染试剂,另外以不含血清的培养基稀释pcDNA、pcDNA-LncRNA CYTOR、pcDNA-LncRNA CYTOR和miR-NC、pcDNA-LncRNA CYTOR和miR-136-5p mimics,将二者充分混匀后于37℃条件下静置20 min。加入大鼠背脊髓神经元细胞,6 h后更换为正常培养基培养48 h。实验分组:转染完成后将上述细胞培养基更换为含有100 μmol/L H2O2的培养基培养24 h,分别记为H2O2+pcDNA组、H2O2+pcDNA-LncRNA CYTOR组、H2O2+pcDNA-LncRNA CYTOR+miR-NC组和H2O2+pcDNA-LncRNA CYTOR+miR-136-5p组。
1.2.2 LncRNA CYTOR、miR-136-5p表达水平检测:取大鼠背脊髓神经元细胞加入Trizol试剂,通过miRNA提取试剂盒提取总RNA保存于-80℃冰箱内。参照反转录试剂盒说明书将RNA反转录合成cDNA后置于-20℃冰箱内保存。cDNA稀释后进行qRT-PCR反应,通过制备qRT-PCR反应体系后设置反应程序(预变性95℃ 2 min,变性95℃ 30 s,退火60℃ 30 s,延伸72℃ 30 s,共40个循环)。GAPDH作为LncRNA CYTOR的内参照物,U6作为miR-136-5p的内参照物,用2-ΔΔCt法统计结果。
1.2.3 细胞增殖检测:取4组大鼠背脊髓神经元细胞,加入0.25%胰蛋白酶消化后接种至96孔板(1×103个/孔),然后置于培养箱内培养并加入20 μl的MTT溶液,孵育4 h后弃上清,每孔加入150 μl DMSO,室温下振荡反应5 min,置于多功能酶标仪检测490 nm波长处吸光度值(A),并计算细胞增殖抑制率。
1.2.4 细胞凋亡率检测:首先用0.25%胰蛋白酶消化并收集4组大鼠背脊髓神经元细胞,后将细胞放入离心机内离心,弃上清液,重悬于500 μl的结合缓冲液中,分别加入Annexin V-FITC和PI各5 μl,室温条件下避光振荡孵育5 min,然后用流式细胞仪检测并计算细胞凋亡率。
1.2.5 IL-6、IL-21的水平检测:分别取4组大鼠背脊髓神经元细胞培养上清液,根据ELISA试剂盒说明书操作步骤检测IL-6、IL-21的水平。
1.2.6 LncRNA CYTOR与miR-136-5p的靶向关系检测:LncRNA CYTOR与miR-136-5p的结合位点及其突变位点分别克隆至pGL3质粒中构建野生型载体wt-LncRNA CYTOR、突变型载体mut-LncRNA CYTOR,参照“1.2.1”转染方法将含有结合位点的wt-LncRNA CYTOR及其突变位点的mut-LncRNA CYTOR分别与miR-NC、miR-136-5p mimics共转染大鼠背脊髓神经元细胞,常规培养24 h后,分别检测各细胞的荧光素酶活性。参照“1.2.1”转染方法将pcDNA、pcDNA-LncRNA CYTOR分别转染至大鼠背脊髓神经元细胞,培养48 h后收集细胞并采用qRT-PCR法检测miR-136-5p相对表达量。
1.2.7 Bax、Bcl-2蛋白表达量检测:分别收集4组大鼠背脊髓神经元细胞,加入细胞裂解液提取总蛋白。BCA法检测蛋白浓度后将蛋白沸水浴变性。按40 μg/孔蛋白加入凝胶中进行SDS-PAGE、转膜后并进行室温封闭2 h,分别加入Bax(1∶1 000)、Bcl-2(1∶1 000)、GAPDH(1∶3 000)抗体稀释液4℃孵育过夜,次日加入IgG(1∶5 000)二抗稀释液,室温下孵育2 h后用TBST充分洗涤,通过Quantity One软件分析Bax、Bcl-2蛋白相对表达量。
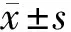
2 结果
2.1 大鼠背脊髓神经元细胞中LncRNA CYTOR和miR-136-5p的表达 与con组比较,H2O2组LncRNA CYTOR的表达量降低(P<0.05),miR-136-5p的表达量升高(P<0.05)。见表1。
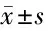
表1 LncRNA CYTOR和miR-136-5p表达的检测 n=9,
2.2 LncRNA CYTOR和miR-136-5p转染效率的检测 与pcDNA组比较,pcDNA-LncRNA CYTOR组LncRNA CYTOR的表达量升高(P<0.05);与miR-NC组比较,miR-136-5p组miR-136-5p的表达量升高(P<0.05)。见表2。
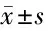
表2 转染效率检测 n=9,
2.3 LncRNA CYTOR对大鼠背脊髓神经元细胞的影响 与con组比较,H2O2组细胞增殖抑制率、凋亡率和、Bax蛋白表达及IL-6、IL-21水平升高,Bcl-2蛋白表达降低(P<0.05);与H2O2+pcDNA组比较,H2O2+pcDNA-LncRNA CYTOR组细胞增殖抑制率、凋亡率、Bax蛋白表达及IL-6、IL-21水平降低(P<0.05),Bcl-2蛋白表达升高(P<0.05)。见图1、表3。

图1 LncRNA CYTOR对大鼠背脊髓神经元细胞凋亡及凋亡相关蛋白表达的影响
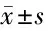
表3 LncRNA CYTOR对大鼠背脊髓神经元细胞抑制率、凋亡率、炎性因子的检测 n=9,
2.4 LncRNA CYTOR靶向、调控miR-136-5p LncRNA CYTOR和miR-136-5p的互补序列。与miR-NC相比,miR-136-5p过表达可抑制wt-LncRNA CYTOR的荧光素酶活性(P<0.05),而未能影响mut-LncRNA CYTOR的荧光素酶活性。与pcDNA组比较,pcDNA-LncRNA CYTOR组miR-136-5p的表达量升高(P<0.05)。见图2,表4、5。

图2 LncRNA CYTOR和miR-136-5p的互补序列
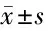
表4 双荧光素酶报告实验 n=9,
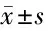
表5 LncRNA CYTOR调控miR-136-5p的表达 n=9,
2.5 miR-136-5p对LncRNA CYTOR处理的大鼠背脊髓神经元细胞的影响 与H2O2+pcDNA-LncRNA CYTOR+miR-NC组比较,H2O2+pcDNA-LncRNA CYTOR+miR-136-5p组细胞增殖抑制率、凋亡率、Bax蛋白表达及IL-6、IL-21水平升高(P<0.05),Bcl-2蛋白表达降低(P<0.05)。见图3、表6。

图3 miR-136-5p对LncRNA CYTOR处理的大鼠背脊髓神经元细胞凋亡及凋亡相关蛋白表达的影响
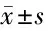
表6 miR-136-5p对LncRNA CYTOR处理的大鼠背脊髓神经元细胞抑制率、凋亡率、炎性因子的检测 n=9,
3 讨论
脊髓损伤是指多种原因引起的脊髓结构缺损及其功能丧失导致运动、感觉等异常,寻找新的脊髓损伤干预靶点成为研究重点,LncRNA可参与基因转录激活等调控过程,LncRNA可通过充当miRNA的竞争性内源RNA(ceRNA)而参与脊髓损伤过程[8-10]。
LncRNA CYTOR表达下调可促进病理性心脏肥大[11]。LncRNA CYTOR过表达可通过调节miR-24/XIAP分子轴而减轻脓毒症诱导的心肌损伤[12]。但笔者发现LncRNA CYTOR在大鼠背脊髓神经元细胞损伤中的影响及机制尚不可知。本研究结果显示,H2O2诱导的大鼠背脊髓神经元细胞中LncRNA CYTOR的表达量降低,提示LncRNA CYTOR可能参与脊髓损伤的发生过程。研究表明Bcl-2基因家族是在caspase家族蛋白上游,并可通过抑制caspase-3蛋白合成而抑制细胞凋亡,而Bax对细胞凋亡的作用与之相反[13]。本研究结果显示,H2O2诱导的大鼠背脊髓神经元细胞增殖抑制率、凋亡率、Bax蛋白表达升高,Bcl-2蛋白表达降低,而LncRNA CYTOR过表达可促进H2O2诱导的大鼠背脊髓神经元细胞增殖及抑制细胞凋亡,提示LncRNA CYTOR过表达可促进细胞增殖及抑制细胞凋亡从而减轻H2O2诱导的大鼠背脊髓神经元细胞损伤。另有研究表明,IL-6、IL-21属于促炎性细胞因子,其水平的升高提示细胞炎性反应程度加重[14]。本研究结果显示,在H2O2诱导的大鼠背脊髓神经元细胞中,IL-6、IL-21水平升高,而LncRNA CYTOR过表达可降低IL-6、IL-21水平,提示LncRNA CYTOR过表达可抑制H2O2诱导的大鼠背脊髓神经元细胞炎性反应。
本研究证实LncRNA CYTOR与miR-136-5p存在靶向调控作用,LncRNA CYTOR可充当miR-136-5p的ceRNA。研究表明,miR-136-5p可通过引起炎性反应从而促进脊髓损伤[15]。miR-136-5p在人视网膜色素上皮细胞损伤中表达水平升高,并可促进炎性反应的发生[16]。本研究结果显示,H2O2诱导的大鼠背脊髓神经元细胞中miR-136-5p的表达量升高,miR-136-5p过表达可减弱LncRNA CYTOR过表达对H2O2诱导的大鼠背脊髓神经元细胞增殖、凋亡及炎性反应的作用。提示LncRNA CYTOR可通过靶向结合miR-136-5p而参与脊髓损伤过程。
综上所述,H2O2诱导的大鼠背脊髓神经元细胞中LncRNA CYTOR表达下调,miR-136-5p表达上调,LncRNA CYTOR过表达可通过抑制miR-136-5p表达而促进H2O2诱导的大鼠背脊髓神经元细胞增殖及抑制细胞凋亡、炎性反应,LncRNA CYTOR可能作为脊髓损伤的潜在治疗靶点。但仍需体内实验验证LncRNA CYTOR/miR-136-5p分子轴在脊髓损伤中的作用机制。
