糖尿病肾病患者血清N/OFQ、IL-6的表达变化及相关性分析
2023-06-15柴丹韩毅侯文飞
柴丹 韩毅 侯文飞
糖尿病肾脏病(diabetic kidney disease,DKD)是导致终末期肾病(end-stage renal disease,ESRD)的首位病因,其患病率的增加与全球范围内糖尿病患病率的急剧上升相平行,大约40%的2型糖尿病(type 2 diabetes mellitus,T2DM)患者会出现这种微血管并发症[1,2]。DKD的发病机制尚不明确,目前普遍认为其发生与代谢紊乱[3]、氧化应激[4]、免疫炎性[5]、遗传因素[6]、自噬[7]等多种因素有关。越来越多的流行病学和临床前证据表明炎性质反应在DKD的发生、发展中起着关键作用[8]。在DKD相关炎症因子中,白细胞介素-6(interleukin-6,IL-6)与其关系最为紧密,因其介导血管内皮细胞损伤,刺激肾小球硬化和肾小管间质炎症及纤维化[9]。内源性孤啡肽(nociceptin/orphanin FQ,N/OFQ)是感觉神经肽的一种,N/OFQ及其受体参与炎症相关信号通路,诱导IL-6高表达[10],且在血管内皮细胞具有高亲和力结合位点,与多种大血管及微血管疾病有关[11],笔者发现,鲜有N/OFQ与DKD的相关性研究。本研究通过观察血清N/OFQ、IL-6在DKD患者中的水平变化,分析二者与DKD的相关性,旨在为DKD的早期识别和诊治提供新的理论依据。报告如下。
1 资料与方法
1.1 一般资料 选择2021年3月至2022年3月于山西医科大学第二医院确诊的T2DM患者180例,其中男96例,女84例;年龄(58.31±1.54)岁;均符合1999年世界卫生组织提出的糖尿病诊断标准和分型[12]。DKD采用2021年糖尿病肾脏疾病临床诊疗中国指南中的诊断标准,即肾小球滤过率(glomerular filtration rate,GFR)<60 ml·min-1·1.73 m-2和(或)尿白蛋白/肌酐比值(urinary albumin/creatinine ratio,ACR)≥30 mg/g持续>3个月[13]。根据ACR将180例患者分为正常白蛋白尿组60例(ACR<30 mg/g)、微量白蛋白尿组60例(30 mg/g≤ACR≤300 mg/g)和大量白蛋白尿组60例(ACR>300 mg/g)。本研究经山西医科大学第二医院伦理委员会批准(2021-YX第059号),患者及家属均签署知情同意书。
1.2 纳入与排除标准 纳入标准:(1)根据1999年世界卫生组织公布的糖尿病诊断和分型标准,确诊为T2DM的患者;(2)年龄30~70岁,相互无亲缘关系。排除标准[14]:(1)原发性肾脏疾病者(例如:急慢性肾小球肾炎、免疫性及遗传性肾病、肾盂肾炎、痛风相关性肾病等);(2)其他因素所致尿微量白蛋白与尿糖异常改变者(例如泌尿系统感染、发热、24 h内有剧烈运动、顽固性高血压、充血性心力衰竭、妊娠、酮症酸中毒等);(3)伴全身其他重要脏器(心、肺、肝)功能衰竭;(4)尿沉渣有活动表现;(5)血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)类药物开始治疗后2~3个月内GFR下降>30%;(6)癌症、创伤、应激及其他内分泌疾病的患者;(7)1型糖尿病及肾损伤患者;(8)先天性智力障碍或依从性较差者。
1.3 方法
1.3.1 样本量计算:采用公式n1=n2=2[(μα+μβ)/(δ/σ)]2+1/4μ2α进行计算,n1和n2分别为DKD组和糖尿病肾病组所需含量;δ=μ1-μ2,为两总体均数之差值,σ为总体标准差(此处假设两总体标准差相等);μα和μβ分别为检验水准α和Ⅱ型错误概率β相对应的值。此处α取双侧,μα=μ0.05/2=1.96;β取单侧,μβ=μ0.01=1.28。本研究未指定δ,因此对δ/σ进行适当假定,此处假定δ/σ=0.60,则本研究样本量计算如下n1=n2=2[(1.96+1.28)/0.6]2+1/4×1.962=111.396≈60。
1.3.2 生化指标检测:所有患者于入院第2天抽取非输液侧肘静脉血进行生化检测,并收取24 h 尿液用于检测尿微量白蛋白(mALB)和肌酐(Scr)水平,计算其估算肾小球滤过率(eGFR)、ACR。采用高压液相法测定糖化血红蛋白(HbA1c)水平。采用全自动生化分析仪检测空腹血糖(FBG)、总胆固醇(CHO)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)。使用 Sysmex 全自动血样分析仪(日本 Sysmex 公司,XE-2100)测定中性粒细胞计数(NEUT)及中性粒细胞百分比(NEU%)。
1.3.3 N/OFQ、IL-6水平检测:于入院第2天清晨采集患者空腹非输液侧肘静脉血 4 ml,于含有STTⅡ分离胶促凝剂的静脉真空采血管中分离血清并储存在-70℃冰箱中待测。采用酶联免疫吸附测定(ELISA)法检测血清N/OFQ及IL-6浓度(人N/OFQ ELISA试剂盒购自太原市云启科贸有限公司,96T-JL19427;人IL-6 ELISA试剂盒购自太原市云启科贸有限公司,96T-JL14113),严格按照 ELISA 试剂盒操作步骤,依次通过包被、加样、加酶标抗体、加底物液显色、终止反应和检测吸光度(A)值完成标本检测。
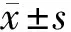
2 结果
2.1 一般资料比较 与正常白蛋白尿组相比,微量白蛋白尿组和大量白蛋白尿组合并糖尿病视网膜病变比例、糖尿病病程逐渐升高(P<0.05),3组患者的年龄、性别、体重指数(BMI)、吸烟及饮酒史、相关合并症比例(高血压、冠心病、脑血管病、糖尿病周围神经病变、糖尿病足)差异无统计学意义(P>0.05)。见表1。

表1 3组一般资料比较 n=60
2.2 生化指标比较 与正常白蛋白尿组相比,微量白蛋白尿组和大量白蛋白尿组HbA1c、mALB、ACR逐渐升高(P<0.05)、eGFR逐渐降低(P<0.05);与微量白蛋白尿组相比,大量白蛋白尿组FBG、NEU%升高(P<0.05);3组患者的CHO、TG、HDL-C、LDL-C、NEUT等差异均无统计学意义(P>0.05)。见表2。
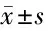
表2 3组生化指标比较 n=60,
2.3 N/OFQ、IL-6浓度比较 与正常白蛋白尿组相比较,微量白蛋白尿组和大量白蛋白尿组N/OFQ、IL-6逐渐升高(P<0.05);大量白蛋白尿组N/OFQ、IL-6水平高于微量白蛋白尿组(P<0.05)。见表3。
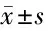
表3 3组血清N/OFQ、IL-6浓度比较 n=60,ng/L,
2.4 DKD患者血清N/OFQ、IL-6浓度与临床各指标的相关性分析 Pearson相关性分析结果显示,糖尿病病程、FBG、HbA1c、mALB、ACR与血清N/OFQ、IL-6均呈正相关(P<0.05),eGFR与血清N/OFQ、IL-6均呈负相关(P<0.05),NEU%与血清N/OFQ呈正相关(P<0.05),而与IL-6无相关性(P=0.257);血清N/
OFQ与IL-6水平呈正相关(P<0.001);血清N/OFQ、IL-6水平与年龄、性别、BMI、CHO、TG、HDL-C、LDL-C、mALB、NEUT无相关性(P>0.05)。见表4。
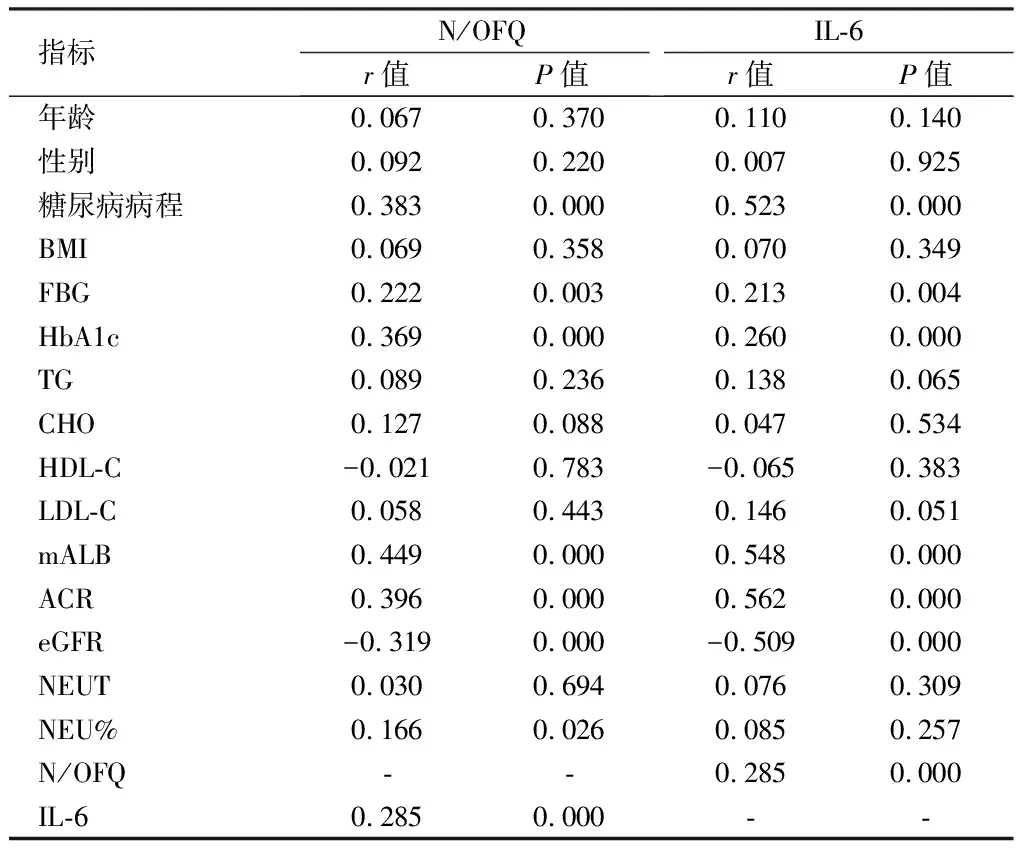
表4 DKD患者血清N/OFQ、IL-6与临床各指标的相关性分析
2.5 T2DM患者并发DKD影响因素分析 以T2DM患者是否合并DKD作为因变量(0=否,1=是),将可能影响DKD的因素(年龄、性别、吸烟、饮酒、BMI、糖尿病视网膜病变、糖尿病病程、FBG、HbA1c、TG、CHO、HDL-C、LDL-C、N/OFQ、IL-6)作为自变量纳入Logistic回归分析,其中分类数据赋值如下:糖尿病视网膜病变、吸烟、饮酒均为0=无,1=有;性别为0=女,1=男。结果显示,合并糖尿病视网膜病变,糖尿病病程、HbA1c、LDL-C、N/OFQ、IL-6水平升高是T2DM并发DKD的独立危险因素(P<0.05);其余因素差异无统计学意义(P>0.05)。见表5。

表5 DKD影响因素的logistic回归分析
2.6 N/OFQ、IL-6单项及二者联合检测对DKD的预测价值 以微量白蛋白尿组和大量白蛋白尿组为阳性样本,以正常白蛋白尿组为阴性样本,建立ROC诊断分析模型。结果显示,N/OFQ预测DKD的ROC曲线下面积(AUC)为0.836(95%CI 0.764~0.909,P<0.001)。IL-6预测DKD的AUC为0.882(95%CI 0.826~0.938,P<0.001)。N/OFQ、IL-6二者联合预测DKD的AUC为0.924(95%CI 0.887~0.961,P<0.001)。见图1,表6。
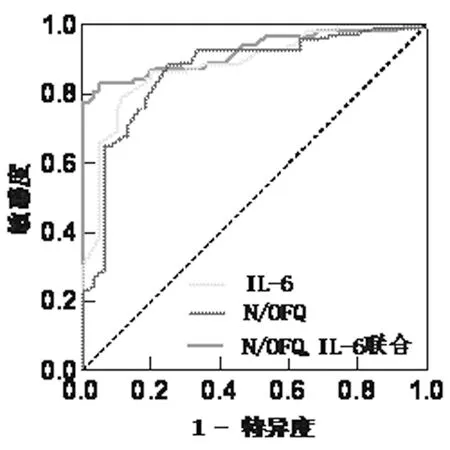
图1 N/OFQ、IL-6及二者联合预测DKD发生的ROC曲线

表6 N/OFQ、IL-6单项及联合检测对DKD的预测价值
3 讨论
DKD发病机制复杂,虽然高血糖、氧化应激和肾素-血管紧张素-醛固酮系统激活是糖尿病相关肾损害的驱动力,但大量证据指出炎性在糖尿病并发症的发生发展中起关键作用[15]。炎症介质升高后通过降低肾脏血流量和滤过率以及改变毛细血管壁的屏障功能导致糖尿病患者的肾损伤,一些针对特定炎症介质(细胞粘附分子、趋化因子和细胞因子)和细胞内信号通路的抗炎策略在实验性DKD模型中显示出有利的效果,减少了蛋白尿和肾脏损害[16]。因此,深入研究DKD炎症信号转导通路或其关键的信号转导分子,对从炎症角度早期识别、干预DKD进展具有重要意义。
有研究表明,肾脏的炎症标志物与蛋白尿、细胞外基质沉积以及肾小球滤过率进行性下降相关[17]。DKD早期,白细胞释放不同的促炎和促纤维化细胞因子,从而引发炎性和不可逆转的纤维化过程[18]。近年来在研究DKD炎性因子中,IL-6的重要性为大家所关注:IL-6 mRNA广泛存在于肾脏间质及小管细胞中[19];IL-6水平在慢性肾病患者中显著升高,并与白蛋白排泄和肾脏肥大相关[20,21]。本研究结果显示,大量白蛋白尿组IL-6浓度明显高于微量白蛋白尿组及正常白蛋白尿组,相关性分析结果中IL-6的水平与FBG、HbA1c、ACR、mALB呈正相关(r=0.213、0.260、0.562、0.548,P<0.05),与eGFR呈负相关(r=-0.509,P<0.05),本研究结果表明在其他因素不变的情况下,IL-6每增加1 ng/L,T2DM患者并发DKD的危险性增加55.0%,以上提示血清IL-6浓度与DKD病情的严重程度相关,这与既往研究结果[22]一致。故推测其机制可能是IL-6 可促进胰岛细胞分泌胰岛素,而过量的IL-6会损伤胰岛细胞进而使得血糖升高[23]。此外,IL-6介导血管内皮细胞的损伤:IL-6 结合于相应的IL-6受体,通过JAK/STAT、NF-κB信号通路诱导细胞外基质沉积和肌成纤维细胞的分化或增殖,以上可能促进肾小球基底膜增厚、足突消失和肾小管死亡,导致糖尿病患者肾脏不可逆的功能和结构改变,从而表现为尿微量白蛋白不同程度的增加[24]。由以上可以推断,DKD患者肾组织表达高水平的IL-6可能参与了DKD发生、发展的病理生理过程,IL-6水平可作为临床观察DKD病情的一项参考指标。
N/OFQ是一种新发现的与经典阿片肽具有序列同源性的神经肽,作用于非经典的阿片受体,N/OFQ及其受体在神经系统、免疫系统以及外周器官中广泛表达[25]。近年来N/OFQ在免疫功能方面的作用受到特别关注,已被描述为免疫调节分子的重要来源:N/OFQ诱导免疫细胞趋化性、调节细胞因子和其他炎性介质的表达以及控制细胞和体液免疫的能力;N/OFQ以浓度依赖的方式诱NF-κB核转位、与DNA结合并激活转录[26]。既往研究表明,高血糖通过激活NF-κB通路诱导炎性细胞因子如IL-6、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)等的表达[19,27], 而IL-6等促炎细胞因子也可以通过NF-κB通路诱导N/OFQ的转录增加,从而形呈正反馈通路[28]。在体外和体内研究的基础上,N/OFQ增加了健康麻醉动物和有脓毒性或炎性过程的动物的炎性反应[29],它影响组织灌注,增加毛细血管渗漏和炎性标记物,并导致免疫细胞趋化性。进一步研究中指出N/OFQ具有直接募集多形核白细胞的能力[30]。本研究中DKD患者NEU%虽控制在正常范围内,但明显高于T2DM患者,相关性分析结果中N/OFQ与NEU%呈正相关(r=0.166,P<0.05)。白细胞通过两种不同的机制促进肾损害:(1)肾小球和肾小管细胞的直接相互作用和激活;(2)释放激活间质肾细胞的趋化因子、细胞因子和促纤维化因子。此外,这些间质肾细胞分泌额外的趋化因子,促进白细胞的进一步浸润[31]。所有这些事件在正反馈回路中放大了炎性反应,从而增强了糖尿病患者的肾脏损伤。
本研究结果发现,微量白蛋白尿组和大量白蛋白尿组血清N/OFQ水平明显高于正常白蛋白尿组,大量白蛋白尿组血清N/OFQ水平又明显高于微量白蛋白尿组,即随着DKD病情的进展,N/OFQ浓度也在升高;相关性分析结果显示,mALB、ACR与N/OFQ、IL-6均呈正相关,eGFR与N/OFQ、IL-6均呈负相关,且N/OFQ与IL-6之间呈正相关;Logistic回归分析结果显示,血清N/OFQ、IL-6水平升高是T2DM患者合并DKD的独立危险因素,提示IL-6和N/OFQ与DKD密切相关,并且在DKD的发生发展中可能起着协同作用。本研究结果还表明在其他因素不变的情况下,N/OFQ每增加1 ng/L,T2DM患者并发DKD的危险性增加56.6%。结合上述研究推测DKD患者血清 N/OFQ 升高的机制可能与持续的高血糖激活NF-κB通路导致IL-6、TNF-α等炎性因子释放增加进而导致N/OFQ转录增加有关,N/OFQ可能通过IL-6介导的炎性机制直接或间接参与肾脏血管内膜的损害,导致血管内皮细胞损伤、血管通透性增加、细胞外基质纤维化等病理生理过程。最后,本研究中N/OFQ、IL-6单项及联合检测对DKD预测价值结果显示,检测N/OFQ、IL-6均可作为DKD的预测因子(AUC=0.836、0.882),二者联合预测DKD明显高于单项检测(AUC=0.924,P<0.001),提示联合检测血清N/OFQ、IL-6对DKD的预测价值更高,二者可作为观察DKD病情进展的参考指标。
糖尿病病程的长短与糖尿病并发症密切相关[32]。一项对T2DM患者并发DKD的回顾性研究证实,糖尿病病程是DKD发生风险的独立预测因素[33]。糖尿病患者由于长期的糖代谢紊乱,血管内皮细胞功能受损,进而使得肾脏组织极易发生微血管病变[34]。本研究结果中糖尿病病程是T2DM患者并发DKD的独立危险因素,在其他因素不变的情况下,糖尿病病程每增加1年,T2DM患者发生DKD的危险性增加56.8%。考虑为随着患者患病时间的增加,患者的微血管病变逐渐加重,导致其不同程度的肾功能损伤,引起患者尿微量白蛋白的增加,这与Ahmad等[35]研究的情况相符。由此可见,T2DM患者应每年至少进行1次mALB或ACR的筛查,有利于早发现是否并发肾脏损伤。
糖尿病视网膜病变也是糖尿病常见的微血管并发症,被NKF/KDOQI指南作为DKD的诊断依据之一[36]。糖尿病视网膜病变与DKD有共同的发病机制:AGEs、ROS、蛋白激酶C、炎性因子等,导致血管视网膜组织屏障和进行性肾功能障碍的破坏[37],使得两者的发生、发展有关联性。糖尿病视网膜病变的发生常早于DKD,大部分DKD患者患有糖尿病视网膜病变[38]。本研究针对糖尿病视网膜病变对T2DM患者肾脏损伤的影响进行logistic回归分析发现,合并糖尿病视网膜病变是T2DM患者肾脏损伤的独立危险因素,即在其他因素不变的情况下,合并糖尿病视网膜病变的患者比未合并糖尿病视网膜病变患者出现肾脏损伤的风险高12.2%,这与其他研究结果[39]一致。对T2DM患者定期进行眼底检查,有利于帮助其早期诊断DKD。
综上所述,本研究结果显示,DKD患者血清中N/OFQ、IL-6含量明显升高且存在相关性,N/OFQ、IL-6是2型糖尿病患者并发DKD的危险因素,通过检测2型糖尿病患者血清N/OFQ、IL-6的水平可为DKD的早期筛查和临床干预提供新思路。
