植物生长调节剂对山牡荆扦插生根及生理变化的影响
2023-06-10吴建宇
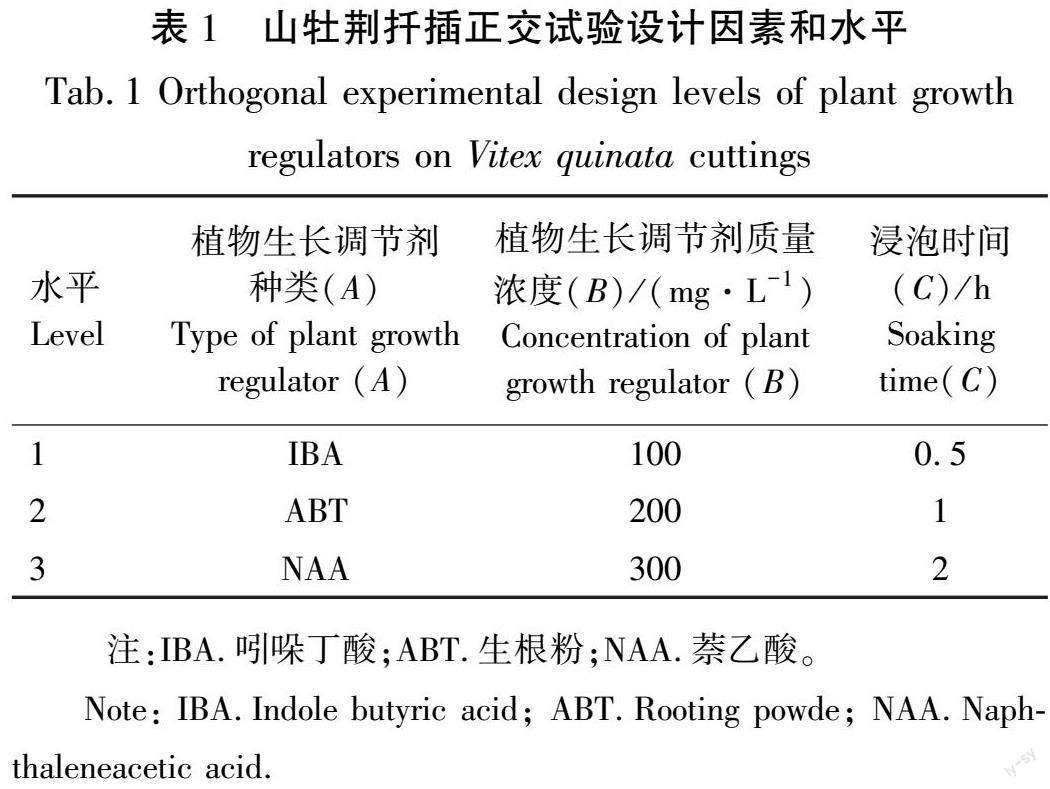

摘 要:为探讨植物生长调节剂对山牡荆扦插生根的影响,用不同植物生长调节剂种类、质量浓度和浸泡时间处理当年生半木质化山牡荆穗条,研究穗条扦插生根情况及生理生化的变化。结果表明,不同植物生长调节剂处理对山牡荆扦插生根率、平均根长、最长根长、平均根数、平均根系直径和最长根系直径差异显著。通过隶属函数法综合评价,植物生长调节剂萘乙酸(NAA)质量浓度为200 mg/L浸泡时间2 h处理的隶属函数值最高,达到了0.88。穗条生根过程中,可溶性糖含量和可溶性蛋白含量呈“下降—上升—下降”的变化趋势。处理组的穗条皮部超氧化物歧化酶(SOD)、过氧化物酶(POD)、多酚氧化酶(PPO)活性高于对照组(CK)处理。根原基诱导阶段,SOD、POD活性上升,不定根形成阶段SOD、PPO活性持续上升,POD活性下降,不定根伸长阶段,POD活性上升,SOD、PPO活性下降。综上所述,NAA质量浓度为200 mg/L浸泡时间为2 h的处理最适宜山牡荆扦插生根,且能改变穗条营养物质含量,提高生根过程中酶的活性,促进扦插生根的生长。
关键词:植物生长调节剂;山牡荆;扦插;生根;营养物质;酶活性
中图分类号:S723.1+3 文献标识码:A 文章编号:1006-8023(2023)03-0049-08
Abstract:In order to study the effect of plant growth regulators on the rooting of Vitex quinata, the cuttings of semilignified Vitex quinata were treated with different kinds, concentrations and soaking time of plant growth regulators to study the rooting and physiological and biochemical changes of cuttings. The results showed that there were significant differences in rooting rate, average root length, longest root length, average root number, average root diameter and longest root system diameter among different plant growth regulators. Through the comprehensive evaluation of membership function method, the membership function value of the treatment with NAA concentration of 200 mg/L and soaking time of 2 h was the highest, reaching 0.88. In the process of rooting, the content of soluble sugar and soluble protein showed a trend of ‘decline-rise-decline. The activities of SOD, POD and PPO in the treatment group were higher than those in CK treatment. In the root primordial induction stage, the activities of SOD and POD increased, while in the adventitious root formation stage, the activities of SOD and PPO continued to increase and the activities of POD decreased. In the adventitious root elongation stage, the activities of POD increased and the activities of SOD and PPO decreased. NAA concentration of 200 mg/L and soaking time of 2 h were the most suitable treatments for cutting rooting of Vitex quinata, which can change the nutrient content of cuttings, improve the enzyme activity during rooting and promote the growth of rooting.
Keywords:Plant growth regulator; Vitex quinata; cutting; rooting; nutrients; enzymatic activity
基金項目:福建省星火项目(2020S0011);福建省财政林业科技推广项目(闽林推2022TG13)
作者简介:吴建宇,助理研究员。研究方向为园林树种栽培与繁育。E-mail: 394288565@qq.com
0 引言
山牡荆(Vitex quinata),又名薄姜木,为马鞭草科(Verbenaceae)牡荆属(Vitex)常绿乡土阔叶乔木[1],在全球主要分布在南亚热带至中亚热带区域,在我国主要分布在东南福建、广东、广西和云南等地[2]。山牡荆不仅是名贵的家具用材树种[3],还可以作为中药材[4]、园林绿化树种,因此开发利用价值较高,市场前景广阔。
目前山牡荆资源非常稀缺,其种子资源较少,结实存在大小年[5],实生苗个体性状分化,优良性状难以稳定遗传,导致良种山牡荆难以推广栽培,严重制约了其产业的发展。扦插繁育技术是林业上苗木繁育最经济有效的手段,具有操作简单、取材方便、繁殖速度快、繁殖系数高和优良性状遗传稳定等优点[6-7],因此开展山牡荆扦插繁殖技术有利于其苗木产业化发展和推广栽培。目前对山牡荆育苗研究有蔡益航[8]开展的山牡荆实生苗育苗技术,叶海荣[5]通过不同穗条、不同基质和不同ABT质量浓度开展薄姜木扦插育苗技术研究。不同植物生长调节剂对山牡荆扦插生根的影响及山牡荆扦插生根过程中可溶性糖、可溶性蛋白、超氧化物歧化酶(SOD)、过氧化物酶(POD)、多酚氧化酶(PPO)含量变化的研究还未见报道。本研究通过植物生长调节剂对山牡荆扦插生根影响的研究,筛选出适宜山牡荆扦插生根的植物生长调节剂,探讨植物生长调节剂对山牡荆穗条扦插生根过程中生理生化变化的影响,为山牡荆容器育苗提供实践参考。
1 材料与方法
1.1 试验地概况
试验地设在福建省莆田市仙游县大济镇山岑村仙游县满光花木苗圃专业合作社,合作社育苗基地位于25°22′3′ N,118°39′19′ E,海拔34 m。属于亚热带海洋性季风气候,年平均气温20.3 ℃,年平均降水量1 610.2 mm,年平均相对湿度76.4%。年平均无霜期318.4 d。年均日照时数1 847.6 h,夏秋有台风,年平均风速1.7 m/s,最多风向为东北偏东风。
1.2 试验材料
扦插穗条采集于育苗基地生长健壮的3 a山牡荆优良母株,选择当年生无病虫害、无机械损伤的半木质化枝条。
1.3 试验设计
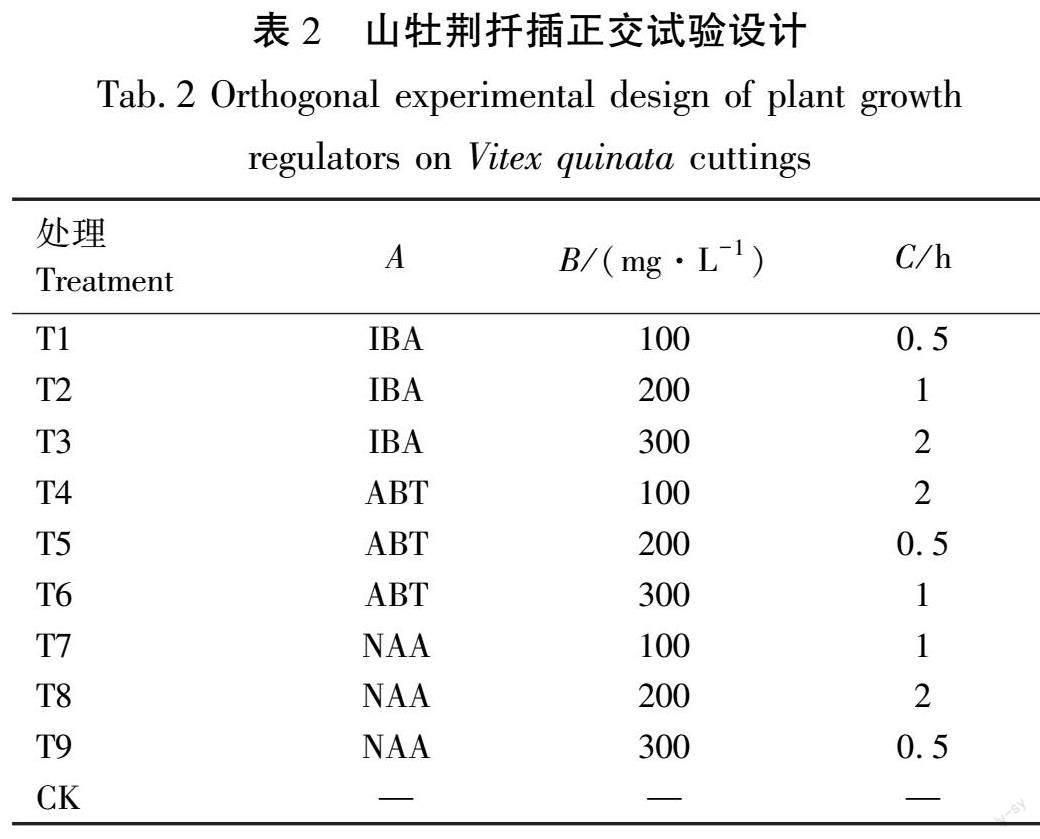
采用L9(34)正交试验设计,设植物生长调节剂种类(A)、调节剂质量浓度(B)和浸泡时间(C)3个因素,每个因素3个水平(表1),以清水处理作对照组,共10个处理(表2)。田间试验采用完全随机区组设计,每个处理3次重复,每次重复50条穗条。
将苗圃地整理成宽1.0 m、高0.2 m的扦插苗床,用砂壤土、黄心土(体积比为1∶1)混合,作为扦插基质。基质在扦插前粉碎均匀,再用0.15%高锰酸钾溶液喷淋消毒。2021年3月初,将采集的半木质化枝条剪成12~15 cm的穗条,先在75%的酒精溶液中浸泡10 min消毒,再用植物生长调节剂浸泡后扦插。用木棍在基质中插一个5~8 cm深小孔,将穗条扦插入基质中,轻轻压实基质,浇透水。扦插后覆盖塑料薄膜和遮阴网,每7 d喷50%多菌灵800倍液消毒。其间注意保湿、除草和病虫害防治。
1.4 指标调查和测定方法
扦插后每隔10 d随机每组采样1次,每次10条穗条,观察穗条生根形态的变化。扦插60 d后调查统计不同植物生长调节剂处理山牡荆穗条生根率、平均根长、最长根长、平均根数、平均根系直径和最长根系直径。用隶属函数法对各指标进行综合评价[9]。隶属函数值计算公式为
隸属函数值U(Xi) =(Xi-Xmin)/(Xmax-Xmin)。
式中:Xi表示某处理指标测定值;Xmax表示某处理指标测定最大值;Xmin表示某处理指标测定最小值。
对穗条进行生理指标可溶性糖含量和可溶性蛋白含量,以及生化指标SOD、POD、PPO活性测定,分别于第0、20、30、40、50、60天各采样1次,每个处理随机取10条穗条,每个处理重复3次。用清水清洗干净后,取穗条基部2~3 cm的韧皮部,用吸水纸吸干后,放入液氮冷冻,存于-80 ℃的低温冰箱中。可溶性糖含量用蒽酮比色法测定[10],可溶性蛋白含量用考马斯亮蓝G-250法测定[11],超氧化物歧化酶SOD活性用氮蓝四唑法(NBT)测定[11],过氧化物酶POD用愈创木酚法测定[12],多酚氧化酶PPO用邻苯二酚比色法测定[13]。
1.5 数据处理
用Excel 2003软件对数据进行统计,用SPSS19.0软件对数据进行方差分析,用Duncan's进行多重比较。
2 结果与分析
2.1 山牡荆扦插生根进程
山牡荆扦插20 d,穗条基部切口处开始长出白色愈伤组织,部分穗条基部开始出现开裂膨大,如图1(a)所示。扦插30 d,各处理都有穗条基部膨大,并长有突起,质量浓度为200 mg/L的NAA处理的穗条在切口上方开始长出乳白色不定根,如图1(b)所示。扦插40 d,各处理都有穗条长出不定根,部分穗条长出新叶。扦插50 d,愈伤组织开始出现褐变,停止生长,不定根增粗变多,如图1(c)所示,新梢继续生长增多。扦插60 d,穗条根系发育完整,新叶逐渐变成深绿色,如图1(d)所示。综合分析生根进程,将穗条生根大致划分为4个阶段:不定根原基诱导和皮部裂开阶段(0~20 d)、不定根表达和形成阶段(20~40 d)、不定根伸长增多阶段(40~50 d)、不定根增粗阶段(50~60 d)。
2.2 不同植物生长调节剂处理对山牡荆扦插生根的影响
由表3可知,不同植物生长调节剂处理对穗条扦插生根率和生根指标的影响差异显著(P<0.05)。T5生根率最高,达到了82.00%,与T4差异不显著,显著高于其他处理,CK处理的生根率最低,且显著低于其他处理。T5的平均根长最长,达到了11.95 cm,与T2的差异不显著,显著高于其他处理,CK处理的平均根长最短,显著低于其他处理。T5的最长根长最长,达到了17.98 cm,与T2差异不显著,CK处理的最长根长最短,显著低于其他处理。T8平均根数最多,达到了12.25条,显著高于其他处理,CK处理的平均根数最少,显著低于其他处理。T8平均根系直径最大,达到了12.25 cm,显著高于其他处理,CK处理的平均根根系直径最少,只有6.02 cm,低于其他处理。T8最长根系直径最大,达到了16.93 cm,显著高于其他处理,CK处理的平均根数最少,显著低于其他处理。
2.3 不同处理生根指标间的相关性分析
通过穗条各生根指标进行相关性分析(表4)可得,生根率与平均根长、最长根长、最长根系直径呈极显著相关(P<0.01),平均根长与生根率、最长根长、平均根数、平均根系直径和最长根系直径呈极显著相关(P<0.01),最长根长与生根率、平均根长、平均根数、平均根系直径和最长根系直径呈极显著相关(P<0.01),平均根数与平均根长、最长根长、平均根系直径和最长根系直径呈极显著相关(P<0.01),平均根系直径与平均根长、最长根长、平均根数和最长根系直径呈极显著相关(P<0.01),最长根系直径与生根率、平均根长、最长根长、平均根数和平均根系直径呈极显著相关(P<0.01)。
2.4 植物生长调节剂对穗条扦插生根的隶属函数值及综合评价
不同生根指标在各处理间的表现存在差异,单一指标无法全面、客观地反映各处理的扦插效果[14]。应用隶属函数法,综合6项指标对扦插生根生长进行综合评价。由表5可知,T8处理排名第1,平均隶属函数值为0.88,即植物生长调节剂为NAA,质量浓度为200 mg/L,浸泡时间为2 h。T5处理排名第2,平均隶属函数值为0.87,即植物生长调节剂为ABT,质量浓度为200 mg/L,浸泡时间为0.5 h。
2.5 穗条生根过程中生理指标的变化
由图2可知,在扦插生根过程中,不同植物生长调节剂处理的穗条可溶性糖含量呈现“下降—上升—下降”的变化趋势。扦插后0~20 d,可溶性糖含量持续降低,随后开始升高,在扦插40 d达到最高,之后又开始降低。CK处理的穗条可溶性糖含量的变化趋势和处理组的相似,扦插初期可溶性糖含量下降速率比处理组的大,可溶性糖含量最大值显著低于处理组的值(P<0.05),说明植物生长调节剂可以促进穗条可溶性糖含量的积累,提高细胞代谢能力,促进不定根的形成。
由图3可知,处理组可溶性蛋白含量变化趋势与可溶性糖含量的变化趋势相似。扦插0~30 d,可溶性蛋白含量持续降低,随后开始升高,在扦插40 d达到最高,之后又开始降低。CK处理的穗条可溶性蛋白含量的变化趋势和处理组相似,扦插0~30 d可溶性蛋白含量下降速率比NAA处理得大,可溶性蛋白含量最大值显著低于处理组的值(P<0.05),说明植物生长调节剂可以促进穗条可溶性蛋白含量的积累,促进不定根的形成。
2.6 穗条生根过程中生化指标的变化
由图4可知,处理组穗条SOD活性随着扦插的进行呈现先上升后下降的变化趋势,在不定根形成阶段(扦插40 d)达到峰值,之后又开始降低。CK处理的SOD活性的变化趋势与处理组相似,也是扦插40 d达到峰值。整个扦插生根进程中,CK处理的SOD活性均低于处理组的SOD活性。
由图5可知,处理组的穗条POD活性随着扦插的进行呈现“上升—下降—上升—下降”双峰值的变化趋势。在不定根原基诱导阶段(0~20 d),处理组的POD活性开始上升,第20天时达到第1个峰值,之后开始下降,第30天时达到谷值,随后又开始上升,在不定根形成阶段(扦插40 d)达到第2个峰值,之后逐渐降低。CK处理的POD活性的变化趋势与处理组相似,扦插第20天和40天达到谷值。整个扦插生根进程中,CK处理的POD活性均低于处理组的POD活性。
由图6可知,处理组穗条PPO活性隨着扦插的进行呈现先上升后下降的变化趋势。在扦插初期,处理组的PPO活性逐渐上升,在不定根表达期(扦插30 d)时达到最高值,之后开始下降。CK处理的PPO活性呈“下降—上升—下降”的变化趋势,扦插初期缓慢下降,第30天时达到最低值,之后开始上升,在不定根形成阶段(扦插40 d)达到最高值,比处理组晚10 d。
3 讨论与结论
植物生长调节剂是影响穗条扦插的重要因素[15-16]。大量研究结果表明,植物生长调节剂能够提高穗条生根率,促进根系生长[17-18]。不同处理植物生长调节剂对穗条扦插生根效果也不同[19-21]。陆秀君等[22]在美国红枫扦插试验中认为ABT效果优于IBA,龚弘娟等[23]在中华猕猴桃扦插试验认为500 mg/L的IBA扦插生长情况比NAA和ABT好。本研究表明,与对照组比较,各处理组均促进了山牡荆穗条扦插生长,且各处理间存在显著差异,山牡荆在200 mg/L的NAA处理2 h的隶属函数达到了最高值,其扦插生根效果最佳。这与薛利艳等[24]认为NAA比ABT、IBA等更利于毛梾扦插生根的研究结果一致。造成不同植物生长调节剂处理对不同穗条扦插生长影响不同的原因可能是不同植物品种对植物生长调节剂种类和质量浓度的需求或敏感程度不同[25]。
植物穗条在扦插生根过程中根原基诱导、不定根的伸长生长阶段需要消耗大量的营养物质[26],所以穗条内所含有的可溶性糖、可溶性蛋白等营养物质对穗条生根生长具有重要的作用[27]。可溶性糖是植物穗条生根的主要能源物质,可溶性蛋白是穗条生根诱导、生长及传递能量的重要因子[28]。本研究中,山牡荆穗条在根原基诱导阶段,细胞分裂和代谢加强,消耗大量的营养物质,可溶性糖含量下降,不定根形成阶段,穗条萌芽长出新叶,可溶性糖含量持续上升,不定根增粗阶段又开始消耗可溶性糖,使之下降。这与李柠等[29]在枫杨扦插生根过程中发现其可溶性糖含量先下降后上升的研究结果一致,与赵云龙等[30]在糙叶杜鹃扦插生根过程中发现其可溶性糖先上升后下降的研究结果不同。其原因可能是不同穗条的扦插生根机制不同影响了可溶性糖含量的变化趋势[29]。可溶性蛋白含量与可溶性糖含量的变化趋势基本相同,在根原基诱导阶段下降,不定根形成阶段后期持续上升,不定根伸长增多阶段因穗条消耗大量营养和能量,可溶性蛋白含量下降。这与李斌[31]在长柄扁桃扦插过程中可溶性蛋白含量变化趋势一致。
植物生长调节剂能提高穗条内生根关键酶SOD、POD、PPO等的活性,促进穗条生根生长[32]。本研究中,处理组的穗条SOD、POD、PPO活性均比CK组高,说明植物生长调节剂处理能提高穗条SOD、POD、PPO活性。SOD活性呈先上升再下降的变化趋势,峰值出现在不定根形成阶段,说明SOD活性提高有利于不定根的形成,与毕会涛等[33]对美国木豆树扦插生根时SOD活性变化趋势一致。POD活性有2个峰值,分别在根原基诱导阶段和不定根形成阶段,说明POD活性的提高有利于根原基诱导分化和不定根的形成,这与宋金耀等[34]在研究几个常见树种扦插生根过程中POD活性变化趋势一致。PPO活性呈先上升再下降的变化趋势,峰值出现在不定根表达阶段,说明PPO活性提高有利于不定根的表达发育,这与王小玲等[35]在研究四倍体刺槐硬枝扦插过程中PPO活性变化趋势一致。
综上所述,通过隶属函数综合评价,山牡荆扦插生根最适宜的植物生长调节剂种类为NAA,质量浓度为200 mg/L,浸泡时间为2 h。植物生长调节剂处理的穗条促进了可溶性糖和可溶性蛋白含量的积累,能提高穗条内生根关键酶SOD、POD、PPO的活性,促进不定根的生长发育。
【参 考 文 献】
[1]卢张伟,郑军,汪豪,等.山牡荆树干心材的化学成分[J].药学与临床研究,2009,17(4):287-289.
LU Z W, ZHENG J, WANG H, et al. Chemical constituents in the stem heartwood of Vitex quinata[J]. Pharmaceutical and Clinical Research, 2009, 17(4): 287-289.
[2]竺勇,黃瑞松,李耀华.HPLC测定山牡荆中蜕皮甾酮含量的方法研究[J].广西医科大学学报,2014,31(3):377-379.
ZHU Y, HUANG R S, LI Y H. Determination of ecdysterone in Vitex negundo by HPLC[J]. Journal of Guangxi Medical University, 2014, 31(3): 377-379.
[3]陈亚莹.不同坡度与林分组成的薄姜木幼苗生长量差异[J].花卉,2018(14):195-197.
CHEN Y Y. Difference of seedling growth of thin Jiang mu with different slope and stand composition[J]. Flowers, 2018(14): 195-197.
[4]江纪武.药用植物辞典[Z].天津:天津科学技术出版社,2005:855.
JIANG J W. Dictionary of medicinal plants[Z]. Tianjin: Tianjin Scientific & Technical Publishers, 2005: 855.
[5]叶海容.薄姜木扦插育苗试验研究[J].林业调查规划,2017,42(3):136-139.
YE H R. Experiment on cuttage seedling of Vitex quinata[J]. Forest Inventory and Planning, 2017, 42(3): 136-139.
[6]张锦春,刘有军,王方琳,等.沙生柽柳扦插生根过程插穗相关理化特征分析[J].西北植物学报,2018,38(3):484-492.
ZHANG J C, LIU Y J, WANG F L, et al. Physiological and biochemical characteristics of Tamarix taklamakanensis cuttings during rooting stages[J]. Acta Botanica Boreali-Occidentalia Sinica, 2018, 38(3): 484-492.
[7]张建珠,童清,唐红燕,等.ABT1生根剂对湿加松扦插育苗成活率影响研究[J].四川林业科技,2014,35(2):37-38.
ZHANG J Z, TONG Q, TANG H Y, et al. Effect of ABT1 rooting agent on survival rate of cuttage seedling of Pinus elliottii[J]. Journal of Sichuan Forestry Science and Technology, 2014, 35(2): 37-38.
[8]蔡益航.山牡荆实生苗培育技术[J].现代农业科技,2019(2):107-109.
CAI Y H. Cultivation techniques of Vitex negundo seedlings[J]. Modern Agricultural Science and Technology, 2019(2): 107-109.
[9]张琳,程亚男,张欣,等.两种植物生长调节剂对木槿插穗生根的影响[J].南京林业大学学报(自然科学版),2021,45(3):123-129.
ZHANG L, CHENG Y N, ZHANG X, et al. Effects of two plant growth regulators on rooting of Hibiscus syriacus cuttings[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2021, 45(3): 123-129.
[10]冷熹鸣,王迪海.陕北晋枣不同部位生长中可溶性糖及蛋白含量变化研究[J].西北林学院学报,2019,34(2):105-108.
LENG X M, WANG D H. Changes of souble sugar and protein contents in different parts of Jin jujube in north Shaanxi[J]. Journal of Northwest Forestry University, 2019, 34(2): 105-108.
[11]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
LI H S. Principles and techniques of plant physiological biochemical experiment[M]. Beijing: Higher Education Press, 2000.
[12]李小方,张志良.植物生理学实验指导[M].5版.北京:高等教育出版社,2016.
LI X F, ZHANG Z L. Experimental instruction of plant physiology[M]. 5th ed. Beijing: Higher Education Press, 2016.
[13]张志良,瞿伟菁.植物生理学实验指导[M].3版.北京:高等教育出版社,2003:120-121.
ZHANG Z L, QU W J. The experimental guide for plant physiology[M]. 3rd ed. Beijing: Higher Education Press, 2003:120-121.
[14]徐振國,黄大勇,梁晓静,等.基质、激素种类和浓度及其交互作用对麻竹扦插生长的影响[J].中南林业科技大学学报,2019,39(2):47-52.
XU Z G, HUANG D Y, LIANG X J, et al. Effects of substrate, hormone types, concentration and their interactions on branch cuttage growth of Dendrocalamus latiflorus[J]. Journal of Central South University of Forestry & Technology, 2019, 39(2): 47-52.
[15]陈胤好,刘玉民,闫洋洋,等.北美红枫‘十月光辉扦插技术及生化分析[J].森林与环境学报,2021,41(4):417-424.
CHEN Y H, LIU Y M, YAN Y Y, et al. Cutting methodology and biochemical analysis of Acer rubrum ‘October Glory Maple[J]. Journal of Forest and Environment, 2021, 41(4): 417-424.
[16]王因花,梁燕,仲伟国,等.基质和生长调节剂对新墨西哥刺槐嫩枝扦插的影响[J].西部林业科学,2022,51(5):16-20,42.
WANG Y H, LIANG Y, ZHONG W G, et al. Effects of substrates and growth regulators on cuttings of Robinia pseudoacacia in New Mexico[J]. Journal of West China Forestry Science, 2022, 51(5): 16-20, 42.
[17]胡勐鸿,欧阳芳群,贾子瑞,等.欧洲云杉扦插生根影响因子研究与生根力优良单株选择[J].林业科学,2014,50(2):42-49.
HU M H, OUYANG F Q, JIA Z R, et al. Factors affecting rooting of Picea abies shoot cuttings and individual selection with high rooting ability[J]. Scientia Silvae Sinicae, 2014, 50(2): 42-49.
[18]陈庆生,周鹏,张敏,等.激素和插穗处理对乌饭树扦插生根的影响[J].东北林业大学学报,2016,44(4):41-43,47.
CHEN Q S, ZHOU P, ZHANG M, et al. Influence of different treatment of cuttings and hormone on rooting of cutting of Vaccinium bracteatum[J]. Journal of Northeast Forestry University, 2016, 44(4): 41-43, 47.
[19]GONBAD R, CHOKAMI A F. Effects of plant growth regulators on rooting of tea cuttings (Camellia sinensis) clone 100 Iran[J]. Asian Journal of Chemistry, 2009, 21: 3298-3300.
[20]师晨娟,刘勇,胡长寿.青海云杉硬枝扦插繁殖研究[J].江西农业大学学报(自然科学),2002,24(2):259-263.
SHI C J, LIU Y, HU C S. Research on hardy branch cutting cultivation of Qinghai spruce[J]. Acta Agriculturae Universitis Jiangxiensis, 2002, 24(2): 259-263.
[21]张亚男,刘勇,贺国鑫,等.植物生长调节剂对毛梾嫩枝扦插生根及内源激素含量的影响[J].西北林学院学报,2021,36(6):92-99.
ZHANG Y N, LIU Y, HE G X, et al. Effects of plant growth regulators on rooting and endogenous hormones content of Cornus walteri softwood cuttings[J]. Journal of Northwest Forestry University, 2021, 36(6): 92-99.
[22]陆秀君,洪晓松,刘景强,等.扦插基质及生根促进剂对美国红枫扦插繁殖的影响[J].西北林学院学报,2015,30(5):138-142.
LU X J, HONG X S, LIU J Q, et al. Effect of different soil substrates and rooting agents on Acer rubrum cutting propagation[J]. Journal of Northwest Forestry University, 2015, 30(5): 138-142.
[23]龚弘娟,李洁维,蒋桥生,等.不同植物生长调节剂对中华猕猴桃扦插生根的影响[J].广西植物,2008,28(3):359-362.
GONG H J, LI J W, JIANG Q S, et al. Effects of different plant regulators on rooting of Actinidia chinensis cutting[J]. Guihaia, 2008, 28(3): 359-362.
[24]薛利艳,康永祥,张丹,等.毛梾全光照喷雾嫩枝扦插繁殖试验[J].东北林业大学学报,2012,40(11):10-13,18.
XUE L Y, KANG Y X, ZHANG D, et al. Influence factors on soft cutting propagation of Cornus wateri under full sunlight and water spraying[J]. Journal of Northeast Forestry University, 2012, 40(11): 10-13, 18.
[25]金江群,郭泉水,朱莉,等.中國特有濒危植物崖柏扦插繁殖研究[J].林业科学研究,2013,26(1):94-100.
JIN J Q, GUO Q S, ZHU L, et al. Study on cutting propagation of Thuja sutchuenensis, an endangered species endemic to China[J]. Forest Research, 2013, 26(1): 94-100.
[26]刘欢,刘济明,骆畅,等.GGR-6对米槁插穗生根过程中生理动态的影响[J].东北林业大学学报,2021,49(10):42-46,64.
LIU H, LIU J M, LUO C, et al. Effect of GGR-6 on physiological dynamics of Cinnamomum migao H. W. Li cuttings during rooting[J]. Journal of Northeast Forestry University, 2021, 49(10): 42-46, 64.
[27]王青,张捷,仲崇禄,等.麻楝扦插生根进程中内源激素和营养物质含量的变化[J].中南林业科技大学学报,2020,40(4):111-119.
WANG Q, ZHANG J, ZHONG C L, et al. Variation of endogenesis hormone and nutritive matter concentration in Chukrasia tabularis cuttings during rooting[J]. Journal of Central South University of Forestry & Technology, 2020, 40(4): 111-119.
[28]黄梅,陈振夏,于福来,等.NAA处理对艾纳香扦插生根生理生化特性的影响[J].热带亚热带植物学报,2022,30(1):97-103.
HUANG M, CHEN Z X, YU F L, et al. Effects of NAA on physiological and biochemical characteristic of Blumea balsamifera during cutting rooting[J]. Journal of Tropical and Subtropical Botany, 2022, 30(1): 97-103.
[29]李柠,陈军,曹福亮,等.枫杨秋季扦插繁殖技术的研究[J].中南林业科技大学学报,2019,39(6):60-65,83.
LI N, CHEN J, CAO F L, et al. Study on the cutting propagation technology of Pterocarya stenoptera C. DC in autumn[J]. Journal of Central South University of Forestry & Technology, 2019, 39(6): 60-65, 83.
[30]赵云龙,陈训,李朝婵.糙叶杜鹃扦插生根过程中生理生化分析[J].林业科学,2013,49(6):45-51.
ZHAO Y L, CHEN X, LI C C. Dynamic of physiology and biochemistry during wild Rhododendron scabrifolium cutting propagation[J]. Scientia Silvae Sinicae, 2013, 49(6): 45-51.
[31]李斌.长柄扁桃嫩枝扦插繁殖技术与生根机理研究[D].北京:中国林业科学研究院,2017.
LI B. Study on cutting propagation technology and rooting mechanism of almond with long handle[D]. Beijing: Chinese Academy of Forestry, 2017.
[32]翟亚芳,刘贤德,吕东,等.植物生长调节剂对鞑靼忍冬扦插生根及酶活性变化的影响[J].中南林业科技大学学报,2021,41(7):52-61.
ZHAI Y F, LIU X D, LYU D, et al. Effects of plant growth regulators on the rooting and enzyme activities changes of Lonicera tatarica cuttings[J]. Journal of Central South University of Forestry & Technology, 2021, 41(7): 52-61.
[33]畢会涛,王言歌,申洁梅,等.IBA处理对美国木豆树扦插生根及其生理生化的影响[J].河南农业大学学报,2020,54(1):44-51.
BI H T, WANG Y G, SHEN J M, et al. Effects of IBA treatment on rooting of cutting and physiological and biochemical twig of Catalpa bignonioides[J]. Journal of Henan Agricultural University, 2020, 54(1): 44-51.
[34]宋金耀,刘永军,宋刚,等.几个常见树种扦插生根过程中POD、IAAO活性及酚含量的变化[J].江苏农业科学,2007,35(6):115-118.
SONG J Y, LIU Y J, SONG G, et al. Changes of POD, IAAO activity and phenol content of several common tree species during cutting rooting[J]. Jiangsu Agricultural Sciences, 2007, 35(6): 115-118.
[35]王小玲,赵忠,权金娥,等.外源激素对四倍体刺槐硬枝扦插生根及其关联酶活性的影响[J].西北植物学报,2011,31(1):116-122.
WANG X L, ZHAO Z, QUAN J E, et al. Rooting and correlative enzyme activities of hardwood cuttings of tetraploid Robinia pseudoacacia[J]. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(1): 116-122.
