香水百合组织培养和快速繁殖条件的优化
2017-02-15方中明��于恒��白根祥��黄玮婷�
方中明��+于恒��+白根祥��黄玮婷��+曾宋君
摘要:以香水百合无菌试管苗小鳞茎作为外植体,从外植物体创伤、基本培养基、植物生长调节剂的配比以及培养基的物理状态等几个方面研究了百合鳞茎增殖的最优条件,并对百合组培苗的生根条件进行了优化。结果表明,一定的外植体创伤处理、氮元素含量较高的基本培养基和合适的植物生长调节剂浓度组合有利于鳞茎的增殖,香水百合鳞茎最佳增殖培养基配方为N6+0.2 mg/L NAA+2.0 mg/L 6-BA;在MS+1.5 mg/L 6-BA+0.4 mg/L NAA培养基中,液体培养的鳞茎增殖倍数极显著高于固体培养;香水百合小苗的最佳生根培养基配方为1/2MS+0.2 mg/L NAA+0.5 mg/L IBA。
关键词:百合;增殖;创伤;液体培养;培养条件;植物生长调节剂
中图分类号: 682.2+90.4+3文献标志码:
文章编号:1002-1302(2016)08-0081-05
百合(Lilium spp.)是指百合科百合属多年生球根花卉,其花色鲜艳、花姿雅致,具有较高的观赏价值和药用价值。香水百合是百合中的“女王”,因其花大、芳香宜人、清雅脱俗而深受欢迎,主要做切花观赏制成花束和花篮[1]。目前,中国香水百合的种球主要依赖进口,百合新品种的选育和商品种球的供应已成为制约我国百合产业发展的“瓶颈”问题,实现优质百合种球的国产化具有重要的现实意义,而国内的种苗繁殖方法以分球繁殖为主,有时也采用鳞片扦插,但以小鳞茎分株法及鳞片扦插法繁殖,繁殖率低,且长期的营养繁殖易使其感染病毒而降低花的质量,应用组培方法实现百合工业化生产是解决这一问题的有效途径。目前,我国学者对香水百合的组织培养进行了相关研究,但主要集中以鳞片、叶片、花器官等为外植体的固体培养基诱导再生植株上[2-9]。本研究以香水百合无菌试管苗鳞茎为外植体,探讨外植体创伤、基本培养基、植物生长调节剂的配比以及培养基的物理状态探究对小鳞茎增殖的影响,筛选出最适宜培养基配方、培养方式以及生根培养基配方,以期为香水百合组培苗的工厂化大生产提供依据。
1材料与方法
1.1材料
香水百合无菌试管苗由武汉生物工程学院细胞工程实验室提供。
1.2方法
1.2.1创伤处理对百合小鳞茎增殖的影响
选用大小相似、长势较好的无性系香水百合小鳞茎作为本试验的外植体材料,切割成0.5 cm×0.5 cm的小块。1组对小块做切割处理(平行切割3刀),1组不进行任何处理作为对照,接种到 MS+20 mg/L 6-BA+0.3 mg/L NAA+3%蔗糖+0.7%琼脂的培养基中,pH值5.8,每瓶接 8个小鳞茎,共接30瓶。
培养条件为先暗培养15 d,然后放到光下培养。培养30 d 后,统计肉眼可以区分的香水百合小鳞茎个数,计算小鳞茎增殖系数(Q)=统计的小鳞茎个数/接种个数。
1.2.2不同增殖培养对百合小鳞茎增殖的影响
将无菌试管小苗切除叶片及根部,接种到15种不同增殖培养基中(表1),每瓶接种8个小鳞茎,共接30瓶。50 d后统计并计算能增殖的小鳞茎百分率、增殖系数和增加的质量。能增殖的小鳞茎百分率=分化的外植体数/接种的外植体数×100%。增殖率=增殖出的小鳞茎数/接种的小鳞茎数×100%。
1.2.3培养基不同物理状态对百合小鳞茎增殖的影响以MS+1.5 mg/L 6-BA+0.4 mg/L NAA+3%蔗糖+0.7%琼脂,pH值5.8为基本培养基,分装在50 mL的锥形瓶中,每瓶分装20 mL;液体培养基中不加琼脂但是加入定量的脱脂棉;液体培养基分装在250 mL的锥形瓶中,每瓶分装100 mL,并且加入0.3 g脱脂棉,灭菌备用。
选用大小相近长势较好的香水百合小鳞茎,将外植体切割成大小为0.5 cm×0.5 cm的小块,接种到培养基上,每瓶均接种4个,共30瓶。摇床转速:100 r/min。培养30 d后,统计香水百合小鳞茎个数,计算小鳞茎增殖系数。
1.2.4香水百合小苗生根
将增殖培养得到的香水百合鳞茎接种于壮苗培养基上培养,百合鳞茎壮苗培养基的配方为MS+0.5 mg/L NAA+1.0 mg/L 6-BA+0.1 mg/L GA+3%蔗糖+0.7%琼脂,pH值5.8。将经过壮苗培养获得的生长健壮的百合小苗,接种到不同生长调节剂浓度的生根培养基上培养(表2)。每瓶接种6棵小苗,共接8瓶,30 d后统计在各个培养基上的生根情况,包括生根小苗数量、生根数、根长及生根率。生根率=生根外植体数/接种的外植体数×100%。
1.2.5培养条件和数据分析
以上培養基除特别说明外,其余的均加入3%蔗糖+0.7%琼脂,pH值5.8。培养条件:培养温度为25 ℃,光照度为1 500 lx,每天光照12 h。数据分析采用SPSS软件进行变量分析(ANOVA),以Duncans在005水平上进行显著性差异分析。
2结果与分析
2.1创伤处理对香水百合鳞茎增殖的影响
经过创伤处理的百合鳞茎的增殖倍数可达到4.40,而未经创伤处理的对照仅为1.33,增殖倍数之间存在极显著性差异(表3)。
2.2不同基本培养基对香水百合鳞茎增殖的影响
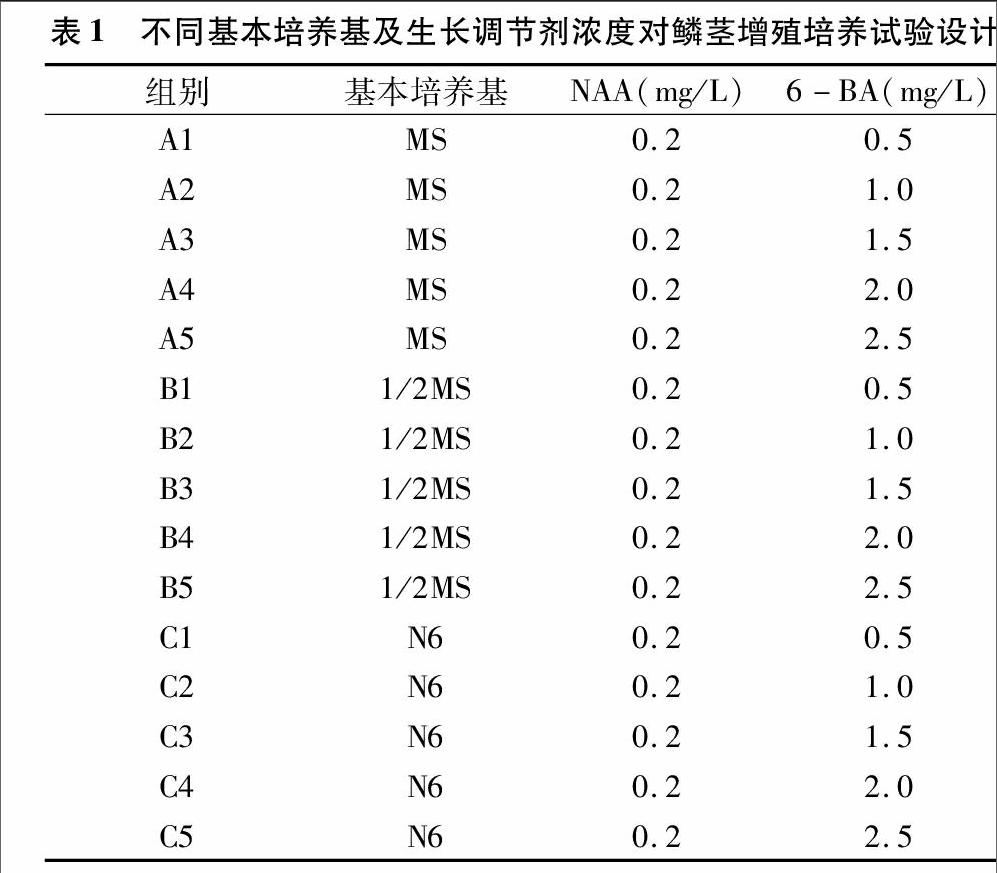
从图1可以看出,不同基本培养基及生长调节剂浓度配比组合的培养基对百合能增殖小鳞茎的百分率具有重要的影响。总体上看,A组的鳞茎分化率低于B组、C组,而B组、C组之间差异不大。表明1/2MS、N6基本培养基较MS基本培养基更适合于香水百合鳞茎的分化增殖。在所有培养基中A5的百分率最低,除与A1、A3、A4和B4外的其他所有培养基均具有显著性差异。C组能增殖小鳞茎的百分率均达到较高的水平,B3组能增殖小鳞茎达到93.75%,而A组均在71%以下。C组所用的基本培养基为N6培养基,说明在此培养基下,鳞茎的分化率稳定且处于较高水平。
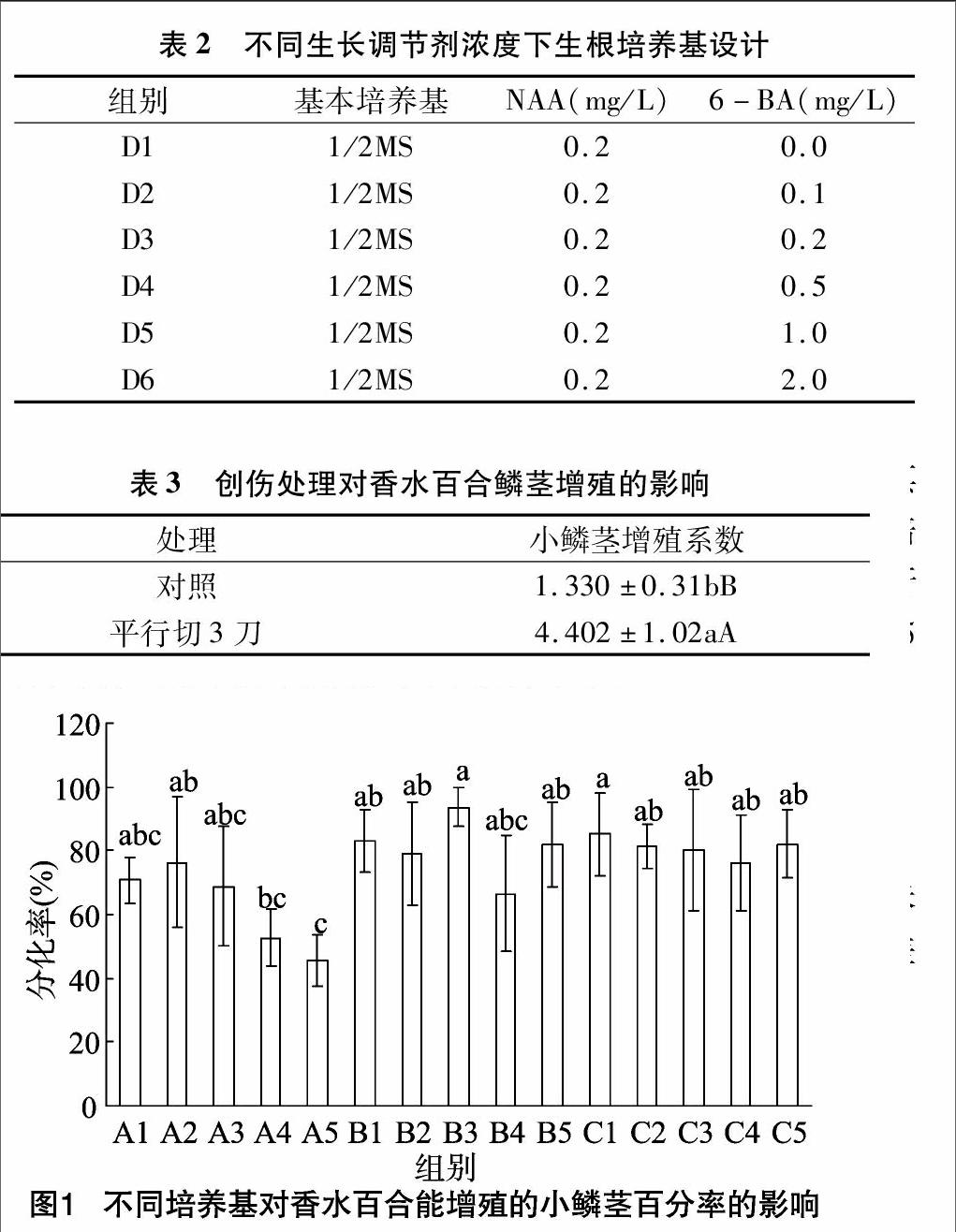
从图2可以看出,不同基本培养基及生长调节剂浓度配比组合培养基对百合小鳞茎增殖率也具有重要的影响。C组鳞茎的增殖系数总体要好于A组、B组,特别是C4组的增殖系数达到8.0。相比较而言,B组鳞茎的增殖系数总体要高于A组,特别是A1、A3这2种培养基的增殖率显著低于其他培养基。在总质量的增加方面,C组的总质量普遍明显高于A组、B组。因此,C组培养基特别是C4最适合于香水百合鳞茎的增殖及增质量(图3)。
从图1可以看出,A组中能增殖小鳞茎的百分率较高的是A1、A2、A3,说明在以基本培养基为MS基本培养基的条件下,低浓度的6-BA有助于鳞茎的启动增殖;B组中能增殖小鳞茎的百分率最高的是B3,即6-BA浓度为1.5 mg/L时,而在6-BA浓度为2.0 mg/L时能增殖小鳞茎的百分率较低;C组中鳞茎的能增殖小鳞茎的百分率较稳定且处于较高水平,说明在基本培养基为N6培养基的条件下,6-BA浓度对鳞茎分化率的影响不大。
从图2可以看出,在A、B、C这3组中,鳞茎增殖系数最高的是C3,而且其增殖系数远高于其他组。表明在基本培养基为N6、6-BA浓度为2.0 mg/L时,最有利于香水百合鳞茎的增殖。从图3可以看出,在A组中,高浓度的6-BA有利于鳞茎的增质量;而在B组、C组中,6-BA浓度对鳞茎的增质量没有明显的影响。
从鳞茎的生长状况(图4、图5、图6)上看,A1、B1、C1的鳞茎苗的生长高度均要好于A、B、C组中的其他处理,说明当生长调节剂配比为0.2 mg/L NAA、0.5 mg/L 6-BA时有利于鳞茎苗的长高;各组中随着6-BA浓度的增加,鳞茎苗越来越粗壮、嫩绿,[JP3]说明在一定范围内,高浓度的6-BA有利于鳞茎苗的壮苗生长。
2.4不同物理状态培养基对百合小鳞茎增殖倍数的影响
从表4可以看出,在MS+1.5 mg/L 6-BA+0.4 mg/L NAA+3%蔗糖+0.7%琼脂培养基下,经液体摇床培养的百合鳞茎的增殖效果显著优于固体培养,其平均增殖系数可达9.00。
2.5不同生长调节剂浓度配比对香水百合小苗生根的影响
3讨论
3.1创伤处理对百合鳞茎增殖的影响
植物细胞在离体条件下仍具有发育为完整植株的潜能;只要外界环境对外植体刺激得当,激素添加比例适中,就能将植物细胞进行定向诱导[10]。本研究对百合鳞茎的创伤处理能使其增殖系数极显著升高,原因可能是适当进行创伤处理對离体条件下的外植体产生了一定的刺激,同时,创伤产生的伤口有利于外植体对营养物质的快速吸收,促进了百合鳞茎的增殖,黄磊等在蝴蝶兰叶片有组织培养中也获得了相似的结果[11]。
3.2基本培养基对百合鳞茎增殖的影响
在百合的组织培养中对基本培养基的研究报道很少。本研究结果表明,在百合组织培养中普遍采用的MS培养基并不是香水百合增殖的适宜培养基,而N6培养基比较适宜香水百合的鳞茎增殖,与徐凌飞的研究结果[12]相似,可能是与N6培养基中较高的氮元素含量相关。张洁等的研究也表明,高浓度的大量元素有利于鳞茎的膨大,但不利于鳞茎的诱导[13]。施用氮肥可显著提高花径、叶面积、叶片数和瓶插寿命,表明氮素对香水百合切花品质有较为重要的影响[14]。适宜高浓度氮营养对百合生长有利[15-17]。
3.3生长调节剂对百合鳞茎增殖的影响
应用组织培养技术可以对香水百合进行快速繁殖,实现种球规模化周年生产,茎芽增殖是扩繁的关键[18]。细胞分裂素与生长素的比例高有利于芽的诱导;细胞分裂素与生长素的比例低有利于根的诱导[10]。因而筛选适宜的激素浓度是增殖培养的关键。张惠华等认为,较高浓度的激素含量可以提高增殖倍数,但小鳞茎呈丛生状态,愈伤化,因此在不同的生产阶段,宜适当控制激素的浓度,在保证较高增殖倍数的同时保证种球的质量[19]。庞新霞等以6-BA、KT、NAA和IBA激素的不同组合培养基增殖东方百合发现,不同激素组合对东方百合的鳞茎组培芽的生长具有明显的影响,相同的激素处理不同品种也存在差异[20]。蓝炎阳等研究表明,细胞分裂素对组培中芽的增殖起主要作用,6-BA利于芽增殖,KT使组培苗更加健壮[21]。本试验综合香水百合鳞茎的增殖系数、增质量情况、生长情况,得出鳞茎增殖的最佳生长调节剂配比为0.2 mg/L NAA、2.0 mg/L 6-BA。
3.4液体培养对百合鳞茎增殖的影响
液体培养是一种简单高效的鳞茎生产方法,它可以极大地减少劳动量[22]。本研究采用液体培养基对香水百合小鳞茎进行增殖的诱导时发现,液体摇床培养的增殖效果极显著优于固体培养,可能原因是在液体摇床培养基中的外植体与培养基有较大的接触面积,有利于营养物质的吸收,从而加速鳞茎的增殖。
3.5植物生长调节剂对百合小苗生根的影响
影响百合鳞茎小苗生根的因素很多,但主要研究集中在基本培养基和植物生长调节剂2个方面。罗凤霞等在新铁炮百合研究中发现,不加任何激素的MS培养基为最佳生根培养基[23]。袁芳亭等认为,1/2MS并附加0.5~1.0 mg/L NAA的培养基效果较好[24]。袁雪等对2种培养基做了对比性研究,研究发现1/2MS培养基中的鳞茎苗生根率较高,达到了100%,但苗很纤弱;在MS培养基中,百合的生根率虽然较高,根系粗壮,但没有侧根发生,单苗根数较少,根长度也较小。在1/2MS培养基中添加适量吲哚丁酸(IBA)后,单苗根数明显增多,根系更粗壮,但根系生长变慢,且侧根发生减少[25]。本研究结果表明,在含有0.2 mg/LNAA的1/2MS培养基上添加一定浓度的IBA有利于香水百合的生根,特别是根数增加较多,获得生根的最佳培养基为1/2MS+0.2 mg/L NAA+0.5 mg/L IBA。
参考文献:[HJ1.5mm]
[1]潘佑找,陈香丽,胡琼,等. 香水百合的组织培养技术研究[J]. 安徽农学通报,2009,15(17):46,95.
[2]李玲莉,刘华敏,孔立生,等. 利用生物反应器进行香水百合培养研究[J]. 西北林学院学报,2014,29(1):89-94.
[3]苏琛. 香水百合再生体系的建立[J]. 安徽农业科学,2012,40(7):3906-3907,3911.
[4]李冰华,金晓玲,刘雪梅. 香水百合鳞片组织培养再生体系的建立[J]. 江苏农业科学,2008(4):83-85.
[5]阮少宁,杨华,梁一池,等. 香水百合组织培养的试验研究[J]. 福建林学院学报,2001,21(2):142-145.
[6]高敏. 香水百合的组培快繁[J]. 广西农业科学,2002(3):120-121.
[7]万容,李群. 香水百合组织培养中外植体和培养基配方的选取[J]. 南方农业,2012(5):46-48.
[8]张立,王日明. 香水百合花瓣组织培养[J]. 现代农业科技,2011(10):191-192,194.
[9]杨子贤,张颖. 香水百合和东方百合鳞片组织培养研究[J]. 中国热带农业,2013(6):53-56.[ZK)]
[10]周吉源. 植物细胞工程[M]. 武汉:华中师范大学出版社,2007.
[11]黄磊,陈之林,吴坤林,等. 切割方式和外植体大小对蝴蝶兰叶片诱导类原球茎的影响[J]. 热带亚热带植物学报,2009,17(3):261-266.
[12]徐凌飞,庞勇,周连霞,等. 兰州百合微繁的研究[J]. 中国农学通报,2005,21(5):113-114,152.
[13]张洁,蔡宣梅,林真,等. 百合试管鳞茎诱导及膨大技术的研究[J]. 福建农业学报,2010,25(3):328-331.
[14]Badiyan D,Wills R H,Bowyer M C. Use of a nitrogen oxide donor compound to extend the vase life of cut flowers[J]. HortScience,2004(6):1371-1372.
[15]王磊,湯庚国,刘彤. 施肥对石蒜叶片生长及生化指标的影响[J]. 东北林业大学学报,2009,37(7):65-66.
[16]Bichsel R G,Starman T W,Wang Y T. Nitrogen,phosphorus,and potassium requirements for optimizing growth and flowering of the nobile Dendrobium as a potted orchid[J]. HortScience,2008,43(2):328-332.
[17]何春梅,何盈,罗涛,等. 施肥方法对百合生长影响的研究[J]. 北方园艺,2006(4):120-122.
[18]李浚明. 植物组织培养教程[M]. 北京:北京农业大学出版社,2000.
[19]张惠华,崔玥晗,李丹,等. 东方百合组培条件优化技术研究[J]. 中国园艺文摘,2010(9):28-29.
[20]庞新霞,岑秀芬,陈国建,等. 不同激素组合对东方百合鳞茎组培芽增殖的影响[J]. 广西园艺,2008,19(2):3-5,14.
[21]蓝炎阳,吴士彬,陈志言,等. 东方百合组织培养研究现状[J]. 福建热作科技,2012,37(2):45-47.
[22]Han B H,Yu H J,Ye B W,et al. In vitro micropropagation of Lilium longiflorum ‘Georgia by shoot formation as influenced by addition of liquid medium[J]. Scientia Horticulturae,2004,103(1):39-49.
[23]罗凤霞,徐桂华,金丽丽,等. 新铁炮百合微繁的研究[J]. 沈阳农业大学学报,2000,31(3):254-257.
[24]袁芳亭,陈龙清. 麝香百合的叶片离体培养及植株再生[J]. 湖北农业科学,2001(3):50-51.
[25]袁雪,钟雄辉,李晓昕,等. 铁炮百合的胚性愈伤组织诱导和植株再生[J]. 核农学报,2012,26(3):454-460,477.
