高致病性FAdV-4传代中的毒力和Fiber2基因的比对分析
2023-05-30邓翔飞陈芳芳
洪 琴,邓翔飞,周 香,徐 彬,陈芳芳
高致病性FAdV-4传代中的毒力和基因的比对分析
洪 琴,邓翔飞,周 香,徐 彬,陈芳芳*
(安徽农业大学动物科技学院,合肥 230036)
为筛选禽腺病毒疫苗株和制备亚单位疫苗提供科学依据,探明高致病性禽腺病毒C亚型4血清型(FAdV-4)毒株在传代中的毒力变化以及不同感染方式对雏鸡死亡率的影响,首先制备2 ~ 15代的高致病性FAdV-4尿囊液,用LMH细胞检测第2、4、8和15代尿囊液的半数细胞感染量(TCID50);其次选取的4个代次尿囊液分别通过黏膜(点眼)和颈背部皮下途径接种SPF雏鸡,观察动物的死亡率;最后应用PCR方法扩增主要结构蛋白基因序列并进行比对分析。结果表明:所有制备的2 ~ 15代FAdV-4毒株均在5 ~ 7 d内致鸡胚死亡(100%),4个代次毒株的TCID50为106.5±0.2/0.1 mL,不同代次毒株间的毒力差异不显著(>0.05);选取的4个代次毒株经颈背部皮下接种雏鸡的死亡率为100%,死亡雏鸡出现典型的心包积液综合征。而经黏膜接种的雏鸡死亡率呈下降趋势,分别为80%、50%、30%和30%;不同代次毒株基因序列没有发生变化。总之,不同代次毒株通过皮下接种后对雏鸡的致病力没有差异,但黏膜接种的死亡率则逐代下降,而主要结构蛋白基因则没有出现碱基变异。
强毒株FAdV-4;毒力;致病性;
禽腺病毒(Fowl adenoviruses,FAdVs)是禽类重要的病原体,I型腺病毒分为5个亚群(FAdV-A、B、C、D和E),含12个血清型,其中C亚群4型(FAdV-4)主要引起心包积液综合症(Hydroperi- cardium syndrome,HPS)。FAdVs虽然是多种禽类的病原,但鸡是主要易感动物[1-3]。2014年之前,该病毒在我国呈零星发病,2015年呈逐年上升趋势。在2007—2020年间,FAdV-4成为我国的优势血清型[4-6]。该病毒不仅感染3~6周龄的肉鸡,也感染10~20周龄的蛋鸡,给养禽业造成巨大经济损失[7]。感染鸡和感染水禽(鸭子与鹅)的FAdV-4之间的同源性较高,达到94%以上[1-3],但是不同物种间仅仅存在有限的交叉感染,尤其是鸡和水禽之间,这可能是因为不同物种产生的细胞因子种类有所差异[8]。不同毒力FAdV-4毒株感染动物的死亡率表现出差异性,高致病性毒株对鸡的死亡率在40%~100%。有的FAdV-4毒株没有致病性,可能与病毒结构蛋白Hexon的差异相关[9]。强毒力FAdV-4毒株感染家禽后可以引发心血管病变进而致使血管壁的通透性增强,导致细胞因子(如IL-1β)大量渗出从而引起心包积液[10-11]。病毒还可引发肝脏细胞细胞质中油滴(甘油三酯)的积聚,导致脂肪变性[12]。除此以外,肾脏也会发生明显病变。
病毒的主要结构蛋白由Hexon、Fiber1和Fiber2组成,其中不同毒株间的Hexon有差异,是不同血清型FAdVs分型的主要依据[13]。Fiber1和Fiber2是病毒的刺突蛋白,与病毒的毒力和刺激机体产生抗体有关,是制备检测和亚单位疫苗的理想纤突蛋白[14-19]。
虽然高致病性FAdV-4的不同毒株间基因差异低于2%,但是据已有的报道表明其导致的死亡率却不同,由于腺病毒容易发生体外重组,FAdV-4的强毒株在体外传代过程中基因是否发生突变导致毒力也发生变化,尚鲜见相关报道。本研究通过强毒株传代,选择有代表性的第2、4、8和15代毒株检测不同代次毒株毒力并分析比对其主要结构蛋白基因序列,以期为研究强毒株在体外的变异规律、筛选疫苗株和制备亚单位疫苗提供实验数据。
1 材料与方法
1.1 样品与试剂
病料来自安徽农业大学禽病诊断中心,采集自某养殖场疑似心包积液综合征(HPS)病鸡的肝脏组织;SPF雏鸡由本实验室购买SPF鸡胚自行孵育,SPF鸡胚购于浙江立华农业有限公司。
克隆载体pMD18-T、PCR plus mix和DNA Marker DL 2000购自东盛生物公司(广州);KOD OneTMPCR Master Mix和T4连接酶购自东洋纺有限公司(日本);大肠杆菌()DH5ɑ感受态细胞购自擎科有限公司(南京);蛋白质标准Marker购于TaKaRa生物有限公司;病毒基因组DNA/RNA提取试剂盒和琼脂糖凝胶DNA回收试剂盒购自天根生物(北京);DMEM/F12培养基和胎牛血清(fetal bovine serum,FBS)购自Hyclone有限公司;鸡肝细胞系LMH细胞由本实验室保存。
1.2 不同代次FAdV-4毒株的制备与鉴定
取1 g病鸡肝脏用剪刀剪碎,研磨后加入无菌生理盐水制成悬液,反复冻融后离心,吸取上清经0.22 μm过滤器滤过后,制成原代(第1代)FAdV-4病毒。将第1代病毒液经尿囊腔途径接种7日龄鸡胚,弃去24 h内死亡鸡胚,收集24~144 h内死亡鸡胚尿囊液。同时,摘取病变鸡胚的肝脏,经无菌PBS洗涤后,提取DNA,应用PCR鉴定其为FAdV-4病毒,将所获鸡胚尿囊液标记为第2代FAdV-4病毒。以此方法进行FAdV-4的传代,一直传至第15代,将获得的死亡鸡胚的尿囊液置于﹣80 ℃储存备用。具体尿囊液的制备,病毒的检测方法按照课题组所建立的方法[20]。
1.3 不同代次FAdV-4毒株TCID50的测定
将LMH细胞分置于96孔细胞培养板中,于37 ℃ 5% CO2培养箱中过夜,次日当细胞达到90%及以上,则进行病毒接种。将不同代次的病毒液作10倍稀释,从10-1~10-8。弃去原有的细胞生长液,将稀释好的病毒液加入到96孔细胞培养板中,孵育1 h,加入含1% FBS的维持液,放入培养箱中培养。每天观察细胞病变,并记录细胞病变情况。获得的数据根据Reed-Muench法计算病毒的TCID50值,利用SPSS 23分析软件,应用多重t检验中的非配对t检验来计算和分析组与组之间差异性(值),多组比较采用单因素方差分析来计算和分析值,当<0.05时,所获得的结果是被认为具有统计学意义的;当>0.05时,所得结果则不具备统计学意义。
1.4 病变鸡胚的剖检观察
取接种FAdV-4后病死鸡胚,用PBS清洗2遍,放入干净的培养皿中。首先观察鸡胚的整体病变特征,包括整体发育状况,鸡胚的腹部、背部、四肢以及头部的皮肤颜色,是否有出血点;再剖检观察鸡胚的肝脏、肾脏和心脏等内脏的病理变化。
1.5 不同代次毒株感染方式与致死率鉴定
取7日龄SPF鸡100羽,每组10羽,分10组,按照每羽0.05 mL的剂量接种病毒,设对照组接种同等剂量的无菌生理盐水。鸡攻毒方式分别为颈背部皮下注射和点眼。雏鸡的饲养均按照SPF饲养标准进行。每天观察动物状态,记录雏鸡死亡日期和羽数,剖检死亡雏鸡,收集死亡动物的肝脏,进行病毒的PCR鉴定。
1.6 病死雏鸡的剖检
将病死鸡羽毛用水淋湿,拉直颈部,使其呈仰姿。将腹部皮肤用镊子提起,顺着体中线纵直切开,将两大腿向后掰折,便于对脏器进行观察。先观察肌肉以及整体皮肤是否正常。之后剪开腹部肌肉和翅肋骨,打开胸腔,检查胸腹腔器官大小及颜色,有无积液、渗出物和血液等。观察腹腔脏器,如消化器官中脏器的颜色,有无出血、坏死及内容物性状;呼吸器官中气管颜色,有无出血点及坏死,是否有黏液或异物;内脏实质器官中心脏、肝脏、脾脏、肾脏、法氏囊的颜色、大小、质地和出血、坏死情况。
1.7 不同代次FAdV-4毒株的主要结构蛋白Fiber2 基因扩增与比对分析
根据GenBank中毒株(登录号:MG547384)基因序列进行设计引物,上游引物为F:(5′-ATGCTCCGGGCCCCTAAAAG-3′);下游引物为R:(5′-TTACGGGAGGGAGGCCGCTG-3′);目的基因大小为1 440 bp。引物由上海通用生物工程股份有限公司合成。以获得的不同代次毒株DNA为模板,进行基因的PCR扩增,并设置阴性对照。PCR反应体系为:2×FastPCR premix 10 µL;上游引物 1 µL;下游引物 1 µL;ddH2O 6 µL;模板DNA 2 µL;总体系为20 µL。PCR反应条件为:95 ℃预变性 3 min;94 ℃变性45 s,58 ℃退火45 s,72 ℃延伸90 s,共30个循环;最后72 ℃延伸10 min,4 ℃保存。
获得基因片段进行连接转化至PMD18-T中构建重组质粒后进行测序,应用Megalign软件对扩增到的不同代次FAdV-4的基因序列进行比对分析并绘制基因差异性分析图。
2 结果与分析
2.1 2至15代次FAdV-4毒株的制备和PCR鉴定
对接种后死亡鸡胚的肝脏进行PCR鉴定,结果显示,均能扩增到大小为599 bp的特异性DNA条带(图1),而在空白对照组未扩增到条带。获得的DNA序列经测序并输入NCBI进行比对分析,结果显示,本次扩增到的目的序列与已经报道的FAdV-4基因的同源性为100%,由此可确定本研究已成功制备2~15代次FAdV-4毒株。
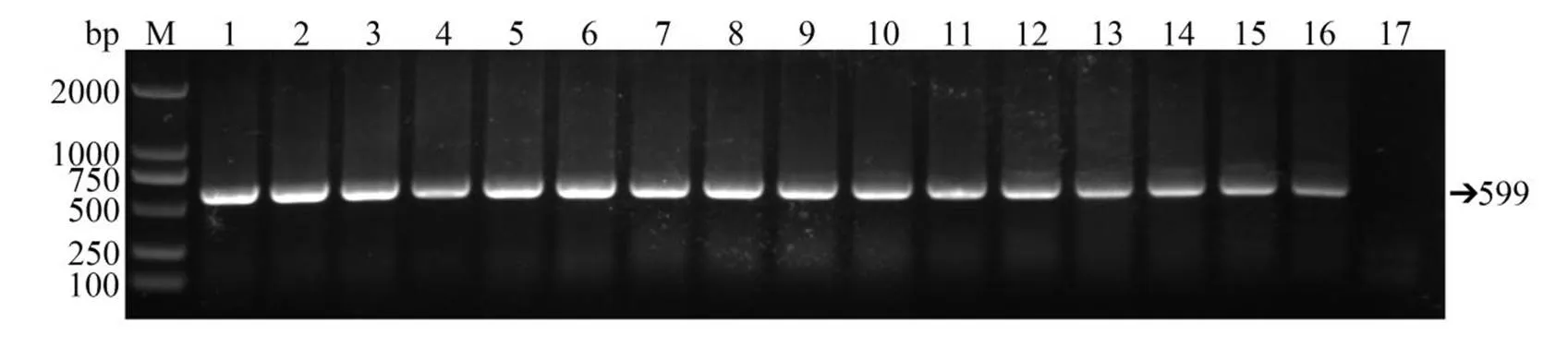
M. DNA标准分子量;1—15.不同代次病毒株Hexon599的 PCR产物;16.FAdV-4阳性对照;17.阴性对照。
Figure 1 Identification of different generations of viruses by PCR

表1 第2代病毒TCID50的计算
2.2 不同代次FAdV-4毒株的TCID50测定结果
选择第2、4、8和15代FAdV-4毒株测定其TCID50,结果显示4个代次毒株的TCID50分别为106.56/0.1 mL、106.37/0.1 mL、106.45/0.1 mL 和106.50/0.1 mL。通过统计分析发现,不同代次病毒的TCID50差异不显著(>0.05),且病毒接种细胞所引起病变时间均为6~8 d。这说明,不同代次毒株的毒力无明显差异。各代次病毒的TCID50见表1—表4。

表2 第4代病毒TCID50的计算

表3 第8代病毒TCID50的计算

表4 第15代病毒TCID50的计算

表5 不同代次毒株感染方式和死亡率统计
2.3 接种不同代次FAdV-4毒株的鸡胚病变
不同代次毒株的尿囊液接种鸡胚后5~7 d内出现死亡,死亡率均为100%。剖检病死鸡胚发现所有鸡胚的肢爪萎缩,胚体瘦小,发育不良,全身皮肤出现大小不等密集出血点。解剖后发现,肝脏出血,有坏死灶,质地较脆,肾红肿并伴有出血。这些均为FAdV-4所导致的鸡胚特征性病变。
2.4 不同代次FAdV-4毒株的雏鸡感染方式和死亡率
第2、4、8、15的FAdV-4毒株分别通过黏膜(点眼)接种和皮下注射两种途径感染7日龄SPF雏鸡,发现死亡率有所差异。4个代次的毒株皮下接种后的雏鸡死亡率均为100%,而在黏膜接种的实验组中,雏鸡死亡率分别为80%、50%、30%和30%,这说明随着代次的增加,雏鸡的死亡率下降,但死亡率均大于30%,这说明毒株毒力是有所下降,且通过黏膜接种更明显。同时皮下接种组雏鸡死亡时间较黏膜接种组早,这表明,毒株通过皮下接种对雏鸡的致病性较黏膜途径强。不同代次FAdV-4毒株不同接种方式组雏鸡死亡率如表5所示。

图2 不同代次分离毒株Fiber2基因比对
Figure 2 Comparison ofgene of different generations of virus strains
2.5 不同代次FAdV-4毒株感染鸡的病变特征
接种病毒3 d后,鸡群出现呆滞、精神沉郁、羽毛蓬乱、嗜卧、聚集。死亡后雏鸡出现鸡冠苍白,死前伴有刺耳鸣叫声。剖检病死鸡可见心脏有淡黄色透明的心包积液,呈水或胶冻状。肝脏外观呈浅褐色至深黄色,轻微肿大,边缘钝厚,表面可见不同大小的出血点及出血斑。肾脏红肿、质地脆。这表明病毒感染后,不同代次毒株接种病毒后出现典型的心包积液综合征。
2.6 不同代次FAdV-4毒株主要结构蛋白Fiber2基因的比对分析
本研究将分离的FAdV-4毒株进行传代,同时对其中的第1、4、5、6、7、8和第15代毒株的基因进行扩增。用MegAlign软件比对,结果显示,不同代次的基因的碱基没有发现突变,如图2所示。进一步用DANMAN软件对它们进行了突变比对分析。结果发现该基因的碱基没有发生突变,相似性为100%,这也说明不同代次FAdV-4毒株的基因遗传性具有高度稳定特征。
3 讨论
本研究将高致病性FAdV-4毒株进行传代至15代,这些不同代次毒株的鸡胚死亡率保持100%,选择的具有代表性的2、4、8和15代病毒之间的TCID50差异不显著(表1—表4),剖检病死鸡胚发现,病死鸡胚均出现胚体出血、肝脏和肾脏的病变等。经颈背部皮下注射雏鸡的致病性也保持100%(表5),对病死雏鸡进行解剖发现,病死雏鸡均出现典型的心包积液综合症,这说明高致病性毒株在鸡胚内传代过程中,病毒的致病症状并没有发生变化。FAdV-4病毒可以感染多个年龄阶段的鸡,但是尤以40日龄以内的鸡死亡率最高,这与有些学者的研究结果是一致的[21]。进一步检测不同代次毒株的主要结构蛋白基因碱基变化,结果发现,在传代过程中该基因序列没有发生变化(图2)。由于是高致病性FAdV-4的主要毒力因子,所以说明该毒株具有稳定的遗传特性。
目前,对于FAdV-4的致病机制仍不清晰。Niu等[21]的研究发现,病毒可导致血管内皮细胞的损伤引起血管通透性增加,血管渗出形成心包积液,心包积液的大量聚集最后导致病鸡心力衰竭。同时,病毒感染后可引起动物机体的细胞因子风暴,因为病毒可以激活机体表达细胞因子途径,如激活Toll样受体(TLR)信号通路,包括细胞因子及其受体相互作用途径、MYD88介导的的炎症,以及通过JNK MAPK或者cGAS途径诱导机体产生IFN等[22-25]。本课题组发现,病毒感染鸡胚肾细胞后可以上调、和基因的表达,而且其相应的调控分子基因的转录水平均呈明显上升,提示FAdV-4感染可引起鸡胚肾细胞产生炎性因子和抗病毒的细胞因子的免疫应答[20]。本课题组在后期的研究中还发现,FAdV-4感染雏鸡后可以抑制有效活化T细胞的细胞因子和基因的表达,并抑制抗原递呈细胞或细胞表面抗原递呈分子的表达。这些因素都可能造成FAdV-4的死亡。
本研究主要目的是测定FAdV-4在传代中的变化,尤其是初始代次和末代的变化,所以挑选出第2、4、8和第15代毒株进行实验。本研究发现,不同代次毒株基因没有发生改变,这为选择亚单位疫苗的结构域提供了理想的依据。有研究表明,无论是单独的作为抗原,还是与病毒重组的疫苗都可以提高鸡对本病毒的保护率[26]。本研究结果显示,在体外传代后第2、4、8和第15代病毒通过点眼的死亡率分别为80%、50%、30%和30%,呈现下降趋势。提取肝脏DNA检测病毒发现,存活下来的雏鸡未感染病毒,这表明有些鸡不能通过黏膜感染。原因可能为,虽然基因序列在传代过程中没有发生变化,而病毒毒力在传代过程中有所降低,但是也依然是强毒株,皮下接种不足以区分这种毒力的差异,而黏膜接种可以,也有可能是病毒的传代次数不够,继续传代50代后可能会发现毒力的明显差异。课题组经过后期的多次重复实验发现,病毒的毒力确实有所降低。作者推测决定FAdV-4病毒毒力因素除了Fiber2蛋白,还有其他蛋白,而这些蛋白可能与侵入动物途径相关,并在遗传性质方面并不稳定,在传代中变异而失去黏膜感染能力,从而导致不同代次毒株感染率下降,进一步的成因还有待于深入研究。
[1] WEI Z P, LIU H, DIAO Y J, et al. Pathogenicity of fowl adenovirus (FAdV) serotype 4 strain SDJN in Taizhou geese[J]. Avian Pathol, 2019, 48(5): 477-485.
[2] PAN Q, LIU L L, WANG Y Q, et al. The first whole genome sequence and pathogenicity characterization of a fowl adenovirus 4 isolated from ducks associated with inclusion body hepatitis and hydropericardium syndrome[J]. Avian Pathol, 2017, 46(5): 571-578.
[3] SHEN Z J, XIANG B, LI S B, et al. Genetic characterization of fowl adenovirus serotype 4 isolates in Southern China reveals potential cross-species transmission[J]. Infect Genet Evol, 2019, 75: 103928.
[4] CHEN L, YIN L J, ZHOU Q F, et al. Epidemiological investigation of fowl adenovirus infections in poultry in China during 2015-2018[J]. BMC Vet Res, 2019, 15(1): 271.
[5] WANG J L, WANG S C, ZOU K Y, et al. Variant serotypes of fowl adenovirus isolated from commercial poultry between 2007 and 2017 in some regions of China[J]. Avian Dis, 2018, 62(2): 171-176.
[6] 冯敬敬, 牛登云, 马利芳, 等. 2015—2020年我国禽腺病毒流行病学调查及高致病性FAdV-4分离株遗传变异性分析[J]. 中国动物传染病学报, 2021, 29(5): 92-98.
[7] MENG K, YUAN X Y, YU J, et al. Identification, pathogenicity of novel fowl adenovirus serotype 4 SDJN0105 in Shandong, China and immunoprotective evaluation of the newly developed inactivated oil-emulsion FAdV-4 vaccine[J]. Viruses, 2019, 11(7): 627.
[8] LI R, LI G, LIN J, et al. Fowl adenovirus serotype 4 SD0828 infections causes high mortality rate and cytokine levels in specific pathogen-free chickens compared to ducks[J]. Front Immunol, 2018, 9: 49.
[9] YU G L, LIN Y, DOU Y G, et al. Prevalence of fowl adenovirus serotype 4 and Co-infection by immunosuppressive viruses in fowl with hydropericardium hepatitis syndrome in Shandong Province, China[J]. Viruses, 2019, 11(6): 517.
[10] WU N, YANG B, WEN B, et al. Pathogenicity and immune responses in specific-pathogen-free chickens during fowl adenovirus serotype 4 infection[J]. Avian Dis, 2020, 64(3): 315-323.
[11] NIU Y J, SUN Q Q, SHI Y Y, et al. Immunosuppressive potential of fowl adenovirus serotype 4[J]. Poult Sci, 2019, 98(9): 3514-3522.
[12] YUAN F, HOU L, WEI L, et al. Fowl adenovirus serotype 4 induces hepatic steatosis via activation of liver X receptor-Α[J]. J Virol, 2021, 95(6): e01938-e01920.
[13] RASHID F, XIE Z X, ZHANG L, et al. Genetic characterization of fowl aviadenovirus 4 isolates from Guangxi, China, during 2017-2019[J]. Poult Sci, 2020, 99(9): 4166-4173.
[14] ZOU X H, RONG Y J, GUO X J, et al. Fiber1, but not fiber2, is the essential fiber gene for fowl adenovirus 4 (FAdV-4)[J]. J Gen Virol, 2021, 102(3): 10.1099/jgv.0.001559.
[15] TIAN K Y, GUO H F, LI N, et al. Protection of chickens against hepatitis-hydropericardium syndrome and Newcastle disease with a recombinant Newcastle disease virus vaccine expressing the fowl adenovirus serotype 4 fiber-2 protein[J]. Vaccine, 2020, 38(8): 1989-1997.
[16] XIE Q, WANG W K, LI L Y, et al. Domain in Fiber-2 interacted with KPNA3/4 significantly affects the replication and pathogenicity of the highly pathogenic FAdV-4[J]. Virulence, 2021, 12(1): 754-765.
[17] WANG W K, LIU Q, LI T F, et al. Fiber-1, not fiber-2, directly mediates the infection of the pathogenic serotype 4 fowl adenovirus via its shaft and knob domains[J]. J Virol, 2020, 94(17): e00954-e00920.
[18] WANG X L, TANG Q X, CHU Z L, et al. Immune protection efficacy of FAdV-4 surface proteins fiber-1, fiber-2, hexon and penton base[J]. Virus Res, 2018, 245: 1-6.
[19] SCHACHNER A, MAREK A, JASKULSKA B, et al. Recombinant FAdV-4 fiber-2 protein protects chickens against hepatitis-hydropericardium syndrome (HHS)[J]. Vaccine, 2014, 32(9): 1086-1092.
[20] LI M Z, RAHEEM M A, HAN C Y, et al. The fowl adenovirus serotype 4 (FAdV-4) induce cellular pathway in chickens to produce interferon and antigen-presented molecules (MHCI/II)[J]. Poult Sci, 2021, 100(10): 101406.
[21] NIU Y J, SUN Q Q, LIU X P, et al. Mechanism of fowl adenovirus serotype 4-induced heart damage and formation of pericardial effusion[J]. Poult Sci, 2019, 98(3): 1134-1145.
[22] YUAN F, SONG H Q, HOU L, et al. Age-dependence of hypervirulent fowl adenovirus type 4 pathogenicity in specific-pathogen-free chickens[J]. Poult Sci, 2021, 100(8): 101238.
[23] ZHANG J Q, ZOU Z, HUANG K, et al. Insights into leghorn male hepatocellular cells response to fowl adenovirus serotype 4 infection by transcriptome analysis[J]. Vet Microbiol, 2018, 214: 65-74.
[24] WANG J, BA G, HAN Y Q, et al. Cyclic GMP-AMP synthase is essential for cytosolic double-stranded DNA and fowl adenovirus serotype 4 triggered innate immune responses in chickens[J]. Int J Biol Macromol, 2020, 146: 497-507.
[25] HE Z Y, CHEN X, FU M J, et al. Inhibition of fowl adenovirus serotype 4 replication in Leghorn male hepatoma cells by SP600125 via blocking JNK MAPK pathway[J]. Vet Microbiol, 2019, 228: 45-52.
[26] XIE Q, CAO S Y, ZHANG W, et al. A novel fiber-2-edited live attenuated vaccine candidate against the highly pathogenic serotype 4 fowl adenovirus[J]. Vet Res, 2021, 52(1): 35.
Comparative analysis of virulence andgene in passage of highly pathogenic FAdV-4
HONG Qin, DENG Xiangfei, ZHOU Xiang, XU Bin, CHEN Fangfang
(School of Animal Science and Technology, Anhui Agricultural University, Hefei 230036)
In order to provide a scientific basis for screening avian adenovirus vaccine strains and preparing subunit vaccines, and to investigate the virulence changes of highly pathogenic avian adenovirus C subtype 4 serotype (FAdV-4) strain in passage and the effects of different infection modes on chicken mortality. Firstly, the 2nd-15thgenerations of highly pathogenic FAdV-4 allantoic fluid were prepared, and LMH cells were used to detect the median tissue culture infective dose ( TCID50) in the 2nd, 4th, 8thand 15thgenerations of allantoic fluid. Secondly, the SPF chickens were inoculated with allantoic fluid of four generations through the mucosal (eye drop) and cervical dorsal subcutaneous routes, respectively, to observe the mortality of the animals. Finally, the main structural proteingene sequence was amplified by PCR and compared. In this study, the 2nd-15thgenerations of FAdV-4 strains were prepared and all strains caused chicken embryo death within 5 - 7 days. The TCID50of the four generations of FAdV-4 strains was 106.5±0.2/ 0.1 mL. There was no significant difference in virulence between different generations of FAdV-4 strains (> 0.05 ). The mortality rate of the selected four generations of strains inoculated subcutaneously through the neck and back was 100%, and the dead chickens showed typical hydropericardium syndrome. The mortality of chicks inoculated by mucous membrane decreased to 80%, 50%, 30% and 30%, respectively. The sequence ofgene did not change in different generations. In summary, there was no difference in the pathogenicity of different generations of strains to chickens after subcutaneous inoculation, while the mortality of mucosal inoculation decreased generation by generation, and there was no base variation in the major structural proteingene.
virulent strain FAdV-4; virulence; pathogenicity;
S852.657
A
1672-352X (2023)02-0249-06
2022-04-06
安徽省教育厅重点项目(KJ2020A0124)资助。
洪 琴,硕士研究生,E-mail:1292175419@qq.com
通信作者:陈芳芳,博士,副教授。E-mail:fang7828887@126.com
10.13610/j.cnki.1672-352x.20230511.020
2023-05-12 10:28:33
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20230511.1338.040.html
