氟唑菌苯胺对蛋白核小球藻的立体选择性毒性效应
2023-05-30温宏伟张召贤薛佳莹段劲生吴祥为
温宏伟,张召贤,薛佳莹*,段劲生,吴祥为
氟唑菌苯胺对蛋白核小球藻的立体选择性毒性效应
温宏伟1,2,张召贤1,薛佳莹1*,段劲生2*,吴祥为1
(1. 安徽农业大学资源与环境学院,合肥 230036;2. 安徽省农业科学院植物保护与农产品质量安全研究所,合肥 230031)
为了探究氟唑菌苯胺对水生生物的立体选择性毒性效应,测定了氟唑菌苯胺对映体对蛋白核小球藻的急性毒性以及光合色素含量的影响。结果表明,-氟唑菌苯胺对蛋白核小球藻具有更高的急性毒性,是-氟唑菌苯胺1.2倍。高剂量暴露浓度下,-氟唑菌苯胺对小球藻叶绿素a、叶绿素b、类胡萝卜素生物合成的抑制率分别为35%、28%、37%,是-对映体的2.1、1.9、2.8倍,表明氟唑菌苯胺对蛋白核小球藻的立体选择性急性毒性可能是由于对映体对光合色素生物合成抑制差异造成的。降解实验结果表明低毒对映体-氟唑菌苯胺被优先降解,第7天时-氟唑菌苯胺和-氟唑菌苯胺降解率分别为82.5%和65.8%,EF值为0.12,且对映体构型稳定。研究结果为氟唑菌苯胺水生生态风险评价提供数据支撑,同时为手性农药立体选择性机制研究提供新的思路。
氟唑菌苯胺;蛋白核小球藻;立体选择性;急性毒性;光合色素,降解
手性农药对映体具有相同的理化性质,但由于立体结构的差异,手性农药对映体与生物大分子(受体、酶等)的作用方式可能不同,导致对映体在生物活性、生态毒性以及环境行为等方面存在立体选择性[1-5]。研究表明手性杀菌剂双炔酰菌胺其-对映体的抑菌活性是-对映体的118~592倍,而-双炔酰菌胺对紫背浮萍的急性毒性高于-对映体;-双炔酰菌胺在豇豆和辣椒中被优先降解,而-对映体在土壤中被优先降解[6-8]。因此,若将手性农药对映体视为同一种化合物,可能导致风险评估不准确、施用过量等问题,对人类健康与生态环境造成不良影响。
氟唑菌苯胺(5-氟-1,3-二甲基--[2-(4-甲基 戊-2-基)苯基]-1H-吡唑-4-甲酰胺)是拜耳公司研发的新型手性吡唑酰胺类杀菌剂,可防治担子菌和子囊菌等病原菌引起的病害,兼具内吸和保护作用,主要用于种子处理,目前已在欧盟、日本和中国等地区登记使用[9-10]。研究表明氟唑菌苯胺在环境中的持效期长,酸性和中性条件下其水解半衰期分为449.8和392.7 d;土壤中的半衰期分别为71.5~101.7 d[11]。氟唑菌苯胺对水生生物具有较高的生态风险,且对映体之间存在明显的立体选择性差异。氟唑菌苯胺对斑马鱼急性毒性实验结果表明-氟唑菌苯胺和-氟唑菌苯胺96 h LC50分别为0.45和24.3 mg·L-1,-氟唑菌苯胺的急性毒性是-对映体的54倍,且-氟唑菌苯胺可增加-氟唑菌苯胺对斑马鱼的暴露风险。慢性毒性实验结果表明高毒对映体-氟唑菌苯胺在斑马鱼体内优先富集,对斑马鱼琥珀酸脱氢酶生物活性的抑制显著高于-对映体,从而引发更为严重的氧化应激效应[12]。氟唑菌苯胺对映体与重金属Cd联合暴露时,Cd促进-氟唑菌苯胺在斑马鱼肝脏中的生物富集,从而增加其环境风险[13]。
图1 氟唑菌苯胺结构式
Figure 1 Structure of penflufen
藻类是淡水生态系统中的初级生产者[14],是水生食物链中的基本环节,任何外源性化合物对藻类的干扰都可能导致整个水生生态系统的失衡[15-16]。因此藻类被广泛用于农药水生生态风险的评价[17-20]。本研究利用蛋白核小球藻,探究了氟唑菌苯胺对水生生物的立体选择性急性毒性,通过测定对映体对蛋白核小球藻光合色素生物合成的影响,以期揭示氟唑菌苯胺立体选择性毒性差异的机制,进一步利用超高效液相色谱串联质谱明确了氟唑菌苯胺在蛋白核小球藻中的立体选择性降解。研究结果为氟唑菌苯胺的安全使用和风险评估提供数据支撑和理论依据。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 氟唑菌苯胺外消旋体(- penflufen,纯度≥99.8%),购自上海安谱实验科技股份有限公司;氟唑菌苯胺手性对映体(-penflufen和-penflufen)由大赛璐药物手性技术(上海)有限公司制备;甲醇、乙腈和丙酮等试剂购自阿拉丁试剂(上海)有限公司。
1.1.2 供试材料 蛋白核小球藻()购自中国科学院水生生物研究所,使用BG11培养基进行培养,培养条件:温度25 ℃,湿度65%,白色日光灯,光照强度4 000 lx左右,光暗比为12∶12 h,静置培养,每日定时人工摇动3~4次[21]。
1.1.3 仪器 三重四极杆液相色谱质谱联用仪(LC-MS 8030,岛津中国);手性色谱柱(CHIRALPAK®IG-3,大赛璐(中国)投资有限公司);光照培养箱(GXZ-1000A,宁波东南仪器有限公司)。
1.2 方法
1.2.1 生长抑制实验 采用半静态法测定目标化合物(-氟唑菌苯胺,-氟唑菌苯胺和-氟唑菌苯胺)对蛋白核小球藻的急性毒性。在无菌操作台中,配置氟唑菌苯胺浓度为0、1、3、5、7和10 mg·L-1的培养基溶液100 mL,将处于对数生长期的蛋白核小球藻接种至含氟唑菌苯胺培养基中,小球藻的初始密度为2×105个cell·mL-1,每个处理设置3个平行。同时设置对照组,以减少由于蛋白核小球藻自然死亡对实验造成的误差。将蛋白核小球藻置于原培养条件下继续培养,每天定时摇动3~4次,分别在48 h、72 h和96 h时,利用紫外可见分光光度计测定690 nm时藻液的吸光度(OD690),计算不同暴露浓度对小球藻的藻抑制率,计算公式如下:
抑制率(%) = (对照组690-处理组690)/对照组690×100%
对浓度-抑制率数据进行非线性,计算不同时间-氟唑菌苯胺,-氟唑菌苯胺和-氟唑菌苯胺的有效中浓度(median effective concentration,EC50),用于评价氟唑菌苯胺对映体对蛋白核小球藻的急性毒性。
1.2.2 光合色素含量的测定 将处于对数生长期的蛋白核小球藻接种至250 mL锥形瓶中,加入氟唑菌苯胺及其对映体,暴露浓度分别为1、3和5 mg·L-1,每个处理设3个平行。置于人工气候箱中培养96 h后,吸取5 mL藻液于离心管中, 5 000 r·min-1离心10 min,弃上清液,加入5 mL丙酮(体积分数80%),避光振荡10 min,置于4 ℃冰箱中保存24 h,再以10 000 r·min-1离心10 min,取上清液分别测定440、663、645和663 nm处的吸光值,计算藻液中叶绿素a、叶绿素b、类胡萝卜素和总叶绿素的含量,计算公式如下[22]:
a=(12.7663-2.69645)/ρ
b=(22.9645-4.68663)/ρ
T=(1000652/34.5)/ρ
K=(4.7440-0.27a+b)/ρ
其中,C为叶绿素a含量(mg·cell-1),C为叶绿素b含量(mg·cell-1);C为总叶绿素含量(mg·cell-1),C为类胡萝卜素含量(mg·cell-1);为藻密度。
1.2.3 降解实验 将处于对数生长期的小球藻接种至250 mL锥形瓶中,小球藻的初始浓度为2×105个cell·mL-1。添加氟唑菌苯胺对映体,初始暴露浓度为5 mg·L-1,每个处理设3个平行。将蛋白核小球藻置于原培养条件下继续培养,每天定时摇动3~4次,分别于0、1、2、3、4、5、6和7 d收集上清和藻细胞,测定氟唑菌苯胺对映体的浓度。
采用QuEChERS法提取蛋白核小球藻细胞和培养液中的氟唑菌苯胺对映体,并通过LC-MS测定样品中氟唑菌苯胺对映体的残留浓度[23]。添加回收实验结果表明,-氟唑菌苯胺和-氟唑菌苯胺的添加回收率分别为86.8%~93.2%和87.6%~91.2%,相对标准偏差小于5%,满足农药残留检测的要求。使用对映体分数(enantiomer fraction,EF)评价氟唑菌苯胺在蛋白核小球藻中的立体选择性[24-25]。使用生物富集因子(bioenrichment factor,BCF)评价氟唑菌苯胺在蛋白核小球藻中的富集性[24]。
1.2.4 数据处理与分析 运用Excel进行数据处理,用SPSS 19.0软件进行差异显著性分析,利用Origin 2018软件绘图。
2 结果与分析
2.1 立体选择性急性毒性
手性农药对映体对非靶标生物的急性毒性往往具有立体选择性[26-28]。本研究测定了48 h、72 h和96 h氟唑菌苯胺对映体对蛋白核小球藻的急性毒性,实验结果如表1所示。随着暴露浓度的增加,蛋白核小球藻受到不同程度的损伤,7 mg·L-1与10 mg·L-1暴露浓度下,24 h时藻液变黄,发生絮凝、沉淀等现象。随着暴露时间的推移,氟唑菌苯胺对蛋白核小球藻的急性毒性增加,-氟唑菌苯胺、-氟唑菌苯胺和-氟唑菌苯胺96 h EC50分别为5.32、5.13和6.11 mg·L-1,-氟唑菌苯胺具有更高急性毒性,为-氟唑菌苯胺的1.2倍。根据农药对藻类急性毒性划分等级,氟唑菌苯胺及其对映异构体均属于低毒化合物。
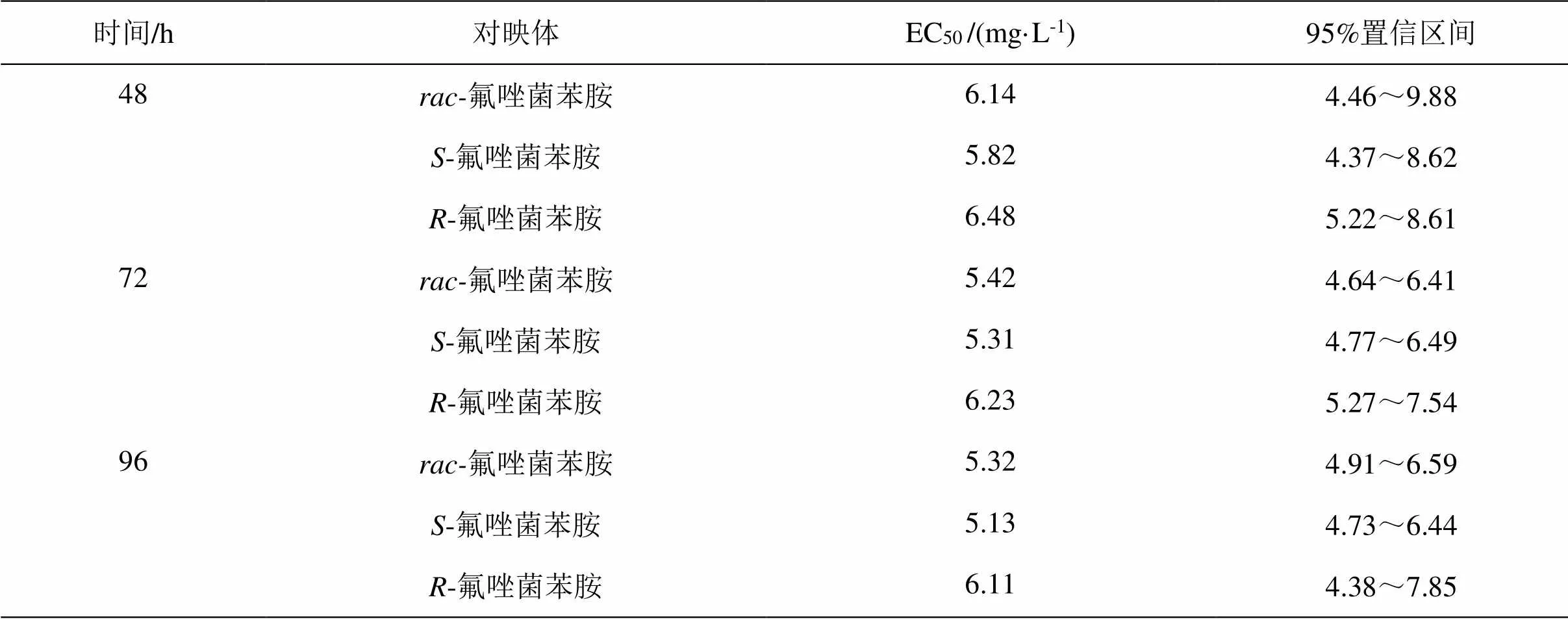
表1 氟唑菌苯胺对映体对蛋白核小球藻的生长抑制
2.2 氟唑菌苯胺对映体对蛋白核小球藻光合色素生物合成的影响
光合色素是植物光合作用中参与吸收、传递光能或引起原初光化学反应的重要物质[29-30]。研究表明农药胁迫条件下,蛋白核小球藻光合色素生物合成会受到不同程度的抑制[31-33]。本实验探究了氟唑菌苯胺对映体对蛋白核小球藻光合色素生物合成的影响,结果如图1所示。低浓度(1 mg·L-1)暴露时,-氟唑菌苯胺、-氟唑菌苯胺和-氟唑菌苯胺对于叶绿素a、叶绿素b、类胡萝卜素以及总叶绿素的生物合成影响不显著。暴露浓度为3 mg·L-1时,蛋白核小球藻光合色素的生物合成受到明显的抑制,与对照组相比,氟唑菌苯胺处理的蛋白核小球藻叶绿素a、叶绿素b、类胡萝卜素以及总叶绿素含量分别降低了23%、22%、21%和32%;氟唑菌苯胺暴露组叶绿素a、叶绿素b、类胡萝卜素以及总叶绿素含量分别降低了35%、28%、37%和33%;氟唑菌苯胺暴露组中叶绿素a、叶绿素b、类胡萝卜素以及总叶绿素含量约分别降低了17%、15%、13%和24%;暴露浓度为5 mg·L-1,氟唑菌苯胺对映体对光合色素生物合成的抑制程度显著高于3 mg·L-1暴露组。测试浓度范围内,蛋白核小球藻光合色素含量与农药浓度呈现剂量效应,暴露浓度越高,光合色素含量越少。
氟唑菌苯胺对映体对于光合色素生物合成的抑制程度也具有明显的立体选择性差异。暴露浓度为3 mg·L-1时,-氟唑菌苯胺对于不同光合色素的抑制效应是-氟唑菌苯胺的1.4~2.8倍;暴露浓度为5 mg·L-1时,-氟唑菌苯胺的抑制效应显著高于-氟唑菌苯胺。这与急性毒性实验结果相符。因此,氟唑菌苯胺对蛋白核小球藻的立体选择性急性毒性可能是由于对映体对光合色素生物合成抑制差异造成的。

表2 氟唑菌苯胺对映体降解动力学方程及半衰期
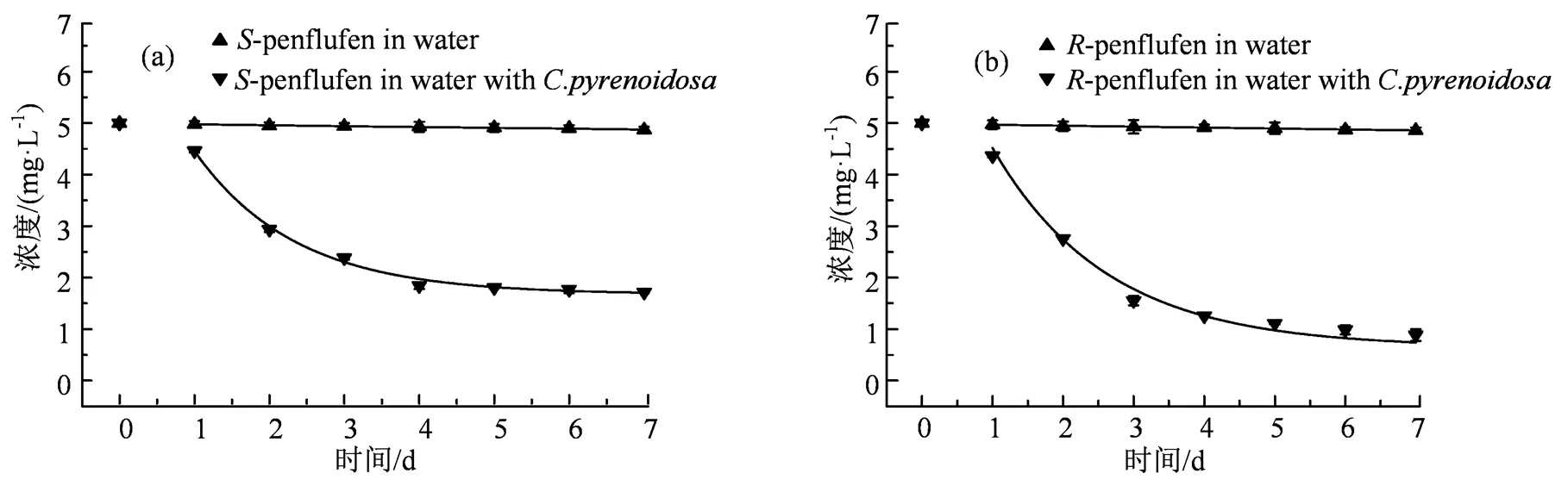
(a)S-氟唑菌苯胺;(b)R-氟唑菌苯胺。
Figure 2 Degradation curve of penflufen enantiomers in water with or without
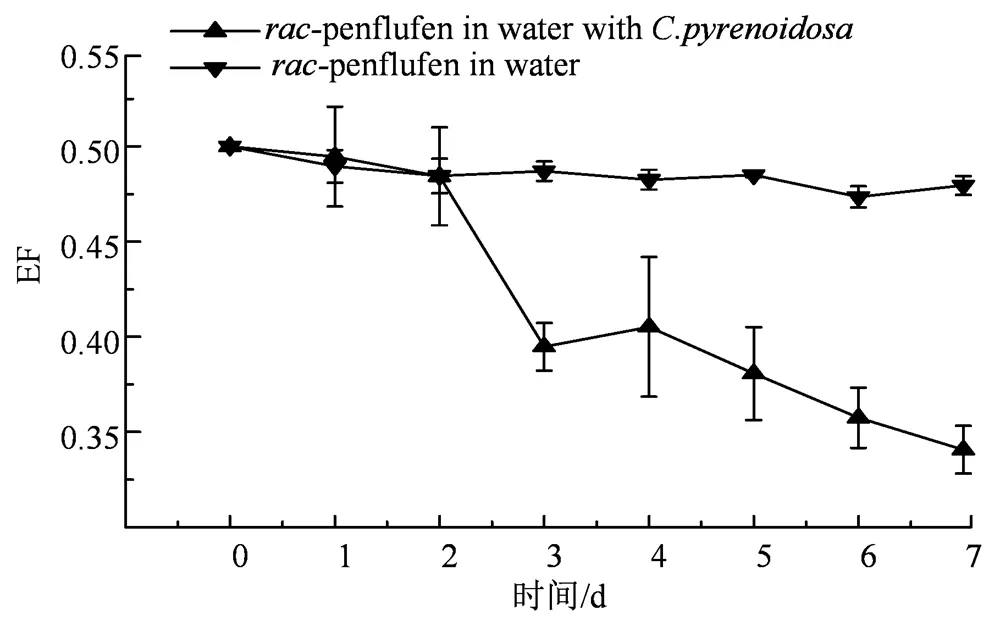
图3 EF值的变化
Figure 3 Variation of EF values
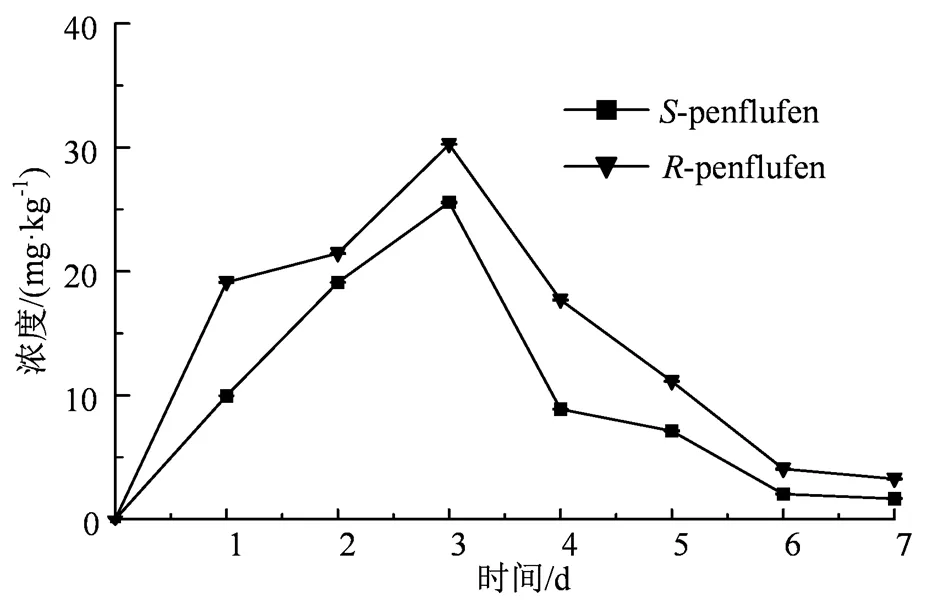
图4 氟唑菌苯胺对映体在小球藻体内浓度变化
Figure 4 Changes of the concentration of penflufen enantiomers ofin
2.3 立体选择性降解与富集
2.3.1 立体选择性降解 手性农药对映体在生物体内的降解往往具有立体选择性[35-36]。本实验测定了氟唑菌苯胺在有无蛋白核小球藻水中的消解动态。实验周期内氟唑菌苯胺对映体在水中未发生降解。当水中含有蛋白核小球藻时,氟唑菌苯胺对映体在藻液中的降解符合一级动力学方程,决定系数2为0.912 4~0.952 6,-和-氟唑菌苯胺半衰期分别为2.6 d和4.2 d(表2),具有明显的立体选择性,EF值为0.12~0.50(图4),表现为低毒对映体-氟唑菌苯胺被优先降解,7 d时-氟唑菌苯胺和氟唑菌苯胺分别降解了65.8%和82.5%,
-氟唑菌苯胺降解过程中未发现S-对映体的生成,-氟唑菌苯胺降解过程中也未发现R-对映体的生成,表明氟唑菌苯胺的构型是稳定的(图2)。
2.3.2 立体选择性富集 如图4所示,氟唑菌苯胺在蛋白核小球藻体内的过程主要分为吸收和清除两个阶段,且对映体之间存在明显的差异。实验周期内,蛋白核小球藻中的氟唑菌苯胺浓度始终高于氟唑菌苯胺,3 d时-氟唑菌苯胺和-氟唑菌苯胺在蛋白核小球藻中的浓度达到最大值,分别为30 mg·kg-1和25 mg·kg-1,生物富集因子分别为19.5和10.7,表明-氟唑菌苯胺较S-对映体容易在藻体内富集。根据GB/T 31270.7[37],氟唑菌苯胺对映体属于中等富集性。3 d后,两个对映体在蛋白核小球藻代谢酶的作用下快速降解,7 d时蛋白核小球藻体内-和-氟唑菌苯胺的浓度分别为3.26 mg·kg-1和1.66 mg·kg-1。
3 讨论与结论
氟唑菌苯胺作为种子处理剂被广泛应用于防治有担子菌门真菌和子囊菌门真菌引起的土传或种传病害[9]。由于种子处理剂直接应用于土壤中,且在土壤中的持效期较长,而残留在土壤中的农药可以通过迁移或地表径流等方式进入水体,从而影响水生生态系统的平衡。先前的研究表明氟唑菌苯胺对水生生物具有较高的生态风险。因此本实验从对映体水平上探究了氟唑菌苯胺对蛋白核小球藻的立体选择性急性毒性,结果表明-氟唑菌苯胺具有更高的毒性。研究发现-氟唑菌苯胺对斑马鱼和非洲爪蟾96 h EC50分别为0.45 mg·L-1和0.3 mg·L-1,且急性毒性均大于-氟唑菌苯胺[12],这与本实验结果一致。同时,氟唑菌苯胺对于水生植物的毒性小于水生动物,根据农药对藻类毒性划分等级(GB/T31270.14-2014)[38],氟唑菌苯胺外消旋体及其对映体均为低毒。
农药影响藻类的光合作用。研究表明戊唑醇可有效抑制藻细胞中叶绿素a和总叶绿素的生物合成,光合色素含量与暴露浓度呈剂量依赖型。随着农药浓度的增加,蛋白核小球藻光合色素含量逐渐降低[36]。光合色素含量的降低可能是由于戊唑醇胁迫对色素生物合成途径的破坏导致的。本研究测定了氟唑菌苯胺对映体对蛋白核小球藻光合色素含量的影响,结果表明氟唑菌苯胺对映体对光合色素的生物合成具有明显的立体选择性抑制作用,-氟唑菌苯胺的抑制效果更为明显。光合作用是藻类吸收光能,把二氧化碳和水合成赋能有机物,同时释放氧气的过程,对于藻类的生长具有重要意义。光合作用受阻,导致藻类呼吸作用底物不足,从而影响能量供给,最终导致藻类死亡,结合急性毒性实验结果,推测氟唑菌苯胺对蛋白核小球藻的立体选择性毒性可能是由于对映体对光合色素生物合成的抑制程度差异所导致的。
手性农药对映体在生物体内的降解往往具有选择性,Zhang等探究了蛋白核小球藻对手性三唑类杀菌剂丙硫菌唑的立体选择性降解[39],结果表明高毒对映体-丙硫菌唑被优先降解,从而降低丙硫菌唑对水生生物的毒性。然而本实验中,蛋白核小球藻优先降解低毒对映体-氟唑菌苯胺,导致氟唑菌苯胺的水生生态风险增加。
生物富集实验结果表明,-氟唑菌苯胺被蛋白核小球藻优先吸收,因此,水中氟唑菌苯胺的立体选择性降解与蛋白核小球藻选择性吸收有关。另外,由于-氟唑菌苯胺急性毒性较大,对于蛋白核小球藻的光合作用的抑制高于-氟唑菌苯胺,从而导致小球藻能量生成不足,影响小球藻主动吸收及代谢酶的活性,最终导致水中-氟唑菌苯胺的浓度高于-对映体。
[1] 李玲, 李俊杰, 王俊英, 等. 手性农药水胺硫磷对浮游生物氧化应激的对映体选择性影响[J]. 生态毒理学报, 2021, 16(3): 264-272.
[2] 唐守英, 王飞, 孟秀柔, 等.含两个手性中心的三唑类杀菌剂色谱分离研究进展[J]. 农药学学报, 2021, 23(4): 617-627.
[3] LIU R, ZHANG H J, DENG Y, et al. Enantioselective fungicidal activity and toxicity to early wheat growth of the chiral pesticide triticonazole[J]. J Agric Food Chem, 2021, 69(38): 11154-11162.
[4] BUSER H R, MÜLLER M D, POIGER T, et al. Environmental behavior of the chiral acetamide pesticide metalaxyl: enantioselective degradation and chiral stability in soil[J]. Environ Sci Technol, 2002, 36(2): 221-226.
[5] LI R N, PAN X L, WANG Q Q, et al. Development of-fluxametamide for bioactivity improvement and risk reduction: systemic evaluation of the novel insecticide fluxametamide at the enantiomeric level[J]. Environ Sci Technol, 2019, 53(23): 13657-13665.
[6] ZHANG J, WU Q Q, ZHONG Y R, et al. Enantioselective bioactivity, toxicity, and degradation in vegetables and soil of chiral fungicide mandipropamid[J]. J Agric Food Chem, 2021, 69(45): 13416-13424.
[7] HAN J H, CHEN Y, LIU Z Y, et al. Enantioselective environmental behavior of the chiral fungicide mandipropamid in four types of Chinese soil[J]. Soil Sci Soc Am J, 2021, 85(3): 574-590.
[8] LI J, LAN T, YANG G, et al. Enantioselective evaluation of the chiral fungicide mandipropamid: Dissipation, distribution and potential dietary intake risk in tomato, cucumber, Chinese cabbage and cowpea[J]. Ecotoxicol Environ Saf,, 2022, 232: 113260.
[9] SUN Y, SHI H, MAO C, et al. Activity of a SDHI fungicide penflufen and the characterization of natural-resistance in[J]. Pestic Biochem Physiol, 2021, 179: 104960.
[10] SINGH D, SINGH N, CHOUDHARY A. Effect of different chemicals on seedling mortality and root rot in American cotton[J]. Plant Dis Res, 2019, 34(1): 45.
[11] 韩平. 氟唑菌苯胺的环境行为研究[D]. 北京: 中国农业大学, 2017.
[12] DI S, WANG Z, CANG T, et al. Enantioselective toxicity and mechanism of chiral fungicide penflufen based on experiments and computational chemistry[J]. Ecotoxicol Environ Saf, 2021, 222: 112534.
[13] DI S, ZHAO H, LIU Z, et al. Low-dose cadmium affects the enantioselective bioaccumulation and dissipation of chiral penflufen in zebrafish ()[J]. Ecotoxicol Environ Saf, 2022, 232: 113270.
[14] EL GAMAL A A. Biological importance of marine algae[J]. Saudi Pharmaceutical Journal, 2010, 18(1): 1-25.
[15] CHAPMAN R L. Algae: the world’s most important “plants”: an introduction[J]. Mitig Adapt Strateg Glob Change, 2013, 18(1): 5-12.
[16] WANG H M D, CHEN C C, HUYNH P, et al. Exploring the potential of using algae in cosmetics[J]. Bioresour Technol, 2015, 184: 355-362.
[17] DELORENZO M E, SCOTT G I, ROSS P E. Toxicity of pesticides to aquatic microorganisms: a review[J]. Environ Toxicol Chem, 2001, 20(1): 84-98.
[18] RYDH STENSTRÖM J, KREUGER J, GOEDKOOP W. Pesticide mixture toxicity to algae in agricultural streams - Field observations and laboratory studies withsamples and reconstituted water[J]. Ecotoxicol Environ Saf, 2021, 215: 112153.
[19] SCHREINER V C, LINK M, KUNZ S, et al. Paradise lost? Pesticide pollution in a European region with considerable amount of traditional agriculture[J]. Water Res, 2021, 188: 116528.
[20] 刘畅, 吴文娟, 李建宏, 等. 不同光强对阿特拉津和百草枯藻类毒性的影响[J]. 环境科学学报, 2014, 34(5): 1339-1343.
[21] MO L Y, ZHENG M Y, QIN M, et al. Quantitative characterization of the toxicities of Cd-Ni and Cd-Cr binary mixtures using combination index method[J]. Biomed Res Int, 2016, 2016: 4158451.
[22] 刘滨扬. 红霉素、环丙沙星和磺胺甲噁唑对羊角月牙藻的毒性效应及其作用机理[D]. 广州: 暨南大学, 2011.
[23] 沈杨. 手性杀菌剂氟唑菌苯胺对映体的分析与选择性环境行为研究[D]. 合肥: 安徽农业大学, 2018.
[24] SANGANYADO E, LU Z, LIU W. Application of enantiomeric fractions in environmental forensics: Uncertainties and inconsistencies[J]. Environ Res, 2020, 184: 109354.
[25] ZHANG Z X, ZHOU L L, GAO Y Y, et al. Enantioselective detection, bioactivity, and metabolism of the novel chiral insecticide fluralaner[J]. J Agric Food Chem, 2020, 68(25): 6802-6810.
[26] YE J, ZHAO M R, LIU J, et al. Enantioselectivity in environmental risk assessment of modern chiral pesticides[J]. Environ Pollut, 2010, 158(7): 2371-2383.
[27] LIU W P, GAN J Y, SCHLENK D, et al. Enantioselectivity in environmental safety of current chiral insecticides[J]. Proc Natl Acad Sci USA, 2005, 102(3): 701-706.
[28] ZHANG Q, HUA X D, SHI H Y, et al. Enantioselective bioactivity, acute toxicity and dissipation in vegetables of the chiral triazole fungicide flutriafol[J]. J Hazard Mater, 2015, 284: 65-72.
[29] VENKATA L, PULLAGURALA R, . ZnO nanoparticles increase photosynthetic pigments and decrease lipid peroxidation in soil grown cilantro ()[J]. Plant Physiol Biochem, 2018, 132: 120-127.
[30] WANG S, LI Q, HUANG S Z, et al. Single and combined effects of microplastics and lead on the freshwater algae[J]. Ecotoxicol Environ Saf, 2021, 208: 111664.
[31] MAJEWSKA M, HARSHKOVA D, POKORA W, et al. Does diclofenac act like a photosynthetic herbicide on green algae?synchronous culture-based study with atrazine as reference[J]. Ecotoxicol Environ Saf, 2021, 208: 111630.
[32] SU Q, ZHENG J, XI J, et al. Evaluation of the acute toxic response induced by triazophos to the non-target green algae[J]. Pestic Biochem Physiol, 2022, 182: 105036.
[33] LIU C, LIU S, DIAO J. Enantioselective growth inhibition of the green algae () induced by two paclobutrazol enantiomers[J]. Environ Pollut, 2019, 250: 610-617.
[34] OU Y, YAN Z, SHI G, et al. Enantioselective toxicity, degradation and transformation of the chiral insecticide fipronil in two algae culture[J]. Ecotoxicol Environ Saf, 2022, 235: 113424.
[35] QU H, MA R X, LIU D H, et al. Enantioselective toxicity and degradation of the chiral insecticide fipronil insuspension system[J]. Environ Toxicol Chem, 2014, 33(11): 2516-2521.
[36] LIU R, DENG Y, ZHANG W J, et al. Enantioselective mechanism of toxic effects of triticonazole against[J]. Ecotoxicol Environ Saf, 2019, 185: 109691.
[37] 中华人民共和国农业部.化学农药环境安全评价试验准则第7部分:生物富集试验:GB/T 31270.7-2014[S]. 北京:中国标准出版社,2015.
[38] 中华人民共和国农业部.化学农药环境安全评价试验准则第14部分:藻类生长抑制试验:GB/T 31270.14- 2014[S]. 北京:中国标准出版社,2015.
[39] ZHANG Z X, XIE Y W, YE Y Z, et al. Toxification metabolism and treatment strategy of the chiral triazole fungicide prothioconazole in water[J]. J Hazard Mater, 2022, 432: 128650.
Stereoselective toxic effects of penflufen against
WEN Hongwei1,2,ZHANG Zhaoxian1, XUE Jiaying1,DUAN Jinsheng2,WU Xiangwei1
(1. School of Resources and Environment, Anhui Agricultural University, Hefei 230036;2. Institute of Plant Protection and Agro-Products Safety, Anhui Academy of Agricultural Sciences, Hefei 230031)
The acute toxicity of penflufen enantiomers and the effects of photosynthetic pigment content towere measured to investigate the stereoselective toxic effect for aquatic organism. The results showed that the EC50of-penflufen towas 1.2 times that of-penflufen, indicating that acute toxicity of-penflufen was higher than that of-penflufen. At the high exposure concentration, the inhibition rates of-penflufen on the biosynthesis of chlorophyll A, chlorophyll B, and carotene were 35%, 28% and 37%, respectively, which were 2.1, 1.9 and 2.8 times that of-penflufen. These results suggested that the enantioselective acute toxicity of penflufen tomight be caused by the difference in the inhibition of biosynthesis of photosynthetic pigments by enantiomers. The degradation percentages of-penflufen and-penflufen at 7 d were 82.5% and 65.8%, respectively, suggesting that the low toxic-penflufen preferred to be degraded with the enantiomer fraction value of 0.12. In addition, the configuration of penflufen enantiomer was stable. These results provide an important basis for the aquatic ecological risk assessment of penflufen and a novel insight into the study of the enantioselective mechanism of chiral pesticides.
penflufen;; enantioselectivity; acute toxicity; photosynthetic pigments; degradation
X592; S481.1
A
1672-352X (2023)02-0283-06
2022-06-23
国家自然科学基金(32072465)和安徽省高校协同创新项目(GXXT-2021-057)共同资助。
温宏伟,硕士研究生。E-mail:shengtaiwhw@163.com
通信作者:薛佳莹,副教授。E-mail:xuejiaying0715@163.com 段劲生,研究员。E-mail:djszbzas@126.com
10.13610/j.cnki.1672-352x.20230511.002
2023-05-12 10:33:30
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20230511.1149.004.html
