大肠杆菌DH5a菌株高效电击转化条件的优化
2023-05-30吕新刘兰英李玥仁
吕新 刘兰英 李玥仁
摘 要:为探索大肠杆菌DH5a高效电击转化条件,通过对电击转化条件中细胞生长状态、DNA加入量、感受态细胞体积、电场强度、速冻和恢复时间等关键因素进行优化,筛选出大肠杆菌DH5a高效电击转化条件。结果表明:大肠杆菌在细胞生长状态OD600值为0.6时制备感受态细胞,按每管50 μL体积分装、-80℃乙醇速冻后,加入10 pg pUC 19质粒DNA,在20 kv·cm-1电场强度、电容25 μF、电阻200 Ω条件下电击转化,转化后恢复培养60 min,转化效率达1010 cfu·μg-1 DNA以上水平,可满足基因文库构建、抗体库筛选等试验需求。
关键词:大肠杆菌;DH5a菌株; 高效;电击转化
中图分类号:Q 939.9 文献标志码:A 文章编号:0253-2301(2023)02-0008-05
DOI: 10.13651/j.cnki.fjnykj.2023.02.002
Agricultural Sciences, Fuzhou, Fujian 350003, China; 2. Fujian Key Laboratory
of Agroproducts Quality & Safety, Fuzhou, Fujian 350003, China)
Abstract: In order to explore the conditions of highefficiency electroporation transformation for Escherichia coli DH5a, the key factors in the conditions of electroporation transformation such as the cell growth state, the adding quantity of DNA, the volume of competent cells, electric field intensity, quick freezing and recovery time were optimized, thus to screen the conditions of highefficiency electroporation transformation for Escherichia coli DH5a. The results showed that: the competent cells of Escherichia coli were prepared when the OD600 value of the cell growth state was 0.6. The competent cells were packed in 50 μL per tube, and frozen in ethanol at -80℃. Then, 10 pg pUC 19 plasmid DNA was added, and the cells were transformed by electric shock under the conditions of 20 kv·cm-1 electric field intensity, 25 μF capacitance and 200 Ω resistance. After the transformation, the cells were cultured for 60 min. The transformation efficiency was above 1010 cfu·μg-1 DNA, which could meet the needs of genomic library construction and antibody library screening.
Key words: Escherichia coli; DH5a strain; Highefficiency; Electroporation transformation
自1972年Cohen等[1]首次报道将质粒DNA成功转化大肠杆菌Escherichia coli,E.coli后,大肠杆菌感受态细胞转化已发展为一项分子生物学实验中的常规技术,主要应用于DNA片段克隆以及基因文库构建等方面,但不同试验场景对转化效率要求存在较大差异,DNA片段克隆只需转化效率在106 cfu·μg-1 DNA左右就可以满足试验要求,而基因文库构建、抗体库筛选等研究则需要1010 cfu·μg-1 DNA以上的转化效率。目前大肠杆菌感受态细胞转化方法可分为物理法和化学法,化学法主要包括氯化钙法[1]、Hanahan法[2]以及Inoue法[3],其中氯化钙法转化效率在
106~108 cfu·μg-1 DNA,Hanahan法和Inoue法转化效率在108 cfu·μg-1 DNA左右,偶能达到109 cfu·μg-1 DNA的水平,均不能满足基因文库构建、抗体库筛选等试验要求[4-5]。电击转化法作为一种物理方法,虽可将转化效率提高至1010 cfu·μg-1 DNA以上水平,但需要提前对大肠杆菌感受态细胞制备和转化条件进行优化方能达成。
大肠杆菌电击转化主要包括感受态细胞制备和转化两个步骤[5-7],目前在电击转化条件优化研究方面存在许多不足之处,主要表现在很多研究将电击转化的两个步骤割裂开,一部分研究仅针对感受态细胞制备条件如菌体培养基、温度、菌体生长状态等条件进行优化,忽略了转化條件对转化效率的影响[8-9],而另一部分研究则只针对转化条件如转化电场强度、恢复培养基成分和转化后复苏时间等方面进行优化[4,10-11],没有考虑到菌体生长状态等感受态细胞制备条件带来的影响,最终导致电击转化试验优化结果不稳定、重现性差。本研究以大肠杆菌DH5a菌株为试验对象,同时对电击转化条件中感受态细胞制备和转化条件中关键因素进行优化,筛选出高效电击转化条件,为基因文库构建、抗体库筛选等试验提供技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 质粒与菌株 大肠杆菌DH5a菌株、pUC 19质粒均为福建省农业科学院农业质量标准与检测技术研究所微生物实验室保存。
1.1.2 材料与试剂 胰蛋白胨、酵母粉(英国Oxoid公司);葡萄糖、琼脂粉、氨苄青霉素、质粒DNA提取试剂盒[生工生物工程(上海)股份有限公司];NaCl、KCl、MgCl2、NaOH、甘油(分析纯,上海阿拉丁生化科技有限公司)。
1.1.3 仪器与设备 分光光度计(TU1901,北京普析通用);电脉冲基因转化仪(Gene Pulser II,美国Biorad公司);台式离心机(Sigma 114,德国希格玛公司);超净工作台(C2HJHC1112B,上海智城公司);核酸蛋白定量仪(Qubit 2,美国Thermo Scientific公司);恒温培养箱(DHP9082型,上海一恒科学仪器有限公司);0.2 cm电击杯(美国Biorad公司)。
1.1.4 培养基 SOB培养基:2%(W/V)胰蛋白胨、0.5%(W/V)酵母粉、0.05%(W/V)NaCl、2.5 mmol·L-1 KCl、10 mmol·L-1 MgCl2。SOC培养基:2%(W/V)胰蛋白胨、0.5%(W/V)酵母粉、0.05%(W/V)NaCl、2.5 mmol·L-1 KCl、10 mmol·L-1 MgCl2、20 mmol·L-1葡萄糖。
1.2 试验方法
1.2.1 大肠杆菌DH5α感受态细胞制备 取出从-80℃保存的大肠杆菌DH5α菌株,在SOB固体培养基上划线,置37℃培养箱中倒置培养24 h,挑取大肠杆菌DH5α单菌落至5 mL SOB液体培养基中,于37℃、200 r·min-1过夜培养12~15 h;用移液枪吸取0.5 mL过夜培养物,在超净工作台中按1∶100比例接种于50 mL SOB液体培养基中,37℃、200 r·min-1振荡培养至不同生长状态,在超净工作台上转移至50 mL离心管中,冰浴10 min后在4℃、5000 r·min-1离心10 min,弃上清,收集细胞;加入50 mL 0℃预冷的18.25 MΩ的去离子水,用移液枪吹悬细胞,4℃、5000 r·min-1离心10 min,弃上清,收集细胞,重复洗涤细胞1次;加入25 mL 0℃预冷的10%甘油缓冲液,用移液枪吹悬细胞,4℃、5000 r·min-1离心10 min,弃上清,收集细胞;加入0.5 mL 10%甘油缓冲液吹悬细胞,按每管40 μL体积分装后,-80℃保存。
1.2.2 大肠杆菌DH5α感受态细胞电击转化 取1 ng pUC 19质粒DNA,加入到40 μL 大肠杆菌DH5α感受态细胞中,手指轻弹使pUC 19質粒DNA和感受态细胞充分混匀,冰浴30 min;转移至0℃预冷的电击杯(内径0.2 cm)中,用电转仪进行电击(电压22 kv·cm-1,电容25 μF,电阻200 Ω,电击1次);立即向电击杯中加入960 μL SOC恢复培养基,移液枪反复轻轻吹打混匀,全部吸至离心管中,37℃、180 r·min-1振荡培养1 h后,涂布于含有终浓度为100 μg·mL-1氨苄青霉素的SOB固体培养基平板上,37℃过夜培养,统计菌落数量,并计算感受态细胞的转化效率(转化效率为每单位重量质粒DNA产生的转化子数量)。
1.2.3 生长状态对大肠杆菌DH5α感受态细胞转化效率的影响 分别选取培养至OD600=0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1和1.2的大肠杆菌DH5α菌液(按1.2.1中所述方法制备感受态细胞),并按1.2.2中所述电击转化后,统计菌落数量,计算感受态细胞的转化效率。
1.2.4 质粒DNA加入量对大肠杆菌DH5α感受态细胞转化效率的影响 按1.2.3确定的最佳OD600值制备感受态细胞,分别取1、10、1、10和100 ng pUC 19质粒DNA,加入到5个40 μL 大肠杆菌DH5α感受态细胞中。按1.2.2中所述电击转化后,统计菌落数量,计算感受态细胞的转化效率。
1.2.5 感受态细胞体积对大肠杆菌DH5α感受态细胞转化效率的影响 按1.2.4优化的质粒DNA加入量,分别加入到40 μL·管-1、50 μL·管-1、60 μL·管-1、70 μL·管-1、80 μL·管-1分装的大肠杆菌DH5α感受态细胞中,按1.2.2中所述电击转化后,统计菌落数量,计算感受态细胞的转化效率。
1.2.6 电场强度对大肠杆菌DH5α感受态细胞转化效率的影响 按1.2.5优化的感受态细胞体积,分别按16、18、20、22和24 kv·cm-1设置不同电场强度,电容25 μF,电阻200 Ω,0.2 cm电击杯进行电击转化。电转化后按1.2.2中所述后续操作,统计菌落数量,计算感受态细胞的转化效率。
1.2.7 低温速冻对大肠杆菌DH5α感受态细胞转化效率的影响 将新制备的50 μL 大肠杆菌DH5α感受态细胞,置-80℃预冷的乙醇中速冻5 min后,按1.2.6优化的电场强度进行电击转化。电转化后按1.2.2中所述后续操作,统计菌落数量,计算感受态细胞的转化效率。
1.2.8 恢复时间对大肠杆菌DH5α感受态细胞转化效率的影响 将速冻后的50 μL 大肠杆菌DH5α感受态细胞,按20 kv·cm-1、电容25 μF,电阻200 Ω设置参数,在0.2 cm电击杯进行电击转化,立即向电击杯中加入950 μL SOC恢复培养基,移液枪反复轻轻吹打混匀;将电击杯中的菌液全部吸出至离心管中,37℃、180 r·min-1分别振荡培养30、60、90和120 min,涂布于含有终浓度为100 μg·mL-1氨苄青霉素的SOB固体培养基平板上,37℃过夜培养,统计菌落数量,并计算感受态细胞的转化效率。
2 结果与分析
2.1 细胞生长状态对大肠杆菌DH5α感受态细胞转化效率的影响
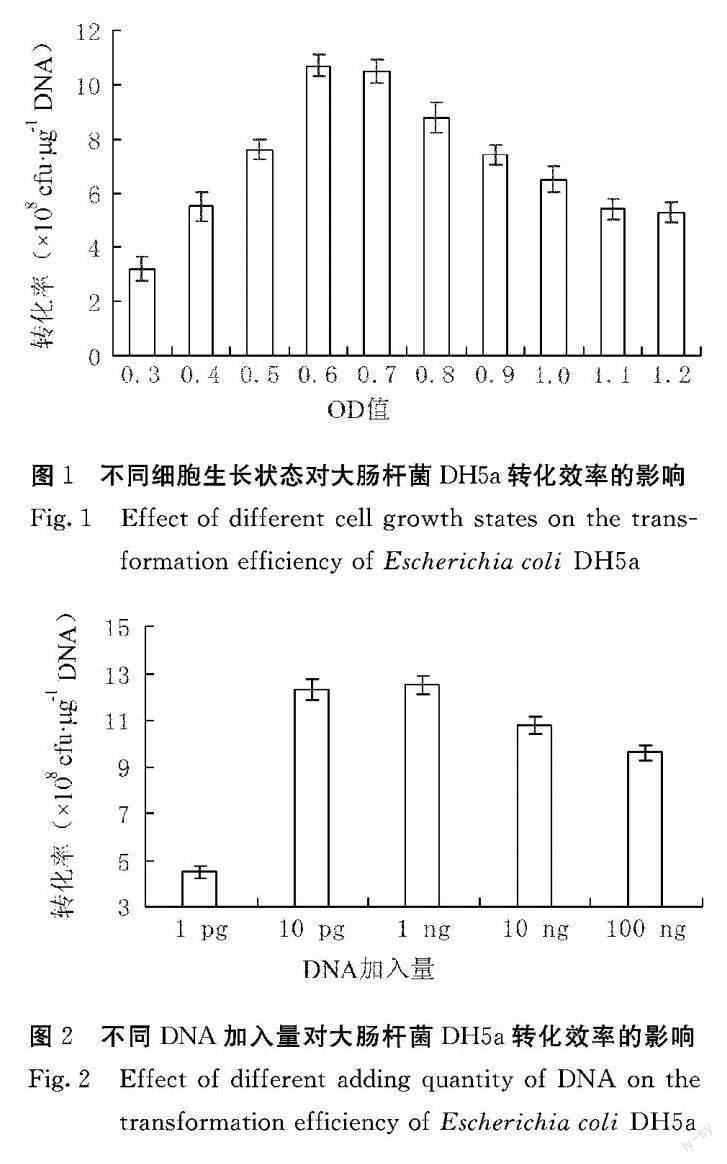
由图1可知,不同细胞生长状态下所制备的感受态细胞的转化效率存在差异,其中以大肠杆菌DH5α细胞生长状态OD600值为0.6时效果最好,转化效率为10.7×108 cfu·μg-1 DNA。
2.2 质粒DNA加入量对大肠杆菌DH5α感受态细胞转化效率的影响
由图2可知,过低或过高的质粒DNA加入量均会导致大肠杆菌DH5a感受态细胞转化效率降低,但在10 pg和1 ng的质粒DNA加入量时,两者的转化效率明显高于其他质粒DNA加入量,分别为12.3×108 cfu·μg-1 DNA和12.5×108 cfu·μg-1 DNA。
2.3 感受态细胞体积对大肠杆菌DH5α感受态细胞转化效率的影响
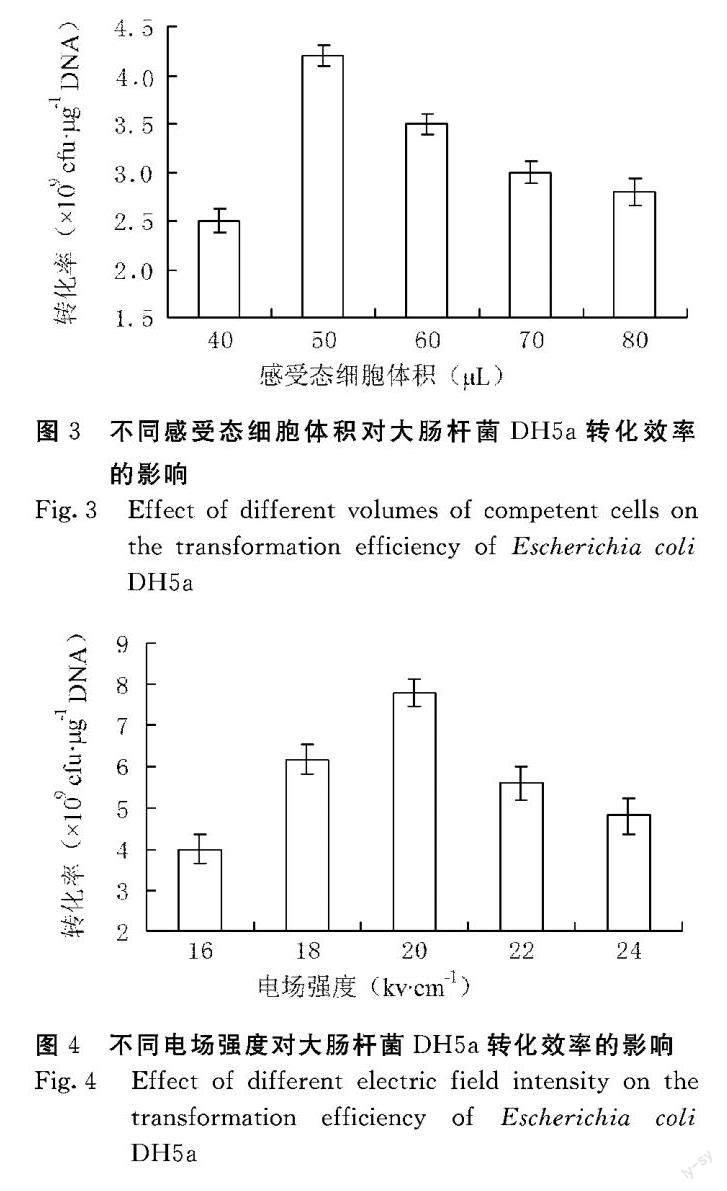
由图3可知,不同的感受态细胞体积会导致转化效率出现高低起伏,其中以50 μL体积的感受态细胞转化效率最高,其转化效率为4.2×109 cfu·μg-1 DNA。
2.4 电场强度对大肠杆菌DH5α感受态细胞转化效率的影响
由图4可知,不同电场强度下感受态细胞转化效率会出现高低变化,其中以电场强度为20 kv·cm-1时,感受态细胞转化效率最高,达7.8×109 cfu·μg-1 DNA。
2.5 低温速冻对大肠杆菌DH5α感受态细胞转化效率的影响
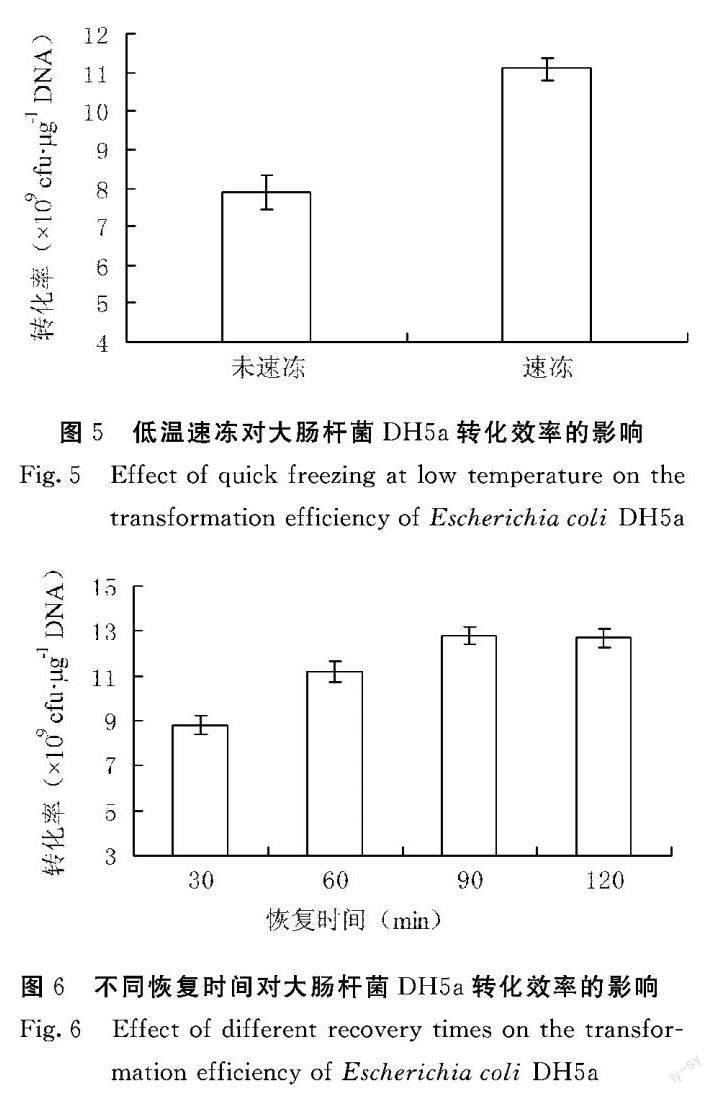
由图5可知,-80℃乙醇速冻后,大肠杆菌DH5α感受态细胞转化效率得到进一步提升,已超过1010 cfu·μg-1 DNA,达到1.11×1010 cfu·μg-1 DNA水平。
2.6 恢复时间对大肠杆菌DH5α感受态细胞转化效率的影响
由图6可知,恢复时间为60 min时感受态细胞转化效率为1.12×1010 cfu·μg-1 DNA,恢复时间延长至90 min时感受态细胞转化效率进一步提升至1.28×1010 cfu·μg-1 DNA,而再继续延长恢复时间至120 min时感受态细胞转化效率为1.27×1010 cfu·μg-1 DNA,与90 min相比感受态细胞转化效率提升不大,故恢复时间在60~90 min时感受态细胞转化效率可在1010 cfu·μg-1 DNA以上。
3 討论与结论
电击转化是目前已知的转化方法中转化效率最高的,其基本原理是利用作用于细胞膜两侧的高压瞬时电场产生的电位差,使细胞膜极化形成可逆孔洞,这些孔洞可以使DNA一类的大分子进入细胞[5,12]。有研究表明影响电转化效率的最主要的因素是电池强度和细胞生长状态,其中电场强度的增强会增加DNA的导入量,但也会造成细胞的大量死亡,只有当电场强度和脉冲时长以一定方式组合而导致50%~70%的细胞死亡时转化效率达到最高[9, 13-14]。因此,在进行电转化时,必须筛选合适的电场强度才可能达到最高的转化效率。本试验结果表明,在电场强度为20 kv·cm-1时,感受态细胞转化效率最高,到7.8×109 cfu·μg-1 DNA。细菌的生长状态也直接影响转化效率。研究表明,在细菌生长需经历4个不同时期,其中以对数生长期早中期时转化效率最高,而随着细菌的老化其转化效率也将大大降低。本试验结果表明,不同细胞生长状态下感受态细胞的转化效率存在差异,其中以在OD600值为0.6时转化效率最高。
电击转化中质粒DNA加入量、感受态细胞体积、速冻和恢复时间等因素也会对转化效率产生影响,通过对上述条件优化,最终最优电击转化条件为:在细胞生长状态OD600值为0.6制备感受态细胞,并按每管50 μL体积分装-80℃乙醇速冻后,加入10 pg pUC 19质粒DNA,在20 kv·cm-1电场强度、电容25 μF、电阻200 Ω条件下电击转化,转化后恢复培养60 min,转化效率可达1010 cfu·μg-1 DNA以上水平。
参考文献:
[1]COHEN S N, CHANG A C, HSU L.Nonchromosomal antibiotic resistance in bacteria: genetic transformation of Escherichia coli by Rfactor DNA[J].Proc Natl Acad Sci U S A, 1972, 69(8): 2110-2114.
[2]HANAHAN D.Studies on transformation of Escherichia coli with plasmids[J].J Mol Biol, 1983, 166(4): 557-580.
[3]INOUE H, NOJIMA H, OKAYAMA H.High efficiency transformation of Escherichia coli with plasmids[J].Gene, 1990, 96(1): 23-28.
[4]冯建成, 崔贞华, 罗素兰.大肠杆菌JM109菌株高效电转化条件的研究[J].湖北大学学报(自然科学版), 2008(1): 79-81.
[5]刘麒, 王阔鹏, 于凌娇, 等.电转化条件对大肠杆菌TG1转化效率的影响[J].吉林农业科技学院学报, 2018, 27(3): 6-9.
[6]朱森康, 黄磊, 李燕飞, 等.制备高效大肠杆菌电转化感受态细胞和电转化条件的研究[J].生物技术通报, 2011(10): 206-209.
[7]蔡松, 杨东成, 唐梅, 等.一种快速脱盐制备大肠杆菌电转化感受态细胞的方法[J].湖北农业科学, 2020, 59(17): 170-174.
[8]唐颜苹, 王小媚, 何薇, 等.大肠杆菌感受态细胞保存条件的研究[J].华中农业大学学报, 2008, 27(6): 745-748.
[9]罗锋, 余腾, 范丽梅.感受态细胞制备和质粒转化冰浴时间对大肠埃希菌转化效率的影响[J].江汉大学学报(自然科学版), 2011, 39(3): 82-85.
[10]张洋, 王志强, 刘斌, 等.DH10B菌株高效电转化条件探究[J].生物工程学报, 2007(2): 347-351.
[11]韦晓明, 苏明权, 杨安钢, 等.电转化条件对大肠杆菌XL1Blue菌株转化效率的影响[J].生物技术通讯, 2003(6): 566-568.
[12]黄学娟, 张金迪, 张壮, 等.一种优化的大肠杆菌感受态细胞制备及转化方法[J].基因组学与应用生物学, 2017, 36(12): 5199-5204.
[13]JANEZ N, MEGLIC S H, FLISAR K, et al.Introduction of Phage Genome into Escherichia coli by Electroporation[J].Methods Mol Biol, 2019, 1898: 51-56.
[14]GREEN M R, SAMBROOK J.Transformation of Escherichia coli by Electroporation[J].Cold Spring Harb Protoc, 2020, 2020(6): 101220.
(责任编辑:柯文辉)
